Журнал физической химии, 2019, T. 93, № 9, стр. 1428-1436
Динитрозильные комплексы железа в процессах сенсибилизированного окисления органических субстратов
А. Б. Соловьева a, *, Н. Н. Глаголев a, Н. А. Аксенова a, b, А. С. Курьянова a, b, А. Ф. Ванин a, b, В. А. Тимофеева a, П. С. Тимашев a, b
a Российская академия наук, Федеральное государственное бюджетное учреждение науки Институт химической физики им. Н.Н. Семенова
Москва, Россия
b Институт регенеративной медицины, Первый Московский государственный медицинский университет
им. И.М. Сеченова
Москва, Россия
* E-mail: anna@polymer.chph.ras.ru
Поступила в редакцию 04.07.2018
После доработки 16.11.2018
Принята к публикации 19.11.2018
Аннотация
Показано, что эффективность процесса фотосенсибилизированного окисления органических субстратов в водной среде (на примере окисления триптофана) может не зависеть от введения в реакционную среду биологически-активных динитрозильных комплексов железа (ДНКЖ) с тиол-содержащими лигандами, если в среде присутствует плюроник F127, тройной блок сополимер этилен и пропиленоксида, концентрация которого превышает ККМ. В этом случае молекулы фотосенсибилизатора локализуются в мицеллах плюроника и экранируются от разрушающих воздействий радикалов NO•, образующихся. при фоторазложении молекул ДНКЖ. Тем самым открывается принципиальная возможность проведения процедур фотодинамической терапии (ФДТ) – фотоиндуцированных процессов некроза и апоптоза клеток патологических тканей с одновременным инициированием при фоторазложении молекул ДНКЖ регенеративно-репарационных процессов “обработанных” тканей.
Фотодинамическая терапия (ФДТ) различного типа новообразований и инфицированных ран (гнойных ран, пролежней и трофических язв) подразумевает не только фотоиндуцируемые (лазерные, фотодиодные) воздействия на патологические ткани с некрозом или апоптозом пораженных клеток, но и эффективную динамику последующих регенеративных процессов грануляции и эпителизации тканей, инициируемых иммунной системой организма в тканях, приграничных с поврежденными тканями новообразований или инфицированных ран. Именно таким образом понимается механизм подавления роста раковых опухолей, открытый T. Hongjo [1]. Оказалось, что на поверхности раковой опухоли образуются специальные рецепторы, которые проявляют себя как иммуносупрессоры, т.е. ограничители (“подавители”) иммунитета. Их сигналы как бы “обманывают” иммунную систему, и Т-лимфоциты перестают реагировать на раковые клетки. Поэтому задача ФДТ должна состоять в подавлении, и только в подавлении активности таких иммуносупрессоров, чтобы регенеративные системы организма могли проявлять свою активность в полной мере. И как показал опыт первых исследований в ФДТ раковых новообразований, использование мощных лазерных источников (энергии в импульсе могли достигать до 1000 Дж) для уничтожения “без следа” наиболее злокачественных опухолей к успехам не приводило. В настоящее время при ФДТ новообразований обычно применяются относительно низкоэнергетические воздействия, как правило, с использованием фотосенсибилизаторов (ФС), и при проведении каждой из таких процедур (в течение от получаса до нескольких часов) поглощается доза в несколько сотен Дж/см2 [2–5].
Можно полагать, что не только новообразования, но и патологически развивающиеся ткани инфицированных ран “защищают себя”, продуцируя в области своей границы свои иммуносупрессоры. И задача ФДТ инфицированных ран, когда интенсивности фотооблучения и энергия, вкачиваемая при проведении каждой из процедур, как правило, на порядок и более, меньше, чем при ФДТ раковых опухолей, должна состоять тоже в выборе оптимальных режимов фотодинамических воздействий на патологические ткани и системы in vivo. Это позволит согласовать скорость подавления иммуносупрессоров со скоростью восстановительных процессов в условиях воздействия иммунной системы, чтобы решить основную задачу – после прекращения лазерных воздействий создать условия для развития регенерационно-восстановительных процессов в организме. Очевидно, что для решения каждой конкретной проблемы должны подбираться свои условия и режимы ФД-воздействий. В частности, согласно [6], при артериальной гипертензии для придания кровеносным сосудам большей гибкости проводили внутривенную лазерную терапию, и через оптоволокно вводился световой поток (длина волны $\lambda = 635$ нм) с плотностью мощности 0.2 Вт/см2 в течение 900 с (10 процедур), так что общая энергетическая доза составляла 180 Дж/см2 [6]. Поскольку при процедурах светового облучения крови целевые компоненты крови как объекты для некроза или апаптоза обычно не обсуждаются, можно полагать, что в данных случаях основным объектом энергетического воздействия оказываются факторы иммунной системы.
В случаях ФДТ инфицированных ран или патологических тканей плотность энергетических световых воздействий может быть на порядок или два выше. Так, при ФДТ венозных язв (venous ulcers) плотность энергетической дозы при $\lambda = 660$ нм составляла 20–30 Дж/см2, а общая доза за процедуру составляла 250–350 Дж при общем количестве – пять процедур [7]. Но и в этих случаях речь идет о создании условий для оптимального инициирования последующих регенерационных процессов, поскольку основным показателем эффективности ФДТ инфицированных ран (гнойных ран, пролежней и трофических язв) являются сроки грануляции и эпителизации тканей, инициируемых иммунной системой организма [8]. На основе именно таких оценок уровень энергетических воздействий при ФДТ инфицированных ран следует в определенной степени минимизировать, чтобы инициировать, но не подавлять в какой-либо мере возможности регенеративных систем организма.
Контролируемое понижение уровня световых воздействий при ФДТ означает и возможное снижение до определенных значений концентрации фотосенсибилизаторов, в частности, порфириновых ФС – ПФС, что крайне важно и для решения еще одной актуальной проблемы фотодинамической терапии – снижения неизбежной фототоксичности таких соединений, остающихся в крови пациентов после процедур ФДТ, особенно при внутривенном введении ФС в организм. Именно для снижения эффектов фототоксичности предпринимается постоянный поиск фотосенсибилизирующих систем, связанный с использованием совместно с ПФС различных водорастворимых полимеров. Это позволяет понижать концентрацию ПФС для достижения определенного уровня терапевтического воздействия за счет “полимерных эффектов” [9]. Прежде всего, такие эффекты связываются с образованием комплексов ПФС с фрагментами используемых водорастворимых амфифильных полимеров (АП) [10], что определяет дезагрегацию ассоциатов ПФС, обычно образующихся в водных средах, в том числе, при образовании лекарственных форм на основе гелей.
В связи с возможностями понижения концентраций ФС и перехода к меньшим энергетическим дозам фотовоздействия при выборе оптимальных режимов ФДТ, обеспечивающих проявление наибольшей эффективности регенеративных процессов, возникает естественный вопрос, возможно ли, используя внешние воздействия или препараты, повысить эффективность регенеративно-репарационных (восстановительных) процессов в условиях проведения сеансов ФДТ. Прежде всего, укажем на возможность (см., например, [11]) инициирования иммунно-корректирующих эффектов при воздействии непосредственно на рану излучения светодиодов с различными длинами волн (470, 530 и 630 нм). Другая возможность, предложенная в работе [12], состоит при проведении процедур ФДТ в условиях, когда наряду с фотосенсибилизатором в систему вводится компонент (фактор), известный как инициатор регенеративно-репарационных процессов в организме. В качестве такого фактора было предложено рассматривать, прежде всего, оксид азота и некоторые его производные, в том числе, динитрозильные комплексы железа (ДНКЖ) с тиол-содержащими лигандами [12]. Оксид азота – многофункциональная сигнальная молекула, управляющая внутриклеточными и межклеточными процессами в животных, бактериальных и растительных организмах и оказывающая как промотирующее (регуляторное, защитное), так и ингибирующее действие на метаболизм [13–18].
При изучении механизма разложения ДНКЖ в условиях фотоинициирования следует иметь в виду, что динитрозильные комплексы железа с тиол-содержащими лигандами (ДНКЖ) существуют в моно- и биядерной форме (М- и Б-ДНКЖ), причем форма Б-ДНКЖ – диамагнитна, а М-ДНКЖ идентифицируется по характерному для них сигналу электронного парамагнитного резонанса (ЭПР) со средним значением g-фактора gср = 2.03 [19]. В соответствии с результатами [20], при рассмотрении биомедицинских эффектов воздействия ДНКЖ с тиол-содержащими лигандами различия в биологической активности форм М- и Б-ДНКЖ обычно не обсуждаются, и лишь в нескольких случаях указывается на определяющую роль формы Б-ДНКЖ с глутатионом в достижении цитотоксического действия в экспериментах на крысах. Как было показано в [12], в условиях фотосенсибилизирующего окисления органических субстратов молекулярным кислородом в водной среде на указанный процесс фактически оказывает влияние лишь одна из форм ДНКЖ, и именно, Б-ДНКЖ, выполняя роль инициатора репарационных процессов. В последующем тексте при использовании аббревиатуры ДНКЖ мы будем иметь в виду Б-ДНКЖ.
Основная проблема совместного использования ПФС и ДНКЖ при терапии патологических тканей и новообразований состоит в том, что синглетный кислород, продуцируемый при воздействии на ПФС и выступающий как основной фактор поражения фрагментов клеток патологических тканей, гибнет при взаимодействии с продуктами окислительной деструкции ДНКЖ, прежде всего, пероксинитритом [12]. Впервые успешные примеры совместного использования ПФС и ДНКЖ были представлены в работе [12], где в качестве ПФС использовался фотодитазин (ФДн) – диглутаминовая соль хлорина при проведении терапии модельных ран у крыс. В этой же работе были представлены и результаты предварительного поиска условий, при которых оказалось возможным добиться проявления совместной активности ФДн и ДНКЖ в модельном процессе фотоинициируемого окисления органического субстрата – триптофана. Оказалось, что разрушающее воздействие синглетного кислорода на ДНКЖ при фотоинициировании процесса окисления триптофана удалось практически исключить при введении в реакционную систему в качестве АП молекул плюроника F127, тройного блок сополимера этилен и пропиленоксида с м.м. 12600 Дa и соотношением пропилен-этиленоксидных группировок – 65/200, при концентрациях молекул плюроника F127, превышающих ККМ. Отсутствие указанных разрушающих воздействий на ДНКЖ, равно как и фиксируемое исключение гибели молекул ФС из-за взаимодействия с радикалами NO•, образующимися при фоторазложении ДНКЖ, позволяло полагать, что процесс окисления триптофана происходил непосредственно в объеме мицелл плюроника.
Тем самым, по-видимому, впервые удалось показать, как процедуры фотосенсибилизированного воздействия на органические субстраты при ФДТ могут быть совмещены с одновременным инициированием регенеративно-репарационных процессов в организме. При этом важно подчеркнуть, что плюроник F127, предотвращающий фотодеградацию ПФС, инициируемую ДНКЖ в рассматриваемом процессе, является разрешенным медицинским препаратом, использование которого в медицинской практике разрешено. При этом возникает вопрос, насколько ДНКЖ может выполнять роль инициатора регенеративно-репарационных (восстановительных) процессов в условиях ФДТ при использовании иных ПФС, разрабатываемых или обычно используемых в медицинской практике, и при наличии в системе плюроника F127. В данной статье этот вопрос разрешается для одного из разрабатываемых в настоящее время фотосенсибилизаторов – димегина при исследовании модельного процесса фотосенсибилизированного окисления в водной среде триптофана при разных составах реакционной смеси.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве порфиринового фотосенсибилизатора использовали динатриевую соль 2,7,12,18-тетраметил-3,8-ди(1-метоксиэтил)-13,17-ди(2-оксикарбонилэтил) порфирина (димегин, ДМГ). В качестве АП использовали плюроник F127 (тройной блок сополимер этилен и пропиленоксида, м.м. 12600 Дa). Динитрозильные комплексы железа синтезировали по методу, описанному в [21]. В качестве АП использовали плюроник F127 с мол. массой 12600 Дa и соотношением пропилен-этиленоксидых группировок – 65/200.
Фотоокисление триптофана (ТФ) (“ч. д. а.”) осуществлялось за счет растворенного в воде молекулярного кислорода в кварцевой кювете (толщина l = = 1 см) при комнатной температуре при перемешивании с помощью магнитной мешалки. Концентрация триптофана составляла 1.0 × 10–5 моль/л, ДМГ – 1.5 × 10–6 моль/л. Концентрация ДНКЖ менялась от 1.7 × 10–6 до 2.0 × 10–5 моль/л, концентрация F127 – от 0 до 5.0 × 10–4 моль/л, что существенно превышало критическую концентрацию мицеллообразования, составляющую ∼10–6 М. Освещение реакционной смеси осуществляли светодиодом АФС (длина волны λ = 400 нм, мощность – 86 мВт, плотность потока мощности – 3.6 мВт/см2, освещенность образца – 1.05 клк). Кинетику процесса фотоокисления фиксировали по уменьшению интенсивности фотолюминесценции триптофана (λex = 275 нм, λem = 355 нм). Спектры фотолюминесценции снимали на спекторофлуориметре Cary Eclipse (Varian). За кинетикой процесса фотодеструкции ДМГ, ФДТ, ДНКЖ следили по уменьшению оптической плотности УФ-полос поглощения в водной среде указанных соединений – λ = 395, 405, 310 и 335 нм, соответственно. УФ- и электронные спектры поглощения (ЭСП) растворов снимали на спекторофотометре Cary 50 (Varian).
Получение наблюдаемой константы kobs скорости фотоокисления триптофана на основе проводимых экспериментов осложнялось тем, что при включении светодиода в момент времени t = 0 одновременно с уменьшением концентрации ${{C}^{{{\text{TP}}}}}(t)$ триптофана в реакционной среде фиксировалось уменьшение концентраций ${{C}^{{{\text{PPS}}}}}(t)$ [$C_{{}}^{{{\text{DMG}}}}(t)$ и $C_{{}}^{{{\text{PD}}}}(t)$] и ${{C}^{{{\text{DNCF}}}}}(t)$ – ПФС (ДМГ и ФДн) и ДНКЖ соответственно. Уравнение для кинетики фотоокисления триптофана представлялось следующим образом:
(1)
$\frac{{d{{C}^{{{\text{TP}}}}}(t)}}{{dt}} = - k{{C}^{{{\text{TP}}}}}(t){{C}^{{{\text{PPS}}}}}(t){{C}^{{{\text{DNCF}}}}}(t).$(2)
${{C}^{{{\text{TP}}}}}(t) = C_{0}^{{{\text{TP}}}}\exp \left[ { - k\int\limits_0^t {{{C}^{{{\text{PPS}}}}}(\tau ){{C}^{{{\text{DNCF}}}}}(\tau )d\tau } } \right].$В дальнейшем будем определять наблюдаемую константу kobs скорости фотоокисления триптофана по уменьшению флуоресценции триптофана, анализируя линейный участок соответствующей кинетической зависимости, в течение которого окисляется примерно 20% количества триптофана в исходном растворе. При этом, как это следует из выражения (2), необходимо одновременно исследовать кинетику фотодеструкции ПФС и ДНКЖ, т.е. фиксировать соответствующие зависимости ${{C}^{{{\text{PPS}}}}}(t)$ и ${{C}^{{{\text{DNCF}}}}}(t)$. Ниже будет показано, что в исследуемом временном интервале [0, $\Delta t$] фотоокисления триптофана и при выбранных концентрациях всех компонентов, участвующих в исследуемом процессе фотоокисления триптофана, интегральное выражение в показателе экспоненты (2) с достаточной относительной точностью (∼5%) может быть представлено в виде линейной зависимости от времени:
(3)
$\chi (\Delta t) \equiv \int\limits_0^{\Delta t} {{{C}^{{{\text{PPS}}}}}(\tau ){{C}^{{{\text{DNCF}}}}}(\tau )d\tau } \approx \xi \Delta t,$(4)
$\Delta {{C}^{{{\text{TP}}}}} \equiv C_{0}^{{{\text{TP}}}} - {{C}^{{{\text{TP}}}}}(\Delta t) = C_{0}^{{{\text{TP}}}}k\xi \Delta t.$Поэтому константу $k_{{{\text{obs}}}}^{{{\text{TP}}}}$ скорости фотоокисления триптофана представляем в виде, учитывая, что фиксируемая интенсивность фотолюминесценции триптофана пропорциональна его концентрации в рабочей ячейке:
(5)
$k_{{{\text{obs}}}}^{{{\text{TP}}}} = {{k}^{{{\text{TP}}}}}\xi = \frac{{\Delta I}}{{{{I}_{0}}\Delta t}},$Можно вводить также эффективную константу keff скорости фотоокисления триптофана, приходящуюся на одну молекулу ПФС, определяя такую константу согласно $k_{{{\text{eff}}}}^{{{\text{TP}}}} = {{k_{{{\text{obs}}}}^{{{\text{TP}}}}} \mathord{\left/ {\vphantom {{k_{{{\text{obs}}}}^{{{\text{TP}}}}} {{{C}^{{{\text{PPS}}}}}}}} \right. \kern-0em} {{{C}^{{{\text{PPS}}}}}}}$.
Константы $k_{d}^{{(i)}}$ скорости фотодеструкции ДМГ и ДНКЖ рассчитывали по линейному участку соответствующих кинетических кривых согласно: $k_{d}^{{(i)}} = {{\Delta {{C}^{{(i)}}}} \mathord{\left/ {\vphantom {{\Delta {{C}^{{(i)}}}} {(C_{0}^{{(i)}}\Delta t)}}} \right. \kern-0em} {(C_{0}^{{(i)}}\Delta t)}}$, где $C_{0}^{{(i)}}$ и $\Delta {{C}^{{(i)}}}$ – соответственно исходная концентрация i-го компонента – ДМГ, ДНКЖ, и изменение концентрации соответствующего компонента при фотоокислении за время Δt. Как было показано ранее [22], существенное влияние на кинетику исследуемых процессов и, соответственно, на константу скорости фотосенсибилизированного окисления органических субстратов оказывает наличие в реакционной смеси АП, в качестве которого в данной работе использовался плюроник F127. При этом облучение светодиодом с длиной волны λ = 400 нм не оказывало воздействия на плюроник.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Была исследована фотосенсибилизирующая активность ДМГ в отсутствии и в присутствии плюроника F127 в реакционных системах на примере модельной реакции фотоокисления триптофана при введении в реакционную смесь ДНКЖ. Исходные концентрации $C_{0}^{{{\text{TP}}}}$ и $C_{0}^{{{\text{PPS}}}}$ ($C_{0}^{{{\text{DMG}}}}$ и $C_{0}^{{{\text{PD}}}}$) соответственно, триптофана и фотосенсибилизатора во всех экспериментах составляли $1 \times {{10}^{{ - 5}}}$ M и $1.5 \times {{10}^{{ - 6}}}$ M. Концентрация ДНКЖ варьировалась в пределах от нуля до $5.5 \times {{10}^{{ - 5}}}$ М, а концентрация плюроника F127 – от нуля до 5$5 \times {{10}^{{ - 5}}}$ М. Ниже мы ограничимся лишь частичным представлением полученных зависимостей. На некоторых примерах показано, каким образом проводился анализ кинетических зависимостей для получения общих заключений о роли разных компонентов в реакционной среде для установления их оптимальных концентраций при проведении фотосенсибилизированных процессов окисления органических субстратов, а также сеансов ФДТ.
На рис. 1 представлена кинетика убыли концентрации триптофана в процессе фотосенсибилизированного окисления растворенным в водной среде молекулярным кислородом при заданных в реакционной среде концентрациях ДМГ, ДНКЖ и плюроника F127. Каждое из значений результатов измерений, приводимых на этом рисунке, а также на всех последующих рисунках, является средней величиной трех независимых измерений. Для всех приводимых величин ошибки не превышали 10%.
Рис. 1.
Изменение концентрации триптофана в процессе реакции фотоокисления при следующих исходных концентрациях компонентов в системе: $C_{0}^{{{\text{DMG}}}} = 1.5 \times {{10}^{{ - 6}}}$ моль/л, $C_{0}^{{{\text{TP}}}} = 1 \times {{10}^{{ - 5}}}$ М, $C_{0}^{{{\text{DNCF}}}} = 2.0 \times {{10}^{{ - 5}}}$ моль/л, $C_{0}^{{{\text{F}}127}} = 5.0 \times {{10}^{{ - 5}}}$ моль/л; 1 – фотоокисление в присутствии DMG; 2 – фотоокисление в присутствии DMG и DNCF; 3 – фотоокисление в присутствии DMG, солюбилизированного плюроником F127, и DNCF.
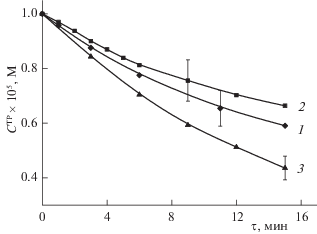
Как указывалось выше, при анализе представленных на рис. 1 зависимостей с целью получения информации о величинах наблюдаемых констант скоростей фотосенсибилизированного окисления триптофана необходимо фиксировать одновременно с уменьшающейся концентрацией ${{C}^{{{\text{TP}}}}}(t)$ триптофана в реакционной среде уменьшающиеся концентрации ${{C}^{{{\text{PPS}}}}}(t)$ и ${{C}^{{{\text{DNCF}}}}}(t)$ – ПФС и ДНКЖ соответственно. В исследуемых нами системах фиксируемые степени превращения этих компонентов варьировались от 10–15% до 50%. На рис. 2 и 3 для примера представлены зависимости ${{C}^{{{\text{DMG}}}}}(t)$ и ${{C}^{{{\text{DNCF}}}}}(t)$, фиксируемые при исследовании кинетических зависимостей окисления триптофана, представленных на рис. 1, когда в качестве ПФС использовался димегин. На рис. 4 представлены результаты численных расчетов (точки) зависимостей $\chi \left( {\Delta t} \right)$, получаемых в соответствии с выражением (3), и соответствующие интерполяционные линейные зависимости, определяющие параметры $\xi $, с использованием которых на основе выражений (5) и (6) определяются константы скорости углы рассматриваемых процессов.
Рис. 2.
Изменение концентрации димегина в процессе реакции фотоокисления триптофана при следующих исходных концентрациях компонентов в системе: $C_{0}^{{{\text{DMG}}}} = 1.5 \times {{10}^{{ - 6}}}$ моль/л, $C_{0}^{{{\text{TP}}}} = 1 \times {{10}^{{ - 5}}}$ М, $C_{0}^{{{\text{DNCF}}}} = 2.0 \times {{10}^{{ - 5}}}$ моль/л, $C_{0}^{{{\text{F}}127}} = 5.0 \times {{10}^{{ - 5}}}$ моль/л; 1 – фотоокисление в присутствии ДМГ, 2 – фотоокисление в присутствии ДМГ и ДНКЖ, 3 – фотоокисление в присутствии ДМГ, солюбилизированного плюроником F127, и ДНКЖ.

Рис. 3.
Изменение концентрации ДНКЖ в процессе реакции фотоокисления триптофана при следующих исходных концентрациях компонентов в системе: $C_{0}^{{{\text{DMG}}}} = 1.5 \times {{10}^{{ - 6}}}$ моль/л, $C_{0}^{{{\text{TP}}}} = 1 \times {{10}^{{ - 5}}}$ М, $C_{0}^{{{\text{DNCF}}}} = 2.0 \times {{10}^{{ - 5}}}$ моль/л, $C_{0}^{{{\text{F}}127}} = 5.0 \times {{10}^{{ - 5}}}$ моль/л; 1 – фотоокисление в присутствии ДМГ и ДНКЖ; 2 – фотоокисление в присутствии ДМГ, солюбилизированного плюроником F127, и ДНКЖ; 3 – фотолиз раствора ДНКЖ.
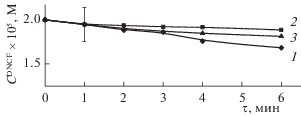
Рис. 4.
Зависимости (3), построенные для расчета величин ${{k}^{{{\text{TP}}}}}$, соответствующих кинетическим зависимостям, представленным на рис. 1: кривой 1 – а, кривой 2 – б, кривой 3 – в.

Найденные на основе этих зависимостей параметры и константы скорости окисления триптофана в водной среде при рассматриваемом содержании компонентов в реакционной среде представлены в табл. 1.
Таблица 1.
Расчетные параметры $\xi $ и константы скорости окисления триптофана (исходная концентрация $C_{0}^{{{\text{TP}}}} = 1 \times {{10}^{{ - 5}}}$ М) при разных составах реакционной среды, указанных в подписи к рис. 1 (здесь ${{R}^{2}}$ – величина достоверности используемых линейных аппроксимаций в зависимостях, представленных на рис. 3)
| Состав реакционной смеси | $\xi $ | ${{R}^{2}}$ | $k_{{{\text{obs}}}}^{{{\text{TP}}}}\, \times \,{{10}^{3}}$, с–1 | ${{k}^{{{\text{TP}}}}}\, \times \,{{10}^{3}}$, с–1 |
|---|---|---|---|---|
| TФ-ДМГ | 0.896 | 0.997 | 0.64 | 0.71 |
| TP-DNCF-DMG | 0.829 | 0.996 | 0.50 | 0.60 |
| TP-DNCF-DMG-F127 | 0.693 | 0.986 | 0.83 | 1.26 |
Очевидно, что фотодеградация ДМГ в процессе окисления триптофана приводит к понижению константы $k_{{{\text{obs}}}}^{{{\text{TP}}}}$ скорости его окисления, то есть к уменьшению функциональной активности рассматриваемой фотосенсибилизирующей (ФС) системы. Наличие в реакционной системе комплексов ДНКЖ с тиол-содержащими лигандами приводит к усилению деградации ДМГ из-за взаимодействия продуктов фотоокислительной деградации ДНКЖ непосредственно с порфириновым макроциклом [12]. Для получения соответствующих количественных оценок был исследован процесс фотолиза ДМГ при наличии или отсутствии в реакционной среде ДНКЖ. В обоих случаях в среде отсутствовал триптофан, наличие которого затрудняло бы получение количественной информации о содержании ДНКЖ реакционной среде, поскольку полосы поглощения продуктов разложения триптофана и ДНКЖ практически совпадают (290–310 нм и 310–360 нм соответственно). Оказалось, что в присутствии ДНКЖ (при концентрациях, используемых обычно в реакциях фотоокисления триптофана – см. рис. 2 и 3), константа скорости фоторазложения димегина возрастает более, чем на порядок. Было показано также, что аналогичным образом в присутствии димегина возрастает и скорость фоторазложения ДНКЖ (этот эксперимент также проводили в отсутствие триптофана в реакционной среде), причем возрастание это оказывается значительным в каталитических концентрациях ДМГ (5 × 10–6 М).
Поскольку при фотоиндуцированном разложении ДНКЖ с введением в реакционную среду радикалов NO• происходит не только фотодеструкция молекул ПФС, но и должна увеличивать скорость целевой реакции – прямого фотоокисления триптофана при взаимодействии с NO•, проблема увеличения общей скорости этого процесса должна состоять в исключении или в существенном снижении негативного разрушающего воздействия NO• и пероксинитрита на молекулы ПФС и, в то же время, сохранении таких воздействия на триптофан. И зависимость 3 на рис. 1 указывает на принципиальную возможность решения этой проблемы за счет введения в реакционную среду плюроника F-127. Ключевая роль плюроника в данном случае определяется ранее обнаруженным феноменом – образованием комплексов ПФС с АП и эффективной солюбилизацией ПФС. Последнее заключается в иммобилизации ДМГ в окрестности внутренних (по отношению к внешней водной среде) фрагментов F127 с формированием комплексов ДМГ-F127, которые эффективно экранируют молекулы ДМГ от воздействия образующихся при разложении ДНКЖ радикалов NO• [12]. При этом константа скорости фотодеструкции солюбилизированного ДМГ в смеси с ДНКЖ уменьшается почти в семь раз при возрастании концентрации плюроника F127 до 2 × 10–4 М. Следует подчеркнуть, что условием экранирования является также отсутствие взаимодействия плюроника F127 с ДНКЖ, на что указывает независимость скорости фотодеструкции ДНКЖ с тиол-содержащими лигандами (это демонстрируют специально поставленные эксперименты) от присутствия в реакционной среде плюроника. Необходимо также указать, что в то время как молекулы ПФС оказываются “защищенными” от разрушающего воздействия NO•, в реакционной среде сохраняются такие “разрушающие” воздействия радикалов NO• на триптофан. При этом одновременно понижается скорость фотодеградации ПФС и возрастает (см. также ниже табл. 2) скорость фотоиндуцированного разложения ДНКЖ, определяя эффективное возрастание константы скорости фотосенсибилизированного окисления триптофана.
Таблица 2.
Расчетные параметры $\xi $ и ${{R}^{2}}$, а также константы скорости разложения ДНКЖ и скорости фотодеградации ДМГ при составах реакционной среды, указанных в подписях к рис. 5
| Система | $\xi $ | ${{R}^{2}}$ | $k_{{{\text{obs}}}}^{{{\text{DNCF}}}} \times {{10}^{3}}$, c–1 | ${{k}^{{{\text{DNCF}}}}} \times {{10}^{3}}$, c–1 | $k_{{{\text{obs}}}}^{{{\text{DMG}}}} \times {{10}^{3}}$, c–1 | ${{k}^{{{\text{DMG}}}}} \times {{10}^{3}}$, c–1 |
|---|---|---|---|---|---|---|
| DMG | 0.9512 | 0.9996 | – | – | 0.50 | 0.526 |
| DNCF | 0.9467 | 0.9997 | 0.35 | 0.37 | – | – |
| DNCF-DMG | 0.5611 | 0.9589 | 0.48 | 0.86 | 5.8 | 10.34 |
| DNCF-DMG-F127 | 0.8354 | 0.9941 | 0.30 | 0.36 | 1.14 | 1.36 |
Объединенные данные по фотодеструкции ДМГ и ДНКЖ приведены на рис. 5а и 5б, где представлены относительные изменения со временем после начала фотовоздействия концентраций ДМГ и ДНКЖ в водных смесях, содержащих и не содержащих плюроник F127.
Рис. 5.
Относительное изменение со временем концентраций ДМГ (а) и ДНКЖ (б) в водных смесях, содержащих и не содержащих ДНКЖ (а), ДМГ (б) и плюроник F127 ($C_{0}^{{{\text{DNCF}}}} = 6.0 \times {{10}^{{ - 5}}}$ моль/л, $C_{0}^{{{\text{DMG}}}} = 1.5 \times {{10}^{{ - 6}}}$ моль/л; $C_{0}^{{{\text{F}}127}} = 2.0 \times {{10}^{{ - 4}}}$ моль/л), при облучении светом с длиной волны 400 нм: 1 – изменение концентрации ДМГ (а), ДНКЖ (б); 2 – изменение концентрации: а – ДМГ в присутствии ДНКЖ и б – ДНКЖ в присутствии ДМГ; 3 – изменение концентрации: а – ДМГ в системе с ДНКЖ и б – ДНКЖ в системе с ДМГ в присутствии плюроника F127.

На основе данных, представленных на рис. 5, были получены константы скорости фотоинициируемого разложения ДНКЖ и константы скорости фотодеградации ДМГ (табл. 2). Найденные величины представленных в этой таблице констант скоростей в полной мере соответствуют сделанным выше заключениям о качественных различиях констант разложения комплексов ДНКЖ с тиол-содержащими лигандами и фотодеградации ПФС для реакционных сред разного состава.
Найденные на основе проведенного анализа зависимости $k_{{{\text{obs}}}}^{{{\text{TP}}}}$ от $C_{0}^{{{\text{DNCF}}}}$ при фиксированных значениях $C_{0}^{{{\text{PPS}}}}$ ($C_{0}^{{{\text{DMG}}}}$ и $C_{0}^{{{\text{PD}}}}$), а также зависимости $k_{{{\text{obs}}}}^{{{\text{TP}}}}$ от $C_{0}^{{{\text{Pl}}}}$ представлены на рис. 6 и 7. На этих же рисунках для сопоставления представлены полученные в работе [12] соответствующие зависимости для констант скорости окисления триптофана при использовании фотодитазина (ФДн) в качестве ПФС. Как следует из сопоставления этих зависимостей, нахождение в реакционной среде плюроника F127 с концентрацией, превышающей концентрацию мицеллообразования, не только обусловливает повышение константы скорости фотоокисления органического субстрата, но и может способствовать проявлению специфической активности ДНКЖ, что особенно важно при осуществлении процедур фотосенсибилизированного окисления органических субстратов в нативных системах. Фактически зависимости, представленные на рис. 6 и 7, отражают в общих чертах взаимосвязи компонентов реакционных смесей, которые можно формировать для процедур ФДТ, имея в виду обнаруженную в данном исследовании возможность – инициирование одновременно с фотосенсибилизирующими воздействиями на патологические фрагменты пораженных тканей дополнительных воздействий, как цитотоксических, так и регуляторно-регенеративных, определяемых введением в систему комплексов ДНКЖ с тиолсодержащими лигандами [22].
Рис. 6.
Зависимости константы ${{k}^{{{\text{TP}}}}}$ скорости фотоокисления триптофана в присутствии ПФС от концентрации ДНКЖ при $C_{0}^{{{\text{F}}127}} = 0$, где в качестве ПФС использовался ДМГ ($C_{0}^{{{\text{DMG}}}} = 2.2 \times {{10}^{{ - 6}}}$ моль/л) – 1 и ФДн ($C_{0}^{{{\text{PD}}}} = 1.5 \times {{10}^{{ - 6}}}$ моль/л) – 2 при исходной концентрации триптофана $C_{0}^{{{\text{TP}}}} = 1 \times {{10}^{{ - 5}}}$ моль/л.
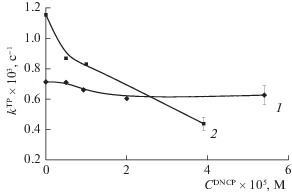
Рис. 7.
Зависимости константы скорости ${{k}^{{{\text{TP}}}}}$ фотоокисления триптофана в присутствии ДНКЖ от концентрации плюроника F127, где в качестве ПФС использовались ДМГ-кривая (1) и ФДн-кривая (2); $C_{0}^{{{\text{PD}}}} = 1.5 \times {{10}^{{ - 6}}}$ моль/л, $C_{0}^{{{\text{DMG}}}} = 2.2 \times {{10}^{{ - 6}}}$ моль/л, $C_{0}^{{{\text{TP}}}} = 1 \times {{10}^{{ - 5}}}$ моль/л, $C_{0}^{{{\text{DNCF}}}} = 1.0 \times {{10}^{{ - 5}}}$ моль/л.

Таким образом, использование плюроника F127 в качестве фактора, предотвращающего фотодеградацию ПФС в условиях фотосенсибилизированного окисления органических субстратов при введении в реакционную систему ДНКЖ с тиол-содержащими лигандами, открывает принципиальную возможность проведения процедур ФДТ с одновременным инициированием регенеративно-репарационных процессов в организме. Конечно, только результаты практического использования таких вариантов ФДТ позволят оценить, насколько совмещение фотоиндуцированных процессов некроза и апоптоза клеток патологических тканей с инициированием процессов грануляции и эпителизации “обработанных” тканей повысит эффективность предлагаемой терапии.
Работа выполнена при поддержке Российского научного фонда (грант 16-13-10295).
Список литературы
Iwai Y., Ishida M., Honjo T. et al. // PNAS. 2002. V. 99. № 19. P. 12293.
Popov P.B. // XLIX International Scientific and Practical Conference. Hajdusoboszlo. Hungary. 2018. P. 88.
Легостаев В.М., Бабенков О.Ю., Мальдонадо Г.М. и др. // Ibid. 2018. P. 42.
Странадко Е.Ф., Малова Т.И., Пономарев Г.В. // Ibid. 2018. P. 134.
Шишко Е.Д., Штонь И.А., Прокопенко И.В. // Ibid. 2018. P. 181.
Kovalenko Y.L., Melekhovets O.K., Melekhovets Yu.V. // Ibid. 2018. P. 36.
Kharchenko T.O., Melekhovets O.K., Meletkhovets Y.V., Rad’ko A.C. // Ibid. 2018. P. 34.
Solovieva A.B., Tolstih P.I., Melik-Nubarov N.S. et al. // Las.Phys. 2010. № 5. P. 1068–1074.
Solovieva A.B., Aksenova N.A., Glagoleva N.N. et al. // R.J. of Ph. Ch. B. 2012. V. 6. № 3. P. 433–440.
Solovieva A.B., Melik-Nubarov N.S., Zhiyentayev T.M. et al. // Las. Phys. 2009. V. 19. № 4. P. 1.
Климова Е.М., Лавинская Е.В., Быченко Е.А. и др. // XLIX International Scientific and Practical Conference. Hajdusoboszlo. Hungary. 2018. P. 103.
Solovieva A.B., Vanin A.F., Timashev S.F. // The 26th International Conference on Advanced Laser Technologies. Tarragona. Spain. 2018. P. B-O-2.
Ванин А.Ф. Динитрозильные комплексы железа с тиолсодержащими лигандами. Физикохимия, биология, медицина. М.: Ижевск. 2015, 219 с.
Ванин А.Ф. // Успехи физических наук. 2000. Т. 170. № 4. С. 455–458.
Murad F. // Biosci Rep. 1999. V. 19. P. 133.
Mur L.A.J., Carver T.W., Prats E. // J. Exp. Bot. 2006. V. 57. P. 489.
Besson-Bard A., Pugin A. // Annu. Rev. Plant Biol. 2008. V. 59. P. 21.
Wink D.A., Mitchell J.B. // Free Radic. Biol. Med. 1998. V. 25. P. 434.
Vanin A.F., Svistunenko D., Mikoyan V.D. et al. // J. Biol. Chem. 2004. V. 279. P. 24100.
Ванин А.Ф. // Биохимия. 1998. Т. 63. № 7. С. 924.
Vanin A.F., Poltorakov A.P., Mikoyan V.D. et al. // Nitric Oxide: Biol. & Chem. 2010. V. 23. № 2. P. 136.
Aksenova N.A., Glagolev N.N., Chernjak A.V. // Laser Physics. 2012. V. 22. № 10. P. 1642.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии


