Журнал физической химии, 2019, T. 93, № 9, стр. 1357-1361
Влияние катионов металлов на кинетику образования и структуру гелей, формирующихся при кислотном гидролизе тетраэтоксисилана
Е. А. Тарасенко a, О. Е. Лебедева a, *, Г. С. Петерс b, А. А. Велигжанин b
a Белгородский государственный национальный исследовательский университет
Белгород, Россия
b Научно-исследовательский центр “Курчатовский институт”
Москва, Россия
* E-mail: OLebedeva@bsu.edu.ru
Поступила в редакцию 06.11.2018
После доработки 11.02.2019
Принята к публикации 12.02.2019
Аннотация
Исследованы процессы гидролиза и поликонденсации тетраэтоксисилана при низких значениях рН в присутствии легирующих добавок – катионов различных металлов. Методом вискозиметрии определено время гелеообразования и рассчитана энергия активации этого процесса; показано, что легирующие добавки влияют на оба указанных параметра. Методом динамического светорассеяния изучено изменение размеров частиц в процессе гидролитической поликонденсации тетраэтоксисилана в присутствии катионов металлов. Методом малоуглового рассеяния рентгеновских лучей определены структурные характеристики полученных гелей – радиус инерции и фрактальная размерность поверхности. Сделан вывод о механизме формирования частиц – кинетически контролируемой агрегации типа кластер–кластер.
Среди перспективных методов получения новых материалов с заданными свойствами выделяется золь-гель метод. На его основе можно получать различные неорганические материалы – стекла, керамику, аэрогели, гибридные материалы в виде пленок и порошков с регулируемыми микроструктурой и свойствами [1–4].
Прекурсором для получения силикатных материалов золь-гель методом часто служит тетраэтиловый эфир ортокремниевой кислоты (тетраэтоксисилан – ТЭОС). Путем его гидролиза с последующей поликонденсацией удается получить широкий спектр материалов [5–8], при этом легирующие добавки вносятся непосредственно в исходный раствор. Наибольшее влияние на структуру конечного продукта оказывают величина pH и природа катализатора гидролиза. В качестве катализаторов кислотного гидролиза наиболее часто используют минеральные кислоты (соляную, азотную и др.), для основного гидролиза применяют гидроксид аммония. Менее распространенными катализаторами гидролиза являются уксусная кислота, гидроксид калия, амины, фторид калия, плавиковая кислота, алкоксиды титана, алкоксиды и оксиды ванадия [9–11].
Выделяют три области значений pH, при которых процессы гидролиза и поликонденсации имеют свои характерные особенности: pH < 2, pH в интервале 2–7 и pH > 7. При гидролизе в области pH 2–7 образуются разветвленные структуры и трехмерные сетки гелей. В щелочных средах происходит образование крупных вторичных частиц с формой, близкой к сферической [12]. Область значений pH < 2 метастабильна. Считается, что в данном диапазоне рН образующиеся частицы кремнезоля имеют положительный заряд, и скорость полимеризации пропорциональна концентрации протонов [12]. Образование структуры геля при низких значениях pH происходит за несколько часов, в то время как при других значениях pH данный процесс может занимать несколько суток.
На формирование структуры гелей также оказывает существенное влияние присутствие электролитов. В литературе описаны механизмы влияния катионов металлов различного заряда на процессы коагуляции золей на основе кремнезема. Большинство из них основано на предположении, что катионы могут выступать как агенты, формирующие мостиковую связь между частицами золя в результате адсорбции катионов на поверхности кремнезоля. Однако представленные результаты исследований относятся к областям pH в диапазоне 4.5–11 [13]. Таким образом, область гидролиза ТЭОС при низких значениях рН наименее изучена, а о влиянии катионов на синтез силикатных материалов и на их структуру в данной области информация практически отсутствует.
Задача настоящей работы – изучение особенностей гидролиза ТЭОС в метастабильной области в присутствии катионов металлов, ведущего к получению новых функциональных силикатных материалов, а также исследование структуры этих материалов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве прекурсора для получения силикатных материалов использовали ТЭОС (Si(C2H5O)4) квалификации “ос. ч.”; в качестве легирующих добавок – катионы металлов различного заряда. Их источниками служили нитраты серебра, натрия, калия, кристаллогидраты нитратов никеля(II), кобальта(II), железа(III), церия(III). Получение гелей осуществляли путем гидролиза водно-спиртового раствора ТЭОС в кислой среде с использованием катализатора – азотной кислоты. Навеску соли металла растворяли в заданном объеме дистиллированной воды. Навеску рассчитывали таким образом, чтобы содержание катиона металла составило 3 × 10–4 моль в 1 г сухого порошка на основе SiO2, полученного после прокаливания ксерогеля. К раствору соли добавляли необходимые объемы ТЭОС, этанола и азотной кислоты. В результате получали прозрачные бесцветные или слабо окрашенные растворы с мольным соотношением ТЭОС : этанол : H2O : HNO3 = 1 : 4 : 16 : 0.6. Полученные растворы термостатировали до образования устойчивого геля.
Кинематическую вязкость кремнезолей в ходе процесса регистрировали с помощью вибрационного вискозиметра SV-10, Япония, до достижения значения 10000 мПа с. Для расчетов энергии активации гелеобразования вязкость растворов измеряли при температурах 40, 50 и 60°C. Изменение гидродинамического размера частиц изучали методом динамического светорассеяния при помощи анализатора ZetaSizer Nano ZS (“Malvern Instruments”, Великобритания), оборудованного лазером He/Ne 633 нм. Исследование структуры конечных продуктов поликонденсации – гелей – проводили методом малоуглового рентгеновского рассеяния (МУРР). Измерения проводили на станции малоуглового рентгеновского рассеяния БиоМУР Курчатовского источника синхротронного излучения с использованием детектора Pilatus 3 1M фирмы Dectris, в диапазоне векторов рассеяния 0.04–1.7 нм–1. Применяли однокристальный фокусирующий монохроматор Si (111) при длине волны 0.1445 нм. Структуру гелей описывали в терминах радиуса инерции Rg и фрактальной размерности.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Гидролиз ТЭОС при использованной концентрации кислоты протекает с высокой скоростью [12], и процесс поликонденсации начинается в первые минуты эксперимента, поэтому временем начала гелеобразования можно считать момент смешивания всех компонентов реакционной смеси. Кривые изменения вязкости с течением времени при температуре 40°С для кремнезолей, легированных различными катионами, представлены на рис. 1.
Рис. 1.
Зависимости вязкости растворов от времени в процессе гидролиза ТЭОС при 40°С в присутствии добавок катионов металлов: 1 – Ni2+, 2 – без добавок, 3 – Ce3+, 4 – Fe3+, 5 – Ag+, 6 – Co2+, 7 – Na+.

Характер изменения вязкости всех золей подобен и включает три временных периода. На первом этапе вязкость золей растет монотонно и очень медленно, что свидетельствует об устойчивости систем золь–гель. Стабильное состояние для силикагеля без добавок легирующих катионов наблюдается в течение ∼11 ч, значение вязкости в этот период изменяется в пределах от 2.21 до 10.00 мПа с. Затем наступает второй временной период, для которого характерно скачкообразное увеличение вязкости, в результате чего происходят резкое снижение текучести золей и формирование пространственной сетки геля. Время, при котором наблюдается интенсивное повышение вязкости, называется временем гелеобразования, оно характеризует переход золя в гель, формирование и уплотнение трехмерной сетки геля. За точку окончания гелеобразования для всех образцов условно принимали время, при котором вязкость раствора достигала 400 мПа с. На третьем этапе происходит уплотнение структуры геля, обусловленное образованием дополнительных связей между структурными элементами сетки, что характеризуется дальнейшим ростом вязкости системы.
Оказалось, что введение в исходную систему катионов легирующих металлов, как правило, значительно увеличивает время существования золя, что проявляется в увеличении времени стабилизации. Наиболее длительное стабильное состояние наблюдается для силикагеля, легированного катионами натрия (∼15.8 ч). Однако в изученном ряду катионов обнаруживаются исключения. Так, в присутствии катионов никеля время стабильности золя при температуре 40°С составляет 9.8 ч, что в 1.1 раза меньше по сравнению с чистым силикагелем. Время достижения точки гелеобразования при 40°С растет в ряду: Ni2+ < силикагель без легирующих добавок < Ce3+ < < Ag+ < Fe3+ < Co2+ < Na+. Расширение области существования золя, предшествующего формированию сетки геля, при введении в раствор ионов металлов указывает на участие катионов в процессах гидролиза и поликонденсации ТЭОС.
На основании данных, полученных в ходе реологических исследований процессов гелеобразования при различных температурах, рассчитывали энергии активации процесса. Расчеты выполняли по уравнению Аррениуса. За среднюю скорость реакции гелеобразования принимали обратное значение времени гелеобразования:
Расчетные значения энергии активации гелеобразования представлены в табл. 1. Из полученных результатов следует, что присутствие ионов металлов влияет не только на время гелеобразования, но и на значение энергии активации процесса гелеобразования. Энергия активации гелеобразования может быть выше или ниже рассчитанной для чистого силикагеля. При этом отсутствует корреляция между энергией активации и зарядом катиона.
Таблица 1.
Расчетные значения энергии активации (Ea, кДж/моль) для различных гелей
| Легирующий катион | – | Ag+ | Na+ | Co2+ | Ni2+ | Fe3+ | Ce3+ |
|---|---|---|---|---|---|---|---|
| Ea | 49.0 | 64.7 | 57.7 | 63.2 | 40.2 | 44.4 | 54.8 |
Анализ данных, полученных методом динамического светорассеяния, о распределении гидродинамических размеров частиц по объему на разных этапах конденсации гелей подтверждает влияние катионов металлов на процессы, протекающие в ходе гидролитической поликонденсации ТЭОС.
Необходимо отметить, что все исследуемые системы полидисперсны. Для них характерно бимодальное распределение, отражающее, по-видимому, сосуществование первичных частиц, образующихся в ходе поликонденсации тетраэтоксисилана, и вторичных агрегатов, которые составляют основную часть формирующихся структурных единиц будущего геля. В случае силикагеля без легирующих добавок на первом этапе процесс поликонденсации начинается с образования мелких зародышевых частиц, а затем следует этап их роста. Однако эти частицы нестабильны, и, вероятно, в результате гидролиза происходит уменьшение их размеров. Дальнейшее взаимодействие частиц при низких значениях рН приводит к формированию более крупных вторичных агрегатов, которые продолжают увеличиваться за счет параллельно формирующихся мелких частиц. Эти данные согласуются с полученными авторами [13] и описываются моделью роста частиц, предложенной в работе [14].
Введение катионов металлов, очевидно, оказывает стабилизирующее действие на процессы поликонденсации, протекающие в золь–гель-системе. На первом этапе, как правило, образуются частицы меньшего размера по сравнению с силикагелем без легирующих добавок. Затем, как и в случае чистого силикагеля, в результате агрегации происходит формирование более крупных вторичных частиц. Динамика роста этих вторичных частиц в процессе гидролитической поликонденсации тетраэтоксисилана в присутствии катионов металлов представлена на рис. 2.
Рис. 2.
Изменение среднего гидродинамического диаметра (d) вторичных агрегатов в ходе гидролитической поликонденсации ТЭОС в присутствии различных катионов.

Для гелей, легированных катионами Na+, Ni2+, Co2+, Ce3+, характерно появление бимодального распределения частиц по объему на ∼30-й минуте эксперимента. Первый максимум соответствует частицам со средним гидродинамическим диаметром 1.4 нм; второй максимум отвечает появлению более крупных частиц со средним гидродинамическим диаметром ∼4 нм.
Для гелей, легированных катионами Ag+ и Fe3+, характерно более позднее образование вторичных агрегатов: оно происходит через ∼8 ч после начала реакции. Для системы, содержащей катионы серебра, частицы со средним диаметром 15.3 нм занимают 8% от общего объема, остальной объем приходится на более мелкие частицы с диаметром ∼5.4 нм. Через 2 ч на долю крупных частиц диаметром 16.2 нм приходится уже 14.6%. Через 12 ч после начала реакции система однородна, и наиболее вероятный гидродинамический размер частиц составляет 18.1 нм, что отвечает самым крупным частицам из всех изученных образцов.
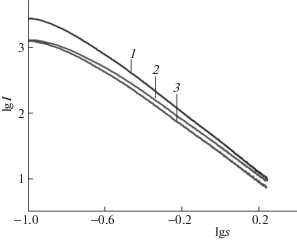
Дополнительную информацию о структурных параметрах конечных продуктов поликонденсации – гелей, легированных катионами металлов, получали с помощью метода МУРР. Радиус инерции Rg определяли по наклону линейной экстраполяции начального участка кривой МУРР (области Гинье), построенной в виде зависимости lnI от s2. Фрактальную размерность рассчитывали на основе тангенса угла наклона касательной, проведенной к графику интенсивности рассеяния в координатах зависимости lg I от lg s в области Порода.
На рис. 3 для примера представлены типичные кривые малоуглового рассеяния в координатах lg I–lg s, а в табл. 2 приведены структурные параметры, рассчитанные на их основе. Можно видеть, что введение легирующих добавок катионов различных металлов оказывает влияние на структуру геля. Так, присутствие катионов (за исключением кобальта) снижает радиус инерции по сравнению с силикагелем без легирующих добавок; наименьший радиус инерции зафиксирован при введении катионов церия.
Таблица 2.
Структурные параметры гелей, рассчитанные по данным МУРР
| Параметр | – | Ag+ | Na+ | Co2+ | Ni2+ | Fe3+ | Ce3+ |
|---|---|---|---|---|---|---|---|
| Rg, нм | 9.5 | 8.0 | 9.0 | 9.6 | 7.4 | 7.8 | 7.0 |
| Dm | 2.2 | 2.6 | 2.3 | 2.4 | 2.2 | 2.2 | 2.2 |
Введение катионов металлов приводит к ограничению общего размера фрактального агрегата. Расчеты показали, что все образцы относятся к массовым фракталам. Фрактальная размерность Dm для всех исследуемых образцов лежит в пределах от 2.20 до 2.60, что соответствует разветвленным структурам (табл. 2). По мере роста Dm структура геля становится все менее рыхлой, и происходит формирование более плотной поперечно-сшитой трехмерной структуры. Среди изученных образцов наиболее плотной структурой обладает гель, легированный катионами серебра. Известно, что в диапазоне значений Dm ≥ 3 происходит переход от трехмерных сеток к компактным частицам с шероховатой поверхностью, однако таких значений для исследуемых образцов не зафиксировано.
В работе [15] показана взаимосвязь фрактальной размерности и модели образования фрактального агрегата. Из множества моделей, предложенных для описания механизмов агрегации в системах на основе SiO2, выделяют две – диффузионно контролируемую агрегацию (ДКА, модель Виттена–Сандера) и кинетически контролируемую агрегацию (ККА) типа кластер–кластер или частица–кластер. Эти процессы приводят к образованию двух структурно различных фрактальных агрегатов. Для модели ДКА фрактальная размерность агрегата не превышает значения Dm = 2. Для ККА фрактальная размерность лежит в пределах 2 < Dm < 3. Модель роста ККА характерна для систем, в которых между частицами имеется высокий отталкивающий барьер; в этом случае процессы агрегации зависят от величины потенциала межчастичного взаимодействия [15]. В нашем случае значения массовой фрактальной размерности агрегатов всех исследуемых образцов соответствуют фрактальным размерностям агрегатов, сформированных в ходе кинетически контролируемой агрегации типа кластер–кластер.
Возникает естественное предположение, что катионы некоторых металлов (например, Ag+, Na+, Co2+, Ce3+), вступая во взаимодействие с частицами кремнезоля, формирующимися в ходе гидролитической поликонденсации тетраэтоксисилана, повышают межчастичный потенциал, тем самым препятствуя процессам конденсации и образования геля. Другие катионы (например, Ni2+ и Fe3+), вероятно, такого воздействия не производят.
Таким образом, добавки катионов легирующих металлов оказывают существенное влияние на кинетику процессов образования гелей на основе тетраэтоксисилана в процессе гидролитической поликонденсации в кислой среде. Установлено, что введение катионов металлов в систему на основе тетраэтоксисилана приводит к увеличению времени гелеобразования в ряду (при температуре 40°С): Ni2+ < силикагель без легирующих добавок < Ce3+ < Ag+ < Fe3+ < Co2+ < Na+. Введение в систему катионов металлов влияет на энергию активации процесса гелеобразования: катионы Fe3+ и Ni2+ снижают энергию активации гелеобразования относительно силикагеля без добавок, в то время как другие катионы, в особенности Co2+, существенно ее увеличивают. Гели, полученные в ходе гидролитической поликонденсации тетраэтоксисилана в присутствии катионов легирующих металлов, являются массовыми фрактальными агрегатами. На основании размерности массовых фракталов сделан вывод о механизме их формирования – кинетически контролируемой агрегации типа кластер–кластер.
Список литературы
Конькова Т.В., Гордиенко М.Г., Алехина М.Б., Меньшутина Н.В. // Журн. физ. химии. 2017. Т. 91. № 3. С. 450.
Bu I.Y. // Optik. 2018. V. 162. P. 121.
Maa Z., Jiang Y. // Appl. Surface Science. 2018. V. 436. P. 732.
Кузнецова Т.Ф., Ратько А.И., Еременко С.И. // Журн. физ. химии. 2012. Т. 86. № 10. С. 1730.
Zhanga Q., Denga X. // Engineering Failure Analysis. 2017. V. 82. P. 64.
Komarneni S., Abothu I.R., Rao A.V.P. // J. Sol–Gel Sci. Techn. 1999. № 15. P. 263.
Lee G.R., Crayston J.A. // J. Adv. Materials. 1993. V. 5. P. 434.
Levy D., Esquivias L. // Ibid.1995. V. 7. № 2. P. 120.
Yousif A., Omer Alhussein O.-Y., Eltoum M.S. // Int. J. Multidisciplinary Sci. Eng. 2015. V. 6. № 1. P. 19.
Nagao D., Osuzu H. // J. Colloid Interface Sci. 2004. V. 279. P. 143.
Cihlz J. // Colloids and Surfaces A. 1993. V. 70. P. 239.
Iler R.K. The Chemistry of Silica: Solubility, Polymerization, Colloid and Surface Properties and Biochemistry of Silica. New York: Wiley and Sons, 1979. 896 p.
Goutam B.K., Ganguli D. // J. Materials Chem. 2000. V. 10. P. 2289.
Lamer V.K., Dinegar R.H. // J. Amer. Chem. Soc. 1950. V. 72. P. 4847.
Ролдугин В.И. // Успехи химии. 2003. Т. 72. № 10. С. 931.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии