Журнал физической химии, 2020, T. 94, № 1, стр. 114-120
Константы комплексообразования наномаркеров семейства флуоресцеина с бычьим сывороточным альбумином в водных растворах
И. М. Власова a, b, *, А. А. Власов a, А. А. Кулешова a, Ю. А. Гордеева a, А. М. Салецкий a
a Московский государственный университет им. М.В. Ломоносова
Москва, Россия
b Российская академия наук, Центр теоретических проблем физико-химической фармакологии
Москва, Россия
* E-mail: vlasovairina1979@mail.ru
Поступила в редакцию 22.02.2018
После доработки 22.02.2018
Принята к публикации 09.04.2018
Аннотация
Исследовано комплексообразование наномаркеров семейства флуоресцеина с БСА в водных растворах и определены его константы. Построены три различные модели для интерпретации экспериментальных данных. С их помощью найдены и объяснены эффект насыщения комплексообразования БСА с наномаркерами, наличие отрицательной кооперативности в комплексообразовании и зависимость комплексообразования от взаимного сочетания величин электростатических зарядов на белке и на наномаркерах. Рассчитан параметр сродства наномаркеров к БСА при образовании комплексов.
Бычий сывороточный альбумин (БСА) – это белок из семейства альбуминов [1], выполняющий транспортные функции в плазме крови. Его молекулярная масса 64 кДа, изоэлектрическая точка БСА pI 4.9. Высокое содержание альбумина в крови, его распространенность в лимфе и в различных тканях говорят о ключевом значении альбумина для организма.
Благодаря уникальному строению (существованию различных центров связывания) БСА образует разнообразные комплексы с органическими и неорганическими лигандами. Это определяет основную функцию белка в кровотоке – транспорт физиологических метаболитов и некоторых лекарственных препаратов, помимо поддержания онкотического давления крови и участия в антиокислительных процессах [1]. При образовании комплексов БСА с лигандами его конформация изменяется определенным образом, что отражается на связывании белка с другими последующими лигандами.
Для исследования процессов комплексообразования БСА с лигандами широко применяется метод флуоресцентного анализа. В этом методе оценивается как собственная флуоресценция белка, так флуоресценция наномаркеров [2–7]. Флуоресцентными методами с применением наномаркеров можно регистрировать очень тонкие конформационные перестройки БСА, что позволяет судить о качественном состоянии самого белка, а по нему и о степени патологического состояния организма в различных медицинских исследованиях.
В данной работе используются анионные при физиологическом значении pH (7.4) наномаркеры семейства флуоресцеина – исходное соединение флуоресцеин и его галоген – производные (тетра-хлор-тетра-йод-производная – бенгальский розовый, тетра-бром-производная – эозин, тетра-йод-производная – эритрозин).
Ранее нами были исследованы механизмы комплексообразования этих наномаркеров с сывороточным альбумином человека (САЧ) и определены соответствующие константы связывания с САЧ [8–15]. В данной работе, в продолжение наших исследований, мы получили экспериментальные данные по константам комплексообразования (ассоциации) наномаркеров с БСА и интерпретировали их с помощью различных моделей.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе для поддержания заданных значений pH приготавливались буферные растворы – 0.1 М CH3COOH – KOH (pH 3.5–5.0) и 0.1 М KH2PO4 – 0.1 М NaOH (pH 6.0–8.0) – из реактивов квалификации “х.ч.”. На их основе были изготовлены растворы соответствующего наномаркера (3 мкМ) (флуоресцеина / эритрозина / эозина / бенгальского розового), к которым добавлялись различные концентрации БСА (10–150 мкМ) производства фирмы SIGMA. Эксперименты далее проводились при различных значениях pH (3.5–8.0).
Измерения флуоресценции наномаркеров проводились на спектрофлуориметре LS 55 (Perkin Elmer). Измерения флуоресценции растворов наномаркеров выполнялись через фиксированный интервал времени после добавления в них БСА при комнатной температуре (298 K).
Флуоресценция наномаркеров возбуждалась светом со следующими длинами волн: 1) флуоресцеин – $\lambda _{{{\text{возб}}}}^{{{\text{фл}}}}$ = 440 нм; 2) эритрозин – $\lambda _{{{\text{возб}}}}^{{{\text{эрит}}}}$ = = 530 нм; 3) эозин – $\lambda _{{{\text{возб}}}}^{{{\text{эоз}}}}$ = 520 нм; 4) бенгальский розовый – $\lambda _{{{\text{возб}}}}^{{{\text{фл}}}}$ = 540 нм.
Спектры флуоресценции обрабатывались программой FL Winlab (Perkin Elmer). Суммарная систематическая погрешность (σсистем) в расчете констант комплексообразования определялась по [16]: ${{\sigma }_{{{\text{систем}}}}} = \sqrt {(\sigma _{{{\text{МНК}}}}^{2} + \sigma _{{{\text{мет}}}}^{2} + \sigma _{{{\text{прибор}}}}^{2} + \sigma _{{{\text{округл}}}}^{2})} $, где σмет – погрешность методов, σприбор – погрешность приборов, σокругл – погрешность округлений, σМНК – погрешность использования метода наименьших квадратов.
Следует особо отметить, что найденные из экспериментов значения констант тушения флуоресценции наномаркеров (или констант их комплексообразования с БСА), не должны рассматриваться в смысле их абсолютных значений. Они важны для сравнения их значений при различных pH и для различных типов наномаркеров в рамках выбранной модели.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Для различных значений pH построены зависимости (F0/F) – 1 от [Q0], где F0 – интенсивность флуоресценции флуоресцеина/эритрозина/эозина/бенгальского розового в отсутствие БСА, F – интенсивность флуоресценции соответствующих наномаркеров в присутствии БСА, [Q0] – концентрация БСА. В качестве примера представлены зависимости для эритрозина (рис. 1, вставка).
Рис. 1.
Зависимости констант (в рамках Модели 1) тушения флуоресценции K1 наномаркеров в растворах БСА от pH: 1 – флуоресцеин, 2 – эритрозин, 3 – эозин, 4 – бенгальский розовый. На вставке: Графики Штерна–Фольмера тушения флуоресценции эритрозина добавлением различных концентраций БСА при различных значениях pH.

Во всех случаях полученные зависимости (F0/F) – 1 от [Q0] имеют нелинейный характер. Для их интерпретации построим различные модели
Модель 1. Разложение кривых тушения флуоресценции на два линейных случая в рамках модели Штерна–Фольмера
При тушении флуоресценции наномаркеров в растворах добавлением различных концентраций БСА можно согласно теории Штерна–Фольмера [5] записать уравнение:
где K – константа тушения флуоресценции наномаркера, определяющая комплексообразование каждого наномаркера с белком (М–1). Данная модель Штерна–Фольмера описывает линейную зависимость (F0/F) – 1 от [Q0].Для более точного описания полученных нелинейных зависимостей (F0/F) – 1 от [Q0] разложим их в рамках данной Модели 1 на две составляющие – для БСА < 20 мкМ и для БСА > 20 мкМ, линейно их аппроксимируем и получим две константы (рис. 1 – константа K1 для БСА < 20 мкМ и рис. 2 – константа K2 для БСА > 20 мкМ) тушения флуоресценции наномаркеров. Эти константы отражают различные виды взаимодействий наномаркеров с БСА. Видно из сравнения констант K1 и K2, что для относительно малой концентрации белка комплексообразование более сильное по сравнению с относительно большой концентрацией.
Рис. 2.
Зависимости констант (в рамках Модели 1) тушения флуоресценции K2 наномаркеров в растворах БСА от pH: 1 – флуоресцеин, 2 – эритрозин, 3 – эозин, 4 – бенгальский розовый.
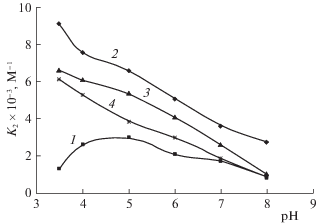
Из рис. 1, 2 видно, что обе константы тушения флуоресценции (K1 и K2) флуоресцеина, фактически отражающие комплексообразование наномаркера и белка, имеют нелинейный характер с максимумом при pH 5.0. То есть максимально эффективное связывание флуоресцеина с БСА имеет место при pH 5.0. Полученный результат можно объяснить, исходя из качественного рассмотрения сравнительных характеристик электрического заряда Q молекул белка и наномаркеров (рис. 3). Из рис. 3 видно, при pH 5.0 молекулы флуоресцеина слабо положительно заряжены, а молекулы БСА слабо отрицательно заряжены, при этом и происходит максимально эффективное комплексообразование.
Рис. 3.
Качественные сравнительные характеристики электрического заряда Q молекул БСА и наномаркеров.

Для эритрозина видно (рис. 1, 2), что максимально эффективное комплексообразование эритрозина с БСА имеет место при pH < 5.0, т.е. когда белок в целом положительно заряжен, а эритрозин или находится в нейтральной форме или находится в форме моноаниона (рис. 3).
Для эозина видно (рис. 1, 2), что максимально эффективное связывание эозина с БСА имеет место при pH < 5.0, когда молекулы белка в целом положительно заряжены, а эозин находится в форме моноаниона (рис. 3).
Для бенгальского розового (рис. 1, 2) видно, что максимально эффективное взаимодействие бенгальского розового с БСА имеет место при pH < 5.0, когда молекулы белка в целом положительно заряжены, а бенгальский розовый находится в формах моноаниона или дианиона (рис. 3).
Также из рис.1, 2 видно, что обе константы тушения флуоресценции (K1 и K2) галоген-производных флуоресцеина имеют монотонно убывающий характер с ростом pH, что отличает комплексообразование с БСА галоген-производных флуоресцеина от исходного соединения – флуоресцеина.
То, что с уменьшением pH происходит увеличение связи наномаркеров с белком, можно объяснить эффектом диссоциации основных групп белка и, соответственно, увеличением положительного заряда на белке и, как следствие, увеличением электростатического взаимодействия белка с отрицательно заряженными наномаркерами.
Из сравнения значений констант K1 обнаружено (рис. 1), что наличие в молекуле наномаркера более электроотрицательного атома (увеличение электроотрицательности происходит в направлении: флуоресцеин – эритрозин – эозин – бенгальский розовый) приводит к уменьшению значений констант K1, отражающих фактически комплексообразование наномаркера с БСА в области pH 5.0–8.0, что указывает на влияние электроотрицательности молекул наномаркеров на ионный механизм взаимодействия наномаркеров с белком.
Обнаруженные две закономерности – 1) нелинейный характер зависимости констант тушения флуоресценции (фактически констант комплексообразования) от pH для исходного флуоресцеина и монотонно убывающий характер зависимости этих констант от pH для галоген-производных флуоресцеина, 2) в области pH 5.0–8.0 уменьшение значений констант комплексообразования K1 с увеличением электроотрицательности наномаркера – схожи для связывания наномаркеров как с БСА, так и с САЧ.
При этом обнаружено и отличие связывания наномаркеров с БСА от связывания с САЧ: значения константы K2 галоген-производных флуоресцеина с белком при высоких значениях pH (6.0–8.0) больше в растворах БСА по сравнению с растворами САЧ (значения констант для САЧ в [15]).
Модель 2. Описание зависимостей Штерна–Фольмера сигмоидальной функцией
При нелинейном характере зависимости (F0/F) – 1 от [Q0] тушение флуоресценции наномаркеров в растворах добавлением различных концентраций белка можно аппроксимировать следующим образом:
где n – коэффициент кооперативности Хилла, Ksigm – константа тушения флуоресценции наномаркеров, фактически константа комплексообразования наномаркеров с белком (М–1), Ksigm = $\sqrt[n]{K}$.В рамках данной модели с использованием сигмоидальной (при n < 1) функции описания тушения флуоресценции определены Ksigm константы тушения флуоресценции наномаркеров, отражающие их комплексообразование с БСА, и коэффициенты кооперативности n Хилла (рис. 4).
Рис. 4.
Зависимости констант (в рамках Модели 2) тушения флуоресценции (Ksigm) наномаркеров семейства флуоресцеина в растворах БСА от pH: 1 – флуоресцеин, 2 – эритрозин, 3 – эозин, 4 – бенгальский розовый. На вставке: Зависимости коэффициента n кооперативности Хилла взаимодействия наномаркеров семейства флуоресцеина с БСА от pH.

Из рис. 4 видно, что зависимость константы Ksigm для флуоресцеина от pH имеет нелинейный характер с максимумом при pH 5.0. При этом в области pH > 5.0 взаимодействие флуоресцеина с БСА происходит более эффективно по сравнению с pH < 5.0.
Из рис. 4 видно, как и в предыдущей модели, константы тушения флуоресценции галоген-производных флуоресцеина имеют монотонно убывающий характер с ростом pH, что указывает на сильное комплексообразование данных наномаркеров с белком при низких значениях pH. При этом наличие в молекуле наномаркера более электроотрицательного атома приводит к уменьшению значений констант комлексообразования Ksigm наномаркера с БСА при соответствующих значениях pH.
При этом обнаружено отличие в растворах БСА от растворов САЧ для зависимостей Ksigm константы комплексообразования галоген-производных флуоресцеина от pH: средняя скорость убывания значений Ksigm от значения pH (ΔKsigm/ΔpH) в растворах БСА меньше, чем в растворах САЧ (значения констант для САЧ приведены в [15]) для каждого соответствующего маркера. При этом, как в растворах БСА, так и САЧ, средняя скорость убывания значений Ksigm от значения pH (ΔKsigm/ΔpH) уменьшается с увеличением электроотрицательности наномаркера (в ряду эритрозин – эозин – бенгальский розовый).
Как видно из рис. 4, коэффициент кооперативности Хилла n при всех значениях pH для всех четырех наномаркеров имеет значения меньше 1, что явно меньше числа активных центров связывания на белке.
Оценить кооперативные взаимодействия при образовании комплексов “белок–наномаркер” возможно с помощью коэффициента крутизны Кошланда Rx, связанного с коэффициентом Хилла следующим выражением Rx = 811/n. При полученных в данной работе значениях коэффициента Хилла, меньших 1, значение коэффициента крутизны Кошланда будет явно больше 81, что свидетельствует об отрицательной кооперативности в системе “БСА–наномаркер” [4]: связывание молекулой БСА первой молекулы наномаркера изменяет конфигурацию молекулы белка таким образом, что ухудшает (затрудняет) связывание белком следующих молекул наномаркера.
Модель 3. Модель ассоциации лиганд-белок
Рассмотрим модель комплексообразования (ассоциации) лиганд–белок из [17]. Эту модель возьмем в простейшем виде:
где лиганд L в нашем случае – это наномаркер, а Q – это макромолекула альбумина. Константу ассоциации наномаркера и альбумина назовем Ka.Тогда для концентраций лиганда и белка имеем такие соотношения:
где нулевой индекс означает исходную полную концентрацию молекул, которая складывается из концентраций свободных ([L], [Q]) и связанных молекул ([QL]).Если принять стандартную гипотезу, что относительная флуоресценция свободного (не связанного) лиганда (наномаркера) пропорциональна его относительной концентрации:
то из приведенных уравнений после некоторых преобразований можно получить следующую главную формулу:Особо отметим, что в отличие от часто использованного в литературе приближения [Q] = [Q0], мы работаем с более точными формулами, в которых делается отличие между полной концентрацией молекул белка [Q0] и концентрацией свободных молекул белка [Q].
Если взять данные по маркерам, то оказывается, что они хорошо укладываются в зависимость
т.е. с ростом [Q0] константа ассоциации Ka убывает по гиперболическому закону.Параметр а зависит от pH растворов. Найденная из экспериментальных данных зависимость величины a от pH изображена на рис. 5. Видно что параметр a с ростом pH уменьшается приближенно по гиперболической функции (за исключением флуоресцеина, когда в этой зависимости существует отчетливый максимум при pH 5.0). Параметр a мы назовем параметром сродства лиганда к белку.
Рис. 5.
Зависимости параметра сродства a (в рамках Модели 3) наномаркеров к БСА от pH: 1 – флуоресцеин, 2 – эритрозин, 3 – эозин, 4 – бенгальский розовый.

Если подставить данный результат в главную формулу для r, то мы видим, что с ростом концентрации белка ([Q0] $ \gg $ [L0]) флуоресценция не гаснет, а стремится к минимальному ненулевому значению
Из приведенной формулы следует, что с увеличением pH, когда параметр сродства а уменьшается, величина относительной флуоресценции rmin = Fmin/F0 увеличивается. Эта новая модель подтверждает вывод, сделанный нами ранее в работе [9].
Итак, вследствие уменьшения Ka с ростом [Q0] мы можем утверждать о существовании эффекта насыщения связей в системе наномаркер–белок, когда каждое последующее добавление белка в смесь ухудшает связывание. Этот вывод в рамках этой модели подтверждает вывод о существовании отрицательной кооперативности в процессе комплексообразования белок–лиганд, сделанный в предыдущей модели.
Уменьшение параметра сродства с ростом pH приближенно по гиперболической функции для производных флуоресцеина можно объяснить уменьшением электростатического взаимодействия белка с отрицательно заряженными лигандами вследствие уменьшения общего заряда на белке от общего положительного значения при малых значениях pH и ростом его общего отрицательного заряда при значениях pH больше pI. Вследствие этого становится понятно, откуда возникает максимум в зависимости a = a (pH) для флуоресцеина для значений вблизи изоэлектрической точки белка – в этой области белок теряет положительный заряд и приобретает отрицательный заряд, а флуоресцеин еще остается положительным. Эти выводы подтверждают указанные ранее в этой работе закономерности.
При этом следует отметить, что, так как комплексообразование лиганда с белком не исчезает при нулевом общем заряде на белке, когда pH = = pI, то вклад в механизм комплексообразования лиганда с белком вносит не только электростатическое взаимодействие (обусловленное взаимодействием зарядов на белке и лиганде), но и другие виды взаимодействий (ковалентные, водородные, ван-дер-ваальсовы и др.).
Таким образом, в данной работе с помощью трех различных моделей впервые исследовано комплексообразование наномаркеров семейства флуоресцеина с БСА в водных растворах.
С помощью первой модели показано наличие нескольких механизмов (ионных, ковалентных и др.) в комплексообразовании наномаркеров семейства флуоресцеина с БСА.
С помощью второй модели зарегистрировано наличие явления отрицательной кооперативности в комплексообразовании наномаркеров семейства флуоресцеина с БСА при всех значениях pH.
Третья модель описывает простую химическую реакцию комплексообразования БСА с наномаркером. Эта модель объясняет найденный нами ранее эффект насыщения этого комплексообразования, а также зависимость комплексообразования от соотношения зарядов на белке и наномаркерах.
Перечисленные закономерности, обнаруженные в данной работе для растворов БСА, схожи с полученными нами ранее для растворов САЧ в [15].
Нами найдены и отличия в комплексообразовании наномаркеров семейства флуоресцеина с БСА от связывания с САЧ: исходя из данных, полученных в первой модели, при высоких значениях pH (6.0–8.0) галоген-производные флуоресцеина эффективнее связываются с БСА по сравнению с САЧ.
Также для галоген-производных флуоресцеина зарегистрированы отличия растворов БСА по сравнению с растворами САЧ в следующем – средняя скорость убывания значений константы комплексообразования Ksigm от значения pH (ΔKsigm/ΔpH) в растворах БСА существенно меньше, чем в растворах САЧ для каждого наномаркера, что указывает на то, что комплексообразование данных наномаркеров с САЧ более сильно зависит от изменения значений pH, чем комплексообразование этих наномаркеров с БСА.
Список литературы
Грызунов Ю.А., Добрецов Г.Е. Альбумин сыворотки крови в клинической медицине. М.: ИРИУС, 1994.
Добрецов Г.Е. Флуоресцентные зонды в исследовании клеток, мембран и липопротеинов. М.: Наука, 1989.
Левшин Л.В., Салецкий А.М. Оптические методы исследования молекулярных систем. М.: Издательство Московского университета, 1994.
Тиноко И., Зауэр К., Вэнг Дж., Паглиси Дж. Физическая химия. Принципы и применение в биологических науках. М.: Техносфера, 2005.
Шмидт В. Оптическая спектроскопия для химиков и биологов. М.: Техносфера, 2007.
Birla L., Prieto B., Noguel T. et al. // Revue Roumaine Chimie. 2007. V. 52. № 7. C. 639.
Власова И.М., Салецкий А.М. // Журн. физ. химии. 2018. Т. 92. № 4. С. 604.
Власова И.М., Салецкий А.М. // Вестн. Московского университета. Серия 3. Физика. Астрономия. 2009. № 4. С. 52.
Vlasova I.M., Saletsky A.M. // Current Applied Physics. 2009. V. 9. № 5. C. 1027.
Власова И.М., Кулешова А.А., Власов А.А., Салецкий А.М. // Вестн. Московского университета. Серия 3. Физика. Астрономия. 2013. № 4. С. 39.
Vlasova I.M., Bukharova E.M., Kuleshova A.A., Saletsky A.M. // Current Applied Physics. 2011. V. 11. № 5. C. 1126.
Vlasova I.M., Saletsky A.M. // J. Molecular Structure. 2009. V. 936. C. 220.
Vlasova I.M., Kuleshova A.A., Panchishin A.I., Vlasov A.A. // Ibid. 2012. V. 1016. C. 1.
Власова И.М., Бухарова Е.М., Салецкий А.М. // Журн. физ. химии. 2011. Т. 85. № 5. С. 964.
Власова И.М., Салецкий А.М. // Там же. 2010. Т. 84. № 6. С. 1181.
Митин И.В., Русаков В.С. Анализ и обработка экспериментальных данных. М.: МГУ, Физический факультет МГУ, 2012.
Маршелл Э. Биофизическая химия. М.: Мир, 1981.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии


