Журнал физической химии, 2020, T. 94, № 10, стр. 1496-1500
Константы протолитических равновесий в растворах никотиновой кислоты в смесях вода–диметилсульфоксид
Н. Н. Куранова a, *, Н. А. Чеснокова a, А. С. Гущина a, К. В. Граждан a, В. А. Шарнин a
a Ивановский государственный химико-технологический университет
Иваново, Россия
* E-mail: kax504@isuct.ru
Поступила в редакцию 23.10.2019
После доработки 13.03.2020
Принята к публикации 17.03.2020
Аннотация
Методами потенциометрического титрования и спектрофотометрии определены константы ступенчатого протонирования никотинат-иона при 298.15 K и ионной силе среды 0.25 (NaClO4) в водно-диметилсульфоксидных растворах. Установлено, что зависимость констант протонирования никотинат-иона от состава растворителя характеризуется сложной S-образной зависимостью; константа протонирования никотиновой кислоты мало зависит от концентрации растворителя. Полученные результаты рассмотрены с позиций сольватационно-термодинамического подхода. Показано, что изменение энергии Гиббса ступенчатого протонирования никотинат-иона определяется в основном изменением сольватного состояния никотиновой кислоты.
Никотиновая кислота (β-пиридинкарбоновая кислота, витамин РР или В3) обладает противопеллагрическими свойствами [1]. В качестве гиполипидемического средства может использоваться в комплексной терапии атеросклероза, гиперлипидемии, инсулинорезистентности [1, 2]. Интенсивность диффузии никотиновой кислоты через мембраны клеток определяется ее кислотно-основными свойствами, т.е. изучение протолитических равновесий в растворе может представлять интерес для аналитической химии и биохимии. ДМСО применяют в качестве местного противовоспалительного средства [1]. Отмечается способность ДМСО проникать через биологические мембраны и усиливать диффузию через кожу ряда лекарственных веществ, что в совокупности с кислотно-основными свойствами никотиновой кислоты может использоваться как один из факторов влияния на транспортную активность витамина. Кроме того, ДМСО как растворитель является активным участником реакции и способен влиять на ее скорость, направление, механизм.
Раствор никотиновой кислоты представляет собой систему, в которой одновременно могут присутствовать четыре вида частиц (рис. 1): никотинат-анион (Nic–); протонированная (H2Nic+), молекулярная (HNic0) и цвиттер-ионная (HNic±) формы никотиновой кислоты. В настоящее время определено, что никотиновая кислота и ее структурные аналоги в водных растворах находятся преимущественно в виде диполярных цвиттер-ионов (HNic±) [3–8], содержание нейтральной частицы (HNic0) по оценкам разных авторов варьируется: 3 [3], 5.3 [4], 10% [5] (при температуре 293–298 K).
Методом спектроскопии 1Н- и 13С-ЯМР установлено наличие таутомерного равновесия между цвиттер-ионной и молекулярной формами никотиновой кислоты и преобладание последней в растворах диметилсульфоксида при Х(ДМСО) > > 0.36 мол. доли [6]. Однако, авторами [7] с помощью методов ЭСП, потенциометрического титрования и межфазного распределения показано, что нейтральная форма не является доминирующей в водно-диметилсульфоксидных растворах с содержанием неводного компонента 0.5 мол. доли.
В литературе представлены работы по исследованию протолитических свойств никотиновой кислоты, с использованием нескольких методов определения термодинамических констант протонирования: УФ-спектроскопии [3, 5, 9]; потенциометрического титрования [4, 9, 10], кондуктометрии [11] и 13С ЯМР-спектроскопии [8]. Подавляющее их большинство направлено на получение ступенчатых констант протонирования в водных растворах при 293–298 K.
Цель данной работы – определение констант ступенчатого протонирования никотинат-иона в водно-диметилсульфоксидных растворах методами потенциометрического титрования и спектрофотометрии.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Методами потенциометрического титрования и спектрофотометрии получены константы протолитических равновесий в растворе никотиновой кислоты при 298.2 ± 0.1 К и ионной силе среды 0.25 (NaClO4) в диапазоне концентраций водно-диметилсульфоксидного растворителя от 0 до 0.7 мол. доли ДМСО. Значения ЭДС измеряли с помощью стеклянного и хлорсеребряного электродов с точностью ±0.1 мВ. Электрод сравнения содержал 0.1 М раствор LiCl с соответствующей концентрацией диметилсульфоксида.
В потенциометрической ячейке находился 0.01 М водно-диметилсульфоксидный раствор никотината натрия, в качестве титранта использовался 0.1 М раствор хлорной кислоты в соответствующем растворителе.
Работоспособность электродной системы проверяли по образцовым буферным растворам в интервале рН от 1.68 до 9.18 (в водных растворах), а также по трем-пяти растворам хлорной кислоты с концентрацией 0.001–0.1 моль л–1 (в водно-органическом растворителе).
Абсорбционные спектры получены на двухлучевом сканирующем спектрофотометре Shimadzu UV-1800, с использованием стандартных кварцевых кювет на 1 см. Пропускная способность UV/Vis, скорость сканирования и интервал данных составляли 0.1 нм, 100 нм мин–1 и 0.5 нм соответственно. Концентрация никотинат-иона варьировалась в пределах от 0.20 до 0.47 ммоль л–1; концентрация хлорной кислоты составляла 0.02–30 ммоль л–1.
В исследованиях использовали кристаллическую никотиновую кислоту квалификации “ос.ч”, NaOH, HClO4 марки “ч. д. а.” без дополнительной очистки, NaClO4 “ч.” дважды перекристаллизовывали из воды. ДМСО марки “ч.” очищали перегонкой под вакуумом. Содержание воды в органическом растворителе определялось амперометрическим титрованием по методу Фишера [12], составляло 0.2–0.4 мас. % и учитывалось при приготовлении растворов. Все растворы готовились на бидистилляте.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Планирование эксперимента и обработку экспериментальных данных проводили с использованием программы KEV [13]. В расчетную схему включали реакции протонирования никотинат-иона и никотиновой кислоты, а также процессы автопротолиза воды и смешанных растворителей [14]. Исключение из расчетной схемы процессов автопротолиза не приводило к изменению равновесных концентраций и определяемых констант. Спектрофотометрические измерения показали наличие двух максимумов при 210 и 262.5 нм (рис. 2), что согласуется с данными [3]. С уменьшением рН раствора пик при 210 нм незначительно смещается в длинноволновую область, также для него наблюдается гипохромный эффект. Для пика при длине волны 262.5 нм отмечен слабый гипсохромный сдвиг с одновременным увеличением интенсивности поглощения на 50%. Логарифмы констант протолитических равновесий никотиновой кислоты в водно-диметилсульфоксидных растворах приведены в табл. 1.
Рис. 2.
Зависимости УФ-спектров водных растворов никотината натрия от рН среды (С(HNic) = = 0.0004030 моль × л–1, pH 6.57 (1)÷1.88 (14).

Таблица 1.
Логарифмы констант протонирования никотинат-иона (Nic–) и никотиновой кислоты (HNic) в водно-диметилсульфоксидном растворителе при 298.2 ± 0.1 K и ионной силе среды 0.25 (NaClO4)
| Х(ДМСО), мол. доли | lg K1 | lg K2 |
|---|---|---|
| 0.00 | 4.86 ± 0.06 4.61 ± 0.11* |
2.34 ± 0.11 2.13 ± 0.19* |
| 0.10 | 4.11 ± 0.07 | 2.16 ± 0.06 |
| 0.20 | 4.14 ± 0.10 | 2.13 ± 0.10 |
| 0.30 | 5.09 ± 0.04 | 2.30 ± 0.05 |
| 0.40 | 5.34 ± 0.77 | 1.97 ± 0.10 |
| 0.50 | 5.35 ± 0.05 | 1.99 ± 0.03 |
| 0.70 | 4.45 ± 0.22 | 2.35 ± 0.10 |
Погрешности определения логарифма констант оценивали путем статистической обработки результатов серии экспериментов и представляли собой доверительный интервал при доверительной вероятности 0.95. Значения логарифмов констант, полученные нами разными методами, достаточно хорошо согласуются между собой и для водных растворов – с представленными в литературе (табл. 2).
Зависимость констант протонирования никотинат-иона от состава растворителя характеризуется сложной S-образной зависимостью с минимумом при Х(ДМСО) = 0.1 мол. доли и максимумом при Х(ДМСО) = 0.5 мол. доли (табл. 1). Константа протонирования никотиновой кислоты мало зависит от концентрации растворителя.
Близкие значения констант протонирования никотинат-иона и пиридина [4] в водных растворах и растворах с низким содержанием ДМСО; способность молекулы никотинат-иона к образованию водородных связей с молекулами воды, в основном, через карбоксилатную группу [16] свидетельствует о протонировании никотинат-иона преимущественно по атому азота пиридинового кольца с образованием цвиттер-ионной частицы. Вторая ступень протонирования в данных растворителях определяется присоединением протона к карбоксилатной группе цвиттер-ионной формы никотиновой кислоты. В смешанных растворителях с концентрацией ДМСО более 0.1 мол. доли, одновременно могут протекать два процесса – протонирование никотиновой кислоты по карбоксилатной группе и через пиридиновый атом азота.
Влияние растворителя на константы протолитических равновесий никотиновой кислоты рассмотрено с позиций сольватационно-термодинамического подхода, который позволяет учесть сольватационные вклады всех реагентов в энергетику изучаемых процессов:
С использованием приведенных выше уравнений, литературных данных по сольватации протона [17] и никотиновой кислоты [7] были рассчитаны энергии Гиббса переноса никотинат-иона и протонированной формы никотиновой кислоты (рис. 3, 4). Значения энергии Гиббса переноса реакции и сольватации реагентов принимались за стандартные, так как поддерживаемая ионная сила растворов имела невысокое значение, и при экстраполяции констант протонирования (для водных растворов) к нулевому значению I, изменения в соответствующих константах протонирования не превышали погрешности их определения. (Например, для реакции протонирования никотиновой кислоты различия в константах протонирования несущественны: lg K = = 2.45 ± 0.20 (I = 0.0); 2.34 ± 0.11 (I = 0.25); 2.15 ± ± 0.10 (I = 0.50); 2.10 ± 0.15 (I = 0.75).
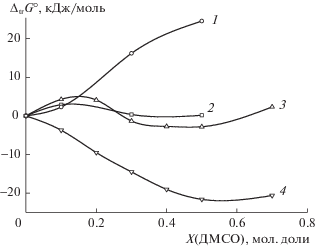
Рис. 4.
Изменение энергии Гиббса реакции протонирования никотиновой кислоты (1) и при переносе никотиновой кислоты (2) и ее протонированной формы (3), протона [17] (4) из воды в растворитель вода–диметилсульфоксид.

Диметилсульфоксид, как донорный растворитель, сольватирует акцепторы электронов лучше, чем вода, что может объяснить значительное уменьшение энергии Гиббса при переносе протона из воды в смешанные растворители. Анионы, способные образовывать с протонодонорными растворителями водородные связи, в апротонных растворителях сольватируются слабо. Вклады от изменения энергии Гиббса при переносе протона и никотинат-иона в значительной степени компенсируют друг друга, вклад сольватации никотиновой кислоты минимальный (рис. 3). По этой причине изменение энергии Гиббса переноса реакции протонирования никотинат-иона имеет незначительную (по сравнению с ионами) величину по всем областям составов растворителя вода–ДМСО и определяется сольватационным вкладом никотиновой кислоты.
Зависимость констант протонирования никотинат-иона от состава водно-этанольного растворителя также экстремальна с минимумом при Х(EtOH) = 0.1 мол. доли [8]. В данном случае, основной причиной изменения энергии Гиббса реакции является бóльшая дестабилизация никотинат-иона по сравнению с никотиновой кислотой [16].
Энергия Гиббса переноса реакции протонирования никотиновой кислоты (реакция (2), рис. 1) практически не зависит от состава водно-диметилсульфоксидного растворителя (рис. 4). Значительная сольватация катионов растворителем не приводит к существенным изменениям в энергетической характеристике реакции, и протекание изозарядного кислотно-основного равновесия в электронодонорном растворителе формально будет определяться величиной ΔtrG0 никотиновой кислоты.
Работа выполнена в НИИ термодинамики и кинетики химических процессов ИГХТУ при финансовой поддержке Совета по грантам при Президенте РФ (проект № 14.Z56.20.2026-MK) в рамках Государственного задания (проект № FZZW-2020-0009).
Список литературы
Машковский М.Д. Лекарственные средства. М.: Новая Волна, 2012. 1216 с.
Karpe F., Frayn F.K.N. // Lancet. 2004. V. 363. P. 1892. https://doi.org/10.1016/S0140-6736(04)16359-9
Nagy P.I., Takács-Novák K. // J. Am. Chem. Soc. 1997. I. 21. V. 119. P. 4999. https://doi.org/10.1021/ja963512f
Halle J.C., Lelievre J., Terrier F. // Can. J. Chem. 1996. V. 74. № 4. P. 613. https://doi.org/10.1139/v96-065
Green R.W., Tong H.K. // J. Am. Chem. Soc. 1956. V. 78. P. 4896. https://doi.org/10.1021/ja01600a023
Khan T., Halle J.-C., Simonnin M.-P., Schaar R. // J. Phys. Chem. 1977. V. 81. № 6. P. 587. https://doi.org/10.1021/j100521a019
Граждан К.В., Гамов Г.А., Душина С.В., Шарнин В.А. // Журн. физ. химии. 2012. Т. 86. № 11. С. 1802. https://doi.org/10.1134/S0036024412110131
Куранова Н.Н., Душина С.В., Шарнин В.А. // Журн. неорган. химии. 2008. Т. 53. № 12. С. 2076. https://doi.org/10.1134/S0036024410050146
Niazi M.S.K., Mollin J. // Bull. Chem. Soc. Jap. 1987. V. 60. № 7. 2605. https://doi.org/10.1246/bcsj.60.2605
Gonçalves E.M., Joseph A., Conceição A.C.L., Minas Da Piedade M.E. // J. Chem. Eng. Data. 2011. V. 56. № 6. P. 2964. https://doi.org/10.1021/je200263g
Orekhova Z., Ben-Hamo M., Manzurola E., Apelblat A. // J. Sol. Chem. 2005. V. 34. № 6. P. 687. https://doi.org/10.1007/s10953-005-4493-2
Пономарёв В.Д. Аналитическая химия (в двух частях). Часть 2. Количественный анализ. М.: Высш. школа, 1982. 288 с.
Meshkov A.N., Gamov G.A. // Talanta. 2019. V. 198. P. 200. https://doi.org/10.1016/j.talanta.2019.01.107
Фиалков Ю.Я. Растворитель как средство управления химическим процессом. Л.: Химия, 1990. 240 с.
Martel A.E., Smith R.M. Critical Stability Constants. New York: Plenum Press, 1989. V. 6. 662 p.
Gamov G.A., Kuranova N.N., Pogonin A.E. et al. // J. Mol. Struct. 2018. V. 1154. P. 565. https://doi.org/10.1016/j.molstruc.2017.10.086
Kalidas C., Hefter G., Marcus Y. // Chem. Rev. 2000. V. 100. № 3. P. 819.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии