Журнал физической химии, 2020, T. 94, № 10, стр. 1505-1509
Разложение диоксида тиомочевины в аэробных и анаэробных условиях в водно-щелочном растворе
К. С. Никитин a, Ю. В. Поленов a, *, Е. В. Егорова a
a Ивановский государственный химико-технологический университет
Иваново, Россия
* E-mail: polyurij@yandex.ru
Поступила в редакцию 18.11.2019
После доработки 26.03.2020
Принята к публикации 17.04.2020
Аннотация
Изучена кинетика и установлен механизм разложения диоксида тиомочевины в водно-щелочном растворе в аэробных и анаэробных условиях. Впервые обнаружено, что наряду с реакцией распада молекул диоксида тиомочевины с разрывом связи C–S и последующим образованием анионов сульфоксиловой кислоты имеет место обратимая стадия образования тиомочевины и пероксид-аниона. На основе экспериментальных данных методом математического моделирования определены константы скорости указанных стадий.
Диоксид тиомочевины (ДОТМ) или формамидинсульфиновая кислота в водных растворах используется в качестве восстановителя как органических [1, 2], так и неорганических [3–5] соединений. Причем в концентрированных водно-щелочных растворах его активность настолько высока, что позволяет восстанавливать до металла катионы кадмия, имеющего достаточно большой отрицательный редокс-потенциал [6]. Из многочисленных источников литературы известно, что высокая восстановительная активность молекул ДОТМ объясняется их распадом с разрывом слабой связи между углеродом и серой и образованием интермедиатов – анионов сульфоксиловой кислоты (${\text{SO}}_{2}^{{2 - }}$), анион-радикалов (${\dot {S}O}_{{\text{2}}}^{ - }$) и дитионит-анионов (${{{\text{S}}}_{2}}{\text{O}}_{4}^{{2 - }}$) [7–12]. Именно указанные частицы обладают сильными восстановительными свойствами.
Необходимо отметить, что ранее стехиометрический механизм разложения водно-щелочных растворов диоксида тиомочевины изучался в ряде работ [13–15]. Однако в них не определялись значения констант скорости отдельных стадий процесса и не проводился сравнительный анализ кинетики разложения ДОТМ в воздушной и инертной атмосферах. Решение этих вопросов и входило в задачи настоящей работы.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Диоксид тиомочевины синтезировали из тиомочевины путем ее окисления водным раствором пероксида водорода согласно методике, описанной в работе [16]. Содержание основного вещества в конечном продукте, определенное иодометрическим методом, составляло 99.1% [17]. ИК -спектр поглощения соответствовал спектру аминоиминометансульфиновой кислоты (другое название ДОТМ), размещенному в базе данных NIST Chemistry WebBook. Все реактивы имели квалификацию “х. ч.”.
При изучении кинетики разложения ДОТМ использовали спектрофотометрический метод, так как согласно данным [18] исходное вещество – диоксид тиомочевины имеет максимум поглощения в электронном спектре при λ = 270 нм, в то же время продукты реакции в этой области спектра не поглощают. Для получения электронных спектров поглощения использовали спектрофотометр марки LEKISS 2110 UV (Финляндия).
Для проведения кинетического опыта 1 г NaOH растворяли в колбе объемом 100 мл, во второй колбе объемом 50 мл растворяли 8.6 мг ДОТМ и доводили до метки дистиллированной водой. После этого в одну кювету спектрофотометра помещали раствор NaOH (раствор сравнения), а в другую – щелочной раствор ДОТМ, который готовили непосредственно перед проведением опыта, прибавляя раствор NaOH к водному раствору ДОТМ. Следует отметить, что в нейтральном растворе разложение ДОТМ не происходит. Для получения кинетических кривых производили автоматическую запись изменения оптической плотности растворов во времени при постоянных длинах волн. Предварительно были сняты спектры поглощения растворов диоксида тиомочевины различных концентраций при длине волны 270 нм, отвечающей максимуму поглощения, и подтверждена линейная зависимость оптической плотности от концентрации. Коэффициент экстинкции, вычисленный на основании закона Бугера–Ламберта–Бера, имел значение ε = 563.41.
В анаэробных условиях растворы гидроксида натрия и ДОТМ предварительно продували аргоном и, плотно закрыв кювету парафиновой лентой, проводили кинетический опыт.
Наличие ионов дитионита качественно определяли на приборе Экотест-ВА (Россия) с использованием трехэлектродной электрохимической ячейки. В качестве рабочего электрода использовали ситалловый, электрода сравнения – хлоридсеребряный, вспомогательного – стеклоуглеродный. Для получения вольтамперной зависимости в растворе диоксида тиомочевины 1 мл его водно-щелочного раствора с концентрацией NaOH 0.25 моль/л и исходной концентрацией ДОТМ 1.7 × 10–3 моль/л после выдержки в течение двух минут смешивали в ячейке с 25 мл буферного раствора Робинсона–Бриттона (рН 9).
Для сравнения снимали полярограмму дитионита натрия, предварительно смешивая в электрохимической ячейке его раствор в дистиллированной воде объемом 0.04 мл и концентрацией 5.74 × 10–4 моль/л с 25 мл буферного раствора Робинсона–Бриттона (рН 9). Скорость развертки потенциала во всех случаях составляла 50 мВ/с, начальный потенциал + 200 мВ, конечный – 1700 мВ. Все полярограммы снимались при комнатной температуре.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
На рис. 1 приведены электронные спектры поглощения в различные моменты времени в ходе разложения ДОТМ в аэробных условиях, из которых видно, что происходит уменьшение высоты максимума при λ = 270 нм, соответствующего поглощению ДОТМ, и появление и увеличение высоты максимума при λ = 315 нм, что, согласно данным литературы [13], связано с образованием анионов дитионита.
Рис. 1.
Электронные спектры поглощения раствора диоксида тиомочевины в аэробных условиях в различные моменты времени, мин: 1 – 0, 2 – 17, 3 – 20, 4 – 42, Т = 301 K, СNaOH = 0.12 моль/л.

Так как изобестической точки в спектре не наблюдается, то ионы ${{{\text{S}}}_{{\text{2}}}}{\text{O}}_{4}^{{2 - }}$ образуются не из молекул диоксида тиомочевины, а из анионов сульфоксиловой кислоты ${\text{SO}}_{2}^{{2 - }}$ при взаимодействии их с кислородом воздуха в результате последовательности стадий:
(1)
$\begin{gathered} {{({\text{N}}{{{\text{H}}}_{{\text{2}}}})}_{2}}{\text{CS}}{{{\text{O}}}_{2}} + 2{\text{O}}{{{\text{H}}}^{--}} \to \\ \to {\text{SO}}_{2}^{{2 - }} + {{({\text{N}}{{{\text{H}}}_{{\text{2}}}})}_{2}}{\text{CO}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}}, \\ \end{gathered} $(2)
${\text{SO}}_{2}^{{2 - }} + {{{\text{O}}}_{2}} \to {\dot {S}O}_{2}^{ - } + {\text{O}}_{{\text{2}}}^{ \bullet },$Для того чтобы качественно подтвердить образование анионов дитионита, нами была получена вольтамперная зависимость как для раствора ДОТМ, так и раствора дитионита натрия. Наличие максимума на вольтамперной зависимости в обоих случаях при потенциале –0.7 В, отвечающего окислению дитионит-ионов, подтверждается также данными работы [8].
На рис. 2 представлена зависимость оптической плотности от времени, построенная в полулогарифмических координатах, которая показывает, что реакция разложения в аэробных условиях описывается кинетическим уравнением первого порядка по ДОТМ. Наблюдаемая константа скорости равна 7.14 × 10–4 с–1, что сопоставимо с точностью до порядка со значением константы скорости, указанной в литературе [14].
Рис. 2.
Полулогарифмическая анаморфоза кинетической кривой A = f(τ). Аэробные условия, λ = 270 нм, СNaOH = 0.13 моль/л, Т = 301 K.

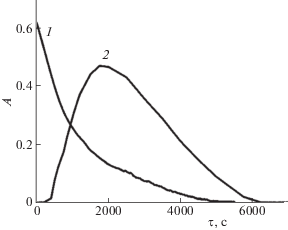
На рис. 3 представлены зависимости оптической плотности от времени, полученные при двух различных длинах волн, отвечающих максимумам поглощения ДОТМ и дитионита. Кинетическая кривая с точкой экстремума по дитиониту подтверждает тот факт, что он является промежуточным продуктом реакции разложения ДОТМ.
Рис. 3.
Зависимости оптической плотности от времени для ДОТМ (1 – λ = 270 нм) и дитионита (2 – λ = = 315 нм) в анаэробных условиях, СNaOH = = 0.13 моль/л, Т = 301 K.
Его образование происходит по стадиям (1)–(3), при этом необходимое количество кислорода поступает в реакцию за счет диффузии из внешней среды, а расходование возможно за счет смещения равновесия стадии (3) вправо и взаимодействия анион-радикалов ${\dot {S}O}_{2}^{ - }$ с супероксидом по реакции:
(4)
${\dot {S}O}_{2}^{ - } + {\text{O}}_{{\text{2}}}^{ \bullet } + {\text{O}}{{{\text{H}}}^{ - }} \to {\text{SO}}_{3}^{{2 - }} + {\text{HO}}_{2}^{ - }.$Можно было предполагать, что в отсутствие кислорода воздуха (в анаэробных условиях) разложение будет происходить по реакции (1) и подчиняться кинетическому уравнению первого порядка по концентрации диоксида тиомочевины. Однако, как показали экспериментальные данные (рис. 4), это предположение неверно.
Рис. 4.
Зависимости оптической плотности от времени для ДОТМ (1, 2 – λ = 270 нм) и дитионита (3 – λ = = 315 нм) в анаэробных условиях; кривая 2 – в присутствии добавки тиомочевины (СТМ = 5.7 × × 10‒4 моль/л), СNaOH = 0.12 моль/л, Т = 301 K.
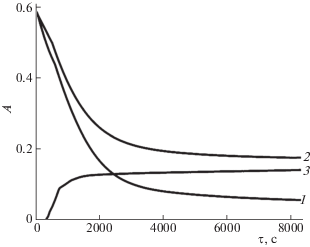
Во-первых, разложение ДОТМ происходит не до конца в отличие от аэробных условий. Во-вторых, первый порядок по концентрации ДОТМ не наблюдается. В-третьих, дитионит-ион все же образуется в процессе, но его концентрация достигает некоторой постоянной величины, а затем не меняется.
Последнее можно объяснить тем, что продувкой аргоном не удается полностью удалить весь растворенный кислород, и он в начальной стадии процесса реагирует по реакции (2). В дальнейшем поступления кислорода из внешней среды не происходит, и концентрация дитионит-иона остается постоянной. На кинетической кривой для ДОТМ в момент исчерпания кислорода наблюдается излом.
С большой долей вероятности можно было предположить, что уменьшение скорости разложения связано с обратимостью первичной стадии (1) распада молекул ДОТМ с разрывом связи C‒S, как это наблюдается в нейтральной и кислой средах [10]. Однако введение добавки мочевины не приводит к торможению процесса разложения.
Но к замедлению реакции и уменьшению в конечном итоге степени разложения исходного вещества приводит введение добавки тиомочевины. Этот факт обнаружен впервые. По-видимому, распад молекул диоксида тиомочевины протекает по двум параллельным реакциям: с гетеролитическим разрывом связи C–S в молекуле ДОТМ и образованием анионов сульфоксиловой кислоты (реакция 1) и без разрыва связи C–S с образованием тиомочевины по обратимой реакции:
(5)
${{({\text{N}}{{{\text{H}}}_{{\text{2}}}}{\text{)}}}_{{\text{2}}}}{\text{CS}}{{{\text{O}}}_{2}} + 2{\text{O}}{{{\text{H}}}^{--}}\;\mathop \rightleftarrows \limits_{{{k}_{{ - 1}}}}^{{{k}_{1}}} \;{{({\text{N}}{{{\text{H}}}_{{\text{2}}}})}_{2}}{\text{CS}} + 2{\text{HO}}_{2}^{ - }.$В аэробных условиях замедления реакции разложения не происходит, так как тиомочевина может реагировать с образующимся на стадии (2) супероксидом, превращаясь в мочевину.
На основании полученных результатов проведено математическое моделирование изученного процесса в анаэробных условиях без учета начальной стадии взаимодействия сульфоксилат-иона с растворенным кислородом.
Математическая модель, учитывающая протекание обратимой стадии (5) и необратимой стадии (1), представлялась в виде системы дифференциальных уравнений:
Концентрация NaOH не входила в систему уравнений, так как была в избытке по сравнению с концентрацией остальных реагентов. С помощью программы wkinet, разработанной на кафедре физической химии МГУ, решалась обратная кинетическая задача. Расчет концентраций диоксида тиомочевины проводили на основании значений оптической плотности, измеренной при длине волны 270 нм согласно описанной ранее методике. Начальное приближение константы скорости k1 оценивалось по кинетической кривой СДОТМ = f (τ). Для других констант начальные приближения варьировались.
Поиск оптимальных значений констант скорости осуществлялся методом градиента путем отыскания минимума суммы квадратов разностей между экспериментальными и вычисленными значениями концентраций ДОТМ.
Числовые значения оптимизированных констант скорости оказались равными: k1 = 3.73 × × 10–4 c–1, k–1 = 125.6 моль/(л с), k2 = 4.39 × 10–5 c–1. Минимальное значение оптимизируемой функции составило 6.8885 × 10–9. Сравнение опытных и расчетных значений концентраций диоксида тиомочевины (рис. 5) свидетельствует об адекватности предполагаемой кинетической модели экспериментальным данным.
Рис. 5.
Результаты моделирования кинетики разложения диоксида тиомочевины в анаэробных условиях. Точки – эксперимент; линия – расчет по кинетической модели.

Таким образом, при разложении диоксида тиомочевины в водно-щелочном растворе впервые обнаружен факт замедления реакции при добавке тиомочевины. Показано, что распад молекул ДОТМ протекает по двум параллельным направлениям – с разрывом и без разрыва связи углерод–сера. Имеются существенные отличия количества образующихся продуктов разложения в аэробных и анаэробных условиях: в первом случае реакция протекает до конца и основным промежуточным продуктом являются дитионит-анионы, во втором – полного разложения ДОТМ не наблюдается, дитионит образуется в незначительном количестве. На основании экспериментальных кинетических кривых проведено математическое моделирование кинетики разложения ДОТМ в анаэробных условиях, рассчитаны числовые значения констант скорости отдельных стадий.
Список литературы
Поленов Ю.В., Егорова Е.В., Николаев А.В. // Изв. вузов. Химия и хим. технология. 2008. Т. 51. № 5. С. 43.
Поленов Ю.В., Буданов В.В. // Там же. 1988. Т. 31. № 8. С. 66.
Колесник В.В., Макаров С.В., Поленов Ю.В. и др. // Радиохимия. 1982. Т. 24. № 5. С. 554.
Поленов Ю.В., Буданов В.В. // Изв. вузов. Химия и хим. технология. 1986. Т. 29. № 5. С. 53.
Буданов В.В., Ермолина С.В., Поленов Ю.В. и др. // Журн. общ. химии. 2000. Т. 70. № 5. С. 705.
Поленов Ю.В., Егорова Е.В., Шестаков Г.А. // Журн. физ. химии. 2018. Т. 92. № 1. С. 62. https://doi.org/10.7868/S0044453718010193
Miller A.E., Bischoff J.J., Pae K. // Chem. Res. Toxicol. 1988. V. 1. № 3. P. 169.
Поленов Ю.В., Макаров С.В., Буданов В.В. // Изв. вузов. Химия и хим. технология. 1986. Т. 29. № 12. С. 30.
Поленов Ю.В., Николаев А.В., Егорова Е.В. и др. // Там же. 2009. Т. 52. № 5. С. 82.
Поленов Ю.В., Макарова Е.В., Егорова Е.В. // Кинетика и катализ. 2014. Т. 55. № 5. С. 594. https://doi.org/10.7868/S0453881114040121
Polenov Y.V., Shestakov G.A., Egorova E.V. // Изв. вузов. Химия и хим. технология. 2018. V. 61. № 12. P. 87. https://doi.org/10.6060/ivkkt.20186112.5835
Polenov Y.V., Egorova E.V., Nikitin K.S. // Taм жe. 2019. T. 62. № 8. C. 95. https://doi.org/10.6060/ivkkt.20196208.5961
Svarovsky S.A., Simoiy R.H., Makarov S.V. // J. Chem. Soc. Dalton Trans. 2000. V. 4. P. 511. https://doi.org/10.1039/a907816i
Gao Q., Liu B., Li L., Wang J. // J. Phys. Chem. A. 2007. V. 111. № 5. P. 872. https://doi.org/10.1021/jp063956q
Svarovsky S.A., Simoiy R.H., Makarov S.V. // J. Phys. Chem. B. 2001. V. 105. № 50. P. 12634. https://doi.org/10.1021/jp0122474
Буданов В.В. Химия и технология восстановителей на основе сульфоксиловой кислоты. Ронгалит и его аналоги. М.: Химия, 1984. 160 с.
Химические реактивы и препараты: труды ИРЕА / Под ред. Р.П. Ластовского. М.: ИРЕА, 1963. Вып. 25. С. 215.
Sodium Dithionite, Rongalite and Thiourea Oxides: Chemistry and Application / S.V. Makarov et al. New Jersey: World Scientific, 2017. XXIII. 219 p.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии


