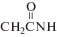Журнал физической химии, 2020, T. 94, № 11, стр. 1731-1734
Константы взаимодействия кофермента пиридоксаль-5'-фосфата с глицином и его олигопептидами в водном буферном растворе
В. П. Баранников a, *, Е. А. Венедиктов a
a Российская академия наук, Институт химии растворов им. Г.А. Крестова
Иваново, Россия
* E-mail: vpb@isc-ras.ru
Поступила в редакцию 07.02.2020
После доработки 06.03.2020
Принята к публикации 17.03.2020
Аннотация
Методом электронной спектроскопии изучены закономерности связывания олигопептидов глицил–глицина и глицил–глицил–глицина с коферментом пиридоксаль-5'-фосфатом при 293 K в фосфатном буферном растворе при pH 7.35 в сравнении с аналогичным процессом для мономерного глицина. Определены константы взаимодействия и спектральные параметры продуктов реакции. Наблюдаемое возрастание константы связывания пептидов с коферментом в ряду Gly–Gly-Gly–Gly-Gly-Gly обусловлено понижением основности реакционной аминогруппы и увеличением в растворе доли пептидов с неионизированными аминогруппами. Возрастание длины цепи пептида сопровождается уменьшением коэффициента экстинкции образующегося основания Шиффа.
Пиридоксаль-5'-фосфат (PP) выступает в роли кофермента во многих процессах метаболизма аминокислот и пептидов (AA) [1]. Известно, что продуктом реакции взаимодействия PP с аминокислотами и пептидами в модельных условиях являются основания Шиффа (ShB) [1, 2]. Выполненные ранее исследования термодинамики реакции PP с различными аминокислотами [3] показали, что эффективность связывания пиридоксальфосфатным коферментом зависит от структуры аминокислот и зарядов их ионогенных групп. В данной работе проведено сравнительное изучение эффективности связывания глицина и его олигопептидов коферментом PP в водном буферном растворе. Реакция конденсации аминокислоты или пептида к PP при pH 7.35 может быть описана следующим уравнением:
где символом R обозначен фрагмент Индекс n = 0 для глицина; n = 1 для глицил-глицина; n = 2 для диглицил-глицина.ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Использовали пиридоксаль-5'-фосфат фирмы Aldich с содержанием основного вещества 0.98; глицин, диглицин и триглицин фирмы Merck имели чистоту ≥0.99. Перед использованием реактивы высушивали в вакууме при 50°С до постоянной массы. Реакцию проводили в водном фосфатно-буферном растворе (0.04165 М NaH2PO4/0.20492 М Na2HPO4) при рН 7.35 и температуре 293 ± 0.3 K. Точное значение pH 7.35 фосфатного буферного раствора обеспечивали варьированием компонентов буферной смеси с использованием pH-метра. Использование буферного раствора обеспечивало стабильность ионных форм реагентов в растворе в ходе реакции. Концентрации пептидов варьировали от 0.2 до 1.8 мM, концентрация пиридоксаль-5'-фосфата составляла 0.04 мM.
Ход реакции между пептидом и PP наблюдали с использованием спектрофотометра Agilent 8455 по изменениям в разностном электронном спектре поглощения PP при различных добавках пептида, регистрируемом относительно раствора свободного PP той же концентрации в интервале длин волн от 250 до 600 нм. Для измерений использовали кварцевые кюветы размером 1 × 1 см. Регистрация изменений в разностном спектре со временем показала, что реакция кофермента с аминокислотами и пептидами в условиях эксперимента заканчивалась через 600 с. Поэтому для определения равновесных концентраций реагентов период ожидания перед измерением оптической плотности составлял не менее 20 мин после смешения растворов PP и AA.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
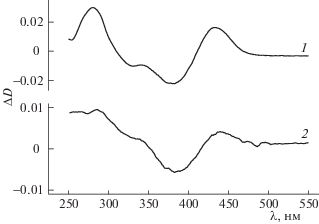
Сопоставление электронных спектров PP с добавками мономерного глицина или его пептидов (рис. 1) указывает на однотипный характер наблюдаемых превращений. Общая тенденция изменения спектров при добавках аминокислоты и пептидов – убывание интенсивности поглощения при 375 нм и появление полос, характерных для поглощения основания Шиффа при 275–280 и 430–440 нм. Появление новых полос вызвано изменением состояния ароматического пиридинового кольца при образовании оснований Шиффа. Ароматическая электронная система входит в сопряжение с двойной связью между атомами углерода и азота, что приводит к заметному смещению исходной полосы поглощения PP от 388 до 444 нм. Кинетические исследования деградации продуктов конденсации PP с триглицином показали высокую стабильность спектральных полос при 430 и 450 нм в нейтральной среде [4]. Интенсивность данной полосы зависит от мольного соотношения реагентов. Поэтому измерение ее интенсивности было использовано для нахождения концентрации продукта взаимодействия пиридоксаль-5'-фосфата с аминокислотой и пептидами (ShB) и равновесной константы этого взаимодействия.
Рис. 1.
Разностный спектр 0.4 мM пиридоксаль-5'-фосфата в водном фосфатном буферном растворе, pH 7.35, T = 293.15 K в присутствии добавок: 1 – 1.4 мM глицина, 2 – 1.4 мM глицил-глицил-глицина.
Методика определения равновесной концентрации образующихся оснований Шиффа из спектральных данных подробно описана нами ранее [3]. Молярный коэффициент поглощения в максимуме полосы основания Шиффа находили из линейного соотношения изменений оптических плотностей и молярных коэффициентов экстинкции для двух полос разностного спектра: поглощения PP при 375 нм (ΔD375, ε375 = 6250 см–1 л моль–1) и поглощения основания Шиффа при 430–444 нм (ΔDShB, εShB).
(1)
$\frac{{\Delta {{D}^{{{\text{ShB}}}}}}}{{\Delta {{D}^{{375}}}}} = \frac{{{{\varepsilon }^{{{\text{ShB}}}}}}}{{{{\varepsilon }^{{375}}}}}.$Эффективные константы образования оснований Шиффа определяли по соотношению
(3)
$K = K{\text{'}}[{{{\text{H}}}_{{\text{2}}}}{\text{O}}] = \frac{{{\text{[ShB]}}}}{{{\text{[PP][AA]}}}},$Таблица 1.
Положение максимума поглощения, коэффициенты экстинкции и эффективные константы образования оснований Шиффа (л/моль) при взаимодействии пиридоксаль-5-фосфата с пептидами глицина при 293.15 K
| Пептид | λ, нм | ε, см–1 л моль–1 | lg K ' |
|---|---|---|---|
| Глицин | 430.5 | 8160 | 1.78 |
| Глицил-глицин | 438 | 3960 | 2.00 |
| Глицил-глицил-глицин | 444 | 1060 | 2.41 |
Анализ полученных спектральных характеристик свидетельствует, что изменения в электронной структуре ароматического пиридинового кольца РР зависят от структуры и свойств присоединяемого пептида. Значительный спад в молярных коэффициентах поглощения оснований Шиффа, образованных Gly; Gly-Gly или Gly-Gly-Gly, свидетельствует об уменьшении степени сопряжения алдиминной группы CH=N с ароматическим оксипиридиновым хромофором в структуре молекулы при удлинении цепи пептидного фрагмента. Это может быть связано с нарушением их компланарности вследствие увеличения степени свободы пептидного фрагмента и, по-видимому, ослаблением индуктивного эффекта карбоксильной группы, расположенной на конце пептидной цепи.
Увеличение расстояния между карбоксильной группой и аминогруппой в ряду Gly – Gly-Gly – Gly-Gly-Gly приводит к понижению основности реакционного NH3+ центра пептида. Известно, что константы кислотной диссоциации протонированной аминогруппы возрастают в ряду от глицина (pK° = –lg K° = 9.78) к триглицину (pK° = 8.04) [8]. Расчеты долевого распределения ионных форм пептидов при pH 7.35 с использованием полученных констант диссоциации показывают значительное увеличение в растворе доли пептидов с неионизированными аминогруппами в указанном ряду: 0.4% для Gly; 31.0% для Gly-Gly-Gly. Повышение доли пептида с молекулярной формой аминогруппы и ослабление специфической гидратации данной группы из-за снижения ее основности приводят к возрастанию степени превращения и константы связывания пептида в реакции конденсации с коферментом PP. Логарифм константы связывания возрастает от 1.78 до 2.41 при переходе от мономерного глицина к его трипептиду. Наличие закономерной корреляции между константами связывания пептидов с PP и константами диссоциации протонированных аминогрупп пептидов (рис. 2) подтверждает указанные положения.
Рис. 2.
Зависимость константы взаимодействия пиридоксаль-5'-фосфата с пептидами глицина при pH 7.35 от константы диссоциации протонированной аминогруппы пептидов.

Таким образом, полученные данные показывают, что в условиях физиологического показателя pH 7.35 концевые аминогруппы в составе пептидов, расположенные вдали от заряженной карбоксильной группы, более реакционно-способны в ферментативных пиридоксаль-зависимых реакциях по сравнению с α-аминогруппами мономерных аминокислот. Химическая активность молекул аминов, не содержащих в своем составе других полярных групп, и аминов, содержащих полярные незаряженные группы, близка к активности пептидов в реакциях с PP. Так, константы образования оснований Шиффа, образующихся с н-амиламином, lg K ' = lg(K/[${{C}_{{{{{\text{H}}}_{2}}{\text{O}}}}}$]) = = 2.24 ± 0.55 [5], и трис-(гидроксиметил)-аминометаном, lg K ' = lg(K/[${{C}_{{{{{\text{H}}}_{2}}{\text{O}}}}}$]) = 2.08 ± 0.26 [5], лежат в области значений, характерных для пептидов, в которых реакционная аминогруппа удалена от ионизированной карбоксильной группы.
Список литературы
Snell E.E. // Vitamin B-6 Pyridoxal Phosphate. Chemical, Biochemical and Medical Aspects / Ed. by D. Dolphin, R. Poulson, O. Avramivic. N.Y.: Wiley, 1986. P. 1–12.
Angees Garcia del Vado M. et al. // J. Mol. Catalysis A: Chemical. 1997. V. 123. P. 9.
Баранников В.П., Баделин В.Г., Венедиктов Е.А. и др. // Журн. физ. химии. 2011. Т. 85. № 1. С. 20.
Pishchugin F.V., Tuleberdiev I.T. // Russ. J. Gen. Chem. 2008. V. 78. № 6. P. 1225.
Matsuo Y. // J. Am. Chem. Soc. 1957. V. 79. P. 2011.
Felty W.L., Ekstrom C.G., Leussing D.L. // Ibid. 1970. V. 92. № 10. P. 3006.
Mitra J., Metzler D.E. Biochimica et Biophysica Acta. 1988. V. 965. № 1. P. 93.
Баделин В.Г., Баранников В.П., Тарасова Г.Н. и др. // Журн. физ. химии. 2012. Т. 86. № 1. С. 46.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии