Журнал физической химии, 2020, T. 94, № 11, стр. 1624-1628
ИК-спектроскопия растворов диметилсульфоксида в моноэтаноламине
Е. Г. Кононова a, М. Н. Родникова b, *, И. А. Солонина b, Е. В. Широкова b
a Институт элементоорганических соединений им. Н.А. Несмеянова, Российская академия наук
Москва, Россия
b Институт общей и неорганической химии им. Н.С. Курнакова, Российская академия наук
Москва, Россия
* E-mail: rodnikova@igic.ras.ru
Поступила в редакцию 12.12.2019
После доработки 12.12.2019
Принята к публикации 14.04.2020
Аннотация
Методом ИК-спектроскопии на фурье-спектрометре Bruker “Tensor 37” в области частот 900–4000 см–1 исследованы растворы диметилсульфоксида (ДМСО) в моноэтаноламине (МЭА). Интервал концентраций 2–66 мол. % ДМСО. Подробно исследованы область валентных колебаний ОН и NН2-групп, связанных водородной связью (2800–4000 см–1), и область колебаний S=O-группы ДМСО (900–1100 см–1). Полученные результаты сравнены с ИК-спектрами этиленгликолевых растворов ДМСО в области валентных колебаний ОН и S=O. Обсуждается влияние NH2-группы в молекуле МЭА на взаимодействие в системе ДМСО-МЭА и физико-химические свойства этой системы по сравнению с этиленгликолевыми растворами ДМСО.
Водные растворы ДМСО и МЭА широко применяются в криобиологии. Обе водные системы имеют низкую температуру замерзания, что позволяет хранить в них биологические объекты [1, 2]. Самая низкая температура замерзания в системе Н2О-ДМСО ∼ –72°С при соотношении компонентов 2 : 1 [1], в системе Н2О-МЭА – при –50°С (3 : 1) [3]. Водный раствор ДМСО может индуцировать слияние клеток [4], действовать как криопротектор для мембран и белков [5, 6]. Водный раствор МЭА может быть использован как криопротектор для стеклования биологических материалов [2].
Молекула ДМСО представляет собой искаженную пирамиду с атомом S в вершине. Она была исследована как методом электронографии [7], так и квантовой химии [8]. Геометрические данные молекулы в газовой фазе, полученные методом микроволновой спектроскопии, представлены на рис. 1 и в табл. 1 [7]. Дипольный момент молекулы в жидкой фазе составляет 3.96D, донорная способность – 29.8 [3]. ИК-спектр жидкого ДМСО представлен на рис. 2 в области наиболее чувствительной к взаимодействиям валентной полосы S=О (область колебаний 900–1100 см–1).
Молекула МЭА (HO–CH2–CH2–NH2) может существовать в 10 разных конформерах. Гош-конформеры предпочтительны в газовой фазе, транс- в кристаллической (зависимость от дигидрального угла (O–CH2–CH2–N). Конформеры в жидкости зависят от температуры и легко переходят друг в друга [9, 10]. Молекула имеет три центра донорности и два центра акцепторности протона, поэтому молекулы МЭА в жидкости образуют пространственную сетку водородных связей [11], которая во многом определяет физико-химические свойства этого растворителя.
Физико-химические свойства ДМСО и МЭА представлены в табл. 2. (Для сравнения приведены свойства ЭГ и Н2О) [12]. Из приведенной таблицы можно сделать следующие выводы.
Таблица 2.
Физико-химические характеристики исследуемых веществ 298 K [12]
| Параметр | МЭА | ЭГ | Н2О | ДМСО |
|---|---|---|---|---|
| М | 61 | 62 | 18 | 78 |
| μ, D | 2.27 | 2.88 | 1.83 | 3.96 |
| $D{{N}_{{{\text{SbC}}{{{\text{l}}}_{{\text{5}}}}}}}$ | 41 | 18.5 | 18 | 29.8 |
| ∆vapH, кДж/моль | 49.83 | 50 | 40.66 | 54.39 |
| ∆Hисп/Ткип, кал/(моль K) | 26.9 | 25.5 | 26.05 | – |
| Тпл, °С | 10.3 | –12.9 | 0 | 18.5 |
| Ткип, °С | 170 | 197 | 100 | 189 |
| pKa [13] | 4.75 | – | 7 | – |
| ρ(25°С), кг/(м3103) | 1.012 | 1.113 | 0.99707 | 1.0955 |
| η(25°С) × 10–3, Па с | 18.95 | 16.16 | 0.8903 | 2.194 |
| D × 105, см2/c [3] | 0.055 | 0.083 | 2.25 | 0.72 |
Молекула МЭА обладает наибольшей электронодонорной способностью из рассматриваемых нами растворителей, но меньшим по сравнению с ЭГ и большим, чем у молекулы воды, дипольным моментом. Из-за наличия в молекуле NH2-группы молекула МЭА имеет значительную константу ионизации pKb = 4.75 [13]. Играет роль с одной стороны наличие NН2-группы, с другой – внутримолекулярной Н-связи в молекуле МЭА, которая сильнее, чем у молекулы ЭГ [14]. Энергия межмолекулярных Н-связей почти одинакова во всех трех растворителях.
Меньшая, чем в ЭГ плотность, но большая вязкость и меньший коэффициент самодиффузии [3, 12]. Меньше температурный интервал жидкой фазы, но больше температура ее переохлаждения [15].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Спектр чистого МЭА представлен на рис. 2. Наиболее чувствительна к взаимодействиям в растворе область валентных колебаний ОН- и NН-групп (2800–4000 см–1). Она характеризуется наличием широкой интенсивной полосы, которая представляет собой комбинацию валентных колебаний ОН- и NН-групп, связанных водородной связью. Полоса характеризуется наличием трех максимумов при 3356, 3292 и 3189 см–1, отвечающих трем видам Н-связей. Сделать точное отнесение полос довольно трудно. Для сравнения на этом же рисунке представлен спектр ЭГ в области валентных колебаний ОН.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Рассмотрим сначала область малых концентраций ДМСО (рис. 3). При содержании 2 мол. % ДМСО в моноэтаноламине наблюдается небольшое уменьшение интенсивности полосы 3189 см–1 (разрыв самых прочных Н-связей в МЭА) и появление полосы 3481 см–1, что указывает на изменение строения раствора МЭА при добавлении незначительного количества ДМСО. Это свидетельствует об уменьшении доли прочных Н-связей в МЭА (вероятно, ОН···NH) и увеличении доли слабых Н-связей.
Рис. 3.
Спектр раствора 2 мол. % ДМСО в МЭА в области частот 2800–4000 см–1; 1 – МЭА, 2 – 2 мол. % МЭА – ДМСО.
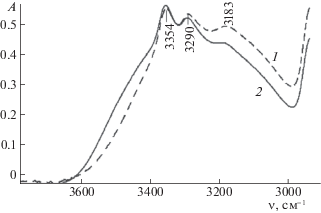
Последующее увеличение содержания ДМСО в растворе МЭА приводит к почти полному исчезновению полос 3189 и 3292 см–1 при содержании 66 мол. % ДМСО. Исчезновение этих полос происходит не монотонно. Наибольшая интенсивность полосы 3189 см–1 наблюдается при содержании 12 мол. % ДМСО и смещении этой полосы до 3179 см–1, а полосы 3292 см–1 – при 5 мол. % ДМСО и смещении полосы до 3288 см–1. Полоса 3353 см–1 продолжает сохраняться при всех концентрациях, немного смещаясь до 3356 см–1. Наибольшая интенсивность ее при 33 мол. % ДМСО (ДМСО : МЭА = 1 : 2).
Появление новых полос поглощения в этой области спектра не наблюдается. Это значит, что при взаимодействии МЭА с ДМСО разрыву подвергаются только два типа водородных связей, имеющихся в чистом МЭА и происходит практически полное разрушение пространственной сетки Н-связей чистого МЭА. Сопоставление соотношений интенсивностей полос 3356 и 1600 см–1 (С–N-связи в МЭА) при различных мольных долях ДМСО указывает на перекачку интенсивности исчезающих полос в полосу 3356 см–1, что означает новый тип Н-связи, образующийся при взаимодействии МЭА с ДМСО, который характеризуется частотой поглощения ОН-группы, близкой к 3356 см–1, что и приводит к росту ее интенсивности (рис. 4 и 5).
Рис. 4.
Спектр раствора 50 мол. % ДМСО в МЭА в области частот 2800–4000 см–1; 1 – МЭА, 2 – 50 мол. % МЭА – ДМСО.

Рис. 5.
Спектр раствора 66 мол. % ДМСО в МЭА в области частот 2800–4000 см–1; 1 – МЭА, 2 – 66 мол. % МЭА – ДМСО.

Сравнение изменений в области ОН-связей в смесях ЭГ с ДМСО и МЭА с ДМСО указывает на значительное различие. Так в случае этиленгликолевых смесей при увеличении мольной доли ДМСО наблюдается небольшое изменение полуширины и положения максимума полосы, соответствующей валентным колебаниям ОН групп. Напротив, для МЭА изменения комбинированной полосы ОН- и NH2-групп при увеличении доли ДМСО очень значительны (рис. 6).
Рис. 6.
Спектры сравнения систем ДМСО-ЭГ и ДМСО-МЭА в области частот 2800–4000 см–1; 1 – МЭА, 2 – 66 мол.% МЭА – ДМСО; 3 – ЭГ, 4 – 50 мол.% ЭГ – ДМСО.

Рассмотрим область валентных колебании S=О группы в ДМСО. Изучение характера изменения спектра смеси МЭА-ДМСО в зависимости от содержания ДМСО в области валентных колебаний S=O-группы (900–1100 см–1) осложняется наличием полосы с максимумом при 1037 см–1 в спектре чистого МЭА, поэтому нельзя избежать перекрывания этой полосы с полосой валентного колебания S=О-группы ДМСО. Тем не менее, видно, что вплоть до 12 мол. % ДМСО полоса МЭА при 1037 см–1 практически не изменяется.
Начиная с 12 мол. % ДМСО эта полоса расширяется, и ее максимум смещается в сторону более низких частот. Это может происходить вследствие наложения на исходную полосу МЭА как полосы, связанной S=O-группы (комплекс 1), так и одновременное появление более высокочастотной полосы S=O-группы, максимум которой достоверно установить не удалось. Она может относиться или к комплексу 2 или к небольшому количеству свободного ДМСО (рис. 7).
Рис. 7.
Спектр раствора 12 мол. % ДМСО в МЭА в области частот 900–1100 см–1; 1 – МЭА, 2 – 12 мол. % МЭА – ДМСО.

Дальнейшее увеличение концентрации ДМСО в смеси его с МЭА приводит к дальнейшему расширению полосы валентных колебаний S=O (900–1100 см–1) как в сторону высоких, так и низких частот. Контур этой полосы позволяет выделить три ее составляющих, кроме полосы 1037 см–1, имеющейся в чистом МЭА. Анализ контура показывает, что в смеси МЭА–ДМСО, начиная с 25 мол. % ДМСО, присутствуют три типа молекул ДМСО: в составе комплекса 1 (максимум ∼1015–1020 см–1), в составе комплекса 2 (максимум ∼1040–1045 см–1) и несвязанный ДМСО (максимум ∼1057 см–1) рис. 8.
Рис. 8.
Спектр раствора 66 мол. % ДМСО в МЭА в области частот 900–1100 см–1; 1 – МЭА, 2 – 66 мол. % МЭА –ДМСО.

Таким образом, сочетание наблюдаемых спектральных изменений в двух частотных диапазонах (валентных колебаний S=О-группы и ОН- и NН2-групп) указывает на образование как минимум двух типов комплексов МЭА–ДМСО, приводящих к исчезновению водородных связей МЭА, характеризующихся полосами с максимумами 3189 и 3292 см–1. Поскольку это самые прочные связи, то их предположительно можно отнести к ОН···NН взаимодействиям, которые заменяются на ОН···О=S. Одновременно, начиная с 25 мол. % ДМСО происходит накопление несвязанного ДМСО.
Сопоставление спектральных изменений в зависимости от мольной доли ДМСО в двух различных системах (ДМСО–ЭГ и ДМСО–МЭА) позволяет предположить, что в обеих системах образуются комплексы S=О···Н–О, характеризующиеся близкими значениями частот колебаний О–Н-групп, включенных в аналогичные водородные связи.
В случае чистого ЭГ, где Н-связи осуществляются за счет ОН···ОН-контактов, они постепенно заменяются на S=О···НО-водородные связи. Частоты колебаний ОН-групп в обоих вариантах, по-видимому, близки; поэтому не наблюдается значительного изменения спектрального контура в области 2800–3400 см–1.
Для МЭА спектральный контур в области 2800–4000 см–1 обусловлен наличием ОН···ОН- и NH···ОН-водородных связей, для которых частоты колебаний ОН-групп отличаются. При добавлении ДМСО происходит разрушение NH···OH- и ОН···ОН-связей и замена их на S=O···HO, для которых частота колебаний ОН-групп близка к частоте ОН- в ОН···ОН-водородных связях. Это объясняет перекачку интенсивностей полос 3189 и 3292 см–1 (NH···ОН) в интенсивность полосы 3354 см–1.
Появление свободного ДМСО в обеих системах наблюдается приблизительно при одинаковой мольной доле ДМСО (около 25 мол. %).
Однако, в отличие от ЭГ, где пространственная сетка Н-связей сохраняется при частичном изменении составляющих ее звеньев, сетка МЭА разрушается практически полностью и замена ее на новую не происходит.
Работа выполнена в рамках государственного задания ИОНХ РАН в сфере фундаментальных научных исследований и при финансовой поддержке Российского фонда фундаментальных исследований в рамках научного проекта № 19-03-00215.
Список литературы
Rassmunsen D.H., Mackenzie A.P. // Nature 1968. V. 220. P. 1315.
Baudot A., Cacela M.L., Duarte M.L., Fausto R. // Criobiology. 2002. V. 44. P. 150.
Родникова М.Н. Особенности растворителей с пространственной сеткой водородных связей. Дисс. … докт. хим. наук. М., 1998.
Ahkong Q.F., Fischer D., Tompion W., Lucy J.A. // Nature. 1975. V. 253. P. 194.
Lovelock J.E., Bishop M.W.Y. // Ibid. 1959. V. 183. P. 1394.
Anchordoguy T.J., Ceccini C.A., Crowe J.N., Crowe L.M. // Cryobiology. 1991. V. 28. P. 467.
Fader H., Dreizer H.D., Rudolph V., Typke Z. // Z. Naturforsch. 1969. B. 244. S. 266.
Fazaeli Reza, Solimanntjad Mohammad // Iran. Chem. Commun. 2014. V. 2. P. 244.
Novakovskaya Yu.V., Rodnikova M.N. // Structural Chemistry. 2015. V. 26. P. 177.
Новаковская Ю.В., Родникова М.Н. // Журн. неорган. химии. 2014. Т. 59. С. 1534.
Родникова М.Н. // Журн. физ. химии. 1993. Т. 67. С. 275.
Солонина И.А., Родникова М.Н., Киселев М.Р. и др. // Журн. неорган. химии. 2019. Т. 64. № 8. С. 889.
Лурье Ю.Ю. Справочник по аналитической химии. М.: Химия, 1979.
Харитонов Ю.Я., Хошабова Э.Г., Родникова М.Н. и др. // Докл. АН СССР. 1989. Т. 304. № 4. С. 917.
Солонина И.А., Родникова М.Н., Киселев М.Р., Хорошилов А.В. // Журн. физ. химии. 2015. Т. 89. № 5. С. 882.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии