Журнал физической химии, 2020, T. 94, № 11, стр. 1616-1623
Кинетика выделения диоксида углерода при озонировании водных растворов муравьиной кислоты
А. В. Леванов a, *, О. Я. Исайкина a, А. Н. Харланов a
a Московский государственный университет имени М.В. Ломоносова, Химический факультет
Москва, Россия
* E-mail: levanov@kge.msu.ru
Поступила в редакцию 05.03.2020
После доработки 05.03.2020
Принята к публикации 17.03.2020
Аннотация
Впервые исследована кинетика выделения диоксида углерода при взаимодействии озона с водным раствором муравьиной кислоты в барботажном реакторе. Разработан эффективный и простой метод определения диоксида углерода в газовом потоке. Показано, что образование 1 моля СО2 соответствует расходованию ∼2.4 моля О3. Найдено значение истинной константы скорости реакции молекулы О3 с формиат-ионом HCOO– (120 ± 15 л моль–1 с–1 при 20–21°С). Подтверждено, что О3 не взаимодействует с недиссоциированной молекулой HCOOH.
Исследование взаимодействия муравьиной кислоты и формиат-иона с озоном представляет интерес как с практической, так и с теоретической точек зрения. Информация о кинетике реакции О3 с НСООН/НСОО– требуется при разработке процессов водоочистки, поскольку муравьиная кислота содержится в сточных водах некоторых производств [1–3] и является побочным продуктом озонирования [4–7]. При теоретических исследованиях взаимодействия озона с органическими соединениями, окисляющимися по фрагменту С−Н, муравьиная кислота и её анион служат удобными модельными субстратами, так как представляют собой простейшие соединения, имеющие связь углерод–водород, и не содержащие кратные связи между атомами углерода [8, 9].
Результаты экспериментальных исследований кинетики реакции озона с НСООН/НСОО– в водных растворах представлены в работах [8, 10, 11]. Показано, что озон не взаимодействует с недиссоциированной молекулой НСООН (${{k}_{{{{{\text{О}}}_{3}}\, + \,{\text{НСООH}}}}}$ = 0 ± 0.035 л моль–1с–1) [11]. Это согласуется с тем фактом, что концентрированная муравьиная кислота – инертный растворитель по отношению к озону [12, 13]. Для константы скорости реакции озона с формиат-ионом при 20–21°С, в литературе даны значения (л моль–1с–1): 100 ± 20 (определено в присутствии 0.001 М н‑пропанола) [10], 140 [14], 46 ± 5 (в присутствии 0.2 М трет-бутанола) [8], 81 ± 9 [8], 280 ± 15 [11]. Значения константы из различных источников отличаются друг от друга, и зависят от присутствия алифатических спиртов – ингибиторов радикальных реакций. Это свидетельствует о том, что реакция О3 с НСОО– протекает по сложному механизму, а ее интермедиаты – свободные радикалы. При этом расходование озона может происходить не только в первичной реакции с формиат-ионом, но и на последующих стадиях с участием свободных радикалов. Однако во всех известных нам публикациях кинетические характеристики реакции озона с муравьиной кислотой определяли лишь на основе измерений концентрации О3. В то же время достоверную информацию о кинетике первичной реакции О3 с НСОО– можно получить путем определения скорости выделения диоксида углерода СО2 − единственного стабильного продукта окисления муравьиной кислоты, но до сих пор подобные исследования не выполнены. Цели настоящей работы – разработка простой и надежной методики определения диоксида углерода в газах, выходящих из барботажного реактора при озонировании водных растворов органических соединений, а также определение кинетических характеристик реакции озона с НСООН/НСОО– в водном растворе на основе скоростей выделения диоксида углерода и расходования озона.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для приготовления рабочих растворов использовали дистиллированную воду, концентрированные муравьиную “reinst zur Analyse” и хлорную “х.ч.” кислоты, стандарт-титры гидроксида натрия (без примесей карбонатов), раствор 0.1 г фенолфталеина (ГОСТ 5850-72) в 100 мл этилового спирта [15].
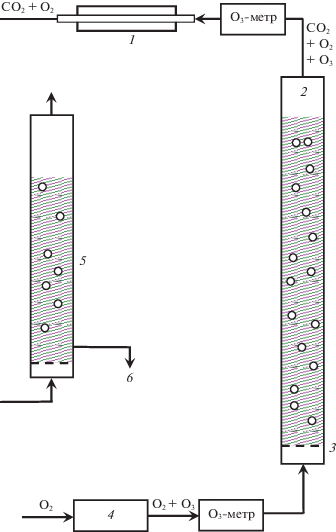
Схема экспериментальной установки показана на рис. 1 и в целом аналогична описанной в работах [11, 16–18], за исключением того, что выходящие из реактора газы после прохождения через печь для разложения озона поступают в ловушку, заполненную раствором гидроксида натрия с добавлением индикатора фенолфталеина. Озонированию подвергали водные растворы, содержащие муравьиную и хлорную кислоты с концентрациями CHCOOH = 0.1–1 М, ${{C}_{{{\text{HCl}}{{{\text{O}}}_{{\text{4}}}}}}}$ = 0.1–0.53 М. Процесс осуществляли в проточном барботажном реакторе при комнатной температуре (20 ± 1°С), скорость потока исходной газовой смеси О3 + О2 ${v}$ = 21 л/ч = 0.35 л/мин (ст.у.), объем реакционного раствора Vреак = 200 мл. Использовали тот же реактор, что и в работе [11]. Озоно-кислородную смесь получали в озонаторе барьерного разряда из чистого кислорода. Концентрацию озона измеряли на входе и выходе из реактора с помощью фотометрических озонометров Медозон-254/5; концентрация на входе C(O3)in = = 28–29 г/м3.
Рис. 1.
Схема экспериментальной установки: 1 – печь для разложения озона, 2 – барботажный реактор с раствором органического соединения, 3 – фильтр из пористого стекла, 4 – озонатор, 5 – ловушка с раствором NaOH и фенолфталеина, 6 – отбор проб для измерения оптической плотности.
Качественный анализ выходящих из реактора газов выполняли методом ИК-спектроскопии на ИК-фурье-спектрометре EQUINOX 55/S (Bruker) при разрешении 0.5 см–1 и усреднении по 50 сканам. Оптическую кювету длиной 10 см с окнами из CaF2 заполняли выходящими газами и помещали в кюветное отделение спектрометра. Для исключения влияния атмосферного СО2, прибор и кюветное отделение продували газообразным азотом.
Скорость поглощения (расходования) озона в реакторе(моль л–1мин–1) находили из соотношения
(1)
$r({{{\text{O}}}_{3}}) = \frac{{v}}{{{{V}_{{{\text{реак}}}}}}}(C^\circ ({{{\text{O}}}_{3}}) - C({{{\text{O}}}_{3}})),$Количество диоксида углерода СО2 в выходящих из реактора газах определяли по времени ∆t (мин), требуемом для нейтрализации раствора NaОН в ловушке. Для этого газовый поток пропускали сначала через печь для разложения озона. Температура печи составляла ∼500°С и была специально подобрана так, чтобы обеспечить практически полное удаление О3 [19]. Затем газы направляли в ловушку, содержащую определенный объем раствора NaOH известной концентрации (VNaOH = 100 мл, CNaOH от 0.005 до 0.01 М) и ∼2 × 10–4 мас. % индикатора фенолфталеина С20Н14О4. Для определения времени нейтрализации, отвечающего исчезновению малиново-розовой окраски фенолфталеина, из ловушки периодически отбирали пробы раствора и регистрировали оптическую плотность на спектрофотометре Agilent-8453 или фотометре КФК-3; после измерений пробы возвращали обратно в ловушку. Скорость выделения СО2 (моль л–1 мин–1), отнесенную к объему раствора в реакторе, рассчитывали по формуле
Разработка методики определения СО2 описана в следующем разделе.ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
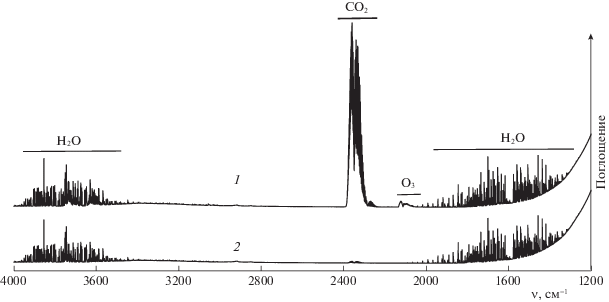
ИК-спектр газов, выходящих из реактора при озонировании раствора муравьиной кислоты в присутствии HClO4, показан на рис. 2 (спектр 1). Очень хорошо проявляется интенсивный сигнал симметричного валентного колебания СО2 с центром 2349 см–1 с характерной колебательно-вращательной структурой, а также колебательно-вращательные полосы паров Н2О 1300–2000 (деформационное колебание) и 3500–4000 см–1 (валентные колебания) [20], кроме того, заметна полоса (101)–(000) молекулы О3 с центром при 2111 см–1 [21]. Полосы поглощения каких-либо других веществ в спектре не зарегистрированы. Спектр выходящих газов, прошедших через печь, отличается от спектра 1 (рис. 2) лишь отсутствием полосы озона. Для сравнения на рис. 2 приведен спектр 2 газообразного кислорода, пропущенного через реактор, заполненный только водой, и таким образом насыщенного парами Н2О. Очень слабый сигнал СО2 в спектре сравнения может быть обусловлен попаданием в кюветное отделение малых количеств диоксида углерода из окружающего воздуха. Из данных рис. 2 следует, что диоксид углерода – единственный газообразный продукт реакции муравьиной кислоты с озоном в водном растворе.
Рис. 2.
Инфракрасный спектр газов, выходящих из реактора при озонировании раствора 1 М НСООН и 0.1 М HClO4, C(O3)in = 27.5 г/м3 (1); спектр кислорода-газа, пропущенного через реактор, содержащий только воду (2).
Для количественного определения диоксида углерода в газовом потоке, использовали метод, основанный на поглощении СО2 раствором гидроксида натрия. Момент, когда весь NaOH прореагировал, находят по исчезновению характерной малиново-розовой окраски фенолфталеина. Подобная идея высказана ранее (например, в [22, 23]), однако при практическом использовании метода в условиях конкретных экспериментов требуется разработка особых приспособлений и приемов. Следует отметить, что исследование кинетики окисления органических соединений озоном на основе измерения скорости выделения СО2 – весьма перспективно, так как позволяет найти характеристики именно целевой реакции. В то же время нам неизвестны работы, в которых такой подход применяется; это прежде всего связано со сложностью определения диоксида углерода по сравнению с озоном.
Поскольку фенолфталеин окисляется озоном [24], в нашей установке выходящие из реактора газы проходили через печь для разложения О3 (рис. 1). Далее газовый поток направлялся в ловушку, в которую помещено 100 мл раствора 0.005–0.01 М NaOH (не содержащего карбонатов) с добавлением 0.2–0.3 мл 0.1% спиртового раствора фенолфталеина. Из нее периодически отбирали пробы раствора и регистрировали оптическую плотность.
Типичный УФ-видимый спектр раствора в ловушке показан на рис. 3 и обусловлен присутствием фенолфталеина. Интервал перехода окраски этого индикатора находится в диапазоне рН 8.2–9.8 [25], что соответствует превращению гидроксида натрия в гидрокарбонат [26]:
при этом окрашенный дианион фенолфталеина С20Н12О$_{4}^{{2 - }}$ переходит в бесцветную форму – нейтральную молекулу С20Н14О4 [25]. Вначале (рис. 3, время 2 мин), практически весь индикатор существует в окрашенной форме С20Н12О$_{4}^{{2 - }}$ с главным максимумом светопоглощения при 552 нм (длины волн всех максимумов оптической плотности приведены на рис. 3). По мере поступления диоксида углерода в ловушку и уменьшения концентрации NaOH доля окрашенной формы уменьшается, а бесцветной – возрастает. Наконец, по прошествии достаточного времени, когда NaOH израсходован, и в растворе присутствует только гидрокарбонат, весь фенолфталеин переходит в форму С20Н14О4, не обладающую окраской в видимом диапазоне, но имеющую характерные максимумы поглощения в УФ-области при 229 и 274 нм.Рис. 3.
Спектры раствора в ловушке в различные моменты времени при озонировании раствора 0.8 М НСООН + 0.5 М HClO4, C(O3)in = 28 г/м3. Длина оптического пути кюветы 1 см.

Образование в растворе в ловушке именно гидрокарбоната по реакции (3) подтверждается кислотным титрованием с индикатором метиловым оранжевым. Цвет индикатора изменяется от желтого при рН > 4.4 до красно-оранжевого при рН < 3.1 (переход окраски в интервале рН 3.1–4.4) [25]. В растворе гидрокарбоната, даже в присутствии СО2, метилоранж должен быть желтым. Мы действительно наблюдаем желтую окраску при прибавлении метилоранжа в раствор в ловушке после поглощения СО2 и соответствующей нейтрализации NaOH с обесцвечиванием фенолфталеина. Титрование этого раствора с помощью HCl до перехода окраски из желтой в оранжево-красную позволяет определить концентрацию NaHCO3 [26]. При этом всегда оказывалось, что величина ${{C}_{{{\text{NaHC}}{{{\text{O}}}_{{\text{3}}}}}}}$ равна исходной концентрации гидроксида натрия CNaOH. Это подтверждает, что обесцвечивание фенолфталеина в ловушке отвечает завершению именно реакции (3) с образованием гидрокарбоната, а также свидетельствует о том, что исходный раствор гидроксида натрия не содержит карбонатов.
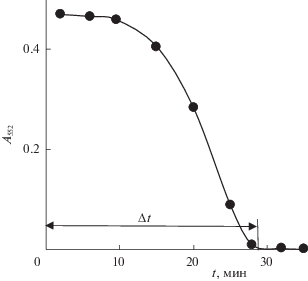
Характерная зависимость оптической плотности окрашенной формы фенолфталеина С20Н12О$_{4}^{{2 - }}$ от длительности пропускания выходящих газов через ловушку показана на рис. 4. В наших экспериментах устанавливается практически стационарный режим [11]: диоксид углерода выходит из реактора и попадает в ловушку с постоянной скоростью. Интегральное количество выделившегося СО2 пропорционально длительности озонирования, и поэтому процесс поглощения СО2 в ловушке по реакции (3) аналогичен титрованию. В результате зависимость оптической плотности фенолфталеина от времени имеет вид кривой титрования с характерным изгибом около точки эквивалентности (см. рис. 4). С учетом того, что изменение окраски фенолфталеина происходит в интервале рН 8.2–9.8, момент полной нейтрализации NaOH (время ∆t) отвечает завершению изгиба на зависимости A552 от t, когда значение A552 приближается к нулю. Весь выделившийся к этому моменту СО2 связан в ловушке в виде NaHCO3, следовательно, скорость поступления СО2 в ловушку, равную скорости его выделения из реактора, r(CO2), можно определить по формуле (1) как отношение начального количества NaOH, nNaOH = CNaOHVNaOH (CNaOH – исходная концентрация гидроксида натрия, VNaOH – объем раствора в ловушке), к времени ∆t и объему раствора в реакторе Vреак. Таким образом, для определения скорости выделения диоксида углерода, мы регистрировали зависимость оптической плотности фенолфталеина при 552 нм в растворе в ловушке, находили момент времени ∆t, отвечающий исчезновению розово-малиновой окраски (A552 → 0), и рассчитывали r(CO2) по формуле (1).
Рис. 4.
Зависимость оптической плотности раствора в ловушке (100 мл 0.01 М NaOH + фенолфталеин) от времени пропускания выходящих из реактора газов при озонировании раствора 0.8 М НСООН + 0.5 МHClO4, C(O3)in = 28 г/м3. Длина оптического пути кюветы 1 см.
Применение описанного метода для исследования озонирования растворов различных веществ позволяло определить значения r(CO2) от 10–5 до 10–3 моль л–1мин–1, что соответствует концентрации СО2 0.01 ∼ 1 об. % (при скорости газового потока 0.35 л/мин (ст.у.) и объеме реакционного раствора 0.2 л). При этом исходная концентрация NaOH в ловушке составляла от 0.002 до 0.01 М, а время ∆t принимало значения в диапазоне 5–100 мин. Потенциальным мешающим фактором при использовании метода является возможность обесцвечивания за счет окисления окрашенной формы фенолфталеина кислородом [25] и следами озона [24], однако в масштабе времени наших экспериментов этот процесс очень медленный. При окислении зависимость A552(t) – слабо убывающая прямая. Ее вид резко отличается от кривой с изгибом при поглощении СО2 (см. рис. 4), что позволяет легко отличить эти два процесса.
В настоящей работе мы определили скорости поглощения озона и выделения диоксида углерода при озонировании растворов муравьиной кислоты концентрации 0.1−1 М с добавками 0.1–0.53 М хлорной кислоты. На рис. 5 представлена зависимость отношения скоростей r(O3)/r(CO2) от параметра CHCOOHKC/${{C}_{{{\text{HCl}}{{{\text{O}}}_{{\text{4}}}}}}}$, где CHCOOH и ${{C}_{{{\text{HCl}}{{{\text{O}}}_{{\text{4}}}}}}}$ – ацидиметрические концентрации муравьиной и хлорной кислот, М, KC − концентрационная константа диссоциации муравьиной кислоты, М. Значения KC в условиях наших экспериментов мы оценили на основе данных [27], причем считали, что ионная сила равна ${{C}_{{{\text{HCl}}{{{\text{O}}}_{{\text{4}}}}}}}$.
Рис. 5.
Экспериментальные значения отношения скоростей поглощения озона и выделения диоксида углерода при озонировании растворов муравьиной кислоты.

Из рис. 5 следует, что значение отношения r(O3)/r(CO2) в различных экспериментах с учетом погрешностей одинаково и составляет 2.36 ± 0.15. Здесь и далее интервалы неопределенности соответствуют доверительной вероятности 95%. Таким образом, образование 1 моль СО2 сопровождается расходованием ∼2.4 моль О3. Этот результат согласуется со следующей схемой взаимодействия муравьиной кислоты с озоном. Первичная стадия заключается во взаимодействии молекулы О3 с формиат-ионом НСОО– (недиссоциированная молекула кислоты НСООН с О3 не реагирует) с образованием СО2 или какого-либо интермедиата, который в последующих реакциях быстро превращается в СО2. Кроме того, в ходе первичной и последующих стадий генерируются такие активные интермедиаты, которые реагируют с О3 и приводят к его дополнительному расходу. В то же время значимое расходование формиата происходит только в первичной стадии. Данная схема соответствует результатам работ [8, 9], где на основе квантово-химических исследований выявлены наиболее вероятные пути сложной реакции О3 с формиат-ионом НСОО– и предложены конкретные интермедиаты, которые могут вызывать дополнительное расходование озона.
Обозначим истинную константу скорости первичной стадии О3 + НСОО– через ${{k}_{{{{{\text{О}}}_{3}}\, + \,{\text{НСО}}{{{\text{О}}}^{ - }}}}}$. Тогда в соответствии со схемой, скорость выделения диоксида углерода представляется выражением
(4)
$r({{{\text{O}}}_{{\text{3}}}}){\text{ }} = {{k}_{{{{{\text{О}}}_{3}}}}}[{{{\text{О}}}_{{\text{3}}}}][{\text{НСО}}{{{\text{О}}}^{--}}],$(5)
${{k}_{{{{{\text{О}}}_{3}}}}}{\text{/}}{{k}_{{{{{\text{О}}}_{3}}\, + \,{\text{НСО}}{{{\text{О}}}^{ - }}}}} = r({{{\text{O}}}_{{\text{3}}}}){\text{/}}r({\text{C}}{{{\text{O}}}_{{\text{2}}}}) = 2.36 \pm 0.15.$Кинетический анализ наших результатов выполним с помощью подхода, использованного в работе [11]. Взаимодействие озона с раствором муравьиной кислотой в барботажном реакторе – это газо-жидкостная реакция, причем в [11] показано, что процессы растворения и химических реакций озона в жидкости можно рассматривать независимо друг от друга. Поэтому можно записать условие равенства скоростей растворения и расходования озона в химической реакции в стационарном режиме функционирования реактора:
(6)
${{k}_{L}}a({{H}_{{{{{\text{О}}}_{3}}}}}C({{{\text{O}}}_{{\text{3}}}})--[{{{\text{О}}}_{{\text{3}}}}]) = {{k}_{{{{{\text{О}}}_{3}}}}}[{{{\text{О}}}_{{\text{3}}}}][{\text{НСО}}{{{\text{О}}}^{--}}],$(7)
$[{{{\text{O}}}_{{\text{3}}}}] = \frac{{{{k}_{L}}a{{H}_{{{{{\text{О}}}_{3}}}}}C({{{\text{O}}}_{{\text{3}}}})}}{{{{k}_{L}}a + {{k}_{{{{{\text{О}}}_{3}}}}}[{\text{HCO}}{{{\text{O}}}^{ - }}]}}.$(8)
$\frac{{v}}{{{{V}_{{{\text{реак}}}}}}}\left( {C^\circ ({{{\text{O}}}_{{\text{3}}}}) - C({{{\text{O}}}_{{\text{3}}}})} \right) = {{k}_{{{{{\text{О}}}_{3}}}}}[{{{\text{О}}}_{{\text{3}}}}][{\text{НСО}}{{{\text{О}}}^{--}}].$(9)
$\begin{gathered} \frac{{v}}{{{{V}_{{{\text{реак}}}}}}}(C^\circ ({{{\text{O}}}_{{\text{3}}}}) - C({{{\text{O}}}_{{\text{3}}}})) = \\ = \frac{{{{k}_{L}}a{{H}_{{\text{O}}}}_{{_{{\text{3}}}}}C({{{\text{O}}}_{{\text{3}}}}){{k}_{{{{{\text{O}}}_{{\text{3}}}}}}}[{\text{HCO}}{{{\text{O}}}^{ - }}]}}{{{{k}_{L}}a + {{k}_{{{{{\text{O}}}_{{\text{3}}}}}}}[{\text{HCO}}{{{\text{O}}}^{ - }}]}}. \\ \end{gathered} $(10)
$F = \frac{{{{k}_{L}}a{{k}_{{{{{\text{O}}}_{{\text{3}}}}}}}[{\text{HCO}}{{{\text{O}}}^{ - }}]}}{{{{k}_{L}}a + {{k}_{{{{{\text{O}}}_{{\text{3}}}}}}}[{\text{HCO}}{{{\text{O}}}^{ - }}]}},$Нетрудно показать, что в условиях наших экспериментов концентрация формиата в растворе может быть с хорошей точностью представлена формулой
(11)
$[{\text{HCO}}{{{\text{O}}}^{--}}] = \frac{{{{C}_{{{\text{HCOOH}}}}}{{K}_{C}}}}{{{{C}_{{{\text{HCl}}{{{\text{O}}}_{{\text{4}}}}}}}}}.$(12)
$F = \frac{{{{k}_{L}}a{{k}_{{{{{\text{O}}}_{{\text{3}}}}}}}{{C}_{{{\text{HCOOH}}}}}{{K}_{C}}{\text{/}}{{C}_{{{\text{HCl}}{{{\text{O}}}_{{\text{4}}}}}}}}}{{{{k}_{L}}a + {{k}_{{{{{\text{O}}}_{{\text{3}}}}}}}{{C}_{{{\text{HCOOH}}}}}{{K}_{C}}{\text{/}}{{C}_{{{\text{HCl}}{{{\text{O}}}_{{\text{4}}}}}}}}},$(13)
$\frac{1}{F} = \frac{1}{{{{k}_{L}}a}} + \frac{1}{{{{k}_{{{{{\text{O}}}_{{\text{3}}}}}}}}}\frac{{{{C}_{{{\text{HCl}}{{{\text{O}}}_{{\text{4}}}}}}}}}{{{{C}_{{{\text{HCOOH}}}}}{{K}_{C}}}}.$Рис. 6.
Значения величины 1/F при различных концентрациях НСООН и HClO4 в реакционном растворе; 1 – наши данные, 2 – работы [11].
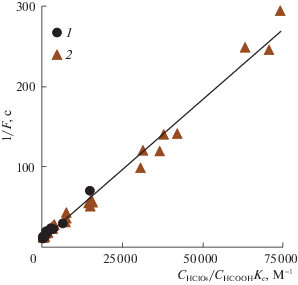
Отметим, что коэффициенты уравнения линейной регрессии на рис. 6 позволяют определить константу скорости ${{k}_{{{{{\text{О}}}_{3}}}}}$ , а также объемный коэффициент массопереноса озона: 1/${{k}_{{{{{\text{О}}}_{3}}}}}$ = (3.51 ± ± 0.13) × 10–3 моль с л–1, 1/kLa = 9 ± 3 с, откуда ${{k}_{{{{{\text{О}}}_{3}}}}}$ = 285 ± 11 л моль–1с–1, kLa = 0.11 ± 0.04 с–1. С учетом погрешностей эти значения совпадают со значениями из работы [11]: ${{k}_{{{{{\text{О}}}_{3}}}}}$ = 280 ± ± 15 л моль–1 с–1, kLa = 0.094 ± 0.016 с–1, найденными с помощью иного метода обработки данных. Это свидетельствует о надежности результатов обоих исследований.
Выше (равенство (5)) определено отношение эффективной константы скорости расходования озона к истинной константе скорости реакции молекулы О3 с формиат-ионом НСОО–${{k}_{{{{{\text{О}}}_{3}}}}}$/${{k}_{{{{{\text{О}}}_{3}}\, + \,{\text{НСО}}{{{\text{О}}}^{ - }}}}}$. Так как величина ${{k}_{{{{{\text{О}}}_{3}}}}}$, найденная в идентичных экспериментальных условиях, известна (${{k}_{{{{{\text{О}}}_{3}}}}}$ = 285 ± ± 11 (эта работа), 280 ± 15 л моль–1 с–1 [11]), можно вычислить значение истинной константы
Таким образом, показано, что единственный конечный продукт окисления муравьиной кислоты в кислых водных растворах – диоксид углерода. Предложен метод количественного определения СО2 в газовом потоке. Подтверждено, что с недиссоциированной молекулой НСООН озон не реагирует. Определено значение истинной константы скорости реакции О3 с формиат-ионом НСОО– в водном растворе при 20–21°С.
Список литературы
Claudel B., Nueilati M., Andrieu J. // Appl. Catal. 1984. V. 11. № 2. P. 217.
Harmsen J.M.A., Jelemensky L., Van Andel-Scheffer P.J.M. et al. // Appl. Catal. A. 1997. V. 165. № 1–2. P. 499.
Lin J., Nakajima T., Jomoto T., Hiraiwa K. // Ozone Sci. Eng. 2000. V. 22. № 3. P. 241.
Kuo C.-Y. // J. Chromatography A. 1998. V. 804. № 1–2. P. 265.
Yapsakli K., Can Z.S. // Water Quality Res. J. Can. 2004. V. 39. № 2. P. 140.
El-Raady A.a.A., Nakajima T. // Ozone Sci. Eng. 2005. V. 27. № 1. P. 11.
Mayer B.K., Ryan D.R. // Applications of Advanced Oxidation Processes (AOPs) in Drinking Water Treatment. Cham: Springer, 2019. P. 345–386.
Von Sonntag C., Von Gunten U. Chemistry of Ozone in Water and Wastewater Treatment. From Basic Principles to Applications. London: IWA Publishing, 2012.
Reisz E., Fischbacher A., Naumov S. et al. // Ozone Sci. Eng. 2014. V. 36. № 6. P. 532.
Hoigné J., Bader H. // Water Res. 1983. V. 17. № 2. P. 185.
Леванов А.В., Исайкина О.Я., Гасанова Р.Б., Лунин В.В. // Журн. физ. химии. 2017. Т. 91. № 8. С. 1307.
Dorland R.M., Hibbert H. // Can. J. Res. 1940. V. 18b. № 1. P. 30.
Bernatek E., Grønning P., Ledaal T. // Acta Chem. Scan. 1964. V. 18. P. 1966.
Von Gunten U. // Water Res. 2003. V. 37. № 7. P. 1443.
Сусленникова В.М., Киселева Е.К. Руководство по приготовлению титрованных растворов. Л.: Химия, 1973. С. 132.
Levanov A.V., Isaikina O.Y., Gasanova R.B., Lunin V.V. // Ind. Eng. Chem. Res. 2018. V. 57. № 43. P. 14355.
Леванов А.В., Исайкина О.Я., Азизова П.Ш. и др. // Журн. физ. химии. 2020. Т. 94. № 1. С. 65.
Леванов А.В., Исайкина О.Я., Лунин В.В. // Там же. 2016. Т. 90. № 12. С. 1791.
Леванов А.В., Кусков И.В., Зосимов А.В. и др. // Журн. аналит. химии. 2003. Т. 58. № 5. С. 496.
Herzberg G. Molecular spectra and molecular structure. II. Infrared and Raman spectra of polyatomic molecules. Toronto – New York – London: D. Van Nostrand Company, 1956.
Иванов С.В., Панченко В.Я. // Успехи физ. наук. 1994. Т. 164. № 7. С. 725.
Juránek J. // Collect. Czech. Chem. Commun. 1958. V. 23. № 1. P. 78.
Grassmann H. // Handbuch der Analytischen Chemie. Elemente der Vierten Hauptgruppe: I Kohlenstoff. Silicium. Berlin–Heidelberg: Springer, 1967. P. 215.
Matsui M., Koike T., Shibata K. // J. Soc. Dyers Colourists. 1988. V. 104. № 12. P. 482.
Bányai É. // Indicators. Ch. 3. Acid–Base Indicators. Oxford: Pergamon Press, 1972. P. 65–176.
Алексеев В.Н. Количественный анализ. М.: Химия, 1972. С. 278.
Bell J.L.S., Wesolowski D.J., Palmer D.A. // J. Sol. Chem. 1993. V. 22. № 2. P. 125.
Леванов А.В., Кусков И.В., Антипенко Э.Е., Лунин В.В. // Журн. физ. химии. 2008. Т. 82. № 7. С. 1275.
Леванов А.В., Исайкина О.Я., Лунин В.В. // Там же. 2019. Т. 93. № 7. С. 986.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии


