Журнал физической химии, 2020, T. 94, № 12, стр. 1882-1888
Фотокаталитические характеристики сложных оксидов Bi4V1.8Me0.2O11 – d (Me = Co, Cu, Fe, Mn, Nb)
Е. С. Буянова a, З. А. Михайловская a, b, *, М. В. Юрченко a, О. А. Липина c
a Уральский федеральный университет им. первого Президента России Б.Н. Ельцина
620002 Екатеринбург, Россия
b Российская академия наук, Уральское отделение, Институт геологии и геохимии им. академика А.Н. Заварицкого
620016 Екатеринбург, Россия
c Российская академия наук, Уральское отделение, Институт химии твердого тела
620990 Екатеринбург, Россия
* E-mail: zozoikina@mail.ru
Поступила в редакцию 03.03.2020
После доработки 25.03.2020
Принята к публикации 14.04.2020
Аннотация
По стандартной керамической технологии синтезированы и рентгенографически аттестованы порошки Bi4V2O11 и Bi4V1.8Me0.2O11 – d (Me = Co, Cu, Fe, Mn, Nb) со средним размером частиц 9−12 мкм и удельной поверхностью 1.2–1.6 м2/г. Фотокаталитическая активность всех составов изучена на примере процесса окисления родамина Б в водном растворе. Установлено, что ее величина достаточно высока и находится в прямой зависимоcти от значений ионных радиусов металлов, содержащихся в слоях (V(ME)O3$\square $0.5)2–, где $\square $ – вакансия кислорода. Предложен механизм действия фотокатализаторов на основе Bi4V2O11 (BIMEVOX), доказано образование радикалов ${\text{O}}_{2}^{{ \bullet - }}$ и ${}^{ \bullet }{\text{OH}}$ как основных окисляющих агентов родамина Б.
Нано- и микроразмерные частицы оксидов металлов, облучаемые светом ультрафиолетового (УФ) и видимого диапазона, могут быть источником активных кислородсодержащих частиц, а также фотогенерированных электронов и дырок [1]. Такие свойства сложнооксидных соединений обуславливают их фотокаталитическую активность, а значит возможность использования в процессах водо- и газочистки, очистки поверхностей конструкционных материалов, конверсии солнечной энергии, в солнечные батареях и фотохимических реакторах [1]. Наиболее эффективными с “энергетической” точки зрения являются сложнооксидные фотокатализаторы, работающие в видимом и ближнем УФ-диапазоне, т.е. имеющие минимальные значения ширины запрещенной зоны (Eg), и/или фотокатализаторы, для которых положение валентной и проводящей зон обеспечивает существенное снижение потенциалов целевых реакций окисления [1].
Наиболее изученные в настоящее время оксидные фотокатализаторы, активные в водных средах – это TiO2, ZnO и сложные оксиды на их основе. Они отличаются химической стабильностью, нетоксичностью и дешевизной [2–4]. Однако из-за относительно высоких значений ширины запрещенной зоны (Eg ≈ 3.2–3.37 эВ [2]) их использование ограничено ультрафиолетовой областью. В качестве альтернативы исследуются другие оксидные полупроводники. Один из возможных вариантов получения материалов с меньшими значениями Eg (т.е. активными при больших длинах волн) заключается в построении валентной зоны полупроводника с использованием 2p-орбитали кислорода, гибридизованной с s-орбиталью металла (например, 6s Bi) [5]. Поэтому Bi-содержащие оксиды металлов рассматривают как потенциальные активные фотокатализаторы видимого света [6]. Например, BiVO4 с величиной запрещенной зоны 2.4 эВ показал высокую фотокаталитическую активность в реакциях выделения О2 при облучении реакционной зоны видимым светом (420 нм), и в настоящее время BiVO4 – один из самых перспективных фото- и электрофотокатализаторов расщепления воды и водоочистки [7–9]. Выраженной фотокаталитической активностью в видимой области спектра обладают сложные оксиды на основе CaBi2O4 [10] Bi2WO6 [11], Bi2MoO6 [12] и Bi2GaTaO7 [13], а сложные оксиды на основе титанатов [14], ниобатов [15], и танталатов [16] висмута активны в ближнем УФ.
В противоположность BiVO4, ванадат висмута состава Bi4V2O11 и сложные оксиды на его основе (семейство BIMEVOX) как фотокатализаторы исследованы весьма ограниченно [17, 18]. Однако значения Eg у Bi4V2O11 и BIMEVOX меньше, чем у BiVO4 [19–25], и составляют 1.9–2.26 эВ. Предполагается, что край валентной зоны Bi4V2O11 состоит из 2p-орбиталей кислорода, а край зоны проводимости образован 3d-орбиталями ванадия [19]. Таким образом, деформация кислородсодержащих полиэдров (например, за счет введения допантов в Bi4V2O11) может приводить к небольшим изменениям плотности состояний кислорода и изменению ширины запрещенной зоны [24, 25]. Кроме того, бóльшая по сравнению с BiVO4 концентрация поляризационных центров, сосредоточенных на слоях (Bi2O2)2+ и (VO3$\square $0.5)2– (где $\square $ – вакансия кислорода) в Bi4V2O11, может способствовать более эффективному разделению фотогенерированных пар электронов и дырок [18].
Для Bi4V2O11 в нанокристаллическом состоянии наблюдается увеличение его фотоактивности и изменение оптических свойств [20] по сравнению с микроразмерными порошками, а при совместном использовании с наноразмерным TiO2 – композиционный эффект [21]. В работах [22, 23] показано, что оптические свойства и каталитическая активность [23] Bi4V2O11 чувствительны к условиям синтеза, которые определяют количественное соотношение V+5 и V+4 в образцах. Из всех представителей семейства BIMEVOX фотокаталитическая активность описана только для составов, где Me = Al, Ga [22], Ni [24], Cu, Zn [17], Mn [25].
Цель настоящей работы – исследовать фотокаталитическую активность твердых растворов Bi4V1.8Me0.2O11 – d (Me = Co, Cu, Fe, Mn, Nb), полученных в идентичных условиях, на примере окисления одного и того же загрязняющего агента, а также предложить механизмы работы указанных фотокатализаторов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Сложные оксиды Bi4V1.8Me0.2O11 – d, где Me = = Co, Cu, Fe, Mn, Nb и Bi4V2O11 синтезированы по стандартной керамической технологии в интервале температур 773–1123 K. Фазовый состав продуктов контролировали рентгенографически (ДРОН-3, ЦКП “Урал-М” ИМЕТ УрО РАН, CuKα-излучение, интервал углов 2θ = 5–70 град со скоростью 2 град/мин). Идентификация фаз проведена с использованием картотеки ICDD [26], определение кристаллографических параметров – с использованием программных пакетов “FPeaK”, “Celref”.
Анализ распределения частиц по размерам выполнен методом динамического светорассеяния на анализаторе дисперсности SALD-7101 Shimadzu. Удельная площадь поверхности порошков определена методом BET (Sorbi M (Meta)). Измерение спектров диффузного отражения проводили на спектрофотометре UV-3600 Shimadzu (ИХТТ УрО РАН), оснащенном приставкой ISR-3100 с интегрирующей сферой, в качестве эталона использовали сульфат бария. Из данных спектра диффузионного отражения (R) по формуле рассчитывали функцию Кубелки–Мунка F [27], пропорциональную коэффициенту поглощения излучения
Для расчета ширины запрещенной зоны в координатах (Fh${v}$)2 – hν линейные участки экстраполировали на ось абсцисс [27], получая величину Eg.
Фотокаталитические свойства Bi4V1.8Me0.2O11 – d исследованы на примере окисления родамина Б (RhB) в водном растворе под воздействием ультрафиолетового излучения. Благодаря отсутствию сорбции на стекле, стабильности в широком диапазоне pH и температур, доступности ксантеновый краситель RhB является распространенной моделью органического загрязнителя для исследования фотокаталитических свойств оксидных систем [1].
Концентрация RhB в данной работе составила 25 мг/л, содержание катализатора – 1 г/л реакционной смеси. Источником УФ- и видимого излучения служила модифицированная ртутная газоразрядная лампа высокого давления мощностью 125 Вт с кварцевым/стеклянным корпусом (максимум излучения ∼365 нм, на который приходится ∼96% интенсивности светового потока). Величину светового потока контролировали при помощи люксометра Testo 545 и радиометра ТКА-ПКМ-13. Окисление RhB проводили в стационарном коаксиальном реакторе объемом 200 мл с внешней водяной системой охлаждения и конвекционным воздушным охлаждением. Для насыщения смеси кислородом через керамический рассеиватель подавали воздух со скоростью 4 л/мин, перемешивание реакционной смеси осуществлялось магнитной мешалкой (∼400 об./мин) и конвекционными потоками воздуха. Рабочую температуру смеси в интервале 313–315 K контролировали при помощи термопары. Эффективность системы водяного охлаждения регулировали путем изменения скорости подачи воздуха на радиатор водяного контура. До начала фотокаталитического эксперимента реакционную смесь перемешивали не менее получаса в закрытом и затемненном сосуде. Образцы реакционной смеси объемом 5 мл отделяли через 0, 30, 60, 120, 180, 300, 600, 900, 1200, 1800 с от начала внесения источника света в фотокаталитический реактор. Каждую порцию смеси фильтровали с использованием бумажных фильтров “синяя лента” в отсутствие внешних источников света, отделяя раствор от порошка фотокатализатора. Спектры полученных фильтратов изучали на спектрофотометре Unico 2800, и, убедившись в отсутствии полупродуктов, поглощающих свет в том же диапазоне, что и RhB, рассчитывали степень превращения α из отношения оптических плотностей раствора при длине волны максимального поглощения (552 нм) до и после воздействия излучения на реакционную смесь по формуле [28]:
где At – оптическая плотность раствора после воздействия излучения за время t, A0 – оптическая плотность исходного раствора. В качестве холостых точек брали значения оптической плотности реакционной смеси, облученной видимым светом без катализатора (8 ч) и значения оптической плотности раствора RhB после воздействия света ртутной газоразрядной лампы со стеклянным корпусом без катализатора (1800 с). Фотокаталитическую активность исследуемых соединений сравнивали с активностью промышленного оксида титана TiO2 (удельная поверхность 25 м2/г, Degussa). Для изучения природы активных частиц в реакционную смесь добавляли поглотители радикалов в соответствующих концентрациях: оксалат аммония 0.002 моль/л, трет-бутанол 0.01 моль/литр, аскорбиновую кислоту (0.05 моль/л). Данные соединения блокируют дырки (h+), гидрооксил-радикалы (OH), и супероксид радикалы (O2−) соответственно [29].ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Синтезированные твердые растворы Bi4V1.8Me0.2O11 – d (Me = Co, Cu, Fe, Mn, Nb) и незамещенный ванадат висмута кристаллизуются в моноклинной, орторомбической или тетрагональной симметрии, рассчитанные параметры элементарной ячейки (табл. 1) согласуются с результатами ранее проведенных исследований [25, 30–32].
Таблица 1.
Параметры элементарной ячейки исследуемых образцов
| Состав | Пр. гр. | a ± 0.005, Å | b ± 0.005, Å | c ± 0.005, Å | β, град |
|---|---|---|---|---|---|
| Bi4V2O11 | C2/m | 5.561 | 15.312 | 16.447 | 89.76 |
| Bi4V1.8Co0.2O11 – d | I4/mmm | 3.937 | 3.937 | 15.475 | 90 |
| Bi4V1.8Cu0.2O11 – d | I4/mmm | 3.921 | 3.921 | 15.467 | 90 |
| Bi4V1.8Fe0.2O11 – d | P21221 | 5.563 | 5.560 | 15.456 | 90 |
| Bi4V1.8Mn0.2O11 – d | I4/mmm | 3.922 | 3.922 | 15.437 | 90 |
| Bi4V1.8Nb0.2O11 – d | I4/mmm | 3.905 | 3.905 | 15.729 | 90 |
Средний размер частиц порошков всех исследуемых образцов составляет 9–12 мкм, удельная поверхность – 1.2–1.6 м2/г.
Фрагменты спектров диффузного отражения образцов приведены на рис. 1. Форма полос для твердых растворов близка к аналогичной для Bi4V2O11, за исключением составов с кобальтом и марганцем, где наблюдаются дополнительные размытые минимумы отражения, что может определяться наличием электронных переходов, соответствующих поглощению излучения, в тетраэдрах MeO4 (Me = Co, Mn), характерных для структуры BICOVOX и BIMNVOX [25, 32, 33]. Для определения ширины запрещенной зоны Eg сложных оксидов построены степенные зависимости функции Кубелки–Мунка от энергии фотонов (Fh${v}$)2 − hν (рис. 2). Видно, что кривые идентичны, однако для составов с кобальтом и марганцем можно выделить небольшие участки, по-видимому, соответствующие полосам поглощения. Результаты определения ширины запрещенной зоны приведены в табл. 2. Для прямых переходов ее величина составляет в среднем 2.02–2.26 эВ, что соответствует длине волны ∼620–550 нм, и мало зависит от состава сложного оксида. Это позволяет использовать для проведения фотохимических исследований источник излучения, имеющий спектральные линии в видимой и ультрафиолетовой области спектра, что и сделано в настоящей работе. Только для Bi4V1.8Co0.2O11 – d величина Eg ближе к 2.0 эВ, что вкупе с размытостью полосы диффузного отражения косвенным образом может свидетельствовать о большей дефектности данных кристаллов [24, 25, 34]. Небольшие изменения ширины запрещенной зоны могут быть связаны со вкладом 3d-орбиталей Co, Cu, Fe, Mn и 4d-орбиталей Nb в зону проводимости, а также искажениями в кислородной подрешетке слоя (V(ME)O3$\square $0.5)2– [24, 25], однако однозначной корреляции на данный момент не выявлено.
Рис. 1.
Фрагмент спектров диффузионного отражения Bi4V1.8Me0.2O11 – d, Me = Co (1), Cu (2), Fe (3), Mn (4), Nb(5); Bi4V2 O11 – d (6).
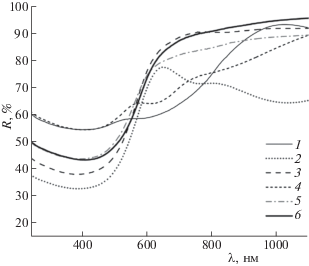
Рис. 2.
Нормированные кривые функций (Fhν)2 для различных составов BIMEVOX: Bi4V1.8Me0.2O11 – d, Me = Co (1), Cu (2), Fe (3), Mn (4), Nb(5); Bi4V2 O11 – d (6) с факторами нормализации n = 0.2 (2), 4.5 (1), 0.5 (3), 1 (5, 6), (5). На вставке показан пример аппроксимации линейных участков функции для Me = Cu (1), Fe (2), Nb (3) для ненормализованных кривых.
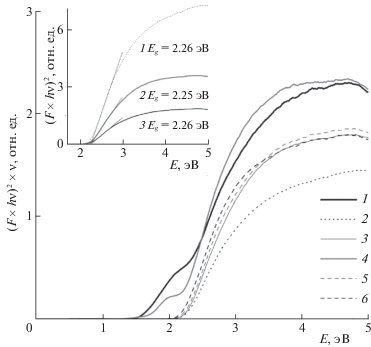
Таблица 2.
Величины ширины запрещенной зоны Eg исследуемых образцов
| Состав | Eg, эВ |
|---|---|
| Bi4V2O11 | 2.20 ± 0.02 |
| Bi4V1.8Co0.2O11 – d | 2.02 ± 0.02 |
| Bi4V1.8Cu0.2O11 – d | 2.26 ± 0.05 |
| Bi4V1.8Fe0.2O11 – d | 2.25 ± 0.04 |
| Bi4V1.8Mn0.2O11 – d | 2.15 ± 0.05 |
| Bi4V1.8Nb0.2O11 – d | 2.25 ± 0.03 |
Чтобы исключить влияние возможной адсорбции RhB на поверхности порошка сложного оксида на изменение оптической плотности исследуемых растворов, исследовали оптическую плотность проб, выдержанных в присутствии катализатора без облучения в течение 60 мин. Отсутствие изменений оптической плотности у таких растворов свидетельствует о том, что в дальнейших экспериментах при введении излучения в систему падение оптической плотности раствора происходит исключительно вследствие процессов разложения красителя, а не сорбции красителя на твердой фазе. Для оценки возможности разложения RhB без применения фотокатализатора, проведен эксперимент с использованием излучения, не содержащего УФ-С- и УФ-B-линий (лампа со стеклянным корпусом), чтобы исключить частичное разложение красителя в этих условиях. В этом случае также наблюдалось минимальное падение оптической плотности раствора (рассчитанная степень превращения в конце облучения продолжительностью 30 мин составила ∼1%, что сравнимо с величиной инструментальной погрешности). Таким образом, в описанных условиях не происходит изменения спектров поглощения RhB (появления новых линий, уширения полос).
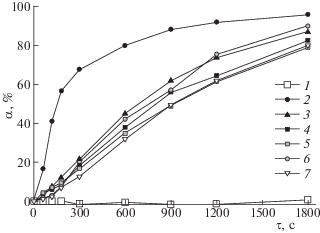
В противоположность вышесказанному, введение в реактор порошка фотокатализатора при одновременном действии облучения приводит к заметному даже визуально изменению оптической плотности фильтрата реакционной смеси. Однако дополнительных линий поглощения в спектре не зафиксировано, уширение линий RhB не наблюдается, что свидетельствует об отсутствии каких-либо промежуточных продуктов процесса фотоокисления, поглощающих излучение в том же диапазоне, что и RhB. Это позволило рассчитать степень превращения α RhB по формуле (2). Полученные зависимости степени превращения RhB от времени при облучении светом и использовании в качестве катализаторов всех составов BIMEVOX, реперного оксида TiO2, и для процесса фотолиза приведены на рис. 3 (измерения для каждого состава проводили в трех параллелях, на рисунке приведены усредненные данные). Существенных отличий между видом кривых для разных составов BIMEVOX не наблюдается, а времени, требующегося для достижения степени превращения ≈80%, требуется примерно в 3–4 раза больше, чем для системы с оксидом титана. Если учесть, что порошки BIMEVOX при выбранных условиях синтеза имеют на порядок меньшую удельную поверхность по сравнению с оксидом титана, то можно предположить, что при уменьшении размеров частиц и изменении их морфологии времени для полного окисления RhB, потребуется существенно меньше. Наибольшие значения степени превращения RhB после 1800 с воздействия достигаются при использовании ванадатов висмута, допированных ниобием и марганцем.
Рис. 3.
Зависимости степени превращения родамина Б от времени в отсутствии и присутствии катализаторов; 1 – фотолиз, 2 – TiO2; Bi4V1.8Me0.2O11 – d, Me = = Mn (3), Co (4), Cu (5), Nb(6), Fe (7).
Для оценки констант скоростей реакции построены зависимости логарифма относительной концентрации RhB от времени для разных случаев (рис. 4). Зависимости линейны, т.е. реакция имеет псевдопервый порядок, что согласуется с данными для других сложнооксидных фотокатализаторов [1]. Рассчитанные константы скоростей реакции приведены в табл. 3. Значения констант различаются между собой до полутора раз. Согласно [1] при использовании источников света высокой интенсивности лимитирующей стадией фотокатализа является адсорбция органического компонента и кислорода на поверхности фотокатализатора. Так как все исследуемые порошки BIMЕVOX близки по своим морфологическим свойствам, то одним из факторов, определяющих изменение их адсорбционных характеристик, может быть природа атома-заместителя. В работах [18, 24, 25] утверждается, что величина поляризуемости ионов, образующих слои (V(ME)O3$\square $0.5)2– в структуре BIMEVOX, играет решающую роль при оценке этого свойства. Сравнить поляризуемости ионов, находящихся в одной степени окисления можно, опираясь на значения их ионных радиусов (см. табл. 3). В рядах Cu–Co–Mn и V–Nb у одноименно заряженных ионов наблюдается возрастание ионного радиуса, что согласуется с изменением констант скорости реакций и ростом каталитической активности соответствующих составов.
Рис. 4.
Кинетические кривые процесса окисления родамина Б; Bi4V1.8Me0.2O11 – d, Me = Nb(1), Cu (2), Mn (3), Co (4), Fe (5).
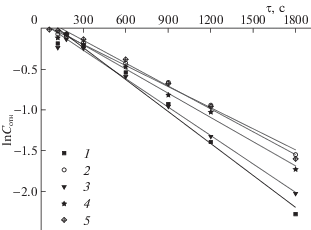
Таблица 3.
Константы скорости реакции окисления родамина Б в присутствии катализаторов
| Катализатор | K × 102, мин–1 | α | ИР, Å |
|---|---|---|---|
| Bi4V1.8Cu0.2O11 – d | 5.10 ± 0.13 | 2+ | 0.57 |
| Bi4V1.8Co0.2O11 – d | 5.76 ± 0.11 | 2+ | 0.59 |
| Bi4V1.8Mn0.2O11 – d | 6.88 ± 0.22 | 2+ | 0.66 |
| Bi4V1.8Fe0.2O11 – d | 5.57 ± 0.11 | 2+/3+ | 0.63/0.49 |
| Bi4V2O11 | 7.40 ± 0.07 | 5+ | 0.355 |
| Bi4V1.8Nb0.2O11 – d | 7.65 ± 0.20 | 5+ | 0.48 |
Обозначения: α – степень окисления допанта, ИР – ионный радиус для КЧ = 4 [35].
Для Bi4V2O11 и BIMEVOX в работах [24, 25] предложен механизм действия их как фотокатализаторов, включающий в себя следующие стадии: адсорбция органического загрязнителя на поверхности BIMEVOX; фотогенерация электронов в зоне проводимости и дырок в валентной зоне; образование радикала ${}^{ \bullet }{\text{OH}}$ [25], либо радикала ${\text{O}}_{2}^{{ \bullet - }}$ [24], которые являются активными окисляющими агентами; окисление загрязнителя. Однако экспериментального подтверждения образования тех или иных радикалов представлено не было.
Для исследования механизма действия катализатора на примере Bi4V1.8Nb0.2O11 – d в настоящей работе использовали ряд известных приемов [29]. В качестве поглотителей радикалов для снижения активности ${\text{O}}_{2}^{{ \bullet - }}$ и ${}^{ \bullet }{\text{OH}}$ использовали аскорбиновую кислоту и трет-бутанол соответственно, для блокировки концентрирующихся на поверхности сложного оксида дырок h+ − оксалат аммония. Указанные соединения вводили по одному в реакционную смесь и анализировали изменение вида спектров и степени превращения RhB в присутствии поглотителя радикалов и без него. Обнаружено, что изменения спектра RhB не происходит и новых линий (кроме полос поглощения поглотителей радикалов) не наблюдается, т.е. не зависимо от природы радикала реакции окисления идут без образования устойчивых полупродуктов, имеющих полосы поглощения в наблюдаемой области спектра.
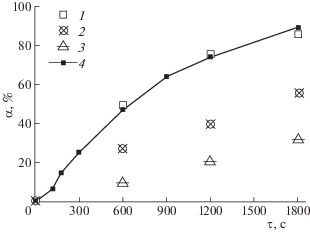
Кривые изменения степени превращения RhB от времени в присутствии различных вводимых соединений и без них представлены на рис. 5. Очевидно, что введение оксалата аммония не влияет на процесс окисления, следовательно, окисление RhB в водном растворе происходит с участием ${\text{O}}_{2}^{{ \bullet - }}$ и ${}^{ \bullet }{\text{OH}}$. Кроме того, было обнаружено, что степень превращения RhB в присутствии аскорбиновой кислоты и степень превращения RhB в присутствии трет-бутилового спирта дают в сумме степень превращения RhB без акцепторов радикалов. Следовательно, радикалы ${\text{O}}_{2}^{{ \bullet - }}$ и ${}^{ \bullet }{\text{OH}}$ образуются независимо друг от друга и их взаимопревращения отсутствуют или минимальны. Уменьшение степени превращения RhB в случае блокировки радикалов ${}^{ \bullet }{\text{OH}}$ примерно в 2 раза выше, чем в случае блокировки радикалов ${\text{O}}_{2}^{{ \bullet - }}$, что означает бóльший вклад радикалов ${}^{ \bullet }{\text{OH}}$ в протекающие процессы. Таким образом, схематически механизм работы Bi4V2O11 (BIMEVOX) как фотокатализатора можно представить следующим образом:
Рис. 5.
Зависимости степени превращения окисления родамина Б от времени в присутствии оксалата аммония (1), аскорбиновой кислоты (2) и трет-бутилового спирта (3); 4 – без акцепторов радикала.
– при поглощении фотонов возникает пара электрон-дырка:
(3)
${\text{B}}{{{\text{i}}}_{4}}{{{\text{V}}}_{2}}{{{\text{O}}}_{{11}}}({\text{BIMEVOX}}) + h{v} \to {{h}^{ + }} + {{\bar {e}}^{--}},$– возможна их рекомбинация с выделением теплоты:
– адсорбированный на поверхности катализатора кислород (O2адс) являясь акцептором электронов, генерирует радикалы ${\text{O}}_{2}^{{ \bullet - }}$:
– дырки окисляют H2O и OH– на поверхности катализатора, образуя радикалы ${}^{ \bullet }{\text{OH}}$:
(6)
${{h}^{ + }} + {{{\text{H}}}_{{\text{2}}}}{\text{O}} \to {}^{ \bullet }{\text{OH}} + {{{\text{H}}}^{ + }},$– окисление органического компонента активными частицами с образованием CO2, H2O и других простых неорганических соединений:
(8)
$\begin{gathered} {\text{O}}_{2}^{{ \bullet - }}\;{\text{орган}}{\text{.}}\;{\text{вещество}} + {{{\text{H}}}^{ + }} \to \ldots \to \\ \to \ldots \to {{{\text{H}}}_{{\text{2}}}}{\text{O}} + {\text{C}}{{{\text{O}}}_{2}}, \\ \end{gathered} $(9)
$\begin{gathered} {}^{ \bullet }{\text{OH}} + {\text{орган}}{\text{.}}\;{\text{вещество}}\; + \to \ldots \to \\ \to \ldots \to {{{\text{H}}}_{{\text{2}}}}{\text{O}} + {\text{C}}{{{\text{O}}}_{2}}. \\ \end{gathered} $Список литературы
Zaleska-Medynska A. Metal Oxide-Based Photocatalysis. Amsterdam: Elsevier, 2018. 364 p.
Ani J., Akpan U.G., Olutoye M.A. et al. // J. Clean. Prod. 2018. V. 205. P. 930.
Raizada P., Sudhaik A., Singh P. // Mat. Sci. Energy Technol. 2019. V. 2. № 3. P. 509.
Pelaez M., Nolan N.T., Pillai S.C. et al. // Appl. Catal. Environ. 2012. V. 125. P. 331.
Kudo A., Omori K., Kato H. // J. Am. Chem. Soc. 1999. V. 121 № 49. P. 11459.
Park J.-H., Woodward P.M. // Int. J. Inorg. Mater. 2000. V. 2. № 1. P. 153.
Fakhrul M., Samsudin R., Sufian S. et al. // J. Mol. Liq. 2018. V. 268. № 15. P. 438.
Tayebi M., Lee B.K. // Renewable Sustainable Energy Rev. 2019. V. 111. P. 332.
Malathi A., Madhavan J., Ashokkumar M. et al. // Appl. Catal. A. 2018. V. 555. P. 47.
Tang J., Zou Z., Ye J. // Angew. Chem. Int. Ed. 2004. V. 43. № 3. P. 4463.
Zhang C., Zhu Y. // Chem. Mater. 2005. V. 17. № 13. P. 3537.
Zhao X., Xu T., Yao W. et al. // Appl. Surf. Sci. 2009. V. 255. № 18. P. 8036.
Luan J., Zou Z., Lu M. et al. // J. Cryst. Growth. 2004. V. 273. № 1–2. P. 241.
Muktha B., Priya M.H., Madras G. et al. // J. Phys. Chem. B. 2005. V. 109. № 23. P. 11442.
Zou Z., Ye J., Arakawa H. // Chem. Phys. Lett. 2001. V. 333. № 1–2. P. 57.
Muktha B., Darriet J., Madras G. et al. // J. Solid State Chem. 2006. V. 179. № 12. P. 3919.
Trzcinski K., Gasiorowski J., Borowska-Centkowska A. et al. // Thin Solid Films. 2017. V. 638. P. 251.
Jiang Z., Liu Y., Li M. // Sci. Rep. 2016. V. 6. № 1. P. 31.
Zainullina V.M., Zhukovskii V.M., Buyanova E.S et al. // Russ. J. Inorg. Chem. 2007. V. 52. № 2. P. 225.
Qiao L., Zhu A., Liu W. et al. // Cryst. Eng. Comm. 2018. V. 20. № 8. P. 1116.
Liang M., Yang Z., Mei Y. et al. // Nano. 2018. V. 13. № 3. P. 1850028.
Thakral V., Uma S. // Mater. Res. Bull. 2010. V. 45. № 9. P. 1250.
Gonzalez L.T., Leyva-Porras C., Sánchez-Domínguez M. et al. // Water Air Soil Pollut. 2017. V. 228. № 2. P. 75.
Al-Areqi N.A.S., Al-Kamali A.S.N., Ghale K.A.S. et al. // Radiat. Eff. Defects Solids. 2014. V. 169. № 2. P. 117.
Alarique H.Q.N.M., Al-Aghbari E.S., Al-Areqi N.A.S. et al. // Am. J. Phys. Chem. 2014. V. 3. № 6. P. 102.
JCPDS – Internation Centre for Diffraction Data. 2000. PCPDFWiN V. 2.1.
Harry G. // J. Res. Natl. Bur. Stand. 1976. V. 80. № 4. P. 567.
Kang M., Liang J., Wang F. et al. // Mater. Res. Bull. 2020. V. 121. № . P. 110614.
Molla I.M.A., Tateishi I., Furukawa M. et al. // Open J. Inorg. Non-Metallic Mater. 2017. V. 7. № 1. P. 1.
Buyanova E.S., Morozova M.V., Emelyanova J.V. et al. // Solid State Ionics. 2013. V. 243. № P. 8.
Buyanova E.S., Emel’yanova Y.V., Morozova M.V. et al. // Russ. J. Inorg. Chem. 2018. V. 63. № 10. P. 1297.
Watanabe A., Das K. // J. Solid State Chem. 2002. V. 163. № 1. P. 224.
Naeem M., Hasanain S.K. // J. Phys.-Condens. Mat. 2012. V. 24. № 24. P. 245305.
Артемьев Ю.М., Рябчук В.К. Введение в гетерогенный фотокатализ. СПб.: Изд-во С.-Петер. ун-та. 1990. 304 с.
Shannon R.D. // Acta Cryst. A. 1976. V. 32. P. 751.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии


