Журнал физической химии, 2020, T. 94, № 12, стр. 1916-1919
Использование бидисперсной модели для описания кинетики сорбции холестерина молекулярно импринтированными органо-неорганическими сорбентами
О. А. Писарев a, *, **, А. А. Осипенко a, И. С. Гаркушина a
a Российская академия наук, Институт высокомолекулярных соединений
Санкт-Петербург, Россия
* E-mail: chrom79@yandex.ru
** E-mail: pisarev@imc.macro.ru
Поступила в редакцию 12.03.2020
После доработки 12.03.2020
Принята к публикации 14.04.2020
Аннотация
Проведена адаптация бидисперсной модели к изучению кинетики сорбции холестерина органо-неорганическими молекулярно импринтированными сорбентами и их неимпринтированным аналогом.
Концентрация холестерина (ХС) в крови человека более 7 ммоль/л способствует развитию атеросклероза, гипертонии, ишемической болезни сердца, возникновению инфаркта миокарда и инсульта. Эти заболевания являются одной из основных причин смертности в развитых странах [1]. Значительное снижение концентрации ХС в крови может быть достигнуто при использовании гиполипидемических препаратов-статинов. Однако прием статинов часто приводит к повреждениям печени, кроме того, существует особая категория больных с гомозиготной формой семейной гиперхолестеринемии, у которых высокая концентрация ХС в крови сохраняется даже после терапии статинами [2]. Поэтому очень актуально развитие методов гемо- и плазмосорбции, при которых удаление ХС из крови больного осуществляется путем использовании селективных по отношению к ХС сорбентов.
Перспективным современным методом создания селективных сорбентов служит молекулярный импринтинг. В результате могут быть синтезированы сорбенты, которые имитируют природные рецепторы – молекулярно импринтированные полимеры (МИПы). МИПы содержат селективные (полученные в результате молекулярного импринтинга) по отношению к целевому объекту сорбционные центры, а также “оставшиеся” неселективные сорбционные центры [3–5].
В последние время большой интерес (с точки зрения улучшения кинетических характеристик сорбции) вызывают МИПы с поверхностным сорбирующим слоем, в которых ядро образовано полимерными наносферами или неорганическими наночастицами [6, 7]. В работе [8] был разработан метод синтеза в эмульсиях Пикеринга, а также изучены физико-химические и равновесные сорбционные свойства новых молекулярно импринтированных ХС гибридных органо-неорганических МИПов. Молекулярное импринтирование было осуществлено в слое сополимера 2-гидроксиэтилметакрилата (ГЭМА) с диметакрилатом этиленгликоля (ДМЭГ) на поверхности наночастиц селена (Se), стабилизированных поливинилпирролидоном (ПВП).
Однако знание структурных особенностей сорбентов, а также равновесных закономерностей сорбции недостаточно для разработки эффективного динамического процесса селективной сорбции целевого компонента из многокомпонентной смеси. По мере миграции целевого компонента по сорбционной колонке его концентрационный профиль размывается под влиянием кинетических факторов. Это приводит к необходимости реализации на практике условий образования резких границ концентрационных профилей веществ, а также нахождения физико-химических свойств системы сорбент–сорбат, при которых происходит переход от равновесного к неравновесному динамическому режиму сорбции [9]. Решение этих задач связано с анализом закономерностей гетерогенного массопереноса целевого компонента. В связи с этим цель данной работы – изучение кинетики сорбции ХС поверхностно импринтированными ХС гибридными органо-неорганическими МИПами.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Использовали ГЭМА, ДМЭГ, ПВП, ХС нормальный пропиловый спирт (ПС), нормальный бутиловый спирт (БС), персульфат аммония (ПСА), аскорбиновую кислоту (АК), селенистую кислоту (H2SeO3) (“Вектон”, С. Петербург, Россия). Для определения ХС в растворе использовали тестовый раствор CHOLESTEROL liquicolor (“Human Gmbh”, Wiesbaden, Germany).
При синтезе гранульных гибридных органо-неорганических сорбентов в водный раствор наночастиц Se, стабилизированных ПВП, вводили ГЭМА и ДМЭГ при соотношении 80 мол. %: 20 мол. % и их суммарной концентрации 30 мас. %, а также инициирующую систему ПСА–АК в количестве 1.0 мас. %. Массовое соотношение ПСА : АК–1.5 : 1. В сополимеризационную смесь ГЭМА–ДМЭГ вводили также темплатные молекулы ХС в количестве 2, 4 и 6 мол. %. ХС предварительно растворяли в БС. После того как темплаты ХС и некоторое количество бутанола в качестве порогена диффундировало в сополимеризующийся слой ГЭМА–ДМЭГ, оставшийся бутанол формировал масляную среду. Водные капли со смесью сомономеров внутри распределялись в среде бутанола. В результате формировалась трехфазная эмульсия Пикеринга масло/вода/масло, в которой стабилизация фаз осуществлялась избытком наночастиц [6].
Были синтезированы МИП-2, МИП-4 и МИП-6 (цифра соответствует мольному содержанию ХС в полимеризационной среде). Сорбент сравнения – контрольный полимер (КП) был синтезирован аналогично МИПам, но без введения темплатов ХС в полимеризационную среду. Более подробно методика синтеза сорбентов и ее оптимизация описаны в работе [8].
Кинетику сорбции ХС изучали методом ограниченного объема в термостатируемом стакане объемом 50 мл с мешалкой при 23 ± 0.5°С. К набухшей навеске сорбентов (100 мг) добавляли 30 мл раствора ХС с концентрацией 9 ммоль/л (этот уровень концентраций соответствует ярко выраженной гиперхолестеринемии). Использовали гранулы сорбентов со средними радиусами 37.5 × 10–4, 65.0 × 10–4 и 118.8 × 10–4 см в набухшем состоянии. В эксперименте через определенные промежутки времени отбирали пробы по 0.2 мл и спектрофотометрически на приборе СФ-256УВИ ЛОМО “Фотоника”, Санкт-Петербург, Россия при λ = 500 нм, предварительно окрашивая раствор ХС с помощью тестового раствора CHOLESTEROL liquicolor, определяли концентрацию ХС. При определении концентрации ХС использовали предварительно построенную калибровочную кривую, которая в области концентраций ХС до 16 ммоль/л описывалась прямой D500 = 0.06C, где C – концентрация ХС (ммоль/л).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
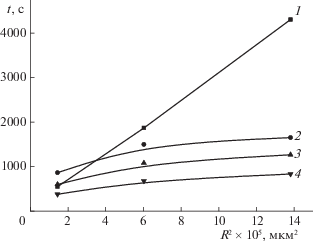
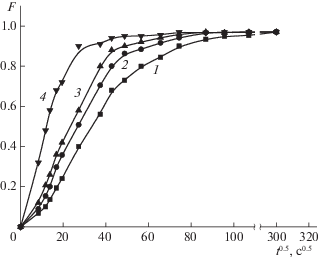
Внутридиффузионный характер сорбции ХС изучаемыми сорбентами доказан опытами с прерыванием контакта фаз, а также линейным характером зависимости F = f($\sqrt t $) до степеней заполнения 0.3–0.4 (рис. 1).
Рис. 1.
Кинетика сорбции ХС КП и МИПами; 1 – КП, 2 – МИП-2, 3 – МИП-4, 4 – МИП-6; R = 65 × × 10–4 см, F – степень завершенности процесса, t – время эксперимента.
Согласно определению статистических моментов [10], момент кинетической кривой k-го порядка определяется следующим образом:
При сорбции из ограниченного объема для гомогенной модели сорбции (модель Бойда) и внутридиффузионной кинетики гетерогенного массообмена [11]:
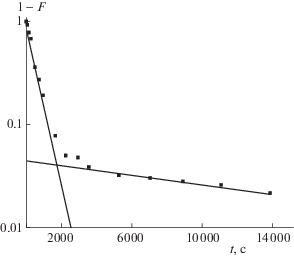
где $\overline {{{t}_{1}}} $ – первый момент кинетической кривой; R – радиус частиц сорбентов в набухшем состоянии (см); $\bar {D}$ – эффективный коэффициент диффузии (см2/с); $\omega $ – параметр ограниченности раствора; $\omega = \bar {V}{\kern 1pt} \bar {c}{\text{/}}Vc$; V и $\bar {V}$ – объемы раствора и сорбента (мл); с и $\bar {c}$ – концентрации сорбата в растворе и сорбенте при равновесии (мг/мл). Так как из условий проведения кинетических экспериментов $\omega $ = 0, то Таким образом, в гомогенной модели величина $\bar {D}$ как кинетическая характеристика системы “сорбент–сорбат ” не должна зависеть от радиуса зерна. Вместе с тем, $\bar {D}$ может быть функцией температуры, pH, степени набухания сорбента и других внешних параметров системы. Соответственно из (2) следует, что, если модель Бойда справедлива, то в эксперименте должна наблюдаться линейная зависимость среднего времени $\bar {t}$ от ${{R}^{2}}$. Однако, экспериментальные зависимости $\bar {t} = f({{R}^{2}})$ для молекулярно импринтированных сорбентов нелинейны (рис. 2, кривые 2–5). Они не проходят через начало координат ($\bar {t} = 0$, ${{R}^{2}} = 0$), как предсказывает модель Бойда (рис. 2, кривая 1).Модель Бойда описывает кинетику сорбции с помощью одного элементарного процесса диффузии, характеризуемого единственным характерным временем $\bar {t}$. Вместе с тем, как видно из рис. 3, процесс сорбции ХС на изучаемых сорбентах должен описываться, по крайней мере, двумя характерными временами (${{\tau }_{1}}$ и ${{\tau }_{2}}$) и двумя эффективными коэффициентами диффузии ($\overline {{{D}_{i}}} $ и $\overline {{{D}_{a}}} $). Эти величины соответственно характеризуют “быстрый” и “медленный” процессы сорбции ХС. Поэтому для описания кинетических кривых сорбции ХС на изучаемых сорбентах можно попытаться применить модель бидисперсного сорбента [12–15], заменив понятия диффузии в транспортные и микропоры понятиями диффузии к специфическим и неспецифическим сорбционным центрам.
Рис. 3.
Зависимость (1–F) в логарифмическом масштабе от времени проведения сорбционного процесса; МИП-6, R = 65 × 10–4 см.
В случае сорбции из ограниченного раствора постоянной концентрации при условии линейности изотермы сорбции (это условие выполняется при выбранной Схс = 9 ммоль/л [8]) можно использовать аналитические выражения для статистических моментов $\overline {{{t}_{1}}} $ и $\overline {{{t}_{2}}} $, полученные ранее [12, 13]. При помощи этих аналитических выражений можно составить систему из двух уравнений с двумя неизвестными, ${{T}_{i}}$ и ${{T}_{a}}$:
(3)
$\begin{gathered} \overline {{{t}_{1}}} = \frac{1}{{15}}({{T}_{i}} + {{T}_{a}}); \\ \overline {{{t}_{2}}} = \frac{4}{{315}}({{T}_{i}}^{2} + 1.4{{T}_{i}}{{T}_{a}} + {{T}_{a}}^{2}), \\ \end{gathered} $Введем обозначения:
Тогда(5)
$\overline {{{t}_{1}}} = \frac{a}{{15}};\quad \overline {{{t}_{2}}} = \frac{4}{{315}}\left( {{{a}^{2}} - \frac{3}{5}b} \right).$(7)
$а = 15\overline {{{t}_{1}}} ;\quad b = \frac{{2.8t_{1}^{{ - 2}} - \overline {{{t}_{2}}} }}{{0.0076}}.$В табл. 1 представлены обработанные в рамках бидисперсной модели экспериментальные данные по кинетике сорбции ХС на молекулярно ипринтированных сорбентах и их неимпринтированном аналоге. Для КП а $ \gg $ b, следствием чего является соотношение $\overline {{{D}_{i}}} $ $ \approx $ $\overline {{{D}_{a}}} $, т.е. бидисперсная модель как бы “не замечает” различия в сорбционных центрах, и сорбция ХС близка к гомогенной модели. Отметим корреляцию полученных данных с кривой 1 на рис 3, где зависимость $\bar {t} = f({{R}^{2}})$ для КП близка к линейной.
Таблица 1.
Кинетические характеристики сорбции ХС, рассчитанные по бидисперсной модели; Схс = 9 ммоль/л, R = 65.0 × 10–4 см
| Сорбент | а, с | b, c2 | ${{T}_{i}}$ × 10–3, c | ${{T}_{a}}$, c | $\overline {{{D}_{i}}} $ × 109, см2/c | $\overline {{{D}_{a}}} $ × 109, см2/c |
|---|---|---|---|---|---|---|
| КП | 0.32 | 0.11 × 10–4 | 0.32 | 0.35 × 10–5 | 3.15 | 2.87 |
| МИП-2 | 640 | 68 | 0.61 | 0.03 × 103 | 1.62 × 102 | 0.34 × 10–4 |
| МИП-4 | 480 | 32 | 0.39 | 0.09 × 103 | 2.53 × 102 | 0.11 × 10–4 |
| МИП-6 | 490 | 59 | 0.22 | 0.27 × 103 | 4.44 × 102 | 0.38 × 10–4 |
Иная ситуация имеет место в случае молекулярно импринтированных сорбентов. В этом случае а > b приблизительно только на порядок и $\overline {{{D}_{i}}} $ $ \gg $ $\overline {{{D}_{a}}} $. Иными словами, в рамках бидисперсной модели из экспериментальных кинетических данных следует, что в сравнении с неспецифичными заполнение специфичных центров происходит намного быстрее.
Результаты работы позволяют полагать, что бидисперсная модель кинетики сорбции может быть использована для оценки кинетических характеристик сорбции ХС на молекулярно импринтированных органо-неорганических сорбентах. Величины первого и второго моментов, которые определяются из экспериментальных кинетических кривых, позволяют оценивать соотношения между средними временами сорбции ХС на специфичных и неспецифичных сорбционных центрах.
Работа выполнена при поддержке Российского фонда фундаментальных исследований (коды проектов № 19-33-90003 и 19-03-00618).
Список литературы
Sanchis-Gomar F., Leichik R // Ann. Trans. Med. 2016. V. 4. № 2. P. 256.
Chogty B., Magazine R., Bairy K. // Am. J. Card. 2017. V. 6. № 3. P. 352.
Spivak D.A., Shea K.I. // J. Mol. Recognit. 2012. V. 25. № 2. P. 320.
Cheong W.J., Yang S.H., Ali F. // J. Sep. Sci. 2013. V. 36. № 2. P. 609.
Chen L., Wang X., Lu W. et al. // Chem. Soc. Rev. 2016. V. 45. № 11. P. 2137.
Clausen D.N., Ruiz Pires I.M., Teixeira Tarley C.R. // Materials Science and Engineering C. 2014. V. 44. № 1. P. 99.
Ding X., Heiden P.A. // Macromol. Mater. Eng. 2015. V. 299. № 2. P. 268.
Polyakova I.V., Borovikova L.N., Osipenko A.A. et al. // React. Funct. Polymers. 2016. V. 109. № 1. P. 88.
Pisarev O.A., Polyakova I.V. // Trends in Chromatogr. 2013. V. 7. № 1. P. 85.
Ахиезер Н.И. Классическая теория моментов. М.: Физматгиз, 1961. 141 с.
Crank J. The Mathematics of Diffusion, London: Oxford University Press, 1956. 252 p.
Золотарев П.П., Дубинин М.М. // Докл. АН СССР. 1973. Т. 210. № 1. С. 136.
Золотарев П.П. // Журн. физ. химии. 1996. Т. 70. № 4. С. 583.
Золотарев П.П. // Росc. хим. журн. 1998. Т. 42. № 1. С. 106.
Мамлеев В.Ш., Золотарев П.П., Гладышев П.П. Неоднородность сорбентов (феноменологические модели). Алма-Ата: Наука, 1989. 287 с.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии