Журнал физической химии, 2020, T. 94, № 12, стр. 1909-1915
Вискозиметрическое и денситометрическое исследование систем вода–ПЭГ–KBr
Э. А. Масимов a, Б. Г. Пашаев a, *, М. Р. Раджабов a
a Бакинский государственный университет
Баку, Азербайджан
* E-mail: p.g.bakhtiyar@gmail.com
Поступила в редакцию 21.07.2019
После доработки 12.05.2020
Принята к публикации 14.05.2020
Аннотация
Измерены динамическая вязкость и плотность системы вода–ПЭГ–KBr в интервале температур 293.15–323.15 K и 0–0.001 мол. доли. Рассмотрены фракции ПЭГ со средней молекулярной массой 1000, 1500, 3000, 4000 и 6000 г/моль; концентрация KBr 0.01 мол. доли. С использованием экспериментальных данных в указанном интервале температур и концентрации исследуемой системы рассчитаны активационные параметры вязкого течения (энергия Гиббса, энтальпия и энтропия), а также парциальный молярный объем ПЭГ в растворе. Показано, что активационные параметры вязкого течения увеличиваются с ростом концентрации и молекулярной массы. Обнаружено, что с увеличением концентрации парциальный молярный объем ПЭГ в растворе уменьшается, а парциальный молярный объем на мономер не изменяется в зависимости от средней молекулярной массы ПЭГ. Описан простой способ определения числа гидратации макромолекулы полимера, на основе которого рассчитано число гидратации макромолекулы ПЭГ в растворе. Обнаружено, что число гидратации макромолекулы ПЭГ уменьшается с ростом температуры и увеличивается с увеличением молекулярной массы.
Полиэтиленгликоль (ПЭГ) широко используется во многих отраслях промышленности (фармакология, биотехнология и т.д.), поэтому является одним из наиболее изученных полимеров [1–18]. Одна из причин широкого использования ПЭГ состоит в том, что он имеет много молекулярно-массовых фракций. ПЭГ не оказывает негативного влияния на иммунную систему организма, не обладает токсическими свойствами и быстро выводится из организма [5, 6]. Высокомолекулярные фракции ПЭГ термостойки и обладают хорошей устойчивостью к атмосферной влаге [6, 7]. Все молекулярно-массовые фракции ПЭГ растворимы в воде. Причина этого заключается в том, что группы ОН и атомы −O− и −H в макромолекуле ПЭГ могут образовывать водородные связи с молекулой воды [8]. Наличие CH2-групп в макромолекуле ПЭГ обусловливают гидрофобный эффект [9]. Исследования структурных свойств систем вода–ПЭГ и структурных изменений в растворе путем включения третьего компонента имеют большое научное и практическое значение.
В работе исследованы структурные особенности системы вода–ПЭГ–KBr методами вискозиметрии и пикнометрии в интервале температур 293.15–323.15 K и концентраций 0–0.001 мол. доли ПЭГ. Динамическая вязкость и плотность исследуемых растворов измерены в указанных интервалах температур и концентрации (табл. 1). На основе экспериментальных оценок вычислены энергия активации Гиббса ($\Delta G_{\eta }^{ \ne }$), энтальпия ($\Delta H_{\eta }^{ \ne }$) и энтропия ($\Delta S_{\eta }^{ \ne }$) активации вязкого течения, парциальный молярный объем ($\tilde {V}$) ПЭГ в растворе и проанализированы их зависимости от концентрации (х) ПЭГ. Отметим, что в указанном интервале температур, как и при 293.15 K зависимость параметров $\Delta G_{\eta }^{ \ne }$, $\Delta H_{\eta }^{ \ne }$, $\Delta S_{\eta }^{ \ne }$ и $\tilde {V}$ от x изменяется с одинаковой закономерностью. Поэтому мы будем ограничиваться результатами, полученными при 293.15 K. В работе также предложен простой способ определения числа гидратации макромолекулы полимера в растворе, и на основе этого способа определены числа гидратации макромолекул ПЭГ с различной молекулярной массой.
Таблица 1.
Зависимость плотности (ρ, кг/м3) и вязкости (η, мПа с) системы вода–ПЭГ–KBr от температуры и от концентрации ПЭГ(x) (xKBr = 0.01)
| x | ρ | η | ρ | η | ρ | η | ρ | η | ρ | η |
|---|---|---|---|---|---|---|---|---|---|---|
| MПЭГ = 1000 | MПЭГ = 1500 | MПЭГ = 3000 | MПЭГ = 4000 | MПЭГ = 6000 | ||||||
| T = 293.15 K | ||||||||||
| 0 | 1047.3 | 0.966 | 1047.3 | 0.966 | 1047.3 | 0.966 | 1047.3 | 0.966 | 1047.3 | 0.966 |
| 0.0001 | 1048.1 | 0.994 | 1048.2 | 1.031 | 1048.7 | 0.848 | 1048.8 | 1.131 | 1052.4 | 1.583 |
| 0.0002 | 1048.8 | 1.025 | 1049.3 | 1.110 | 1050.6 | 0.764 | 1051.3 | 1.343 | 1056.8 | 2.178 |
| 0.0004 | 1050.7 | 1.109 | 1051.7 | 1.249 | 1054.2 | 0.695 | 1056.0 | 1.743 | 1066.0 | 4.884 |
| 0.0006 | 1052.6 | 1.184 | 1054.9 | 1.486 | 1059.1 | 0.635 | 1063.1 | 2.550 | 1075.4 | 7.712 |
| 0.0008 | 1054.5 | 1.217 | 1057.4 | 1.809 | 1063.0 | 0.584 | 1067.9 | 2.984 | 1083.8 | 12.66 |
| 0.001 | 1056.6 | 1.282 | 1060.9 | 1.979 | 1068.1 | 0.540 | 1075.6 | 3.976 | 1092.2 | 20.77 |
| T = 298.15 K | ||||||||||
| 0 | 1045.9 | 0.864 | 1045.9 | 0.864 | 1045.9 | 0.864 | 1045.9 | 0.864 | 1045.9 | 0.864 |
| 0.0001 | 1046.6 | 0.890 | 1046.8 | 0.921 | 1047.3 | 0.951 | 1047.4 | 1.007 | 1051.1 | 1.402 |
| 0.0002 | 1047.4 | 0.915 | 1047.8 | 0.988 | 1049.2 | 0.855 | 1049.8 | 1.189 | 1055.4 | 1.912 |
| 0.0004 | 1049.1 | 0.987 | 1050.1 | 1.108 | 1052.6 | 0.776 | 1054.3 | 1.533 | 1064.5 | 4.216 |
| 0.0006 | 1050.9 | 1.051 | 1053.1 | 1.313 | 1057.4 | 0.708 | 1061.2 | 2.224 | 1073.5 | 6.586 |
| 0.0008 | 1052.8 | 1.079 | 1055.7 | 1.589 | 1061.2 | 0.649 | 1065.9 | 2.592 | 1081.8 | 10.71 |
| 0.001 | 1054.8 | 1.136 | 1059.0 | 1.735 | 1066.1 | 0.598 | 1073.4 | 3.431 | 1089.7 | 17.38 |
| T = 303.15 K | ||||||||||
| 0 | 1044.3 | 0.778 | 1044.3 | 0.778 | 1044.3 | 0.778 | 1044.3 | 0.778 | 1044.3 | 0.778 |
| 0.0001 | 1045.0 | 0.800 | 1045.0 | 0.827 | 1045.7 | 1.061 | 1045.8 | 0.904 | 1049.6 | 1.251 |
| 0.0002 | 1045.7 | 0.823 | 1046.2 | 0.887 | 1047.5 | 0.952 | 1048.1 | 1.064 | 1053.8 | 1.692 |
| 0.0004 | 1047.4 | 0.887 | 1048.4 | 0.992 | 1050.9 | 0.860 | 1052.5 | 1.363 | 1062.8 | 3.687 |
| 0.0006 | 1049.1 | 0.943 | 1051.3 | 1.169 | 1055.4 | 0.782 | 1059.3 | 1.962 | 1071.5 | 5.688 |
| 0.0008 | 1051.0 | 0.965 | 1053.8 | 1.411 | 1059.4 | 0.715 | 1064.0 | 2.276 | 1079.6 | 9.162 |
| 0.001 | 1052.9 | 1.015 | 1057.0 | 1.535 | 1064.1 | 0.657 | 1071.3 | 2.993 | 1087.0 | 14.73 |
| T = 308.15 K | ||||||||||
| 0 | 1042.5 | 0.707 | 1042.5 | 0.707 | 1042.5 | 0.707 | 1042.5 | 0.707 | 1042.5 | 0.707 |
| 0.0001 | 1043.2 | 0.726 | 1043.3 | 0.751 | 1043.8 | 1.307 | 1043.9 | 0.819 | 1047.9 | 1.125 |
| 0.0002 | 1043.7 | 0.747 | 1044.2 | 0.803 | 1045.6 | 1.165 | 1046.2 | 0.958 | 1052.0 | 1.510 |
| 0.0004 | 1045.4 | 0.803 | 1046.3 | 0.894 | 1048.9 | 1.048 | 1050.5 | 1.220 | 1060.9 | 3.250 |
| 0.0006 | 1047.0 | 0.853 | 1049.1 | 1.051 | 1053.6 | 0.949 | 1057.4 | 1.748 | 1069.4 | 4.959 |
| 0.0008 | 1048.8 | 0.871 | 1051.6 | 1.262 | 1057.0 | 0.864 | 1061.6 | 2.018 | 1077.1 | 7.925 |
| 0.001 | 1050.7 | 0.916 | 1054.7 | 1.370 | 1061.8 | 0.791 | 1069.0 | 2.642 | 1084.3 | 12.66 |
| T = 313.15 K | ||||||||||
| 0 | 1040.2 | 0.646 | 1040.2 | 0.646 | 1040.2 | 0.646 | 1040.2 | 0.646 | 1040.2 | 0.646 |
| 0.0001 | 1040.8 | 0.663 | 1040.9 | 0.685 | 1041.5 | 1.513 | 1041.6 | 0.746 | 1045.6 | 1.020 |
| 0.0002 | 1041.4 | 0.681 | 1041.8 | 0.731 | 1043.2 | 1.342 | 1043.8 | 0.870 | 1049.6 | 1.357 |
| 0.0004 | 1042.9 | 0.732 | 1043.9 | 0.812 | 1046.4 | 1.200 | 1048.1 | 1.101 | 1058.5 | 2.886 |
| 0.0006 | 1044.5 | 0.776 | 1046.7 | 0.951 | 1050.9 | 1.081 | 1054.6 | 1.567 | 1066.7 | 4.359 |
| 0.0008 | 1046.2 | 0.790 | 1048.9 | 1.138 | 1054.4 | 0.979 | 1059.0 | 1.801 | 1074.3 | 6.912 |
| 0.001 | 1048.0 | 0.831 | 1052.0 | 1.229 | 1059.0 | 0.893 | 1066.1 | 2.347 | 1081.2 | 10.95 |
| T = 318.15 K | ||||||||||
| 0 | 1038.1 | 0.594 | 1038.1 | 0.594 | 1038.1 | 0.594 | 1038.1 | 0.594 | 1038.1 | 0.594 |
| 0.0001 | 1038.7 | 0.610 | 1038.8 | 0.629 | 1039.3 | 1.960 | 1039.4 | 0.683 | 1043.5 | 0.930 |
| 0.0002 | 1039.2 | 0.625 | 1039.7 | 0.670 | 1041.0 | 1.730 | 1041.7 | 0.793 | 1047.4 | 1.225 |
| 0.0004 | 1040.7 | 0.671 | 1041.6 | 0.741 | 1044.1 | 1.540 | 1045.8 | 0.998 | 1056.2 | 2.578 |
| 0.0006 | 1042.2 | 0.710 | 1044.3 | 0.864 | 1048.5 | 1.381 | 1052.3 | 1.413 | 1064.2 | 3.855 |
| 0.0008 | 1043.8 | 0.722 | 1046.6 | 1.031 | 1051.9 | 1.245 | 1056.5 | 1.617 | 1071.8 | 6.068 |
| 0.001 | 1045.5 | 0.758 | 1049.5 | 1.110 | 1056.5 | 1.131 | 1063.5 | 2.099 | 1078.5 | 9.548 |
| T = 323.15 K | ||||||||||
| 0 | 1035.8 | 0.548 | 1035.8 | 0.548 | 1035.8 | 0.548 | 1035.8 | 0.548 | 1035.8 | 0.548 |
| 0.0001 | 1036.3 | 0.562 | 1036.4 | 0.580 | 1036.9 | 2.205 | 1037.1 | 0.629 | 1041.3 | 0.851 |
| 0.0002 | 1036.8 | 0.576 | 1037.3 | 0.617 | 1038.7 | 1.937 | 1039.3 | 0.728 | 1045.1 | 1.113 |
| 0.0004 | 1038.2 | 0.618 | 1039.2 | 0.680 | 1041.6 | 1.715 | 1043.4 | 0.911 | 1053.8 | 2.318 |
| 0.0006 | 1039.6 | 0.653 | 1041.8 | 0.791 | 1046.0 | 1.531 | 1049.9 | 1.284 | 1061.7 | 3.433 |
| 0.0008 | 1041.1 | 0.663 | 1044.0 | 0.941 | 1049.4 | 1.376 | 1053.9 | 1.463 | 1069.0 | 5.361 |
| 0.001 | 1042.8 | 0.696 | 1046.9 | 1.010 | 1053.9 | 1.245 | 1060.9 | 1.889 | 1075.5 | 8.373 |
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Объекты и методы исследования. В качестве объекта исследования взята система вода–ПЭГ–KBr. Рассмотрены фракции ПЭГ со средней молекулярной массой 1000, 1500, 3000, 4000 и 6000 г/моль. Во всех случаях концентрация KBr составляла 0.01 мол. доли. Использованы ПЭГ и KBr “х.ч.”. Растворы изготовлены гравиметрическим методом. При приготовлении растворов использована бидистиллированная вода. Для приготовления образцов использованы аналитические весы KERN 770, измерения проведены с точностью до 0.0001 г. Вязкость измерена капиллярным вискозиметром ВПЖ-2 диаметром 0.56 мм, а плотность – тонким стеклянным пикнометром объемом 15 см3. Эксперимент проведен при нормальном атмосферном давлении. Время протекания жидкости в вискозиметре определено с точностью ±0.01 с. Все измерения выполнены 3 раза, взяты их средние значения. Плотность жидкости определена по изменению объема с помощью калиброванного пикнометра. Значения вязкости и плотности определены относительно эталонной жидкости. В качестве эталонной жидкости использована бидистиллированная вода, а значения вязкости и плотности воды взяты из [10]. Для определения вязкости и плотности растворов при различных температурах (293.15, 298.15, 303.15, 308.15, 313.15, 318.15 и 323.15 K), вискозиметр и пикнометр помещены в термостат. Температура измерена с точностью ±0.05 K. Максимальная относительная погрешность эксперимента составляла при определении плотности 0.3%, а при определении вязкости – 1.0%.
По теории Френкеля и Эйринга [9, 19, 20], энергия активации Гиббса ($\Delta G_{\eta }^{ \ne }$) вязкого течения определяется выражением:
Согласно теории Эйринга [19], ${{\eta }_{0}} = {{N}_{{\text{A}}}}h\rho {\text{/}}M$. Здесь, ${{N}_{{\text{A}}}} = 6.02 \times {{10}^{{23}}}$ моль–1 – число Авогадро, $R = 8.31$ Дж K–1 моль–1 – универсальная газовая постоянная, $h = 6.626 \times {{10}^{{ - 34}}}$ Дж с – постоянная Планка, M – молярная масса раствора, которая определяется выражением $M = \sum\nolimits_{i = 1}^N {{{x}_{i}}{{M}_{i}}} $, где xi и Mi – мольная доля и молярная масса i-го компонента соответственно [9]. При абсолютной температуре Т динамическая вязкость (η) и плотность (ρ) жидкости определялись в эксперименте. Значения динамической вязкости (η) и плотности (ρ) жидкости в эксперименте определялись по абсолютной шкале температур Т.Энтальпия вязкого течения ($\Delta H_{\eta }^{ \ne }$) определяется выражением [21, 22]:
(2)
$\Delta H_{\eta }^{ \ne } = R\frac{{\partial \ln (\eta {\text{/}}{{\eta }_{0}})}}{{\partial (1{\text{/}}T)}}.$Парциальный молярный объем ($\tilde {V}$) в растворе ПЭГ определяется по формуле [21–23]:
(4)
$\tilde {V} = {{V}_{{\text{м}}}} + \left( {1 - x} \right){{\left( {\frac{{\partial {{V}_{{\text{м}}}}}}{{\partial x}}} \right)}_{{p,T}}},$(7)
$N = \frac{{{{m}_{2}}}}{{{{M}_{2}}}}{{N}_{{\text{A}}}} = {{\nu }_{2}}{{N}_{{\text{A}}}},\quad {{V}_{k}} = \frac{{{{m}_{k}}}}{{{{\rho }_{1}}}} = \frac{{{{M}_{2}}}}{{{{N}_{{\text{A}}}}{{\rho }_{1}}}},$(8)
${{N}_{{\text{г}}}} = \left( {\frac{{{{x}_{1}}}}{{{{x}_{2}}}} + \frac{{{{M}_{2}}}}{{{{M}_{1}}}}} \right)\left( {1 - \frac{{{{\rho }_{1}}}}{\rho }} \right),$(9)
${{N}_{{\text{г}}}} = \left( {\frac{{1 - x}}{x} + \frac{{{{M}_{2}}}}{{{{M}_{1}}}}} \right)\left( {1 - \frac{{{{\rho }_{1}}}}{\rho }} \right).$ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В табл. 2 и 3 представлены зависимости энергии активации Гиббса и энтальпии активации вязкого течения ($\Delta G_{\eta }^{ \ne }$, $\Delta H_{\eta }^{ \ne }$) системы вода–ПЭГ–KBr от концентрации (х) ПЭГ при температуре 293.15 K для разных молярных масс ПЭГ. А на рис. 1 представлена зависимость энтропии активации вязкого течения ($\Delta S_{\eta }^{ \ne }$) от концентрации (х) ПЭГ. Расчеты показывают, что во всех рассмотренных случаях параметры $\Delta G_{\eta }^{ \ne }$, $\Delta H_{\eta }^{ \ne }$ и $\Delta S_{\eta }^{ \ne }$ уменьшаются с ростом температуры. Как видно из табл. 2 и 3 и рис. 1, для исследуемой системы активационные параметры вязкого течения ($\Delta G_{\eta }^{ \ne }$, $\Delta H_{\eta }^{ \ne }$, $\Delta S_{\eta }^{ \ne }$) увеличиваются с ростом концентрации при данной температуре, а концентрация увеличивается с ростом средней молекулярной массы при данной температуре.
Таблица 2.
Зависимость энергии Гиббса активации вязкого течения ($\Delta G_{\eta }^{ \ne }$, Дж/моль) системы вода–ПЭГ–KBr от концентрации ПЭГ(x) (xKBr = 0.01, T = 293.15 K)
| x | MПЭГ = 1000 | MПЭГ = 1500 | MПЭГ = 3000 | MПЭГ = 4000 | MПЭГ = 6000 |
|---|---|---|---|---|---|
| 0 | 9222 | 9222 | 9222 | 9222 | 9222 |
| 0.0001 | 9299 | 9395 | 9495 | 9649 | 10 485 |
| 0.0002 | 9385 | 9589 | 9804 | 10 111 | 11 326 |
| 0.0004 | 9596 | 9908 | 10 389 | 10 832 | 13 411 |
| 0.0006 | 9776 | 10 362 | 10 818 | 11 835 | 14 635 |
| 0.0008 | 9862 | 10 870 | 11 522 | 12 296 | 15 949 |
| 0.001 | 10 009 | 11 117 | 11 876 | 13 063 | 17 256 |
Таблица 3.
Зависимость энтальпии активации вязкого течения ($\Delta H_{\eta }^{ \ne }$, Дж/моль) системы вода–ПЭГ–KBr от концентрации ПЭГ(x) (xKBr = 0.01, T = 293.15 K)
| x | MПЭГ = 1000 | MПЭГ = 1500 | MПЭГ = 3000 | MПЭГ = 4000 | MПЭГ = 6000 |
|---|---|---|---|---|---|
| 0 | 16 489 | 16 489 | 16 489 | 16 489 | 16 489 |
| 0.0001 | 16 618 | 16 923 | 17 033 | 17 180 | 18 068 |
| 0.0002 | 16 936 | 17 221 | 17 516 | 17 827 | 19 165 |
| 0.0004 | 17 274 | 17 578 | 18 284 | 18 826 | 21 584 |
| 0.0006 | 17 457 | 18 294 | 18 867 | 20 094 | 23 180 |
| 0.0008 | 17 698 | 18 984 | 19 803 | 20 697 | 24 688 |
| 0.001 | 17 889 | 19 267 | 20 406 | 21 756 | 26 328 |
Рис. 1.
Зависимости энтропии активации вязкого течения от концентрации ПЭГ в системе вода–ПЭГ–KBr (xKBr = 0.01, T = 293.15 K); MПЭГ = 1000 (1), 1500 (2), 3000 (3), 4000 (4), 6000 (5).
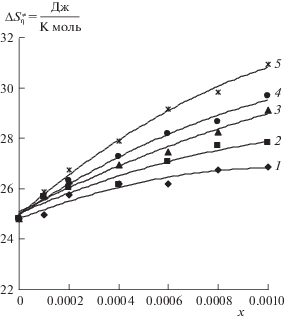
Когда жидкость находится в покое, вероятность перемещения частиц жидкости по всем направлениям одинакова. Однако во время течения переход частиц из одного места в другое в направлении течения больше, чем в других направлениях, а параметры $\Delta G_{\eta }^{ \ne }$, $\Delta H_{\eta }^{ \ne }$ и $\Delta S_{\eta }^{ \ne }$ равны разности значений соответствующих параметров при переходе 1 моля частиц из связанного состояния (${{G}_{{\text{с}}}}$, ${{H}_{{\text{с}}}}$, ${{S}_{{\text{с}}}}$) в активное (${{G}_{{\text{a}}}}$, ${{H}_{{\text{a}}}}$, ${{S}_{{\text{a}}}}$) [9]. Известно, что $\Delta G_{\eta }^{ \ne }$ – энергия перехода 1 моля молекул из связанного состояния в активное, $\Delta H_{\eta }^{ \ne }$ характеризует происходящие изменения в растворе с точки зрения энергии, а $\Delta S_{\eta }^{ \ne }$ характеризует структурные изменения [3, 9, 25]. Таким образом, увеличение $\Delta G_{\eta }^{ \ne }$ с ростом концентрации растворимого вещества показывает, что для преодоления потенциального барьера для молекулы понадобится больше энергии. Увеличение $\Delta H_{\eta }^{ \ne }$ свидетельствует о более устойчивой структуре системы, а увеличение $\Delta S_{\eta }^{ \ne }$ показывает, что система перешла в более структурированное состояние [15, 21, 22]. По зависимостям активационных параметров вязкого течения ($\Delta G_{\eta }^{ \ne }$, $\Delta H_{\eta }^{ \ne }$, $\Delta S_{\eta }^{ \ne }$) от концентрации (табл. 2, 3 и рис. 1) видно, что исследуемые системы при данной температуре становятся более структурированными при увеличении концентрации ПЭГ.
В водных растворах структурные свойства характеризуются молярным объемом компонентов раствора. Известно, что парциальный молярный объем i-го компонента равен изменению объема при добавлении 1 моля данного компонента к данной системе [9, 23]. В табл. 4 представлены зависимости парциального молярного объема ПЭГ ($\tilde {V}$) в системе вода–ПЭГ–KBr от концентрации (x) ПЭГ при 293.15 K для разных молярных масс ПЭГ. Расчеты показывают, что во всех рассмотренных случаях параметр $\tilde {V}$ увеличивается с ростом температуры.
Таблица 4.
Зависимость парциального молярного объема ($\tilde {V}$, см3/моль) системы вода–ПЭГ–KBr от концентрации ПЭГ(x) (xKBr = 0.01, T = 293.15 K)
| x | MПЭГ = 1000 | MПЭГ = 1500 | MПЭГ = 3000 | MПЭГ = 4000 | MПЭГ = 6000 |
|---|---|---|---|---|---|
| 0 | 827 | 1275 | 2611 | 3512 | 4903 |
| 0.0001 | 816 | 1251 | 2572 | 3449 | 4864 |
| 0.0002 | 807 | 1230 | 2536 | 3388 | 4828 |
| 0.0004 | 790 | 1192 | 2472 | 3278 | 4765 |
| 0.0006 | 778 | 1161 | 2420 | 3182 | 4714 |
| 0.0008 | 770 | 1137 | 2380 | 3100 | 4676 |
| 0.001 | 765 | 1120 | 2351 | 3032 | 4649 |
Как видно из табл. 4, парциальный молярный объем ПЭГ ($\tilde {V}$) в исследуемой системе уменьшается с увеличением концентрации ПЭГ и увеличивается с ростом средней молекулярной массы при данной температуре и концентрации. Расчеты показывают, что парциальный молярный объем ПЭГ на один мономер ${{\left( {\frac{{\tilde {V}}}{n}} \right)}_{{{\text{ср}}}}}$ при данной температуре и концентрации практически не зависит от средней молекулярной массы ПЭГ. На рис. 2 показана зависимость среднего значения молярного объема на один мономер от концентрации при температуре 293.15 K, для разных молярных масс ПЭГ. Эти зависимости мы можем представить с помощью выражения:
Рис. 2.
Зависимость среднего значения парциального молярного объема на один мономер ПЭГ в системе вода–ПЭГ–KBr от концентрации ПЭГ (xKBr = 0.01, T = 293.15 K).
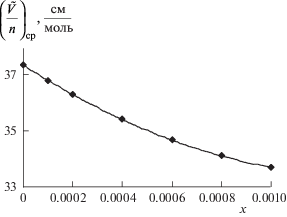
Таблица 5.
Зависимость числа гидратации ПЭГ системы вода–ПЭГ–KBr от температуры
| T, K | MПЭГ = 1000 | MПЭГ = 1500 | MПЭГ = 3000 | MПЭГ = 4000 | MПЭГ = 6000 |
|---|---|---|---|---|---|
| 293.15 | 8.3 | 11.4 | 18.5 | 24.1 | 50.9 |
| 298.15 | 7.9 | 11.0 | 18.1 | 23.5 | 50.6 |
| 303.15 | 7.6 | 10.4 | 17.8 | 23.1 | 50.3 |
| 308.15 | 7.2 | 10.0 | 17.3 | 22.6 | 50.1 |
| 313.15 | 6.8 | 9.6 | 16.9 | 22.2 | 49.7 |
| 318.15 | 6.5 | 9.4 | 16.3 | 21.7 | 49.3 |
| 323.15 | 5.9 | 8.9 | 16.0 | 21.5 | 49.2 |
Таким образом, по зависимостям энтропии активации вязкого течения и парциального молярного объема ПЭГ в растворе от концентрации можно предположить, что при данной температуре и для данной фракции ПЭГ с ростом концентрации, и при данной концентрации, но разных фракций ПЭГ с увеличением молекулярной массы раствор становится более структурированным. Можно предположить, что в исследуемой системе за счет водородных связей вокруг молекул ПЭГ образуются определенные агрегаты в результате скопления молекул воды (прежде всего свободных молекул воды). Это видно из табл. 5. С ростом концентрации ПЭГ количество таких агрегатов увеличивается, а с ростом молекулярной массы увеличиваются и их размеры, в результате чего раствор становится более структурированным. С увеличением концентрации и средней молекулярной массы ПЭГ число и размеры таких агрегатов в растворе увеличиваются, что приводит к более структурированному раствору. Несомненно, структура системы вода–ПЭГ–KBr будет отличаться от структуры системы вода–ПЭГ, так как ионы ${{{\text{K}}}^{ + }}$ и ${\text{B}}{{{\text{r}}}^{ - }}$ подвергаются гидратации. Исследования [21] показывают, что значения параметров $\Delta G_{\eta }^{ \ne }$, $\Delta H_{\eta }^{ \ne }$, $\Delta S_{\eta }^{ \ne }$, $\tilde {V}$ и ${{N}_{{\text{г}}}}$ в системе вода–ПЭГ–KBr меньше, чем в системе вода–ПЭГ, т.е. соль KBr ослабляет структурный эффект ПЭГ. Следует отметить, что деструктивное воздействие соли KBr на структуру воды показано в [21]. Мы предполагаем, что это связано с отрицательной гидратацией ионов ${{{\text{K}}}^{ + }}$ и ${\text{B}}{{{\text{r}}}^{ - }}$ [21, 28].
Список литературы
Ji Chen, Scott K. Spear, Jonathan G. Huddleston, Robin D. Rogers // J. Green Chem. 2005. V. 7. P. 64.
Щуляк И.В., Грушова Е.И., Семеченко А.М. // Журн. физ. химии. 2011. Т. 85. № 3. С. 485.
Parmoona G., Mohammadi Nafchib A., Pirdashtic M. // Phys. Chem. Res. 2019. V. 7. № 4. P. 859.
Tang Z., Fang K., Song Y., Sun F. // J. Polymers. 2019. V. 11. P. 739.
Ланге К.Р. // Поверхностно-активные вещества, синтез, свойства, анализ, применение. СПб.: “ПРОФЕССИЯ”, 2005. 240 с.
Sung J.H., Lee D.C., Park H.J. // Polymer. 2007. V. 48. P. 4205.
Bailey F.F., Koleske J.V. // Poly(Ethylene Oxide). New York: Academic Press, 1976. 173 p.
Tirosh O., Barenholz Y., Katzhendler J., Priev A. // J. Biophysical. 1998. V. 74. P. 1371.
Masimov E.A., Hasanov H.Sh., Pashayev B.G. // Liquid Viscosity. Baku: “Publishing House Laman”, 2016. 285 p.
Graber T., Andrews B., Asenjo J. // J. Chromatogr. B 2000. V. 743. P. 57.
Taboada M.E., Galleguillos H.R., Graber T.A., Bolado S. // J. Chem. Eng. 2005. V. 50. № 1. P. 264.
Масимов Э.А., Пашаев Б.Г., Гасанов Г.Ш., Гаджиева Ш.Н. // Журн. физ. химии. 2019. Т. 93. № 6. С. 845.
Pashayev B.G. // J. Low Dimensional Systems. 2019. V. 3 (2). P. 29.
Madadi B., Pazuki G., Nasernejad B. // J. Chem. Eng. 2013. V. 58. P. 2785.
Масимов Э.А., Пашаев Б.Г., Раджабов М.Р. // Журн. физ. химии. 2019. Т. 93. № 12. С. 1913.
Mozafar A., Goodin J.R. // Plant Physiol. 1981. V. 67. P. 64.
Leininger N.F., Clontz R., Gainer J.L., Kirwan D.J. // J. Chem. Engng Comm. 2003. V. 190. P. 431.
Harris J.M. // Springer Science & Business Media, 1992. P. 385
Глесстон С., Лейдлер К., Эйринг Г. // Теория абсолютных скоростей. М.: Изд-во иностр. лит., 1948. 600 с.
Френкель Я.И. // Кинетическая теория жидкостей. Л.: Наука, 1975. С. 221–235.
Масимов Э.А., Пашаев Б.Г., Гасанов Г.Ш., Гасанов Н.Г. // Журн. физ. химии. 2015. Т. 89. № 7. С. 1133.
Масимов Э.А., Пашаев Б.Г., Гасанов Г.Ш. // Там же. 2017. Т. 91. № 4. С. 644.
Atkins P., De Paula J. // Physical Chemistry. Oxford University Press, 2006. 1067 p.
Макагон Б.П., Вондаренко Т.А. // Высокомолекуляр. соединения. (А). 1985. Т. 27. № 3. С. 563.
Тагер А.А. // Физикохимия полимеров. М.: “Научный мир”, 2007. 573 с.
Nemethy G., Scheraga H. // J. Chem. Phys. 1962. V. 36. № 12. P. 3382.
Калоус В., Павличек З. // Биофизическая химия. М.: Мир, 1985. P. 267–273.
Samoylov O.Y. // Структура водных растворов электролитов и гидратация ионов. М.: Изд-во АН СССР, 1957. 250 с.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии


