Журнал физической химии, 2020, T. 94, № 2, стр. 281-288
Диффузионная модель процесса образования гидрата метана в “сухой воде”
А. А. Кислицын a, *, А. О. Драчук b, Н. С. Молокитина b, Л. С. Поденко b, **
a Тюменский государственный университет
Тюмень, Россия
b Российская академия наук, Сибирское отделение,
Федеральный исследовательский центр Тюменский научный центр, Институт криосферы Земли
Тюмень, Россия
* E-mail: akislicyn@utmn.ru
** E-mail: lpodenko@yandex.ru
Поступила в редакцию 19.04.2019
После доработки 19.04.2019
Принята к публикации 14.05.2019
Аннотация
Изучена кинетика образования гидрата метана в “сухой воде” с использованием “диффузионной” модели (модифицированной известной модели “сжимающегося ядра”). Получено аналитическое решение уравнений, описывающих процесс образования гидрата метана для “сухой воды” в квазистационарном приближении, и показана его корректность. Определено распределение по размеру частиц водной фазы “сухой воды”, стабилизированной разными диоксидами кремния. Установлен преимущественно бимодальный характер этого распределения. Получены кинетические кривые образования гидратов метана в “сухой воде”, стабилизированной разными диоксидами кремния. Проведены расчеты кинетических кривых образования гидратов метана в “сухой воде” с помощью предложенной “диффузионной” модели и показано хорошее согласие теоретических и экспериментальных значений кинетических параметров процесса гидратообразования, подтверждающее адекватность разработанной модели и найденного решения.
Газовые гидраты – клатратные соединения газа с водой содержат значительное количество газа (при образовании одного объема гидратов природного газа поглощается свыше 170 объемов газа (STP, IUPAC) [1]). В этой связи ведутся масштабные исследования в области разработки технологий хранения и транспортирования природного газа, основанных на использовании газовых гидратов (газогидратных технологий) [2]. Сравнительно недавно показано, что дисперсная вода, дисперсный водный гель полимера, стабилизированные наночастицами диоксида кремния (известные под названием “сухая вода”, “сухой гель”), являются перспективными системами для использования в газогидратных технологиях, благодаря высокой скорости и степени перехода содержащейся в них воды в газовый гидрат [3, 4].
Водная фаза “сухой воды” включает капли воды и плотноупакованные их агрегаты, стабилизированные гидрофобизированным диоксидом кремния. Наночастицы диоксида кремния, адсорбированные на поверхности капель водной фазы “сухой воды”, препятствуют их слиянию. Газопроницаемый каркас, образованный из частиц диоксида кремния, заполняет пространство между отдельными агрегатами, состоящими из капель водной фазы “сухой воды”, препятствуя их объединению [5, 6]. “Сухую воду” обычно получают смешиванием в воздушной атмосфере воды и наночастиц гидрофобизированного диоксида кремния [3]. Для получения “сухого геля” воду заменяют на водный гель [4].
Работы, посвященные образованию гидратов в “сухой воде” и “сухом геле”, в основном, направлены на экспериментальное исследование влияния состава этих материалов на кинетику образования в них газовых гидратов [3, 4, 7, 8]. При этом механизм образования газовых гидратов в этих материалах остается слабо изученным. Лишь в работе [9] интерпретация экспериментальных данных кинетики образования гидратов метана в “сухой воде” проведена с использованием физико-математической модели. Для интерпретации экспериментальных данных авторы работы [9] использовали известную модель “сжимающегося ядра” [10, 11]. Однако удовлетворительного соответствия данных эксперимента и теории удалось достигнуть, лишь предположив наличие в “сухой воде” значительного количества (около 30 мас. %) включений свободной воды. Данное предположение вступает в противоречие с известными экспериментальными фактами, согласно которым в свежеприготовленной “сухой воде” включения свободной воды отсутствуют [6]. Кроме этого анализ процессов образования и последующей диссоциации гидратов, полученных в “сухой воде”, указывает на то, что формирование свободной воды происходит лишь на стадии диссоциации газового гидрата, а не при его образовании [7]. Недостатком использованной модели, по нашему мнению, является отсутствие в ней аналитического решения дифференциальных уравнений, описывающих самосогласованные процессы диффузии метана через гидратную оболочку, и движения фронта гидратообразования внутрь капли. Известно также, что распределение по размеру частиц водной фазы “сухой воды” имеет полимодальный характер [6], однако это обстоятельство не было учтено авторами работы [9] в использованной ими модели гидратообразования.
В настоящей работе предложена диффузионная модель образования газовых гидратов в “сухой воде”, учитывающая полимодальный характер распределения по размеру частиц водной фазы “сухой воды”. Представлены данные распределения по размеру частиц водной фазы “сухой воды”, полученные с помощью метода ядерного магнитного резонанса (ЯМР). Получены кинетические кривые образования гидратов метана в “сухой воде”. Проведено сравнение кинетических кривых образования гидратов метана в “сухой воде”, полученных экспериментально и рассчитанных с использованием предложенной диффузионной модели.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для приготовления “сухой воды” использовались дистиллированная вода и гидрофобизированный пирогенный диоксид кремния (далее стабилизатор). В качестве стабилизатора мы применяли диоксид кремния, выпускаемый фирмой Evonik Industries AG под торговым названием Aerosil® R202 (далее R202) или фирмой Wacker Chemical под торговым названием HDK® Н17 (далее Н17) и HDK® Н18 (далее Н18). Данный выбор обусловлен тем, что значения удельной поверхности (БЭТ) для указанных диоксидов отличаются почти в два раза (100, 150, 200 м2/г для R202, Н17, Н18 соответственно), при этом содержание углерода (параметр, зависящий от содержания гидрофобизатора в стабилизаторе) и насыпная плотность отличаются несущественно.
“Сухую воду” получали по методике, описанной в [8], смешивая дистиллированную воду и один из выше перечисленных стабилизаторов. Содержание в смеси стабилизатора R202 изменяли от 2 до 15 мас. %. Содержание Н18 и Н17 в “сухой воде” задавали равным 5 мас. %.
Нами определены распределения частиц водной фазы “сухой воды” по размеру с помощью метода ЯМР на ядрах водорода. ЯМР-релаксационные измерения выполнены на импульсном ЯМР-релаксометре Bruker Minispec mq с резонансной частотой 20 МГц. В эксперименте реализована импульсная последовательность Карра–Парселла–Мейбум–Гилла (СPMG) для определения времени спин-спиновой релаксации. Для всех измеренных образцов “сухой воды” наблюдали двухэкспоненциальный спад ядерной намагниченности А:
где Т21, Т22 – время спин-спиновой релаксации для первой и второй компонент сигнала ЯМР; А1, А2 – максимальные интенсивности компонент сигнала ЯМР соответственно.Двухэкспоненциальный спад ядерной намагниченности свидетельствует о том, что “сухую воду” можно представить как смесь двух фракций частиц водной фазы “сухой воды” с радиусами R01 и R02, и с соответствующими значениями массовой концентрации f1 и f2 (“бимодальное распределение” по размерам) [6].
Полученные значения Т21, Т22 использовались для расчета среднего размера частиц водной фазы “сухой воды” для каждой фракции с помощью методики, описанной в [6]. Весовая доля каждой фракции (моды) рассчитана как отношение максимальной интенсивности сигнала ЯМР для каждой компоненты к сумме максимальных интенсивностей обеих компонент. Рассчитанные таким образом значения R01, R02 и f1, f2 приведены в табл. 1.
Таблица 1.
Радиусы микрокапель R01, R02 водной фазы “сухой воды”, и их содержание в “сухой воде” (массовые доли f1 и f2), измеренные методом ЯМР-спектрометрии; β – концентрация диоксида кремния в “сухой воде” (в массовых долях)
| β | R01, мкм | f1 | R02, мкм | f2 |
|---|---|---|---|---|
| Aerosil R202 | ||||
| 0.02 | 3.65 | 0.21 | 14.3 | 0.79 |
| 0.03 | 3.0 | 0.25 | 9.15 | 0.75 |
| 0.05 | 3.05 | 0.34 | 7.3 | 0.66 |
| 0.07 | 2.95 | 0.16 | 4.6 | 0.84 |
| 0.10 | 3.3 | 1.0 | – | – |
| 0.12 | 3.1 | 1.0 | – | – |
| 0.15 | 3.0 | 1.0 | – | – |
| H18 | ||||
| 0.05 | 1.95 | 0.17 | 4.5 | 0.83 |
| H17 | ||||
| 0.05 | 1.95 | 0.24 | 4.3 | 0.76 |
В качестве газа-гидратообразователя использовался метан (99.9 мол. %). Кинетические кривые гидратообразования получены для образцов “сухой воды”, стабилизированных R202, Н18 и Н17. Для получения гидратов в реактор высокого давления из нержавеющей стали объемом 60 см3 загружали при комнатной температуре примерно 7 г “сухой воды”. Затем реактор продували метаном при атмосферном давлении, охлаждали до температуры 273.2 К, после чего давление метана в реакторе повышали до 5.5 МПа. Получение гидратов продолжали в течение 20 ч. Для каждой из концентраций стабилизатора проведено не менее трех экспериментов по образованию гидратов метана в “сухой воде”. Каждый раз для гидратообразования использовались вновь приготовленные образцы “сухой воды”.
Сразу после заправки реактора газом, либо спустя некоторое время (не превышающее 15 мин), известное как индукционный период гидратообразования, наблюдали уменьшение давления и небольшое (не более 0.2 К) повышение температуры образца, обусловленное образованием гидратов.
Количество молей метана n, поглощенного при образовании гидрата, рассчитывали по уравнению:
где Р, V и T – давление, объем газовой фазы и температура в реакторе; R – универсальная газовая постоянная; Z – сжимаемость газа, для вычисления которой использовали уравнение состояния Пенга–Робинсона. Индексы 0 и t обозначают начальный (сразу после заправки реактора газом) и текущий момент времени соответственно. Полагая, что состав гидратов метана определяется стехиометрическим соотношением CH4·5.9 ⋅ H2О [1], рассчитывали степень превращения воды в гидрат αexp: где μw – молярная масса воды; mw – исходная масса воды в исследуемом образце.ОПИСАНИЕ ФИЗИКО-МАТЕМАТИЧЕСКОЙ МОДЕЛИ
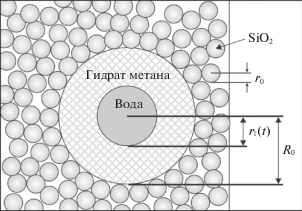
Нами использовано представление “сухой воды” в виде множества сферических капель воды, окруженных частицами диоксида кремния. Рассмотрим процесс, в котором нуклеация гидрата в отдельной капле инициирует гидратообразование преимущественно во всех каплях водной фазы “сухой воды”. Такое поведение гидрата характерно для “сухой воды” с содержанием стабилизатора не более 7 мас. % [8]. В этом случае скорость гидратообразования после нуклеации гидрата не лимитируется частотой нуклеации, а зависит от скорости роста гидрата в каплях. Схема образования газогидратной оболочки в отдельной капле воды, изображена на рис. 1. Движение метана к фронту гидратообразования происходит в результате его диффузии с поверхности капли сквозь уже образовавшийся слой гидрата. В квазистационарном приближении (проверка применимости этого приближения сделана ниже), т.е. считая, что координата фронта r1(t) меняется (уменьшается) существенно медленнее, чем устанавливается давление в сферическом слое, уравнение диффузии принимает вид
(3)
$D\frac{1}{{{{r}^{2}}}}\frac{d}{{dr}}\left( {{{r}^{2}}\frac{{du}}{{dr}}} \right) = 0,\quad {{r}_{1}} \leqslant r \leqslant {{R}_{0}},$(4)
$\frac{{du}}{{dr}} = \frac{{{{C}_{1}}}}{{{{r}^{2}}}},\quad u = - \frac{{{{C}_{1}}}}{r} + {{C}_{2}},$(5)
${{\left. u \right|}_{{r = {{R}_{0}}}}} = {{u}_{0}} = \frac{\mu }{{RTZ}}p,\quad {{\left. u \right|}_{{r = {{r}_{1}}}}} = {{u}_{{{\text{eq}}}}} = \frac{\mu }{{RTZ}}{{p}_{{{\text{eq}}}}},$(6)
$u = \frac{{{{R}_{0}}\left( {r - {{r}_{1}}} \right)}}{{r\left( {{{R}_{0}} - {{r}_{1}}} \right)}}\left( {{{u}_{0}} - {{u}_{{{\text{eq}}}}}} \right) + {{u}_{{{\text{eq}}}}},$(7)
$j = - D\frac{{du}}{{dr}} = - D\frac{{{{C}_{1}}}}{{{{r}^{2}}}} = - D\frac{{{{R}_{0}}{{r}_{1}}}}{{{{R}_{0}} - {{r}_{1}}}}\frac{{{{u}_{0}} - {{u}_{{{\text{eq}}}}}}}{{{{r}^{2}}}}.$Если бы вся поверхность капли находилась в контакте с атмосферой метана, диффузионный поток был бы направлен к центру капли и имел бы сферическую симметрию. На самом деле большая часть поверхности закрыта частицами диоксида кремния SiO2, сквозь которые диффузия метана затруднена или невозможна, а газ поступает через большое количество малых отверстий между частицами вследствие их неплотного прилегания друг к другу. Чтобы учесть этот факт, введем безразмерный коэффициент проницаемости σ, равный доле поверхности, доступной для метана, и назовем произведение σD “эффективным” коэффициентом диффузии. В идеализированной модели коэффициент σ, в зависимости от плотности укладки, лежит в пределах от 0.22 (рис. 2а) до 0.094 (рис. 2б). Можно ожидать, что в реальных экспериментах эта величина будет находиться приблизительно в этих же пределах.
Рис. 2.
Наименее плотная (а) и наиболее плотная (б) укладки сферических частиц на поверхности капли.

Запишем полный диффузионный поток метана через поверхность капли в виде:
(8)
$J = 4\pi R_{0}^{2}j\sigma = - 4\pi \sigma D\frac{{{{R}_{0}}{{r}_{1}}}}{{{{R}_{0}} - {{r}_{1}}}}\left( {{{u}_{0}} - {{u}_{{{\text{eq}}}}}} \right),$Пусть за время dt радиус фронта уменьшился на dr1. Это означает, что объем гидрата вырос на $4\pi r_{1}^{2}d{{r}_{1}}$, а масса поглощенного метана составила $dM = \rho \varphi 4\pi r_{1}^{2}d{{r}_{1}}$, где ρ – плотность гидрата, φ – массовая доля метана в гидрате. Тогда баланс массы на фронте гидратообразования $dM = Jdt$ принимает вид:
(9)
$\begin{gathered} x(1 - x)dx = - \frac{{\sigma D}}{{\varphi \rho R_{0}^{2}}}\left( {{{u}_{0}} - {{u}_{{{\text{eq}}}}}} \right)dt = \\ \, = - \frac{{\sigma D}}{{\varphi \rho R_{0}^{2}}} \cdot \frac{\mu }{{RTZ}}\left( {p - {{p}_{{{\text{eq}}}}}} \right)dt, \\ \end{gathered} $Теперь рассмотрим динамику давления метана в реакторе. Вначале будем считать “сухую воду” монодисперсной средой, т.е. при заданной массовой концентрации β диоксида кремния все капли имеют радиус R0, равный среднему значению. Тогда количество капель в реакторе равно $N = 3{{m}_{w}}{\text{/}}(4\pi {{\rho }_{w}}R_{0}^{3})$ где ρw – плотность воды. За время dt количество метана в реакторе уменьшается на dM = NJdt, при этом температура и объем остаются постоянными (небольшим повышением температуры образца, обусловленным образованием гидратов, пренебрегаем). Из уравнения состояния с учетом равенств (5) и (8) находим, что за время dt давление метана уменьшается на величину dp:
(10)
$\begin{gathered} dp = \frac{{RTZ}}{{V\mu }}dM = \frac{{RTZ}}{{V\mu }}NJdt = \\ \, = - \frac{{3{{M}_{{w0}}}\sigma D}}{{VR_{0}^{2}{{\rho }_{w}}}}\left( {p - {{p}_{{{\text{eq}}}}}} \right)\frac{x}{{1 - x}}dt. \\ \end{gathered} $Разделив (10) на (9), исключаем время и получаем уравнение, связывающее изменение давление p с движением фронта гидратообразования: $dp = 3b{{x}^{2}}dx$. Интегрируя его с учетом начального условия ${{\left. p \right|}_{{x = 1}}} = {{p}_{0}}$, находим:
где $b = ({{m}_{w}}\varphi \rho RTZ){\text{/}}(V\mu {{\rho }_{w}})$ – константа, равная разности давлений в реакторе в начале и в конце эксперимента (от x = 1 до x = 0). Подставляя (11) в (9), получаем дифференциальное уравнение, определяющее зависимость x(t): где a3 – безразмерная константа, равная избыточной разности между начальным давлением в реакторе и равновесным давлением на фронте гидратообразования, нормированная на величину b; τ – константа, имеющая размерность времени, и определяющая временной масштаб процесса гидратообразования в данном эксперименте:Уравнение (12) интегрируется в элементарных функциях; его решение с учетом начального условия ${{\left. x \right|}_{{t = 0}}} = 1$ имеет вид:
(15)
$\begin{gathered} \frac{t}{\tau } = \frac{1}{{6a}}\ln \frac{{({{a}^{2}} - a + 1){{{\left( {a + x} \right)}}^{2}}}}{{({{a}^{2}} - ax + {{x}^{2}}){{{\left( {a + 1} \right)}}^{2}}}} + \\ \, + \frac{1}{{a\sqrt 3 }}{\text{arctg}}\frac{{\sqrt 3 \left( {1 - x} \right)a}}{{a\left( {2a - 1} \right) + x\left( {2 - a} \right)}} + \frac{1}{3}\ln \frac{{{{a}^{3}} + {{x}^{3}}}}{{{{a}^{3}} + 1}}. \\ \end{gathered} $Отсюда время полного гидратообразования t0, соответствующее x = 0, равно:
(16)
$\begin{gathered} {{t}_{0}} = \tau \left[ {\frac{1}{{6a}}\ln \frac{{({{a}^{2}} - a + 1)}}{{{{{\left( {a + 1} \right)}}^{2}}}} + } \right. \\ \, + \left. {\frac{1}{{a\sqrt 3 }}{\text{arctg}}\frac{{\sqrt 3 }}{{\left( {2a - 1} \right)}} + \frac{1}{3}\ln \frac{{{{a}^{3}}}}{{{{a}^{3}} + 1}}} \right]. \\ \end{gathered} $Разделив (15) на (16), исключаем размерную константу τ, и получаем функцию, определяющую однозначное соответствие между безразмерным временем t/t0 и безразмерной координатой фронта гидратообразования x:
(17)
$\frac{t}{{{{t}_{0}}}} = \frac{{\ln \frac{{({{a}^{2}} - a + 1){{{\left( {a + x} \right)}}^{2}}}}{{({{a}^{2}} - ax + {{x}^{2}}){{{\left( {a + 1} \right)}}^{2}}}} + 2\sqrt 3 {\text{arctg}}\frac{{\sqrt 3 \left( {1 - x} \right)a}}{{a\left( {2a - 1} \right) + x\left( {2 - a} \right)}} + 2a\ln \frac{{{{a}^{3}} + {{x}^{3}}}}{{{{a}^{3}} + 1}}}}{{\ln \frac{{({{a}^{2}} - a + 1)}}{{{{{\left( {a + 1} \right)}}^{2}}}} + 2\sqrt 3 {\text{arctg}}\frac{{\sqrt 3 }}{{\left( {2a - 1} \right)}} + 2a\ln \frac{{{{a}^{3}}}}{{{{a}^{3}} + 1}}}}.$Единственный параметр a, входящий в (17), не зависит ни от радиуса капель R0, ни от коэффициента диффузии σD, является константой для каждой концентрации β, и слабо (на несколько процентов) различается при различных значениях β. Поэтому отношение t/t0 также слабо зависит от β, и в этом смысле формула (17) является универсальным соотношением между безразмерным радиусом фронта гидратообразования x и текущим временем t, нормированным на t0, для монодисперсной среды. На рис. 3 изображена зависимость t/t0 от x, рассчитанная по формуле (17) для β = 0.07 (сплошная линия). Для других значений β (от 0.02 до 0.15) значения t/t0 в середине графика отклоняются от сплошной линии не более чем на 2%, а в крайних точках, по определению, совпадают. По этой кривой, как по номограмме, можно определить безразмерное время, которое требуется для достижения любой степени превращения воды в гидрат для капель любого радиуса R0, и, (с погрешностью не более 2%) для любой концентрации β. Например, безразмерное время “полупревращения” монодисперсной “сухой воды”, состоящей из капель заданного радиуса R0, в гидрат, соответствующее α = 0.5, т.е. соответствующее точке x = (0.5)1/3 = 0.794, равно t1/2/t0 = 0.0729. Чтобы найти размерное время “полупревращения” t1/2, надо эту величину умножить на размерное значение t0, определенное по формуле (16), для чего предварительно по формуле (14) вычислить параметр τ. Необходимый для этого эффективный коэффициент диффузии σD определен ниже.
Рис. 3.
Универсальное соотношение между безразмерным радиусом фронта гидратообразования x и текущим временем t, нормированным на t0. Сплошная линия – график, вычисленный по формуле (17). Экспериментальные точки: + – β = 0.05; о – β = 0.07; треугольники – β = 0.10; ромбы – β = 0.12.

На рис. 3 приведены также экспериментальные точки для различных концентраций β, которые, как видно из графика, отклоняются от линии t/t0 не более чем на 15–20%. При этом для малых значений x наблюдается систематическое отклонение экспериментальных точек выше кривой t/t0, а при больших x – ниже этой линии. Объясняется это тем, что реальная “сухая вода” не является монодисперсной системой, т.е. кроме капель, размер которых равен или близок к R0, в ней присутствует некоторое количество капель, радиусы которых как меньше, так и больше, чем R0. Согласно формуле (14), время полного гидратообразования растет как квадрат радиуса капли, поэтому более мелкие капли гидратируются быстро, смещая экспериментальные точки в начале процесса в сторону меньших времен, а более крупные капли, наоборот, “затягивают” процесс на заключительном этапе гидратирования. Это подтверждают результаты наших экспериментальных исследований, описанные ниже.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Первый шаг обработки экспериментальных данных заключался в сравнении теоретических значений αth(t) c экспериментальными данными αexp, полученными нами при выполнении настоящей работы, а также опубликованными нами ранее в статье [8].
Теоретические значения вычислялись на основе данных табл. 1 в предположении, что “сухая вода” состоит из капель воды с начальными радиусами R01, R02, и с соответствующими значениями массовой концентрации фракций капель воды f1, f2. Для каждого момента времени ti, соответствующего каждому значению αiexp, теоретическое значение αith(ti) определялось по формуле:
(18)
${{\alpha }_{{i\;{\text{th}}}}}({{t}_{i}}) = {{f}_{1}}[1 - x_{{i1}}^{3}({{t}_{i}})] + {{f}_{2}}[1 - x_{{i2}}^{3}({{t}_{i}})],$Критерием согласия теоретических и экспериментальных данных считалась остаточная дисперсия:
(19)
${{S}^{2}} = \frac{1}{{n - 1}}\sum\limits_{i = 1}^n {{{{({{\alpha }_{{i\;\exp }}} - {{\alpha }_{{i\;{\text{th}}}}})}}^{2}}} ,$Таблица 2.
Основные параметры процесса образования гидрата метана в “сухой воде”, полученные в результате расчетов и обработки экспериментальных данных
| β, отн. ед. | τ × 10–3, мин | t0 × 10–3, мин | t1/2 exp, мин | t1/2 th, мин | σD × 1016, м2/с | σ | $R_{0}^{2}{\text{/}}D$, мин |
|---|---|---|---|---|---|---|---|
| R 202 | |||||||
| 0.02 | 99.8 ± 1.9 | 17.6 ± 0.6 | 1130 ± 100 | 1290 ± 150 | 2.6 ± 0.5 | 0.16 ± 0.03 | 2100 ± 100 |
| 0.03 | 54.8 ± 0.9 | 9.67 ± 0.2 | 474 ± 50 | 700 ± 100 | 2.0 ± 0.4 | 0.12 ± 0.02 | 870 ± 40 |
| 0.05 | 27.9 ± 0.5 | 4.92 ± 0.1 | 154 ± 12 | 360 ± 50 | 2.4 ± 0.5 | 0.15 ± 0.03 | 550 ± 30 |
| 0.07 | 8.3 ± 0.2 | 1.47 ± 0.03 | 84 ± 4 | 108 ± 20 | 3.2 ± 0.6 | 0.20 ± 0.04 | 220 ± 10 |
| 0.10 | 4.3 ± 0.1 | 0.75 ± 0.02 | 78 ± 3 | 55 ± 10 | 1.7 ± 0.3 | 0.10 ± 0.02 | 110 ± 5 |
| 0.12 | 4.19 ± 0.1 | 0.74 ± 0.02 | 70 ± 2 | 54 ± 10 | 3.0 ± 0.5 | 0.18 ± 0.03 | 100 ± 5 |
| 0.15 | 4.16 ± 0.1 | 0.73 ± 0.02 | 123 ± 4 | 53 ± 10 | 2.7 ± 0.5 | 0.17 ± 0.03 | 93 ± 5 |
| H17 | |||||||
| 0.05 | 7.23 ± 0.2 | 1.28 ± 0.03 | 49 ± 4 | 93 ± 18 | 3.5 ± 0.6 | 0.22 ± 0.04 | 210 ± 10 |
| H18 | |||||||
| 0.05 | 16.1 ± 0.4 | 2.85 ± 0.05 | 135 ± 12 | 207 ± 20 | 1.5 ± 0.3 | 0.09 ± 0.02 | 190 ± 10 |
Обозначения: β – концентрация диоксида кремния в “сухой воде” (в мас. долях); τ – константа, определяющая временной масштаб процесса гидратообразования, вычисленная по формуле (14); t0 – время полного гидратообразования капель с радиусами R0, вычисленное по формуле (16); t1/2 exp – время “полупревращения” воды в гидрат, экспериментальные значения; t1/2 th – время “полупревращения” воды в гидрат, вычисленное по формуле (17) для x = (0.5)1/3; σD – “эффективный” коэффициент диффузии метана в газогидрате; σ – доля поверхности капли, доступная для метана; $R_{0}^{2}{\text{/}}D$ – характерное время установления концентрации метана в сферическом гидратном слое. Для экспериментов с бимодальным распределением при вычислениях по формулам (14), (16) и (17) брались радиусы R0 более крупных капель.
Естественно предположить, что “истинный” коэффициент диффузии D метана в гидрате во всех экспериментах должен быть одинаковым, а различие “эффективных” коэффициентов определяется множителями σ. Однозначно определить эти множители по имеющейся информации невозможно, но можно сделать приближенные оценки, предположив, что наибольшему значению σD соответствует наибольший множитель σ ≈ 0.22, который получается при наименее плотной укладке наночастиц диоксида кремния на поверхности капель воды. Тогда для коэффициента диффузии получаем оценку
которая по порядку величины хорошо согласуется с опубликованными в литературе данными [15, 16]. Значения других множителей σ, которые получаются делением “эффективных” значений на D, лежат в пределах принятой физико-математической модели. Оценка неопределенностей всех параметров производилась по стандартной методике; наибольший вклад вносит неопределенность радиуса капель R0, которая принималась равной 7%.Оценив D, можно проверить корректность использования квазистационарного решения уравнения диффузии. Квазистационарный метод применим, если характерное время установления концентрации $R_{0}^{2}{\text{/}}D$ много меньше, чем время полного гидратообразования t0. Значения $R_{0}^{2}{\text{/}}D$ приведены в табл. 2. Сравнивая их с соответствующими значениями t0 из этой же таблицы, видим, что условие применимости выполняется для всех значений β.
На рис. 4 представлены зависимости αth(t), рассчитанные по формуле (15), а также соответствующие экспериментальные точки. Видно, что определенные таким образом значения αth практически (в пределах 7%-ной погрешности) не отличаются от экспериментальных αexp, т.е. гораздо лучше согласуются с экспериментом, чем вычисленные выше в предположении монодисперсности (рис. 3), но при этом теряют “универсальность”. Наиболее сильное отклонение экспериментальных и теоретических данных наблюдалось для “сухой воды” с концентрацией β 0.15. Ранее нами показано [8], что при этой концентрации стабилизатора массовая скорость образования гидратов может лимитироваться частотой нуклеации гидрата в водной фазе “сухой воды”. Это могло стать причиной расхождения экспериментальных и теоретических данных для “сухой воды” с концентрацией β 0.15, поскольку модель “сжимающегося ядра” не включает процессы нуклеации гидрата. Согласно данным, представленным в таблице 2, максимальное отклонение параметра σD от среднего значения (для “сухой воды” с концентрацией от 0.02 до 0.15) не превышало 32% при этом с увеличением концентрации R 202 от 0.02 до 0.12 период полупревращения воды в гидрат монотонно уменьшился более чем в 20 раз. Это свидетельствует о том, что причиной роста скорости гидратообразования для “сухой воды” с концентрацией от 0.02 до 0.12 явилось уменьшение размера частиц водной фазы “сухой воды” (табл. 1).
Рис. 4.
Рост массы воды, превращенной в гидрат метана α(t). Сплошные линии – расчет по формуле (15) при “наилучших” значениях τ, приведенных в табл. 1. Кривая 1 – β = 0.03; 2 – β = 0.05; 3 – β = 0.12; + – соответствующие экспериментальные точки для “сухой воды” стабилизированной R 202.

Таким образом, в результате проведенных исследований установлено бимодальное распределение по размеру частиц водной фазы “сухой воды”.
Предложена и апробирована модель процесса образования гидрата метана в “сухой воде”, основанная на модификации известной модели “сжимающегося ядра”, учитывающая распределение по размерам частиц водной фазы “сухой воды”. Сформулирована система уравнений, описывающих процесс образования гидрата метана в “сухой воде”. Получено аналитическое решение этих уравнений в квазистационарном приближении. Показана корректность применения квазистационарного приближения.
Установлено хорошее согласие теоретических и экспериментальных значений параметров процесса образования гидратов метана в “сухой воде”, стабилизированной разными стабилизаторами с разными их концентрациями, подтверждающее адекватность диффузионной модели и найденного решения. Предложен универсальный график в безразмерных переменных, позволяющий с точностью 15–20% оценить время превращения определенной части воды в гидрат при любой концентрации любого стабилизатора.
Работа выполнена по госзаданию, согласно Плану НИР ТюмНЦ СО РАН на 2018−2020 годы, протокол № 2 от 8.12.2017 (Приоритетное направление IX.135. Программа IX.135.2 Проект: IX.135.2.3. Механизмы и кинетика гидратообразования газов в объемных фазах и пористых средах).
Список литературы
Sloan E.D., Koh C.A. Clathrate Hydrates of Natural Gases, 3rd ed. CRC Press, 2008. 721 p.
Rehder G., Eckl R., Elfgen M. et al. // Energies. 2012. V. 5. № 7. P. 2499.
Wang W., Bray C.L., Adams D.J. et al. // J. Am. Chem. Soc. 2008. V. 130. P. 11608.
Carter B.O., Wang W., Adams D.J. et al. // Langmuir. 2010. V. 26. P. 3186.
Forny L., Saleh K., Pezron I. et al. // Powder Technology. 2009. V. 189. P. 263.
Поденко Л.С., Нестеров А.Н., Комисарова Н.С. и др. // Журн. прикл. спектроскопии. 2011. Т. 78. № 2. С. 260.
Fan S., Yang L., Wang Y. et al. // Chem. Eng. Sci. 2014. V. 106. P. 53.
Поденко Л.С., Драчук А.О., Молокитина Н.С. и др. // Журн. физ. химии. 2018. Т. 92. № 2. С. 239.
Shi B.H., Fan S., Lou X. // Chem. Eng. Sci. 2014. V. 109. P. 315.
Staykova D.K., Kuhs W.F., Salamatin A.N., Hansen T. // J. Phys. Chem. B. 2003. V. 107. P. 10299.
Kuhs W.F., Staykova D.K., Salamatin A.N. // J. Phys. Chem. B. 2006. V. 110. № 26. P. 13283.
Васильев Ф.П. Численные методы решения экстремальных задач. М.: Наука, 1980. 520 с.
Кислицын А.А., Фадеев А.М. // Журн. физ. химии. 1994. Т. 68. № 2. С. 340.
Андреев П.О., Кислицын А.А., Сальникова Е.И. // Там же. 2013. Т. 87. № 9. С.1490.
Shi B.H., Gong J., Sun C.Y., Zhao J.K., Ding Y., Chen G.J. // Chem. Eng. Journal. 2011. V. 171. P. 1308.
Шагапов В.Ш., Чиглинцева А.С., Белова С.В. // Инженерно-физический журн. 2017. Т. 90. № 5. С. 1208.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии