Журнал физической химии, 2020, T. 94, № 3, стр. 342-348
Физико-химические и электрохимические аспекты функционирования биологических мембран
Ю. А. Ермаков a, В. С. Соколов a, С. А. Акимов a, О. В. Батищев a, *
a Российская академия наук, Институт физической химии и электрохимии им. А.Н. Фрумкина
Москва, Россия
* E-mail: olegbati@gmail.com
Поступила в редакцию 24.06.2019
После доработки 24.06.2019
Принята к публикации 03.09.2019
Аннотация
Представлены наиболее важные научные достижения в области физико-химической биологии клеточных мембран, полученные в разные годы сотрудниками лаборатории биоэлектрохимии ИФХЭ РАН и получившие широкое мировое признание, а также перспективы развития данного научного направления. Исследования, проводимые в лаборатории, ориентированы на развитие теоретических, физико-химических и электрохимических методов и подходов для изучения биологических мембран. Эти работы позволили значительно продвинуться в понимании термодинамики, механики и электростатики мембран, организации транспорта различных веществ через клеточные мембраны, их фазового равновесия и латеральной организации в присутствии мембранно-активных ионов, макромолекул и белков, механизмов топологической перестройки, а также поведения возбудимых сред. Сотрудниками лаборатории предложены принципиально новые теоретические модели и экспериментальные методы, которые внесли существенный вклад в развитие физико-химических подходов в соответствующих разделах биофизики мембран.
В середине 60-х годов прошлого столетия в мировой науке существенно усилился интерес к различным физико-химическим аспектам функционирования биологических мембран. Стала очевидной особая роль ионного транспорта через внешнюю оболочку клеток и мембран внутриклеточных органелл в жизнедеятельности клеток и организмов в целом. К этому времени экспериментальные исследования, выполненные А.Л. Ходжкиным и А.Ф. Хаксли, позволили осуществить так называемую функциональную реконструкцию ионных каналов, которая доказала, что мембранный транспорт поддерживает ионный баланс на оболочке нервных клеток и создает условия для возникновения и распространения нервного импульса [1]. Это одна из первых работ в области физиологии клеточных мембран, за которую ее авторы удостоились Нобелевской премии. Примерно в те же годы появились работы будущего нобелевского лауреата П. Митчелла [2], которые связали протонный транспорт и электрический потенциал на мембранах митохондрий с биоэнергетическими процессами и механизмом окислительного фосфорилирования. Экспериментальные исследования подобных явлений в значительной степени опирались на применение достаточно простой экспериментальной методики формирования липидных моделей клеточных мембран – плоских бислойных липидных мембран (БЛМ) [3, 4]. Такие модели сделали возможным всестороннее изучение электрических явлений на границах липид-раствор электролита традиционными и вновь создаваемыми электрохимическими методами. Перечисленные факты стимулировали образование нового раздела физической химии, которое принято называть биоэлектрохимией. По инициативе академика А.Н. Фрумкина и члена-корреспондента В.Г. Левича методики, ориентированные на использование липидных моделей биомембран, были сконцентрированы в рамках новых подразделений института электрохимии АН СССР, которые скоро привели к образованию лаборатории биоэлектрохимии. Следует отметить, что в известной степени развитие этого направления было начато еще в ранних работах академика А.Н. Фрумкина на монослойных системах в присутствии ряда жирных кислот [5, 6]. Эти работы предопределили его особый интерес к развитию электрохимических методов в приложении к биологическим объектам. Безусловно, идея организовать в рамках руководимого им института изучение физико-химических и электрических процессов в биологических мембранах, была весьма своевременной и, как оказалось, вполне плодотворной.
Сотрудники теоретической группы под руководством члена-корреспондента РАН Ю.А. Чизмаджева были нацелены на изучение механизмов функционирования ионных каналов и подвижных переносчиков с помощью математических моделей [7]. Ими было предложено решение задачи распространения нервного импульса по гладкому однородному волокну и разработаны теоретические модели возбуждения нейронных сетей [8]. В группе Л.И. Богуславского были обобщены экспериментальные подходы к изучению электрических явлений на границах раздела несмешивающихся жидкостей [9], каталитических процессов и механизмов заряжения таких границ, а также транспортных явлений в БЛМ [10–12]. Эти группы в 1977 году вошли в состав вновь образованной лаборатории биоэлектрохимии под руководством члена-корреспондента РАН Ю.А. Чизмаджева. Уже в ближайшие годы в лаборатории сложилась оригинальная научная школа, которая получила широкое международное признание.
Поры в биологических мембранах
Одна из первых научных задач, решенная в лаборатории теоретическими и экспериментальными методами, состояла в определении структурных изменений липидного бислоя под действием внешнего электрического поля. При определенных условиях это поле приводит к электрическому пробою липидного бислоя. Образованные при этом проводящие поры могут либо “залечиваться”, либо полностью разрушать мембраны, поскольку размеры пор и их дальнейшая “судьба” зависит от липидного состава мембран, линейного натяжения кромки поры и напряженности трансмембранного электрического поля [13, 14]. Полученные результаты внесли существенный вклад в развитие медицинских и биотехнологических приложений, а метод электропорации мембран в настоящее время является одним из основных в технологии генетической трансформации бактериальных клеток.
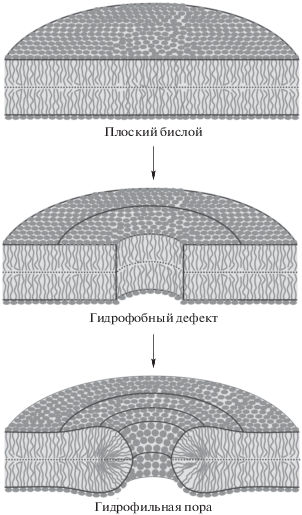
Детальное описание процесса порации липидных мембран было важной задачей, поставленной перед лабораторией практически с момента ее основания. В ранних работах поры рассматривались преимущественно феноменологически, как сквозные дефекты мембран, обладающие линейными размерами (“радиусом”) и характеризующиеся избыточной энергией липида на их кромке – так называемым, линейным натяжением [15, 16]. Однако попытки теоретически предсказать величину линейного натяжения оказывались безуспешными, поскольку расчетные величины практически всегда в несколько раз превышали измеряемые экспериментально [17]. В серии недавних работ сотрудниками лаборатории была впервые предложена непрерывная траектория образования сквозной поры: от невозмущенной мембраны, через гидрофобный дефект к гидрофильной поре [18–20] (рис. 1), количественно согласующаяся с экспериментальными данными и расчетами, проведенными методами молекулярной динамики.
Рис. 1.
Схема процесса формирования сквозной поры (внизу) из исходно плоского липидного бислоя (вверху) через гидрофобный дефект (посередине). Предполагается, что липиды в плоском бислое сдвигаются в радиальном направлении, образуя гидрофобный дефект. При достаточно большом радиусе дефекта липиды могут переориентироваться из исходного вертикального положения, характерного для плоского бислоя, в горизонтальное положение на кромке поры.
Были установлены возможные механизмы и предложены методы стабилизации мембран по отношению к формированию пор [21]. Кроме того, разработанная ранее теория упругости жидких кристаллов впервые обобщена на случай мембран, сформированных из так называемых болалипидов, т.е. липидов, в которых две полярные группы на противоположных сторонах липидной мембраны соединяются двумя углеводородными цепями [22]. Такие липиды встречаются в мембранах архей, обеспечивающих выживание этих организмов в экстремальных внешних условиях, и являются перспективным агентом для модификации и защиты поверхностей различных материалов.
Электростатика липидных мембран
Разработанная ранее теория подвижных переносчиков была распространена на случай Na+ и K+-каналов электровозбудимых клеточных мембран и активного транспорта в присутствии на поверхности БЛМ случай белка Na+, K+-АТФазы. Наиболее крупным достижением лаборатории в этом направлении явилась разработка оригинальных методов, основанных на явлении электрострикции липидных мембран. Российским ученым принадлежит приоритет в открытии важного свойства липидных мембран изменять удельную электрическую емкость под влиянием приложенного к ней внешнего электрического напряжения [23]. Наиболее вероятное объяснение этого явления состоит в способности мембран к изменению толщины их гидрофобной области [24]. В работах Р. Латорре [25] было показано, что это свойство дает возможность контролировать и измерять разность скачков потенциала на границах плоских БЛМ. Техническая реализация таких измерений разрабатывалась многими авторами [24, 26, 27], но наибольших успехов удалось достичь сотрудникам лаборатории. Ими был предложен потенциодинамический метод [28] и создан его более удобный вариант, метод компенсации внутримембранного поля (КВП) с применением второй гармоники емкостного тока мембран [29]. Основные принципы, примеры использования и интерпретации данных метода КВП подробно изложены в обзорах [30, 31]. Тем самым, была реализована возможность изучать адсорбцию заряженных частиц на поверхности липидных мембран, оценивая изменения граничного потенциала. Конечно потребовалось несколько лет напряженных исследований, чтобы доказать, что изменения потенциала на границах мембран, регистрируемые методом КВП, хорошо согласуются с известными в литературе сведениями об изменении поверхностного заряда при адсорбции большинства неорганических катионов, окружающих биомембраны. В конечном итоге удалось экспериментально доказать достаточно простую схему распределения электрического поля в липидных мембранах и их окрестности [31, 32] (рис. 2).
Рис. 2.
Распределение электрического поля в мембране при равенстве потенциалов в водных объемах с обеих сторон БЛМ (условие коротко замкнутой цепи). Полярная область мембраны заштрихована. Вертикальный пунктир указывает положение плоскости скольжения в пределах диффузной части электрического двойного слоя при электрокинетических измерениях. Внизу схематически показаны электрические емкости соответствующих областей.

Падение потенциала в диффузной части электрического двойного слоя, поверхностный потенциал, φs, отражает состояние ионизации полярных групп и их экранирование ионами электролита. Оценка этого потенциала проводится на основании электрокинетических измерений дзета-потенциала липосом. Работами С. Маклафлина [33] было убедительно доказано, что для количественного описания связи этого потенциала с составом электролита можно применять хорошо известную в электрохимии модель электрического двойного слоя Гуи-Чепмена, дополненную уравнением типа Ленгмюра. Как следует из проведенного нами анализа [34], параметры такой модели оказываются вполне достаточными и даже избыточными для количественного анализа большинства экспериментальных данных [35]. Применение метода КВП в сочетании с электрокинетическими измерениями в суспензиях липосом позволило установить, что адсорбция типичных для биологических систем катионов приводит, главным образом, к изменениям только поверхностного заряда и потенциала, если при этом учесть положение плоскости скольжения на расстоянии δ = 0.2 нм от условной границы мембраны [36]. Полученные экспериментально результаты удалось воспроизвести и при расчете поведения липидных бислоев в окружении водных растворов некоторых электролитов методами молекулярной динамики [37].
Метод КВП оказался весьма ценным для выявления тех мембранно-активных соединений, адсорбция которых сопряжена со структурными изменениями в мембране и проявляется в изменении дипольной компоненты граничного потенциала (φd на рис. 2). Это относится к многочисленным природным и синтетическим амфифильным соединениям, потенциал-чувствительным флуоресцентным зондам и некоторым многовалентным неорганическим катионам с высоким сродством к фосфолипидам. Все эти объекты используются в различных биомедицинских приложениях и детально исследуются на модельных мембранах физико-химическими методами, разработанными сотрудниками лаборатории.
Значительные успехи достигнуты в понимании структурных изменений мембран в присутствии катионов многовалентных металлов (лантаниды, бериллий) и природы их токсического действия [38, 39]. Опыты с механочувствительными каналами бактерий Escherichia Coli, встроенными в БЛМ, позволили установить блокирование этих каналов в присутствии катионов гадолиния, как следствие плотной упаковки липида вокруг белка [40]. Тем самым, удалось доказать важную роль липидного окружения в функционировании мембранных белков. Изменения дипольного потенциала при адсорбции наименьшего из двухвалентных катионов, бериллия, ясно указывает на аналогичные изменения в структуре липидного матрикса клеточных мембран, которые оказались важным фактором при искажении нормального процесса апоптоза. Согласно нашей гипотезе, эти искажения служат первым этапом серьезного заболевания – бериллиоза [41].
Более сложные процессы удается зарегистрировать при адсорбции на мембранах синтетических макромолекул и полипептидов. Первые эксперименты с макромолекулярными объектами были инициированы разработкой на их основе новых иммуностимуляторов [42], а также эффективных лекарственных и антибактериальных препаратов [43, 44]. К настоящему времени можно считать установленным, что крупные полипептиды на основе лизина (полилизины) и синтетические поликатионы сорбируются только на отрицательно заряженных мембранах, меняют знак поверхностного заряда и потенциала в микромолярной области концентраций [45, 46], а при заполнении поверхности способны группировать присутствующие в мембранах отрицательно заряженные фосфолипиды [47]. В настоящее время в лаборатории разрабатывается теоретическое описание этих явлений [48, 49]. Для уточнения особенностей структуры мембран в присутствии полипептидов оказалось полезным использовать рентгеноструктурные методы, в частности, регистрацию рассеяния рентгеновского излучения [50, 51]. Весьма существенную помощь в понимании молекулярных механизмов процессов, наблюдаемых в экспериментах с липидными мембранами, оказывают вычислительные методы молекулярной динамики [52]. С их помощью удалось связать обнаруженные в опыте электростатические изменения на границах мембран с состоянием гидратации полярных областей и перестройкой водородных связей на их поверхности. На рис. 3 приведен пример организации этих связей, инициированной адсорбированными молекулами лизина.
Рис. 3.
Структурные элементы в плотной части двойного электрического слоя по данным молекулярной динамики, показанные со стороны водной фазы. Пунктирами показаны связи, направленные к водной фазе; атомы, расположенные в глубине бислоя, показаны в светлом тоне. Молекулы лизина обведены тонкими линями. В многоугольники заключены функциональные гидрофильные группы двух соседних молекул диолеоилфосфатидилсерина.

Теория упругости жидких кристаллов в применении к топологическим перестройкам биологических мембран
Традиционными для лаборатории являются теоретические исследования, которые во многом определяют ее значительный авторитет в научном сообществе. В число классических работ современной биофизики вошли разработанные в лаборатории модели слияния и деления мембран. Центральная гипотеза, предложенная сотрудниками лаборатории и получившая затем экспериментальное подтверждение, состоит в том, что ключевой стадией процесса слияния является образование перемычки между взаимодействующими мембранами (сталка) [53]. Предложенный и теоретически обоснованный механизм их слияния получил широкое признание во всем мире [54]. Последующие исследования показали, что этот механизм работает и в случае вирус-индуцированного слияния, а также экзоцитоза [55].
Позднее была разработана модель полного процесса вирус-индуцированного слияния мембран [54, 56], а также построена непрерывная траектория процесса [57]. В рамках дальнейшей детализации были в явном виде учтены физико-химические свойства вирусных белков слияния, и показано, что слияние мембран может либо протекать полностью, с образованием поры слияния, либо останавливаться на “тупиковом” промежуточном состоянии [58]. Было показано, что упорядоченные липидные домены в мембране-мишени могут способствовать вирус-индуцированному слиянию [59].
Появившиеся в последние десятилетия методы исследования самоорганизации сложных липид-белковых структур в физиологических условиях на молекулярном уровне, такие, как методы атомно-силовой микроскопии и малоуглового рентгеновского рассеяния, позволили досконально изучить физико-химические механизмы самоорганизации каркаса оболочечных вирусов, к которым относятся такие опасные патогены, как ВИЧ, гепатит, герпес, грипп и др. Работы, проведенные сотрудниками лаборатории в этой области, показали, что модели адсорбции и взаимодействия частиц, активно используемые в физической химии и коллоидной химии, могут достаточно хорошо описывать самоорганизацию сложных белок-липидных наноструктур [60–63].
Международным коллективом авторов с участием сотрудников лаборатории биоэлектрохимии был установлен молекулярный механизм деления мембран специфическим белком, ГТФ-азой динамином, на финальной стадии процесса эндоцитоза. Было показано, что для эффективного деления достаточно всего двух-трех витков спирали динамина, причем гидролиз ГТФ приводит не к сжатию мембранного перешейка, соединяющего эндоцитозную везикулу с материнской мембраной, а, напротив, к деполимеризации спирали [64–66].
Значительная часть достижений коллектива лаборатории связана с исследованием липидных и липид-белковых доменов, образующихся в клеточных мембранах. Считается, что такие домены, называемые рафтами, играют важную роль в процессах передачи клеточных сигналов [67], эндоцитоза, вирус-индуцированного слияния мембран, и т.д. Предполагается, что рафты образуются в результате латерального фазового разделения, глобального или локального (т.е. индуцированного белками по механизму смачивания) [68]. В модельных системах были установлены основные свойства рафтов. Показано, что липид в них находится в жидко-упорядоченном состоянии, и за счет этого толщина рафтов превышает толщину окружающей мембраны. Кроме того, в биологических мембранах рафты практически всегда оказываются бислойными. Сотрудниками лаборатории было теоретически показано, что за счет большей изгибной жесткости упорядоченных липидных монослоев в доменах подавляются нормальные тепловые флуктуации формы мембраны. Монослойные домены предпочитают распределяться в менее изогнутые области мембраны. Это обеспечивает сопряжение больших монослойных доменов в бислойные рафты [69, 70]. Кроме того, было показано, что граница рафта с окружающей мембраной имеет нетривиальную структуру, энергетика которой обеспечивает сопряжение малых (наноскопических) монослойных упорядоченных доменов в бислойные рафты [71, 72]. Специфическая структура границы приводит к тому, что любые мембранные компоненты, обладающие спонтанной кривизной (или неламеллярной молекулярной геометрией), преимущественно распределяются на границу рафтов и понижают межфазную энергию, т.е. обладают линейной активностью, по аналогии с действием поверхностно-активных веществ. Таким образом, был установлен механизм и указан универсальный критерий линейной активности мембранных компонентов [73, 74]. Кроме того, было показано, что взаимодействие доменов определяется, прежде всего, спонтанной кривизной монослоев сосуществующих фаз. При синдроме Смита-Лемли-Опитца происходит замена холестерина на его метаболический предшественник 7-дегидрохолестерин, обладающий большей спонтанной кривизной. В результате такой замены рафты при столкновениях перестают сливаться: круглые домены “слипаются” в протяженные агрегаты, которые совместно движутся по мембране, не сливаясь и не разделяясь. Такое изменение динамики полностью объясняется теоретической моделью, разработанной сотрудниками лаборатории [75, 76].
Список литературы
Hodgkin A.L., Huxley A.F. // J. Physiol. 1952. V. 117. № 4. P. 500.
Mitchell P. // Nature. 1961. V. 1991. P. 144.
Montal M., Mueller P. // Proc. Natl. Acad. Sci. U.S.A. 1972. V. 69. № 12. P. 3561.
Mueller P., Rudin D.O., Tien H.T., Wescott W.C. // J. Phys. Chem. 1963. V. 67. P. 534.
Фрумкин А.Н. // 1924. In: Сбоpник pабот по чистой и пpикладной химии / Ed. А.Н. Бах. Петpогpад: Химический институт им. Л.Я. Карпова. С. 3.
Фрумкин А.Н. // 1925. In: Сбоpник pабот по чистой и пpикладной химии / Ed. А.Н. Бах. Петpогpад: Химический институт им. Л.Я. Карпова. С. 75.
Маркин В.С., Чизмаджев Ю.А. // Индуцированный ионный транспорт. М.: Наука, 1974. С. 252.
Маркин В.С., Пастушенко В.Ф., Чизмаджев Ю.А. // Теория возбудимых сред. М.: Наука, 1981. С. 276.
Богуславский Л.И. // Биоэлектрохимические явления и граница раздела фаз. М.: Наука, 1978. С. 360.
Богуславский Л.И., Волков А.Г., Канделаки М.Д. и др. // Биофизика.1977. Т. 22. С. 223.
Boguslavsky L.I., Kondrashin A.A., Kozlov I.A. et al. // FEBS Lett. 1975. V. 50. № 2. P. 223.
Markin V.S., Sokolov V.S., Bogulavsky L.I. et al. // J. Membr. Biol. 1975. V. 25. № 1–2. P. 23.
Пастушенко В.Ф., Чизмаджев Ю.А. // Биофизика. 1982. Т. 27. С. 475.
Chernomordik L.V., Sukharev S.I., Popov S.V. et al. // Biochim. Biophys. Acta. 1987. V. 902. № 3. P. 360.
Abidor I.G., Arakelyan V.B., Chernomordik L.V. et al. // Bioelectrochemistry and Bioenergetics. 1979. V. 6. P. 37.
Pastushenko V.F., Chizmadzhev Y.A., Arakelyan V.B. // Bioelectrochemistry and Bioenergetics. 1979. V. 6. P. 53.
Молотковский Р., Акимов С.А. // Биол. мембраны. 2009. Т. 26. С. 149.
Akimov S.A., Volynsky P.E., Galimzyanov T.R. et al. // Sci. Rep. 2017. V. 7. № 1. P. 12509.
Akimov S.A., Volynsky P.E., Galimzyanov T.R. et al. // Sci. Rep. 2017. V. 7. № 1. P. 12152.
Акимов С.А., Александрова В.В., Галимзянов Т.Р. и др. // Биол. мембраны. 2017. Т. 34. С. 270.
Панов П.В., Акимов С.А., Батищев О.В. // Там же. 2014. Т. 31. С. 331.
Galimzyanov T.R., Kuzmin P.I., Pohl P. et al. // Soft Matter.2016. V. 12. № 8. P. 2357.
Babakov A.V., Ermishkin L.N., Liberman E.A. // Nature.1966. V. 210. № 5039. P. 953.
Пасечник В.И. // Биофизика мембран. Москва: ВИНИТИ, 1981. С. 267.
Alvares O., Latorre R. // Biophys. J. 1978. V. 21. P. 1.
Carius W. // Ber. Bunsen-ges. Phys.Chem. 1979. V. 83. P. 905.
Wobschall D. // J. Colloid Interface Sci. 1972. V. 40. № 3. P. 417.
Абидор И.Г., Айтьян С.Х., Черный В.В. и др. // Докл. АН СССР.1979. Т. 245. С. 977.
Соколов В.С., Кузьмин С.Г. // Биофизика. 1980. Т. 25. С. 170.
Sokolov V.S., Mirsky V.M. // Ultrathin Electrochemical Chemo- and Biosensors: Technology and Performance / Ed. V.M.Mirsky. Heidelberg: Springer-Verlag, 2004. P. 255.
Ermakov Yu.A., Sokolov V.S. // PLANAR LIPID BILAYERS (Blms) AND THEIR APPLICATIONS / Ed. H.T. Tien, A. Ottova. Amsterdam: Elsevier, 2003. P. 109.
Ермаков Ю.А. // Росс. хим. журн. 2005. Т. 49. № 5. С. 114.
McLaughlin S. // Annu. Rev. Biophys Biophys Chem. 1989. V. 18. P. 113.
Ермаков Ю.А. // Коллоидн. журнал. 2000. Т. 6. № 4. С. 437.
Ermakov Yu.A. // Biochim. Biophys. Acta. 1990. V. 1023. № 1. P. 91.
Ермаков Ю.А., Черный В.В., Соколов В.С. // Биол. мембраны. 1992. Т. 9. С. 201.
Нестеренко А.М., Ермаков Ю.А. // Там же. 2012. Т. 29. № 5. С. 374.
Ermakov Y.A., Makhmudova S.S., Averbakh A.Z. // Colloids and Surfaces A-Physicochemical and Engineering Aspects.1998. V. 140. № 1–3. P. 13.
Ermakov Y.A., Averbakh A.Z., Yusipovich A.I. et al. // Biophys J. 2001. V. 80. № 4. P. 1851.
Ermakov Y.A., Kamaraju K., Sengupta K. et al. // Ibid. 2010. V. 98. № 6. P. 1018.
Ermakov Yu., Kamaraju K., Dunina-Barkovskaya A., et al. // Biochemistry. 2017. V. 56. P. 5457.
Февралева И.С., Ермаков Ю.А., Атаулаханов Р.И. // Иммунология.1986. Т. 1. С. 66.
Timofeeva L.M., Kleshcheva N.A., Shleeva M.O. et al. // Appl. Microbiol. Biotechnol. 2015. V. 99. № 6. P. 2557.
Pashkovskaya A.A., Lukashev E.P., Antonov P.E. et al. // Biochim. Biophys Acta. 2006. V. 1758. № 10. P. 1685.
Финогенова О.А., Батищев О.В., Инденбом А.В. и др. // Биол. мембраны. 2009. Т. 26. № 5. С. 429.
Marukovich N., McMurray M., Finogenova O. et al. // Advances in Planar Lipid Bilayers and Liposomes. A Tribute to Marin D. Mitov / Eds. A.Iglic, J.Genova. Amsterdam, London, San Diego: Elsevier, Academic press, 2013. P. 139.
Ярославов А.А., Ефимова А.А., Лобышев В.И. и др. // Биол. мембраны. 1996. Т. 13. № 6. С. 628.
Воротынцев М.А., Ермаков Ю.А., Маркин В.С. и др. // Электрохимия. 1993. Т. 29. С. 596.
Молотковский Р.Ю., Галимзянов Т.Р., Ермаков Ю.А. // Коллоидн. журнал. 2019. Т. 81. № 2. С. 190.
Ермаков Ю.А., Асадчиков В.Е., Волков Ю.О. и др. // Письма в ЖЭТФ. 2019. Т. 109. № 5. С. 340.
Тихонов А.М., Асадчиков В.Е., Волков Ю.О. и др. // ЖЭТФ. 2017. Т. 152. № 6 (12). С. 1233.
Марукович Н.И., Нестеренко А.М., Ермаков Ю.А. // Биол. мембраны. 2014. Т. 31. № 6. С. 401.
Маркин В.С., Козлов М.М. // Биофизика. 1983. Т. 28. С. 72.
Kuzmin P.I., Zimmerberg J., Chizmadzhev Yu. et al. // PNAS. 2001. V. 98. P. 7235.
Markin V.S., Kozlov M.M., Borovjagin V.L. // Gen. Physiol. Biophys. 1984. V. 5. P. 361.
Акимов С.А., Кузьмин П.И., Чизмаджев Ю.А. // Биол. мембраны. 2002. Т. 19. С. 264.
Акимов С.А., Молотковский Р.Ю., Галимзянов Т.Р. и др. // Там же. 2014. Т. 31. С. 14.
Molotkovsky R.J., Galimzyanov T.R., Jimenez-Munguia I. et al. // Int. J. Mol. Sci. 2017. V. 18. № 12. P. 2598.
Molotkovsky R.J., Alexandrova V.V., Galimzyanov T.R. et al. // Ibid. 2018. V.19. № 5. P. 1483.
Batishchev O.V., Shilova L.A., Kachala M.V. et al. // J. Virol. 2016. V. 90. P. 575.
Shtykova E.V., Baratova L.A., Fedorova N.V. et al. // PLoS.One. 2013. V. 8. e82431.
Shtykova E.V., Dadinova L.A., Fedorova N.V. et al. // Sci. Rep. 2017. V. 7. P. 16793.
Shtykova E.V., Petoukhov M.V., Dadinova L.A. et al. // J. Virol. 2019. V. 93. P. e01450-18.
Bashkirov P.V., Akimov S.A., Evseev A.I. et al. // Cell. 2008. V. 135. № 7. P.1276.
Frolov V.A., Escalada A., Akimov S.A. et al. // Chem. Phys Lipids. 2015. V. 185. P. 129.
Shnyrova A.V., Bashkirov P.V., Akimov S.A. et al. // Science. 2013. V. 339. № 6126. P. 1433.
Bocharov E.V., Mineev K.S., Pavlov K.V. et al. // Biochim. Biophys Acta Biomembr. 2017. V. 1859. № 4. P. 561.
Akimov S.A., Frolov V.A., Kuzmin P.I. et al. // Phys Rev. E. Stat. Nonlin. Soft Matter Phys. 2008. V. 77. № 5. Pt. 1. P. 051901.
Galimzyanov T.R., Kuzmin P.I., Pohl P. et al. // Biophys J. 2017. V. 112. P. 339.
Галимзянов Т.Р., Калуцкий М.А., Кондрашов О.В. и др. // Биол. мембраны. 2019. Т. 36. С. 184.
Galimzyanov T.R., Molotkovsky R.J., Bozdaganyan M.E. et al. // Phys. Rev. Lett. 2015. V. 115. № 8. P. 088101.
Галимзянов Т.Р., Молотковский Р.Ю., Кузьмин П.И. и др. // Биол. мембраны. 2011. Т. 28. № 4. С. 307.
Akimov S.A., Hlaponim E.A., Bashkirov P.V. et al. // Биол. мембраны. 2009. Т. 26. № 3. С. 234.
Galimzyanov T.R., Lyushnyak A.S., Aleksandrova V.V. et al. // Langmuir. 2017. V. 33. № 14. P. 3517.
Staneva G., Osipenko D.S., Galimzyanov T.R. et al. // Langmuir. 2016. V. 32. № 6. P. 1591.
Galimzyanov T.R., Molotkovsky R.J., Kheyfets B.B. et al. // JETP Letters. 2013. V. 96. P. 681.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии


