Журнал физической химии, 2020, T. 94, № 3, стр. 431-435
Физико-химический анализ систем, содержащих алканы и циклододекан
А. А. Шамитов a, *, И. К. Гаркушин a, А. В. Колядо a
a Самарский государственный технический университет
Самара, Россия
* E-mail: Sansher@mail.ru
Поступила в редакцию 06.04.2019
После доработки 04.06.2019
Принята к публикации 09.07.2019
Аннотация
Трехкомпонентные системы с участием циклододекана и н-алканов исследованы методом дифференциального термического анализа (ДТА) на установке дифференциального сканирующего микрокалориметра (ДСК). Сделан вывод, что экспериментально исследованные 13 трехкомпонентных систем ряда н-CnH2n + 2–C12Н24–н-CmH2m + 2 (n, m = 2k, k = 5, …, 12), характеризуются образованием тройных эвтектик, большинство систем удовлетворительно согласуются с ранее предложенными и разработанными методами по прогнозированию систем.
В настоящее время актуальна разработка новых алгоритмов и методов моделирования фазовой диаграммы, а также ее отдельных элементов, отвечающих моновариантным и нонвариантным равновесиям в системе [1–11]. Современный подход к разработке новых составов для тепловых аккумуляторов невозможно представить без исследования фазовых равновесий в многокомпонентной системе. Для этого необходимо подобрать теплоаккумулирующий материал, обладающий работоспособностью в определенном узком диапазоне температур. Для тепловых аккумуляторов в качестве рабочего тела могут служить сплавы эвтектического состава в трехкомпонентных системах на основе углеводородов циклического строения и алканов нормального строения. Другое направление промышленного использования инвариантных составов на основе углеводородов (в том числе и циклододекана), состоящих из двух-, трех- и более компонентов, – создание теплоносителей с низким давлением насыщенных паров компонентов и температурой вспышки в закрытом тигле более 61°С [12–16].
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
В качестве объектов исследования для поиска новых теплоносителей выбраны системы ряда н-CnH2n + 2–C12Н24–н-CmH2m + 2 (n, m = 2k, k = 5, …, 12). Предварительный расчет фазовых диаграмм двух- и трехкомпонентных систем осуществлялся с использованием уравнения Вильсона, в котором с целью уменьшения отклонения расчетных данных от эксперимента дополнительно в систему уравнений были введены коэффициенты активности компонентов. Основная идея ее состоит в том, что вследствие различия в межмолекулярных взаимодействиях локальный состав вблизи конкретной молекулы в растворе будет отличаться от состава жидкости. Для бинарной пары два параметра (Λij, Λji) связаны со степенью, в которой каждая молекула влияет на состав своего локального окружения [17]. Зависимость коэффициентов активности определяется в системах по уравнениям:
(1)
$\ln {{\gamma }_{i}} = \frac{{{{\Delta }_{m}}{{H}_{i}}}}{R}\left( {\frac{1}{{{{T}_{i}}}} - \frac{1}{{{{T}_{e}}}}} \right) - \ln {{x}_{i}},$(2)
$\begin{gathered} \ln {{\gamma }_{i}} = - \ln ({{x}_{i}} + {{\Lambda }_{{ij}}}{{x}_{j}}) + \\ + \;{{x}_{j}}\left( {\frac{{{{\Lambda }_{{ij}}}}}{{{{x}_{i}} + {{\Lambda }_{{ij}}}{{x}_{j}}}} - \frac{{{{\Lambda }_{{ji}}}}}{{{{x}_{j}} + {{\Lambda }_{{ji}}}{{x}_{i}}}}} \right), \\ \end{gathered} $Параметры взаимодействия Λ12, Λ21 (табл. 1) определяли по данным о взаимной растворимости компонентов путем решения системы, составленной из системы уравнений (1)–(2):
(3)
$\left\{ \begin{gathered} \frac{{{{\Delta }_{m}}{{H}_{1}}}}{R}\left( {\frac{1}{{{{T}_{1}}}} - \frac{1}{{{{T}_{e}}}}} \right) - \ln {{x}_{1}} = - \ln ({{x}_{1}} + {{\Lambda }_{{12}}}{{x}_{2}}) + \hfill \\ + \;{{x}_{2}}\left( {\frac{{{{\Lambda }_{{12}}}}}{{{{x}_{1}} + {{\Lambda }_{{12}}}{{x}_{2}}}} - \frac{{{{\Lambda }_{{21}}}}}{{{{x}_{2}} + {{\Lambda }_{{21}}}{{x}_{1}}}}} \right), \hfill \\ \frac{{{{\Delta }_{m}}{{H}_{2}}}}{R}\left( {\frac{1}{{{{T}_{2}}}} - \frac{1}{{{{T}_{e}}}}} \right) - \ln {{x}_{2}} = - \ln ({{x}_{2}} + {{\Lambda }_{{21}}}{{x}_{1}}) + \hfill \\ + \;{{x}_{1}}\left( {\frac{{{{\Lambda }_{{12}}}}}{{{{x}_{1}} + {{\Lambda }_{{12}}}{{x}_{2}}}} - \frac{{{{\Lambda }_{{21}}}}}{{{{x}_{2}} + {{\Lambda }_{{21}}}{{x}_{1}}}}} \right). \hfill \\ \end{gathered} \right.$Таблица 1.
Расчетные значения параметров взаимодействия Λ12, Λ21 (первого со вторым и второго с первым) для компонентов 1 и 2 эвтектик двойных систем
| 1 | 2 | Λ12 | Λ21 | 1 | 2 | Λ12 | Λ21 |
|---|---|---|---|---|---|---|---|
| н-С10Н22 | н-С20Н42 | 3.4475 | 0.0027 | н-С16Н34 | н-С22Н46 | 3.4475 | 0.0027 |
| н-С10Н22 | н-С22Н46 | 3.4475 | 0.0027 | н-С16Н34 | н-С24Н50 | 3.4475 | 0.0027 |
| н-С12Н26 | н-С18Н38 | 3.4475 | 0.0027 | н-С14Н30 | С12Н24 | 0.3522 | 0.3991 |
| н-С12Н26 | н-С20Н42 | 3.4475 | 0.0027 | н-С20Н42 | С12Н24 | 0.8311 | 0.2455 |
| н-С12Н26 | н-С22Н46 | 3.4475 | 0.0027 | н-С22Н46 | С12Н24 | 1.1065 | 0.2087 |
| н-С14Н30 | н-С20Н42 | 3.4475 | 0.0027 | н-С24Н50 | С12Н24 | 1.4731 | 0.1775 |
| н-С14Н30 | н-С22Н46 | 3.4475 | 0.0027 | ||||
| н-С14Н30 | н-С24Н50 | 3.4475 | 0.0027 |
Для трехкомпонентной системы расчетные уравнения примут вид:
(4)
$\begin{gathered} \ln {{\gamma }_{i}} = 1 - \ln [{{x}_{i}} + {{x}_{j}}{{\Lambda }_{{ij}}} + {{x}_{k}}{{\Lambda }_{{ik}}}] - \\ - \;\frac{{{{x}_{i}}}}{{{{x}_{i}} + {{x}_{j}}{{\Lambda }_{{ij}}} + {{x}_{k}}{{\Lambda }_{{ik}}}}} - \\ - \;\frac{{{{x}_{j}}{{\Lambda }_{{ji}}}}}{{{{x}_{i}}{{\Lambda }_{{ji}}} + {{x}_{j}} + {{x}_{k}}{{\Lambda }_{{jk}}}}} - \frac{{{{x}_{k}}{{\Lambda }_{{ki}}}}}{{{{x}_{i}}{{\Lambda }_{{ki}}} + {{x}_{j}}{{\Lambda }_{{kj}}} + {{x}_{k}}}}, \\ \end{gathered} $(5)
$T = {{\left[ {\frac{1}{{{{T}_{i}}}} - \frac{R}{{{{\Delta }_{m}}{{H}_{i}}}}(\ln {{x}_{i}} + \ln {{\gamma }_{i}})} \right]}^{{ - 1}}}.$(6)
$\left\{ {\begin{array}{*{20}{l}} {T = {{{\left[ {\frac{1}{{{{T}_{i}}}} - \frac{R}{{{{\Delta }_{m}}{{H}_{i}}}}\left( {\ln {{x}_{i}} + \ln {{\gamma }_{i}}} \right)} \right]}}^{{ - 1}}},} \\ {T = {{{\left[ {\frac{1}{{{{T}_{j}}}} - \frac{R}{{{{\Delta }_{m}}{{H}_{j}}}}\left( {\ln {{x}_{j}} + \ln {{\gamma }_{j}}} \right)} \right]}}^{{ - 1}}},} \\ {T = {{{\left[ {\frac{1}{{{{T}_{k}}}} - \frac{R}{{{{\Delta }_{m}}{{H}_{k}}}}\left( {\ln {{x}_{k}} + \ln {{\gamma }_{k}}} \right)} \right]}}^{{ - 1}}},} \\ {{{x}_{i}} + {{x}_{j}} + {{x}_{k}} = 1.} \end{array}} \right.$Данные по температурам и энтальпиям плавления индивидуальных компонентов взяты из литературы [18]. Исходя из элементов огранения – эвтектических двухкомпонентных систем, можно заключить, что системы ряда н-CnH2n + 2–C12Н24–н-CmH2m + 2 (n, m = 2k, k = 5, …, 12), относятся к системам эвтектического типа. Расчет по уравнению Вильсона позволил определить температуры плавления и составы тройных эвтектик E, которые приведены в табл. 2.
Таблица 2.
Характеристики сплава эвтектического состава, рассчитанные с использованием уравнения Вильсона
| Система | Содержание компонентов, мас. % | Тпл, K | Источник | ||
|---|---|---|---|---|---|
| 1 | 2 | 3 | |||
| н-С10Н22–С12Н24–н-С16Н34 | 84.2 | 11.6 | 4.2 | 241.5 | [23] |
| н-С10Н22–С12Н24–н-С18Н38 | 86.7 | 13.1 | 0.2 | 241.5 | [25] |
| н-С10Н22–С12Н24–н-С20Н42 | 87.0 | 12.9 | 0.1 | 241.6 | [21] |
| н-С10Н22–С12Н24–н-С22Н46 | 86.8 | 13.1 | 0.1 | 241.6 | [22] |
| н-С12Н26–С12Н24–н-С16Н34 | 69.9 | 19.1 | 11.0 | 259.8 | [24] |
| н-С12Н26–С12Н24–н-С18Н38 | 82.0 | 16.8 | 1.2 | 261.0 | [29] |
| н-С12Н26–С12Н24–н-С20Н42 | 79.6 | 17.4 | 3.0 | 261.0 | * |
| н-С12Н26–С12Н24–н-С22Н46 | 75.5 | 18.5 | 6.0 | 261.0 | [30] |
| н-С14Н30–С12Н24–н-С20Н42 | 65.4 | 24.2 | 10.4 | 274.0 | [28] |
| н-С14Н30–С12Н24–н-С22Н46 | 61.6 | 24.4 | 14.0 | 274.4 | [27] |
| н-С14Н30–С12Н24–н-С24Н50 | 75.9 | 21.9 | 2.2 | 276.1 | [26] |
| н-С16Н34–С12Н24–н-С22Н46 | 46.5 | 32.8 | 20.7 | 283.9 | * |
| н-С16Н34–С12Н24–н-С24Н50 | 61.9 | 32.4 | 5.6 | 287.1 | * |
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Экспериментальные исследования фазовых превращений в системах ряда н-CnH2n + 2–C12Н24–н-CmH2m + 2 (n, m = 2k, k = 5, …, 12) [19] проводили на установке дифференциального термического анализа. Основным инструментальным методом исследования служил дифференциальный сканирующий микрокалориметр (ДСК-500С), на котором снимали кривые нагревания и охлаждения образцов [19]. Съемку кривых нагрева (охлаждения) проводили 3 раза. Скорость нагрева 4 К/мин обеспечивала четкое разделение пиков для образцов с массой навески 15–20 мг. Хладагент – твердый СО2. Для исследований использовали вещества заводского изготовления квалификаций “ч”, “х.ч.” и “ч.д.а.” Составы готовили взвешиванием на аналитических весах CAS марки CAUW 120D специального класса точности по ГОСТ Р 53228-2008, масса приготовленных смесей составляла от 1.0 до 8.0 г, точность взвешивания ±0.0001 г. Составы всех смесей на диаграммах, исследованных экспериментально, выражены в мас. %, температура – в °С.
С учетом координат эвтектик двойных систем, системы ряда н-CnH2n + 2–C12Н24–н-CmH2m + 2 (n, m = 2k, k = 5, …, 12), относятся к системам эвтектического типа.
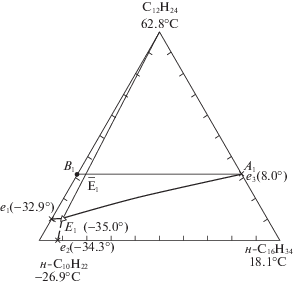
Системы исследовались проекционно-термографическим методом (ПТГМ) [20]. Согласно правилам ПТГМ для исследования каждой системы был выбран политермический разрез А [% н-CnH2n + 2– % C12Н24] – В [% н-CmH2m + 2 – % C12Н24], расположенный в поле кристаллизации циклододекана [21, 22]. Из Т–х-диаграммы политермического разреза АВ определено соотношение алканов в эвтектике, точка $\bar {E}$ на разрезе АВ и температура плавления тройной эвтектики Е [23]. Исследование политермического разреза С12Н24 → → $\bar {E}$ → E, исходящего из циклододекана и проходящего через найденное направление $\bar {E}$ на эвтектику Е, позволило определить ее состав. Данные по всем системам представлены в табл. 3. На фазовом комплексе систем н-CnH2n + 2– C12Н24–н-CmH2m + 2 (n, m = 2k, k = 5, …, 12), расположены три поля кристаллизации: н-CnH2n + 2, н-CmH2m + 2 и циклододекана [24, 25].
Таблица 3.
Температуры плавления (Те) и составы эвтектических сплавов (xi, мас. %), выявленных экспериментальным методом
| Система | x1 | x2 | x3 | Те, К | Источник |
|---|---|---|---|---|---|
| н-С10Н22–С12Н24–н-С16Н34 | 85.0 | 11.0 | 4.0 | 238.2 | [23] |
| н-С10Н22–С12Н24–н-С18Н38 | 84.5 | 10.0 | 5.5 | 238.2 | [25] |
| н-С10Н22–С12Н24–н-С20Н42 | 89.2 | 8.0 | 2.8 | 239.4 | [21] |
| н-С10Н22–С12Н24–н-С22Н46 | 86.5 | 10.0 | 3.5 | 239.7 | [22] |
| н-С12Н26–С12Н24–н-С16Н34 | 73.0 | 18.0 | 9.0 | 255.5 | [24] |
| н-С12Н26–С12Н24–н-С18Н38 | 80.0 | 19.0 | 1.0 | 256.6 | [29] |
| н-С12Н26–С12Н24–н-С20Н42 | 83.0 | 14.0 | 3.0 | 256.8 | * |
| н-С12Н26–С12Н24–н-С22Н46 | 82.0 | 15.0 | 3.0 | 257.0 | [30] |
| н-С14Н30–С12Н24–н-С20Н42 | 68.0 | 29.7 | 2.3 | 270.3 | [28] |
| н-С14Н30–С12Н24–н-С22Н46 | 65.0 | 33.8 | 1.2 | 270.9 | [27] |
| н-С14Н30–С12Н24–н-С24Н50 | 65.0 | 33.0 | 2.0 | 274.0 | [26] |
| н-С16Н34–С12Н24–н-С22Н46 | 65.0 | 28.5 | 6.5 | 280.5 | * |
| н-С16Н34–С12Н24–н-С24Н50 | 62.0 | 34.0 | 4.0 | 280.6 | * |
На рис. 1 и 2 представлены проекции некоторых фазовых комплексов системы н-CnH2n + 2–C12Н24–н-CmH2m + 2 (n, m = 2k, k = 5, …, 12) с данными по элементам огранения.
Полученные данные в процессе эксперимента по температурам плавления и составам двойных и тройных эвтектик позволяют определить коэффициенты активности компонентов в эвтектиках по уравнению:
(7)
$\ln {{\gamma }_{i}} = \frac{{{{\Delta }_{m}}{{H}_{i}}}}{R}\left( {\frac{1}{{{{T}_{i}}}} - \frac{1}{{{{T}_{e}}}}} \right) - \ln {{x}_{i}},$Результаты расчета по коэффициентам активности трехкомпонентной системы приведены в табл. 4.
Таблица 4.
Данные по коэффициентам активности компонентов 1–3 в сплавах эвтектических составов
| 1 | 2 | 3 | Те, K | γ1 | γ2 | γ3 |
|---|---|---|---|---|---|---|
| н-С14Н30 | С12Н24 | – | 275.7 | 0.06 | 1.19 | |
| н-С20Н42 | С12Н24 | – | 303.2 | 0.001 | 1.27 | |
| н-С22Н46 | С12Н24 | – | 305.1 | 0.004 | 1.11 | |
| н-С24Н50 | С12Н24 | – | 310.2 | 0.00003 | 1.18 | |
| н-С10Н22 | н-С20Н42 | С12Н24 | 239.4 | 0.86 | 0.01 | 3.62 |
| н-С10Н22 | н-С22Н46 | С12Н24 | 239.7 | 0.90 | 0.03 | 2.94 |
| н-С12Н26 | н-С18Н38 | С12Н24 | 256.6 | 0.21 | 0.10 | 1.75 |
| н-С12Н26 | н-С20Н42 | С12Н24 | 256.8 | 0.21 | 0.02 | 2.42 |
| н-С12Н26 | н-С22Н46 | С12Н24 | 257.0 | 0.21 | 0.04 | 2.27 |
| н-С14Н30 | н-С20Н42 | С12Н24 | 270.3 | 0.05 | 0.02 | 1.26 |
| н-С14Н30 | н-С22Н46 | С12Н24 | 270.9 | 0.06 | 0.11 | 1.10 |
| н-С14Н30 | н-С24Н50 | С12Н24 | 274.0 | 0.06 | 0.0004 | 1.13 |
| н-С16Н34 | н-С22Н46 | С12Н24 | 280.5 | 0.01 | 0.02 | 1.48 |
| н-С16Н34 | н-С24Н50 | С12Н24 | 280.6 | 0.01 | 0.0002 | 1.21 |
Как видно из табл. 4, коэффициенты активности отличается от 1. Следовательно, системы не являются идеальными.
Таким образом, системы н-CnH2n + 2–C12Н24–н-CmH2m + 2 (n, m = 2k, k = 5, …, 12) относятся к системам эвтектического типа. Сплавы эвтектических составов могут быть использованы в качестве рабочего тела низкотемпературных аккумуляторов тепла или в качестве среднетемпературных теплоносителей в гелиоэнергетических установках с температурой эксплуатации от 5 до 240°С. Все рассматриваемые системы имеют отклонение от идеальности, поэтому необходимо учитывать коэффициент активности компонентов системы при расчете параметров эвтектики.
Список литературы
Ten Y.S., Rangaiah G.P. // Chem. Eng. Res. and Design. 2002. V. 80. Part A. P. 745.
Goff M.J., Suppes G.J., Dasari M.A. // Fluid Phase Equilib. 2005. V. 238. P. 149.
Allal F., Dahmani A. // Ibid. 2001. V. 190. P. 33.
Abildskov J., Gani R., Rasmussen P., O’Connell J.P. // Ibid.2001. V. 181. P. 163.
Kuramochi H., Maeda K., Kato S. et al. // Fuel. 2009. V. 88. P. 1472.
Domanska U., Gloskowska M. // Fluid Phase Equilib. 2004. V. 216. P. 135.
Santiago R.S., Aznar M. // Ibid. 2011. V. 303. P. 111.
Espada J.J., Coto B., Pena J.L. // Ibid. 2007. V. 259. P. 201.
Nebig S., Gmehling J. // Ibid. 2010. V. 294. P. 206.
Гаркушин И.К., Агафонов И.А., Копнина А.Ю., Калинина И.П. Фазовые равновесия с участием н-алканов, циклоалканов и аренов . Екатеринбург: УрО РАН, 2006. 127с. ISBN 5-7691-1697-8.
Копнина А.Ю., Агафонов И.А., Гаркушин И.К. // Изв. вузов. Химия и хим. технология. 2001. Т. 44. Вып. 5. С. 84.
Котельников Е.Н., Филатов С.К. Кристаллохимия парафинов // СПб.: Изд-во “Журнал Нева”. 2002. 352 с.
Гаркушин И.К., Люстрицкая Д.В., Мощенский Ю.В. Теплоаккумулирующий состав / Пат. РФ 2357995. 2009.
Данилин В.Н., Железняк А.В., Марцинковский А.В., Долесов А.Г., Доценко С.П. Фазопереходный теплоаккумулирующий состав / Пат. РФ 2282652. 2006.
Гаркушин И.К., Калинина И.П., Копнина А.Ю. Теплоаккумулирующее вещество / Пат. РФ 2280668. 2006.
Гаркушин И.К., Калинина И.П., Копнина А.Ю. Теплоноситель / Пат. РФ 2243249. 2004.
Рид Р., Шервуд Т. Свойства газов и жидкостей. Л.: Химия, 1971. 704 с.
Татевский В.М. Физико-химические свойства углеводородов. М.: Гостоптехиздат, 1960. 412 с.
Мощенский Ю.В. Микрокалориметр ДСК: Метод. указ. к лаб. работе. Самара: Самар. гос. техн. ун-т, 2004. 19 с.
Космынин А.С., Трунин А.С. // Тр. Самарской научной школы по физ.-хим. анализу многокомпонентных систем. Т. 9 . Самара: Самар. гос. техн. ун-т, 2006. 183 с.
Гаркушин И.К., Колядо А.В., Шамитов А.А. // Журн. физ. химии. 2016. Т. 90. № 5. С. 815.
Шамитов А.А., Гаркушин И.К., Колядо А.В. // Там же. 2016. Т. 90. № 7. С. 1124.
Шамитов А.А., Гаркушин И.К., Колядо А.В., Петров Е.П. // Там же. 2018. Т. 92. № 2. С. 282.
Шамитов А.А., Гаркушин И.К., Колядо А.В., Петров Е.П. // Там же. 2018. Т. 92. № 3. С. 370.
Шамитов А.А., Гаркушин И.К., Колядо А.В., Петров Е.П. // Там же. 2018. Т. 92. № 9. С. 1421.
Шамитов А.А., Колядо А.В., Гаркушин И.К. // Там же. 2015. Т. 89. № 10. С. 1598.
Шамитов А.А., Колядо А.В., Гаркушин И.К., Журавлев И.А. // Башкирский хим. журн. 2015. Т. 22. № 4. С. 3.
Шамитов А.А., Колядо А.В., Гаркушин И.К., Журавлев И.А. Использование метода // Вестн. СамГТУ. Сер. Техн. науки. 2015. № 1 (45). С. 189.
Шамитов А.А., Колядо А.В., Гаркушин И.К. // Теоретическая и экспериментальная химия жидкофазных систем. Крестовские чтения. 2015. С. 39.
Шамитов А.А., Колядо А.В., Гаркушин И.К. // Матер. IV Межд. конф. “Возобновляемая энергетика: проблемы и переспективы”. Махачкала, 2015. Т. 2. С. 342.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии