Журнал физической химии, 2020, T. 94, № 4, стр. 545-549
Гидрогенизация замещенных бензолов, содержащих нитро- и азогруппы на скелетном никеле в водных растворах 2-пропанола
О. В. Лефедова a, *, Хоанг Ань a, А. В. Белова a, М. П. Немцева a
a Ивановский государственный химико-технологический университет
Иваново, Россия
* E-mail: physchem.606@yandex.ru
Поступила в редакцию 19.04.2019
После доработки 19.04.2019
Принята к публикации 14.05.2019
Аннотация
Проанализированы кинетические характеристики гидрогенизации 4-нитро- и 2-нитро-2'-гидрокси-5'-метилазобензолов, а также 4-нитроанилина и 4-аминоазобензола, на скелетном никеле, как в нейтральном водном растворе 2-пропанола азеотропного состава, так и с добавками уксусной кислоты или гидроксида натрия. Установлено, что селективность гидрогенизации названных изомеров по промежуточным продуктам зависит от состава и природы растворителя, и определяется соотношением скоростей превращения реакционноспособных групп. При гидрогенизации 4-нитро-2'-гидрокси-5'-метилазобензола в присутствии уксусной кислоты вклад направления, обусловленного превращением азогруппы, заметно возрастает, в то время как введение гидроксида натрия подавляет этот процесс, и присоединение водорода преимущественно осуществляется по нитрогруппе. Добавка к растворителю основания при гидрогенизации 2-нитро-2'-гидрокси-5'-метилазобензола приводит к увеличению констант скорости превращения нитрогруппы и внутримолекулярной циклизации промежуточного соединения, что приводит к росту селективности реакции по продуктам, содержащим бензотриазольный цикл, в частности N-оксида 2-2'-гидрокси-5'-метилфенилбензотриазола. Установлена близкая к линейной корреляция между селективностью каталитической гидрогенизации изомеров нитро-2'-гидрокси-5'-метилазобензола и кинетическими характеристиками гидрогенизации нитро- и азогруппы в соединениях с одним реакционноспособным заместителем при различных значениях рН среды.
Продукты гидрогенизации замещенных нитробензолов могут иметь как целевое значение, так и быть использованы при синтезе широкого спектра полупродуктов и красителей [1]. Стадийность превращений замещенных нитро- и азобензолов, содержащих по одной реакционноспособной по отношению к адсорбированному водороду группе, достаточно хорошо изучена [2–7]. При этом неоправданно мало внимания уделяется изучению кинетики гидрогенизации соединений, имеющих в своем составе две группы, способные активно взаимодействовать с водородом в условиях гидрогенизации.
Цель работы – сопоставление констант скорости превращения нитро- и азогрупп в соединениях, содержащих один реакционноспособный заместитель, с селективностью гидрогенизации изомеров замещенных нитроазобензолов в водных растворах 2-пропанола с различными добавками, а также выяснение причин изменения селективности 2-нитро-2'-гидрокси-5'-метилазобензола по продуктам, содержащим бензотриазольный цикл, под влиянием состава растворителя, в частности величины рН.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе исследована гидрогенизация 4-нитроанилина (4НА), 4-аминоазобензола (4ААБ), 4‑нитро-2'-гидрокси-5'-метилазобензола (4НАБ) и 2-нитро-2'-гидрокси-5'-метилазобензола (2НАБ). Процесс проводили при атмосферном давлении водорода и температуре 288 К в реакторе с интенсивным перемешиванием (3200 об./мин) жидкой фазы объемом 100 см3. В качестве растворителя использовали как нейтральный водный раствор 2-пропанола азеотропного состава (х2 = 0.68), так и с добавками гидроксида натрия (0.01 М) или уксусной кислоты (0.01 М). Масса катализатора (mкат), вносимого в реактор, составила 0.625 ± ± 0.01 г, количество исходного соединения варьировали от 0.79 ± 0.05 ммоль до 1.950 ± ± 0.05 ммоль. При таком соотношении катализатора и гидрируемого соединения, соблюдалась прямо пропорциональная зависимость наблюдаемой скорости процесса от количества катализатора [3, 4]. Непрерывную подачу водорода в реактор и фиксацию его расхода в ходе реакции осуществляли с помощью системы газовых бюреток, связанных с источником водорода. Выбранные условия проведения гидрогенизации обеспечили исключение влияния внешнего массопереноса на кинетические характеристики и позволили определять наблюдаемую скорость реакции с высокой надежностью и погрешностью не выше 5%.
Скелетный никелевый катализатор (никель Ренея) получали по стандартной методике [8] из никель-алюминиевого сплава, с массовым содержанием 50% Ni, 48.8% Al и 0.2% Fe.
С целью определения содержания используемых исходных соединений и продуктов гидрогенизации 2НАБ и 4НАБ в ходе процесса отбирали пробы, которые анализировали с помощью тонкослойной и жидкостной хроматографии, а также спектрофотомерии.
Восходящую тонкослойную хроматографию проводили на пластинках “Sorbfill” с использованием в качестве элюента бинарной смеси толуол : этилацетат в объемном соотношении 7 : 3 и оксидов азота как проявителя. Для идентификации продуктов гидрогенизации рабочие хроматограммы сопоставляли с хроматограммами индивидуальных чистых веществ.
Для количественного анализа проб использовали жидкостной хроматограф “Shimadzu LC-6A”, снабженный спектрофотометрическим детектором с дейтериевым и вольфрамовым элементами для УФ- и видимой области спектра и с насадочной колонкой из нержавеющей стали с неподвижной фазой “Lichrosorb RP-18”. В качестве элюента применяли водные растворы ацетонитрила: 70 об. % при анализе нитро- и аминоазосоединений, и 30 об. % при анализе нитроанилинов и 2-амино-4-метилфенола (2АМФ). Погрешность в определении концентрации всех анализируемых веществ не превышала 4%, а воспроизводимость результатов анализа составляла 96–99%.
Содержание 2- и 4-фенилендиаминов (2ФДА и 4ФДА), образующихся при гидрогенизации 2НАБ и 4НАБ соответственно, определяли методом, сочетающим тонкослойную хроматографию и спектрофотометрию. После хроматографирования пробы гидрогенизата заданного объема с пластинки “Sorbfill” пятно, соответствующее фенилендиамину, смывали в бюкс определенным количеством 2-пропанола. Концентрацию веществ в полученном растворе фиксировали с погрешностью не более 3–5% спектрофотометрически в УФ-области на приборе “CARY 50 Scan UV-Visible Spectrophotometers” с чувствительностью не ниже (1–3) × 10–5 М.
Концентрацию 2ФДА и 4ФДА дополнительно рассчитывали как разность между содержанием 2АМФ и соответствующего изомера нитроанилина в анализируемой пробе.
Общее число анализируемых соединений в каждом отдельном опыте составляло не менее 98%, что свидетельствует о высокой надежности полученных результатов, и позволяет сделать объективные выводы о стадийности превращения гидрируемых соединений в ходе процесса.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В ряде работ [1, 2, 4, 6, 7, 9] показано, что заметное влияние на скорость гидрогенизации на скелетном никеле различных ненасыщенных групп, в частности, нитро- и азогруппы в замещенных бензолах, оказывают добавки к растворителю кислоты или основания. В присутствии этих веществ в водных растворах алифатических спиртов заметно изменяется также и содержание 4НА и 4-амино-2'-гидрокси-5'-метилазобензола (4ААБ) – промежуточных продуктов гидрогенизации 4НАБ [10, 11].
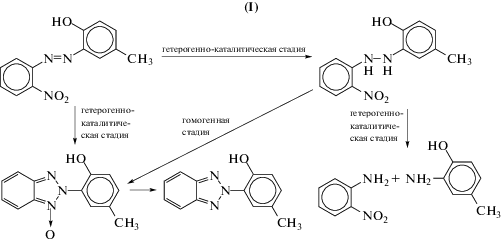
Особенность гидрогенизации 2НАБ, в отличие от 4НАБ, заключается в возможности протекания внутримолекулярной перегруппировки промежуточных продуктов реакции с образованием бензотриазольного цикла. Например, продукт гидрогенизации азогруппы 2-нитро-2'-гидрокси-5'-метилгидразобензол (2НГБ) в объеме раствора может перегруппироваться в N-оксид 2-2'-гидрокси-5'-метилфенилбензотриазола (НО). Известно, что скорость внутримолекулярной циклизации возрастает в присутствии оснований [12]. Таким образом, каталитическая гидрогенизация 2НАБ может сопровождаться образованием соединений, не содержащих бензотриазольный цикл – 2НГБ, или содержащих таковой – НО и продукт его последующей гидрогенизации – 2-2'-гидрокси-5'-метилфенилбензотриазол (БТ). В работе за селективность по продуктам гидрогенизации 2НАБ, содержащим бензотриазольный цикл (ПБТЦ), принята суммарная селективность по НО и БТ.
В результате гидрогенизации азогруппы в 2НАБ и 4НАБ образуются 2АМФ и соответственно 2-нитроанилин (2НА) и 4-нитроанилин (4НА). Далее в условиях гидрогенизации 2НА и 4НА восстанавливаются до соответствующих диаминов – до 1,2-фенилендиамина (2ФДА) и 1,4-фенилендиамина (4ФДА).
На приведенных ниже схемах показаны основные стадии и последовательность превращений продуктов гидрогенизации 2НАБ (I) и 4НАБ (II) [10]:
В таблице 1 представлены данные, иллюстрирующие зависимость констант скорости гидрогенизации 4НА и 4ААБ, а также селективности гидрогенизации 2НАБ и 4НАБ в водном растворе 2‑пропанола от рН среды. Наблюдаемую скорость гидрогенизации 4НА и 4ААБ определяли по тангенсу угла наклона начального участка кинетической кривой, построенной в координатах “количество поглощенного водорода – время”. Константу скорости рассчитывали как отношение наблюдаемой скорости реакции к растворимости водорода в используемом растворителе с поправкой на плотность катализатора. За селективность реакции (S) было принято отношение максимального количества продукта реакции к количеству исходного соединения, прореагировавшего к данному моменту времени.
Таблица 1.
Константы скорости гидрогенизации (${{k}_{{{{{\text{H}}}_{2}}}}}$) 4НА и 4ААБ и селективность (S) гидрогенизации 2НАБ и 4НАБ на скелетном никеле в водных растворах 2-пропанола (х2 = 0.68) с различными добавками
| Добавки | рН | ${{k}_{{{{{\text{H}}}_{2}}}}}$, с–1 | S, % | ||||
|---|---|---|---|---|---|---|---|
| k4НА | k4ААБ | 4НАБ | 2НАБ | ||||
| 4НА | 4ААБ | 2НГБ | ПБТЦ | ||||
| СН3СООН, 0.01 М | 4.6 | 39 ± 3 | 115 ± 10 | 30 ± 1 | 2.5 ± 0.2 | 76 ± 4 | 20 ± 2 |
| Без добавок | 8.0 | 71 ± 2 | 46 ± 2 | 26 ± 1 | 6 ± 1 | 48 ± 4 | 35 ± 2 |
| NaOH, 0.01 М | 13.4 | 91 ± 5 | 23 ± 3 | 4 ± 1 | 15 ± 1 | 32 ± 3 | 70 ± 2 |
Из приведенных данных следует, что введение добавок гидроксида натрия или уксусной кислоты в водный раствор спирта приводит к заметному изменению скорости гидрогенизации соединений с одной реакционноспособной группой. Уменьшение кислотности среды способствует увеличению скорости восстановления нитрогруппы и снижению скорости гидрирования азогруппы. Соответственно изменяется селективность гидрогенизации 4НАБ: в присутствии кислоты содержание 4НА увеличивается, а 4ААБ снижается, а в присутствии основания наблюдаются противоположные изменения. Следовательно, характер влияния рН жидкой фазы на константы скорости гидрогенизации 4НА и 4ААБ и на селективность по продуктам, образующимся при гидрогенизации 4НАБ, подобен. При гидрогенизации 2НАБ увеличение рН среды приводит к росту селективности гидрогенизации по ПБТЦ, в то время как селективность по 2НГБ снижается. Следует обратить внимание на аналогию зависимости селективности по ПБТЦ и 4ААБ и зависимости селективности по 2НГБ и 4НА от рН растворителя. Таким образом, можно заключить, что при гидрогенизации 2НАБ использование растворителей, способствующих ускорению восстановления нитрогруппы или торможению гидрирования азогруппы, приводит к росту вклада стадии, в результате которой образуется НО.
Анализ результатов эксперимента позволил установить взаимосвязь между кинетическими параметрами гидрогенизации соединений, содержащих только нитро- или азогруппу, и селективностью гидрогенизации изомеров нитроазобензолов. Согласно представленным данным полученные зависимости близки к линейным. Рисунок 1а иллюстрирует взаимосвязь между соотношениями селективностей 4НА и 4ААБ (S4НА/S4ААБ), образующихся при гидрогенизации 4НАБ, и константами скорости гидрогенизации соединений, содержащих только нитро- или азогруппу – 4НА и 4ААБ (k4НА/k4ААБ). При переходе от растворителя, содержащего основание, к растворителю с добавкой кислоты, соотношение S4НА/S4ААБ изменяется с 0.3 до 12. При этом, чем выше константа скорости превращения нитрогруппы при гидрогенизации 4НАБ в соответствующем растворителе, тем ниже селективность по 4НА. На рис. 1б приведена взаимосвязь селективности гидрогенизации 2НАБ по ПБТЦ (SПБТЦ) с соотношением констант скорости гидрогенизации 4НА и 4ААБ (k4НА/k4ААБ). Эти данные свидетельствуют о том, что селективность по продуктам, содержащим бензотриазольный цикл, возрастает в растворителях, которые обеспечивают более высокие скорости гидрогенизации нитрогруппы по сравнению с азогруппой.
Рис. 1.
Взаимосвязь соотношения селективностей гидрогенизации 4НАБ по 4НА и 4ААБ (S4НА/S4ААБ) (а) и селективности гидрогенизации 2НАБ по ПБТЦ (SПБТЦ) (б) с соотношением констант скорости гидрогенизации соединений содержащих нитро- или азогруппу (k4НА/k4ААБ).

Увеличение селективности по ПБТЦ в присутствии основания следует отнести на счет увеличения вклада гетерогенно-каталитической стадии, то есть перегруппировки промежуточных продуктов гидрогенизации 2НАБ в начальной фазе реакции непосредственно в поверхностном слое, а не только за счет циклизации 2НГБ в объеме раствора. Этому предположению не противоречат следующие факты. При проведении гидрогенизации 2НАБ в присутствии гидроксида натрия селективность по ПБТЦ составляет 70%, что на 35% выше, чем в нейтральном водном растворе 2-пропанола. Если принять, что образование НО обусловлено только гомогенным превращением 2НГБ, то согласно экспериментальным данным и схеме превращений 2НАБ следовало бы ожидать, что селективность по ПБТЦ возрастет на большую величину, в частности на 48%, а 2НГБ в щелочной среде не обнаружится. Следует отметить, что константа скорости циклизации 2НГБ в объеме раствора в присутствии гидроксида натрия (рН 13.4) составляет 3.8 × 10–3 с–1, что практически на два порядка ниже константы скорости превращения 2НАБ в условиях гидрогенизации в таком же растворителе, которая равна 55 × 10–2 с–1 [1, 2].
Из полученных экспериментальных данных следует, что при гидрогенизации 2НАБ высокая селективность по ПТБЦ может быть достигнута при некотором оптимальном соотношении скоростей присоединения водорода по нитро- и азогруппе на скелетном никеле в водных растворах алифатических спиртов. При этом одновременная атака водорода по нитро- и азогруппе без полного раскрытия связей может привести к образованию ассоциативного комплекса смешанного типа, способного к внутримолекулярной перегруппировке. Вероятность циклизации подобного ассоциативного комплекса подтверждается проведенными нами квантово-химическими расчетами [13] и не противоречит представлениям о механизме образования внутримолекулярных циклов [14, 15].
В случае присоединения трех моль водорода только по нитрогруппе получится неспособный к внутримолекулярной перегруппировке 2-амино-2'-гидрокси-5'-метилазобензол, а поглощение двух моль водорода по азогруппе приведет к образованию 4НА и 2АМФ.
Список литературы
Zollinger H. Diazo Chemistry I. Aromatic and heteroaromatic compounds. Weinheim; New York; Basel; Cambridge; Tokyo: VCH 1994. 453 p.
Теория и практика процессов жидкофазной гидрогенизации замещенных нитробензолов / Под ред. О.И. Койфмана. М.: КРАСАНД. 2016. 528 с.
Смирнова И.В., Немцева М.П., Лефедова О.В. // Изв. ВУЗ. Химия и хим. технология. 2010. Т. 53. №11. С. 4.
Кротов А.Г., Лефедова О.В. // Журн. физ. химии. 2002. Т. 76. № 6. С. 1048.
Лефедова О.В., Нгуен Тхи Тху Ха, Буданов М.А., Комаров А.А. // Журн. физ. химии. 2012. Т. 86. № 1. С. 37.
Нгуен Тхи Тху Ха, Лефедова О.В., Меркин А.А. // Изв. ВУЗ. Химия и хим. технология. 2012. Т. 55. № 10. С. 79.
Смирнова И.В., Немцева М.П., Лефедова О.В. // Изв. ВУЗ. Химия и хим. технология. 2009. Т. 52. № 5. С. 25.
Улитин М.В., Барбов А.В., Гостикин В.П., Шалюхин В.А. // Журн. прикл. химии. 1993. Т. 66. № 3. С. 497.
Буданов М.А., Улитин М.В., Нгуен Тхи Тху Ха, Лефедова О.В. // Журн. физ. химии. 2010. Т. 84. № 11. С. 2085.
Hoang Anh, Nemtzeva M.P., Lefedova O.V. // Russ. J. of Phys. Chem. 2018. V. 92. № 4. P. 669.
Хоанг Ань, Калашникова В.А., Лефедова О.В., Филиппов Д.В. // Изв. вуз. Химия и хим. технология. 2018. Т. 61. № 8. С. 66.
Пальм В.А. Основы количественной теории органических реакций. Л.: Химия 1967. 356 с.
Frisch M.J., Trucks G.W., Schlegel H.B., Scuseria G.E., Robb M.A., Cheeseman J.R., Montgomery J.A.Jr., Vreven T., Kudin K.N., Burant J.C., Millam J.M., Iyengar S.S., Tomasi J., Barone V., Mennucci B., Cossi M., Scalmani G., Rega N.G., Petersson A., Nakatsuji H., Hada M., Ehara M., Toyota K., Fukuda R., Hasegawa J., Ishida M., Nakajima T., Honda Y., Kitao O., Nakai H., Klene M., Li X., Knox J.E., Hratchian H.P., Cross J.B., Adamo C., Jaramillo J., Gomperts R., Stratmann R.E., Yazyev O., Austin A.J., Cammi R., Pomelli C., Ochterski J.W., Ayala P.Y., Morokuma K., Voth G.A., Salvador P., Dannenberg J.J., Zakrzewski V.G., Dapprich S., Daniels A.D., Strain M.C., Farkas O., Malick D.K., Rabuck A.D., Raghavachari K., Foresman J.B., Ortiz J.V., Cui Q., Baboul A.G., Clifford S., Cioslowski J., Stefanov B.B., Liu G., Liashenko A., Piskorz P., Komaromi I., Martin R.L., Fox D.J., Keith T., Al-Laham M.A., Peng C.Y., Nanayakkara A., Challacombe M., Gill P.M.W., Johnson B., Chen W., Wong M.W., Gonzalez C., Pople J.A. Gaussian 03 revision B.04; Gaussian Inc.: Pittsburgh PA 2003.
Горностаев Л.М. // Соросовский образовательный журнал. 1996. № 4. С. 33.
Klopman G. Chemical Activity and Reaction Paths. New York: John Wiley & Sons Inc. 1974. 382 p.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии