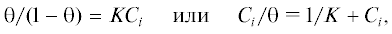Журнал физической химии, 2020, T. 94, № 4, стр. 639-644
Ингибирующая способность метаванадата натрия в условиях коррозии сплава алюминия АД31 в нейтральных хлоридсодержащих средах
Д. С. Харитонов a, b, *, М. А. Осипенко b, A. Wrzesińska c, А. А. Касач b, И. В. Макарова d, И. И. Курило b
a Jerzy Haber Institute of Catalysis and Surface Chemistry of Polish Academy of Sciences
30-239 Krakow, Niezapominajek 8, Poland
b Белорусский государственный технологический университет
220006 Минск, Республика Беларусь
c Lodz University of Technology, Department of Molecular Physics
90-924 Lodz, Poland
d Lappeenranta University of Technology
FI-53850 Skinnarilankatu 34, Finland
* E-mail: kharitonov@belstu.by
Поступила в редакцию 31.05.2019
После доработки 31.05.2019
Принята к публикации 18.06.2019
Аннотация
Изучен механизм коррозии сплава алюминия АД31 (АА6063) в 0.05 М растворах NaCl, содержащих 0.03–5 ммоль/дм3 ингибитора NaVO3. На основании данных потенциодинамических поляризационных измерений рассчитан защитный эффект ингибитора, построена изотерма адсорбции Ленгмюра и определены значения эффективной энергии активации анодного процесса. Методом ЯМР установлены ионные формы соединений ванадия в водных растворах, содержащих 3 ммоль/дм3 NaVO3. Показано, что механизм ингибирования коррозии сплава АД31 растворимыми ванадатами заключается в физической адсорбции ионов ингибитора на поверхности металла, что препятствует адсорбции кислорода, снижая скорость его катодного восстановления.
Широкому промышленному использованию алюминиевых сплавов способствуют как уникальные эксплуатационные характеристики, так и многообразие форм, в которых они выпускаются. В зависимости от характера коррозионной среды, состава и способов термической обработки алюминиевых сплавов они подвержены различным видам локальной коррозии, что обусловлено гетерогенной структурой их поверхности [1–6]. В случае электрохимической коррозии анодный процесс растворения металла сопровождается катодным процессом, как правило восстановлением кислорода, механизм которого прежде всего определяется значением рН коррозионной среды и природой металла. Согласно предложенным механизмам [7, 8], лимитирующей стадией катодного процесса является адсорбция кислорода и/или продуктов его восстановления на поверхности корродирующего металла. В связи с этим повышение перенапряжения катодного процесса и предотвращение адсорбции кислорода на поверхности металлических конструкций используются для снижения скорости их коррозии.
Введение в коррозионную среду ингибиторов – один из самых распространенных методов антикоррозионной защиты металлических материалов [9–11]. Существующие ингибиторы коррозии зачастую токсичны и/или дороги, а соблюдение новых экологических норм требует разработки и внедрения новых более доступных и безопасных для окружающей среды ингибиторов [10, 12–15]. Перспективно использование неорганических ингибиторов, среди них – оксоанионов переходных металлов (Mo, Mn, V, W) [8, 16–24]. Из этой группы ингибиторов наиболее изучены ингибиторы на основе ванадатов [8, 19, 20, 25–28]. Тем не менее, механизм их защитного действия достаточно подробно описан только для легированного медью и магнием сплава Д16 [8, 25, 29]. В наших предыдущих работах [19, 20, 23, 30] мы провели анализ процессов коррозии легированного кремнием и магнием сплава алюминия АД31 в растворах хлорида натрия с добавлением растворимых ванадатов с целью изучения эффективности ингибирования в зависимости от рН среды. Однако не был достаточно изучен механизм ингибирования, в частности процессы адсорбции ингибитора на поверхности сплава АД31, а также не были экспериментально определены ионные формы ванадийсодержащих частиц в используемых растворах. Цель данной работы – изучение процесса коррозии сплава алюминия АД31 в нейтральной хлоридсодержащей среде с ингибитором метаванадатом натрия и установление механизма ингибирующего действия ванадат-ионов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе исследовали деформируемый алюминиевый сплав марки АД31 (сплав АА6063 по классификации ANSI). Номинальный состав сплава по ГОСТ 4784–97 представлен в табл. 1. Г-образный алюминиевый профиль, полученный методом горячей деформации (термическая обработка T5 – охлаждение от температуры формования с последующим искусственным старением) разрезали на заготовки размером 20 мм × 20 мм × 2 мм, которые механически шлифовали наждачной бумагой Р1000, после чего промывали дистиллированной водой и высушивали. Полученные образцы хранили в 99.9%-ном этаноле. Сушку образцов перед проведением исследований проводили в потоке сжатого азота.
Таблица 1.
Номинальный состав сплава АД31 (с, мас. %) по ГОСТ 4784–97
| Элемент | Si | Fe | Cu | Mn | Мg | Cr | Zn | Тi | Al |
|---|---|---|---|---|---|---|---|---|---|
| с | 0.45 | 0.50 | 0.10 | 0.10 | 0.60 | 0.10 | 0.20 | 0.15 | баланс |
В качестве коррозионной среды использовали 0.05 М раствор хлорида натрия (≥99%, Sigma-Aldrich). Для изучения ингибирующего действия ванадат-ионов в коррозионную среду дополнительно вводили ингибитор метаванадат натрия NaVO3 (≥98%, Sigma-Aldrich) в количестве от 0.03 до 5 ммоль/дм3. Концентрации ингибитора выбирали на основе предыдущих исследований [19, 20, 23, 25, 30] и анализа фазовой диаграммы соединений ванадия в водной среде [19, 31]. Растворы для коррозионных исследований готовили с использованием деионизированной воды с удельным сопротивлением 18.2 МОм/см (система деионизации Milli-Q, Merck). Корректировки значений рН полученных растворов не проводили. Для установления равновесия ионных форм ванадия в растворах их использовали через 24 ч после приготовления.
Электрохимические исследования проводили с использованием потенциостата/гальваностата Metrohm Autolab PGSTAT 302N (Metrohm Autolab B.V.), оснащенного модулем анализа частот FRA32M в стандартной трехэлектродной плексигласовой электрохимической ячейке с боковым креплением рабочего электрода и насыщенным хлоридсеребряным электродом сравнения. В качестве вспомогательного электрода использовали платиновую сетку. Значения потенциалов пересчитывали на шкалу стандартного водородного электрода. Площадь рабочего электрода во всех исследованиях составляла 1 см2. Потенциодинамические поляризационные кривые снимали при линейной скорости развертки потенциала 1 мВ/с. Электрохимические параметры процесса коррозии определяли с использованием алгоритма Левенберга–Марквардта в ПО CorrView 3.2c. Эффективную энергию активации анодного процесса растворения сплава АД31 в исследуемых растворах определяли термокинетическим методом. Термостатирование осуществляли при помощи жидкостного термостата 5 ОК-20/0.05-02 (“Пять океанов”) с погрешностью стабилизации температуры в рабочем режиме ±0.05 K.
Спектры 51V ядерного магнитного резонанса (ЯМР) высокого разрешения снимали на ЯМР-спектрометре Bruker AVANCE 250 MHz в стандартных ЯМР-трубках диаметром 5 мм при непрерывной рабочей резонансной частоте 65.72 МГц и рабочих параметрах: спектральная ширина – 75.2 кГц, время накопления – 0.055 с, количество накоплений – 5000, задержка релаксации – 0.2 с. Химический сдвиг сигнала определяли относительно 20% VOCl3 в C6D6 (0 м. д.).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Для выбора оптимальной концентрации ингибитора проводили потенциодинамические поляризационные исследования в 0.05 М растворах NaCl без ингибитора и при добавлении NaVO3 в количестве от 0.03 до 5 ммоль/дм3 (рис. 1). Из анализа полученных кривых видно, что при отсутствии в растворе ингибитора (рис. 1, кривая 1) процесс коррозии сплава АД31 протекает с достаточно высокой скоростью. Катодная ветвь поляризационной кривой линейна в широком интервале поляризаций, а на анодной ветви можно выделить несколько участков с различными угловыми коэффициентами, что служит критерием стадийности протекающих на аноде электродных процессов [3]. Значение бестокового потенциала составило –432 ± 14 мВ, а излом на анодной кривой в области потенциалов (–373 ± 10 мВ) соответствует потенциалу питтингообразования. Рассчитанная плотность тока коррозии в растворах NaCl без ингибитора составила 1.52 ± 0.05 мкА/см2.
Рис. 1.
Потенциодинамические поляризационные кривые сплава АД31 в 0.05 М растворе хлорида натрия с различным содержанием NaVO3: 1 – 0, 2 – 0.03, 3 – 0.7, 4 – 3, 5 – 5 ммоль/дм3.

Введение в 0.05 М раствор хлорида натрия дополнительно метаванадата натрия в количестве от 0.03 до 5 ммоль/дм3 приводит к постепенному смещению бестокового потенциала в электроположительную область (рис. 1, кривые 2–5). При концентрации NaVO3 в растворе 0.03 ммоль/дм3 величина сдвига составляла 60 мВ и возрастала до 70 и 80 мВ при содержании метаванадата натрия соответственно 3 и 5 ммоль/дм3. Установлено, что введение даже малых порций ингибитора (0.03 ммоль/дм3 NaVO3) приводит к снижению плотности тока коррозии примерно в 2 раза до 0.91 ± 0.09 мкА/см2. В 0.05 M растворах хлорида натрия, содержащих 3 и 5 ммоль/дм3 NaVO3, значения плотности токов коррозии уменьшались более чем на порядок и составили соответственно 6.9 × 10–8 и 4.3 × 10–8 А/см2. Для оценки эффективности ингибитора использовали величину защитного эффекта ЕI, рассчитываемую по уравнению [23]:
(1)
$EI,\;{\text{\% }} = \frac{{i_{{{\text{корр}}}}^{0} - i_{{{\text{корр}}}}^{{}}}}{{i_{{{\text{корр}}}}^{0}}} \times 100,$Полученные поляризационные зависимости свидетельствуют о смешанном механизме защитного действия ингибитора. В данном случае соединения ванадия, вероятно, адсорбируются на поверхности электрода, тем самым затрудняя протекание анодных реакций растворения фазы алюминия и электрохимически активных легирующих добавок (магния, цинка), протекающих на анодных участках поверхности сплава, а также замедляя процесс восстановления кислорода на катодных участках поверхности. В наших предыдущих работах [3, 23] показано, что в сплаве АД31 катодными участками являются микроразмерные интерметаллические частицы, содержащие железо, марганец и кремний.
Для более детального установления механизма ингибирования на основании полученных поляризационных кривых строили изотерму адсорбции. Процессы адсорбции ингибиторов коррозии, как правило, соответствуют изотерме Ленгмюра [8, 32, 33]:
где θ – степень адсорбции; K – константа адсорбции; Сi – концентрация ингибитора, моль/дм3. Предпологая, что полная адсорбция и экранирование поверхности сплава молекулами или ионами ингибитора приведут к 100%-ному защитному эффекту (уменьшению тока коррозии, iкорр, до нуля), степень адсорбции θ рассчитывали по выражению, аналогичному (1):(3)
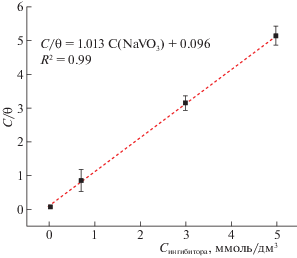
${\theta } = \frac{{i_{{{\text{корр}}}}^{0} - i_{{{\text{корр}}}}^{{}}}}{{i_{{{\text{корр}}}}^{0}}} = EI.$Изотерма адсорбции, построенная на основании поляризационных исследований, представлена на рис. 2. Экспериментальные данные хорошо описываются предложенной изотермой Ленгмюра. Линейная аппроксимация данных по методу наименьших квадратов показала, что полученная прямая имеет наклон 1.013, а величина 1/K составляет 0.096. С использованием этих данных по выражению (4) рассчитывали величину $\Delta G_{{{\text{адс}}}}^{0}$, которая составила –15.78 кДж/моль. Полученные результаты согласуются с данными [8]. Отрицательное значение $\Delta G_{{{\text{адс}}}}^{0}$ свидетельствует о том, что процесс адсорбции протекает самопроизвольно сразу же после погружения образца сплава в растворы с ингибитором. Процессы адсорбции, для которых значения $\Delta G_{{{\text{адс}}}}^{0}$ находятся в интервале от –15 до –30 кДж/моль, имеют физическую природу [33, 34]. Это также объясняет постепенное возрастание защитного эффекта с увеличением начальной концентрации ингибитора.
Рис. 2.
Изотерма Ленгмюра, построенная по результатам анализа потенциодинамических поляризационных кривых сплава АД31 в 0.05 М растворе хлорида натрия с различным содержанием NaVO3.
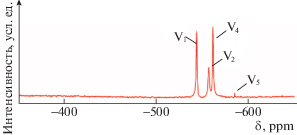
Дальнейшие исследования проводили в растворах с концентрацией ингибитора 3 ммоль/дм3. Ионные формы соединений ванадия в 3 ммоль/дм3 растворе NaVO3 устанавливали методом ЯМР (рис. 3). Расшифровку проводили по данным [25, 26, 35, 36]. В исследуемом растворе одновременно присутствуют такие олигомеры, как моно- (V1), ди- (V2), тетра- (V4) и пентаванадаты (V5). Установленное смещение пика V1 (‒544.7 ppm) относительно литературных данных (–541.3 ppm) свидетельствует о том, что в растворе доминируют протонированные формы монованадатов ${\text{VO}}_{2}^{{}}{\text{(OH)}}_{2}^{ - }$ и ${\text{V(OH)}}_{3}^{{}}$. Положение пика V2 указывает на существование в растворе в равновесии двух протонированных форм: ${\text{H}}{{{\text{V}}}_{{\text{2}}}}{\text{O}}_{7}^{{3 - }}$ и ${{{\text{H}}}_{{\text{2}}}}{{{\text{V}}}_{{\text{2}}}}{\text{O}}_{7}^{{2 - }}$. Значения химических сдвигов для пиков V4 и V5 могут быть обусловлены переходом между циклическими и линейными формами ионов ${{{\text{V}}}_{{\text{4}}}}{\text{O}}_{{12}}^{{4 - }}$ и ${{{\text{V}}}_{{\text{5}}}}{\text{O}}_{{15}}^{{5 - }}$ [35]. Все эти ионы имеют тетраэдрическую конфигурацию, что является важным для обеспечения ингибирования коррозии соединениями ванадия [25, 26, 37].
Физический механизм адсорбции ингибитора на поверхности сплава АД31 проявляется и в изменении его эффективности в зависимости от температуры коррозионной среды [33]. Эта особенность характерна для антикоррозионной защиты сплавов, на поверхности которых присутствуют участки различного состава (матрица и интерметаллические частицы). Влияние температуры на скорость коррозии может рассматриваться как аррениусовская зависимость. Это позволяет оценить значения эффективной энергии активации процесса коррозии сплава АД 31 с использованием термокинетического метода (рис. 4).
Рис. 4.
Зависимость эффективной энергии активации анодного процесса коррозии сплава АД31 от перенапряжения в 0.05 М растворе хлорида натрия без ингибитора (1) и при добавлении 3 ммоль/дм3 NaVO3 (2).
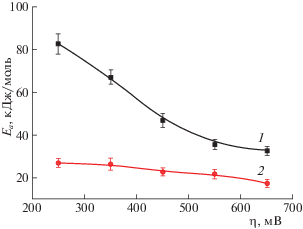
Для сплава АД31 в 0.05 М растворе хлорида натрия без добавления ингибитора в области перенапряжений 200–500 мВ значения Ea находятся в интервале 40–82 кДж/моль, что указывает на протекание процесса с лимитирующей электрохимической стадией. В области перенапряжений 500–650 мB значения Ea составили 32–40 кДж/моль, указывая на то, что анодный процесс протекает в области смешанной кинетики. В растворе, дополнительно содержащем 3 ммоль/дм3 NaVO3, характер зависимости значительно отличался. Введение ингибитора снижает значения Ea, которые во всем исследованном интервале поляризаций 200–650 мВ составляли 17–26 кДж/моль, что характерно для процессов с лимитирующей стадией диффузии. Это подтверждает сделанное ранее предположение об адсорбции ингибитора на поверхности сплава, что приводит к ее экранированию и появлению диффузионных ограничений.
Проведенные исследования позволяют предложить механизм ингибирования коррозии сплава АД31 метаванадатом натрия. В начальный момент времени ингибирующее действие NaVO3 обусловлено физической адсорбцией ионов ингибитора на поверхности металла, которая, согласно данным рис. 2, протекает самопроизвольно. Адсорбированные тетраэдрически-координированные моно- и поливанадаты препятствуют адсорбции кислорода на поверхности электрода, тем самым снижая скорость его катодного восстановления, о чем свидетельствует ход поляризационных кривых (рис. 1) и данные термокинетического анализа (рис. 4). Экранирование поверхности металла слоем ингибитора также приводит к торможению переноса электронов, затрудняя восстановление кислорода. Адсорбция ингибитора на поверхности сплава локализована на катодных участках поверхности (интерметаллических частицах), являющихся активными центрами восстановления кислорода. В пользу данного механизма свидетельствует относительно малое (на 13 и 15% соответственно) увеличение защитного эффекта при увеличении концентрации ингибитора в растворе в 100 и ≈170 раз. Тем не менее, традиционный механизм развития питтинговой коррозии предполагает, что хлорид-ионы истончают пассивную пленку на поверхности металла, либо проникают через нее. Смещение потенциала питтингообразования в электроположительную сторону в растворах, содержащих ингибитор, указывает на возможную адсорбцию ванадат-ионов также на поверхности алюминиевой матрицы. В дальнейшем, процесс ингибирования заключается в восстановлении слоя ингибитора на катодных участках поверхности сплава [30].
ЗАКЛЮЧЕНИЕ
Таким образом, введение в 0.05 M раствор NaCl ингибитора метаванадата натрия в количестве 0.03–5 ммоль/дм3 приводит к существенному снижению скорости коррозии сплава АД31. По результатам потенциодинамических поляризационных измерений защитный эффект ингибитора составил соответственно 39, 82, 95 и 97% в растворах, содержащих 0.03, 0.07, 3 и 5 ммоль/дм3 NaVO3. Адсорбция метаванадата натрия на поверхности сплава АД31 описывается изотермой адсорбции Ленгмюра. Рассчитанное значение свободной энергии Гиббса (–15.78 кДж/моль) свидетельствует о самопроизвольном протекании процесса и его физической природе.
Согласно данным ЯМР, в исследуемом 3 ммоль/дм3 растворе NaVO3 одновременно присутствуют такие олигомеры, как моно- (${\text{VO}}_{2}^{{}}{\text{(OH)}}_{2}^{ - }$, ${\text{V(OH)}}_{3}^{{}}$), ди- (${\text{H}}{{{\text{V}}}_{{\text{2}}}}{\text{O}}_{7}^{{3 - }}$, ${{{\text{H}}}_{{\text{2}}}}{{{\text{V}}}_{{\text{2}}}}{\text{O}}_{7}^{{2 - }}$), тетра- (${{{\text{V}}}_{{\text{4}}}}{\text{O}}_{{12}}^{{4 - }}$) и пентаванадаты (${{{\text{V}}}_{{\text{5}}}}{\text{O}}_{{15}}^{{5 - }}$). Согласно данным термокинетического анализа, анодный процесс коррозии сплава АД31 в 0.05 М растворе хлорида натрия без добавления ингибитора в области перенапряжений 200–500 мВ лимитируется электрохимической стадией (энергия активации 40–82 кДж/моль), в диапазоне перенапряжений 500–650 мB протекает в области смешанной кинетики (Еа = 32–40 кДж/моль), а в растворе, дополнительно содержащем 3 ммоль/дм3 NaVO3, во всем исследуемом интервале поляризаций лимитируется стадией диффузии (Еа = 17–26 кДж/моль).
Потенциодинамические поляризационные измерения свидетельствуют о смешанном характере защитного действия метаванадата натрия. Механизм ингибирования коррозии сплава АД31 заключается в физической адсорбции ионов ингибитора на поверхности металла, которая протекает самопроизвольно и описывается изотермой Ленгмюра. Адсорбированные на поверхности сплава частицы ингибитора препятствуют адсорбции кислорода, снижая скорость его катодного восстановления и, вероятно, адсорбции хлорид-ионов.
Исследования выполнены при финансовой поддержке Министерства образования Республики Беларусь (грант 20192322 “Композиционные оксидные покрытия на алюминиевой матрице с улучшенными физико-механическими и коррозионными свойствами”).
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Liu C., Khullar P., Kelly R.G. // J. Electrochem. Soc. 2019. V. 166. P. C153.
Vargel C., Jacques M., Schmidt D.M.P. // Corrosion of Aluminium. Amsterdam: Elsiever, 2004. 700 p.
Kharitonov D.S., Dobryden I.B., Sefer B. et al. // Prot. Met. Phys. Chem. Surfaces. 2018. V. 54. P. 291.
McCafferty E. // Corros. Sci. 1995. V. 37. P. 481.
Szklarska-Smialowska Z. // Corros. Sci. 1999. V. 41. P. 1743.
Revilla R.I., De Graeve I. // J. Electrochem. Soc. 2018. V. 165. P. C926.
Yang H.-H., McCreery R.L. // J. Electrochem. Soc. 2002. V. 147. P. 3420.
Iannuzzi M., Frankel G.S. // Corros. Sci. 2007. V. 49. P. 2371–2391.
Scamans G.M., Birbilis N., Buchheit R.G. // Shreir’s Corrosion. 2010. P. 1974–2010.
Rani B.E.A., Basu B.B.J. // Int. J. Corros. 2012. P. 1–15.
Ghali E., Sastri V.S., Elboujdaini M. Corrosion Prevention and Protection Practical Solutions. Chichester: Wiley, 2007. 574 p.
Twite R.L., Bierwagen G.P. // Prog. Org. Coatings. 1998. V. 33. P. 91.
Zhang F., Ju P., Pan M. et al. // Corros. Sci. 2018. V. 144. P. 74.
Bethencourt M., Botana F.J., Calvino J.J. et al. // Corros. Sci. 1998. V. 40. P. 1803.
Udoh I.I., Shi H., Liu F., Han E.-H. // J. Electrochem. Soc. 2019. V. 166. P. C185.
Yoganandan G., Balaraju J.N. // Surf. Coatings Technol. 2014. V. 252. P. 35.
Madden S.B., Scully J.R. // J. Electrochem. Soc. 2014. V. 161. P. C162.
Lopez-Garrity O., Frankel G.S. // Ibid. 2013. V. 161. P. C95.
Kharitonov D.S., Kurilo I.I., Wrzesinska A., Zharskii I.M. // Mat.-wiss. u. Werkstofftech. 2017. V. 48. P. 646.
Kharitonov D.S., Kurilo I.I., Zharskii I.M. // Russ. J. Appl. Chem. 2017. V. 90. P. 1089.
Gao Y.-B., Hu J., Zuo J. et al. // J. Electrochem. Soc. 2015. V. 162. P. C555.
Hurley B.L., Ralston K.D., Buchheit R.G. // Ibid. 2014. V. 161. P. 471.
Kharitonov D.S., Ornek C., Claesson P.M. et al. // Ibid. 2018. V. 165. P. С116.
Mosiałek M., Mordarski G., Nowak P. et al. // Surf. Coatings Technol. 2011. V. 206. P. 51.
Ralston K.D., Chrisanti S., Young T.L., Buchheit R.G. // J. Electrochem. Soc. 2008. V. 155. P. C350.
Iannuzzi M., Young T., Frankel G.S. // Ibid. 2006. V. 153. P. B533.
Ralston K.D., Buchheit R.G. // ECS Electrochem. Lett. 2013. V. 2. P. C35.
Osipenko M.A., Yanushevskii V.I., Kharitonov D.S. et al. // Mater. Today Proc. 2019. V. 6. P. 164.
Iannuzzi M., Kovac J., Frankel G.S. // Electrochim. Acta. 2007. V. 52. P. 4032.
Kharitonov D.S., Sommertune J., Örnek C. et al. // Corros. Sci. 2019. V. 148. P. 237.
Larson J.W. // J. Chem. Eng. Data. 1995. V. 40. P. 1276.
Kern P., Landolt D. // J. Electrochem. Soc. 2001. V. 148. P. B228.
Ryl J., Wysocka J., Cieslik M. et al. // Electrochim. Acta. 2019. V. 304. P. 263.
Wysocka J., Krakowiak S., Ryl J. // J. Electrochem. Soc. 2017. V. 258. P. 1463.
Heath E., Howarth O.W. // J. Chem. Soc. Dalt. Trans. 1981. P. 1105.
Rehder D., Polenova T., Bühl M. // Annual Reports on NMR Spectroscopy. 2007. V. 62. P. 49.
Iannuzzi M., Kovac J., Frankel G.S. // Electrochim. Acta. 2007. V. 52. P. 4032.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии