Журнал физической химии, 2020, T. 94, № 4, стр. 645-648
Морфология и каталитические свойства кобальт-содержащих катализаторов, синтезированных разными методами
К. Досумов a, Г. Е. Ергазиева a, *, Б. Т. Ермагамбет b, Л. К. Мылтыкбаева a, М. М. Тельбаева a, А. В. Мироненко a, М. М. Мамбетова a, Ж. Касенова b
a Институт проблем горения
Алматы, Казахстан
b Институт химии и технологии угля
Нурсултан, Казахстан
* E-mail: ergazieva_g@mail.ru
Поступила в редакцию 12.07.2019
После доработки 12.07.2019
Принята к публикации 10.09.2019
Аннотация
Кобальтсодержащие катализаторы исследованы методами БЭТ, РФА, СЭМ и ТПВ-Н2. Изучена их активность в реакции углекислотной конверсии метана и в процессе синтеза Фишера–Тропша. Показано, что в отличие от методов пропитки, приготовление Co/γ-Al2O3 методом solution combustion способствует увеличению дисперсности активной фазы катализатора, а также облегчает восстановление оксида кобальта, что приводит к повышению активности катализатора.
Известно, что на активность и селективность кобальтовых катализаторов в процессах получения синтез-газа из метана и жидких углеводородов из синтез-газа оказывает влияние множество различных факторов, например, природа носителя, промотора, способ приготовления, условия восстановления и др. [1–3]. Несмотря на большое количество работ, посвященных выбору носителя, активной фазы кобальтовых катализаторов, изучению влияния метода приготовления, условий активации катализаторов требуется более детальное исследование влияния перечисленных отдельных факторов на их активность в получении синтез-газа из метана, а также в процессе Фишера–Тропша. Исследования в данном направлении актуальны, особый интерес представляет изучение изменения свойств кобальтовых катализаторов, приготовленных различными методами.
В данной работе изучено влияние метода приготовления на морфологию и каталитические свойства кобальтсодержащего катализатора в углекислотной конверсии метана (УКМ) и в синтезе Фишера–Тропша.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Катализаторы были приготовлены методами пропитки и solution combustion. Метод solution combustion является одним из вариантов самораспространяющегося высокотемпературного синтеза [4]. Оксидные катализаторы Co/γ-Al2O3 готовили методом капиллярной пропитки (КП) носителя (γ-Al2O3) по влагоемкости водным раствором Co(NO3)2 · 6H2O с содержанием оксида кобальта 3, 5, 10, 15 и 20 мас. % и затем исследовали в процессе УКМ до синтез-газа. Наибольшую активность среди изученных катализаторов показал состав 15 мас. % Co/γ-Al2O3. Для сравнения 15 мас. % Co/γ-Al2O3 готовили различными методами. Суть способа капиллярной пропитки носителя (γ-Al2O3) по влагоемкости водным раствором Co(NO3)2 · 6H2O заключается в том, что носитель пропитывается по его влагоемкости растворами солей металлов, и активная фаза концентрируется на поверхности в виде “корочки”. Метод обычной пропитки носителя осуществляется традиционно погружением носителя в раствор солей металлов до глубокой его пропитки (ГП). В методе “solution combustion” применяется диспергирующее вещество, позволяющее получить активную фазу из наносимых солей металлов, которая равномерно распределяется на поверхности носителя. Синтезированные катализаторы сушили при 300°С (2 ч) и прокаливали при 500°С в течение 3 ч.
Тестирование активности синтезированных катализаторов в УКМ проводили на лабораторной установке проточного типа ПКУ-1. Условия проведения процесса: P = 0.1 МПа, W = 500–4000 ч–1, Т = 600–850°С, CH4 : CO2 = 1 : 1, Vкат = = 2 мл. Исследование катализаторов в синтезе Фишера–Тропша проводили на проточной установке высокого давления ПКУ-2ВД, при условиях: Т = 220–280°С, Р = 1 МПа, Н2 : CO = 2 : 1, Vкат = 4 мл. Определение концентрации исходных реагентов и анализ продуктов реакции проводили на хроматографе (Хромос ГХ-1000) на следующих колонках: колонка с молекулярными ситами CaA для определения N2, H2 и O2, колонка HP/Plot Q для идентификации CH4, CO2 и CO и капиллярная колонка HP-FFAP для определения жидких углеводородов (спирты, эфиры и др.). Физико-химические характеристики катализаторов исследовали методами БЭТ, РФА, СЭМ и ТПВ-Н2.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Текстурные характеристики чистого носителя γ-Al2O3 и исследуемых катализаторов представлены в табл. 1. Чистый носитель γ-Al2O3 имеет развитую поверхность (Sуд = 180.0 м2/г) и удельный объем пор 0.084 см3/г. Из табл. 1 видно, что нанесение нитрата кобальта методами пропитки – Со(ГП) и Со(КП) приводит к большему снижению значений удельной поверхности и удельного объема пор γ-Al2O3 по сравнению с методом solution combustion Со(SC).
Таблица 1.
Результаты БЭТ (Vуд – удельный объем пор)
| Образец | Sуд, м2/г | Vуд, см3/г |
|---|---|---|
| γ-Al2O3 | 180.0 | 0.084 |
| Co(ГП) | 166.0 | 0.071 |
| Со(КП) | 170.2 | 0.072 |
| Со(SC) | 174.3 | 0.074 |
По данным РФА, во всех образцах основной кристаллической фазой является оксид кобальта Со3О4, а также образовавшаяся кристаллическая фаза шпинели СоAl2O4. Исследование кобальтовых катализаторов методом СЭМ (рис. 1) показало, что на микроснимках катализаторов Со(КП) и Co(ГП) наблюдаются более крупные частицы по сравнению с Со(SC). На СЭМ-снимке Со(SC) можно увидеть более равномерное распределение дисперсных аморфных частиц.
На ТПВ спектре (рис. 2) исследуемых катализаторов наблюдаются два интенсивных пика, которые относятся к двухступенчатому восстановлению Co3O4 в металлический кобальт через СоО, аналогичные результаты получены в работе [5]. Из рис. 2 видно, что на спектре Н2-ТПВ катализатора Со(КП) наблюдаются два интенсивных пика с максимумами при $Т_{{\max }}^{1}$ = 394°С и $Т_{{\max }}^{2}$ = 573°С, количество поглощенного водорода на восстановление оксидов кобальта составляет А1 = = 472 мкмоль/г и А2 = 962 мкмоль/г соответственно. На Н2-ТПВ-профиле Со(ГП) и Со(SC) также присутствуют два интенсивных пика с $Т_{{\max }}^{1}$ = = 390°С, А1 = 640 мкмоль/г, $Т_{{\max }}^{2}$ = 566°С, А2 = 1318 мкмоль/г и $Т_{{\max }}^{1}$ = 384°С, А1 = 588 мкмоль/г и $Т_{{\max }}^{2}$ = 532°С, А2 = 950 мкмоль/г соответственно. Сравнение полученных результатов показывает, что при приготовлении катализатора 15 мас. % Co/γ-Al2O3 методом solution combustion в ТПВ-спектрах пики, относящиеся к восстановлению оксида кобальта до Со0 (Со3О4 → СоО → Со0), смещались в низкотемпературную область по сравнению с наблюдаемыми для катализаторов, синтезированных методами обычной и капиллярной пропитки. Эти данные могут свидетельствовать о том, что при приготовлении 15 мас. % Co/γ-Al2O3 катализатора методом solution combustion облегчается восстановление оксидов кобальта и тем самым повышается активность катализатора.
Далее каталитическая активность полученных систем была исследована в процессах УКМ и Фишера–Тропша. На рис. 3 показаны результаты активности кобальтовых катализаторов в конверсии метана и диоксида углерода. Из рис. 3 видно, что конверсия метана и диоксида углерода до синтез-газа на катализаторе Со(SC), выше, чем на Со(ГП) и Со(КП). Это может быть связано с уменьшением площади поверхности и затруднением восстановления кобальтового катализатора, приготовленного методами глубокой и капиллярной пропитки, по сравнению с методом solution combustion (см. табл. 1, рис. 2).
Рис. 3.
Влияние метода приготовления 15 мас. % Co/γ-Al2O3 на активность в углекислотной конверсии метана.
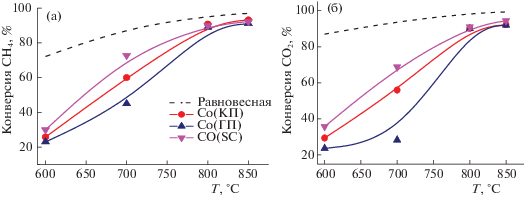
Исследование катализаторов в процессе Фишера–Тропша при 250°С и давлении 1 МПа показало, что активность Со(КП) и Со(ГП) в реакции конверсии синтез-газа оказалась более низкой по сравнению с Со(SC). Конверсия моноксида углерода на них составила 3.2 и 2% соответственно, тогда как на Со(SC) – 9%.
Таким образом, приготовление 15 мас. % Co2О3/γ-Al2O3 катализатора разными методами приводит к изменению его физико-химических свойств. Приготовление 15 мас. % Co/γ-Al2O3 методом solution combustion по сравнению с методами обычной и капиллярной пропитки облегчает восстановление оксидов кобальта, увеличивает дисперсность активной фазы катализатора и способствует равномерному распределению активной фазы на поверхности носителя, которая приводит к значительному повышению активности катализатора в изучаемых реакциях.
Работа выполнена по грантам МОН РК № BR05236359 и № AP05132114.
Список литературы
Лапидус А.Л., Цапкина М.В., Крылова А.Ю., Тонконогов Б.П. // Успехи химии. 2005. Т. 74 (6). С. 634.
Sun Y., Zhang G., Xu Y., Zhang Y. et al. // Fuel Processing Technology. 2019. V. 192. P. 1.
Gnanamani M.K., Jacobs G., Shafer W.D., Davis B.H. // Catalysis Today. 2013. V. 215. P. 13.
Dossumov K., Ergazieva G.E., Myltykbaeva et al. // Theoretical and Experimental Chemistry. 2019. V. 55(2). P. 137.
Jacobs G., Das T.K., Zhang Y., Li J. et al. // Applied Catalysis A: General. 2002. V. 223. P. 263.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии




