Журнал физической химии, 2020, T. 94, № 4, стр. 483-499
Концепция наноразмерных мембранных реакторов гидрирования с аккумулированным водородом
a Российская академия наук. Институт нефтехимического синтеза им. А.В. Топчиева
Москва, Россия
* E-mail: Soldatov@ips.ac.ru
Поступила в редакцию 29.04.2019
После доработки 11.07.2019
Принята к публикации 03.09.2019
Аннотация
Обобщены результаты исследований по разработке концепции наноразмерных мембранных реакторов (НРМР) нового поколения, в которых реакции гидрирования проводятся в порах переменного диаметра с использованием водорода, предварительно адсорбированного в моно- и многослойных ориентированных углеродных нанотрубках из графенов (ОУНТГ), сформированных на внутренней поверхности пор керамических мембран. В рамках этой задачи проведен сравнительный анализ морфологии таких углеродных наноструктур, как графены. ОУНТГ и нанокристаллиты пироуглерода (НКП), которую исследовали методами рентгенографического анализа, рентгеновской фотоэлектронной спектроскопии (РФЭС), спектроскопии комбинационного рассеяния (КРС) и просвечивающей электронной микроскопии (ПЭМ). Показано, что аккумулировать и сохранять водород способны только ОУНТГ. Рассмотрены механизм и закономерности адсорбции водорода в отмеченной наноструктуре. Проанализированы результаты некаталитического гидрирования децена-1 и нафталина в НРМР водородом, адсорбированным в ОУНТГ, и установлены кинетика и энергии активации этих реакций. Для оценки влияния субстрата, на котором синтезированы графеновые наноструктуры, проведен сравнительный анализ механизмов адсорбции водорода в ОУНТГ и в цилиндрических и планарных графеновых наноструктурах (ЦПГНС), сформированных на цеолитах. Сформулирована концепция НРМР и рассмотрены направления ее развития, включающие разработку методов формирования каталитически активных металлсодержащих центров в их структуре и влияние стерического фактора конфигурации нанореактора на селективное гидрирование органических субстратов различной природы.
В настоящее время развитие работ по синтезу и изучению наноструктур углеродного состава является неоспоримым приоритетом. Среди всего многообразия тематик исследованию нанотрубок, фуллеренов, графенов, графанов, графдинов, графдиновых нанотрубок, обладающих уникальными поверхностно-адсорбционными и электронно-эмиссионными свойствами, уделяется наибольшее внимание [1–26 ].
Поскольку в настоящей работе приведены результаты исследований адсорбции водорода в ОУНТГ и некаталитических реакций гидрирования с его использованием, кратко рассмотрим лишь публикации, затрагивающие водород-адсорбционные свойства углеродных нанотрубок. Это связано с тем, что литературные данные по некаталитическому гидрированию химических соединений адсорбированным водородом, на сегодняшний день отсутствуют.
В 1997 г. были опубликованы первые экспериментальные результаты, указывающие на повышенную сорбцию водорода (5–10 мас. % при нормальных условиях) материалом, содержащим одностенные углеродные нанотрубки [27]. Последующие многочисленные исследования сорбции водорода различными утлеродными наноматериалами, и их допированными металлами модификациями, подтвердили, что требуемый уровень сорбции водорода при комнатной температуре и приемлемом давлении принципиально достижим, но трудно реализуем [28–35].
В [27] углеродный материал, полученный электродуговым методом и содержащий несколько мас. % однослойных углеродных НТ (нанотрубок) в виде пучков из 7–14 НТ, аморфный углерод и ∼20% частиц катализатора. Например, Сo адсорбирует, в пересчете на чистые ОНТ (однослойные нанотрубоки), 5–10 мас. % Н2 при давлении Н2 300 Торр и температуре 293 K с последующим охлаждением до 90 K. Согласно данным по температурно-программируемой десорбции (TПД), водород десорбируется из нанотрубок и активированного угля при температуре 133 K. Однако, если образец подвергнуть обработке, которая позволит открыть торцевые “заглушки” на концах ОНТ, то на кривой ТПД наблюдается второй пик выделения водорода при температуре, близкой к комнатной (290 K).
Появление этого пика связывают с выделением водорода, адсорбированного во внутреннем канале ОНТ в результате проникновения молекул Н2 через открытые концы трубок.
На неочищенных образцах ОНТ (содержание закрытых ОНТ 20–30%), полученных методом лазерного испарения графита в присутствии катализатора, адсорбировали водород (давление 11 МПа) при комнатной температуре с последующим охлаждением до 25 K [36]. Оцененная водородсорбционная способность этих образцов составляет ∼0.5 мас. %. В спектре неупругого рассеяния нейтронов (НРН) для водорода, адсорбированного пучком ОНТ, присутствует единственный пик при ∼14.5 мэВ. Вид НРН спектра свидетельствует о локализации водорода на поверхности носителя.
Количество адсорбированного водорода (чистота 99.9999%) для относительно чистых ОНТ, полученных лазерным методом [37, 38], составляет более 8 мас. % при давлениях 10–12 МПа и температуре 80 K [39]. При этом средний диаметр и удельная поверхность отдельной ОНТ равны соответственно ∼1.3 нм и 1300 м2/г. Диаметр пучков ОНТ составляет ∼6–12 нм. Внешняя удельная поверхность пучков, измеренная методом Брунауэра–Эммета–Теллера, равна 285 ± 5 м2/г. Количество адсорбированного водорода зависит от числа циклов сорбция–десорбция. Для свежеприготовленных образцов чистых ОНТ отношение H : C ≈ ≈ 1 (∼8.25 мас. % Н2) достигалось при 80 K и давлении Н2 7 МПа. Водород сначала сорбируется на внешней поверхности пучка. Увеличение количества поглощенного Н2, наблюдаемое с ростом давления до 12 Мпа, связывают с проникновением молекул Н2 в межтрубное пространство пучков. В результате межтрубное расстояние увеличивается, и пучок разделяется на отдельные ОНТ, при этом наблюдается заполнение внешней и частично внутренней поверхностей трубок молекулами Н2. Увеличение расстояния между трубками внутри пучка ОНТ можно зарегистрировать с помощью рентгеновской дифракции и спектроскопии ЯМР [40].
В работе [41] углеродные ОНТ синтезировали электродуговым методом (с выходом до 2 г ОНТ/ч) в присутствии водорода. В качестве катализатора использовали порошок никеля, кобальта и железа (Ni : Co : Fe = 3 : 0.75 : 0.75 ат. %). Содержание ОНТ в полученном углеродном материале составляет ∼60%. При этом средний размер ОНТ равен 1.85 нм, а диаметр пучков ОНТ ∼ 20 нм. После обработки образцов ОНТ, включающей в том числе их прогрев при 770 K, количество адсорбированного водорода (99.999% чистоты) при комнатной температуре и давлении Н2 10 МПа составляло 4.2 мас. % Н2, что соответствует соотношению Н/С = 0.52. До 78% этого водорода десорбировалось при нормальных условиях. Оставшийся водород (от 0.52 до 0.95 мас. % для разных образцов ОНТ) десорбировался при нагревании образца до 423 K.
Количество водорода, поглощаемое углеродными НТ (диаметр 50–100 нм), синтезированными при плазменном разложении углеродных волокон, составляет 5–7 мас. % при комнатной температуре и повышенном давлении Н2 (10 атм). Обработка НТ, которая включает прогрев образцов до 573 K и удаление металлических частиц, повышает сорбционную способность НТ в отношении водорода до 13 мас. %. Десорбция водорода происходит при нагревании образца до 573 K [42].
Исследования водородсорбционных свойств углеродного материала, полученного электродуговым методом [43] и содержащего ∼70 мас. % однослойных НТ, показали, что он адсорбирует ∼3.5 мас. % водорода при 10 МПа и повторении циклов “охлаждение до 77 К ⇔ нагрев до 300 K”. Следует отметить сообщение о поглощении водорода ОНТ в количестве до 6.5–7.0 мас. % при комнатной температуре и давлении 0.1 МПа [44].
Предварительная ультразвуковая обработка ОНТ с использованием сплава TiAl0.1V0.04 привела к поглощению до 7 мас. % водорода, причем 2.5 мас. % выделялось при 300 K, а десорбция оставшегося Н2 наблюдалась в интервале 475–800 K. Данная обработка НТ используется не только для разрезания нанотрубок, но и позволяет вводить частицы сплава в углеродный материал. Предполагается, что присутствие водородсорбирующего сплава может стимулировать поглощение Н2 и углеродным наноматериалом [45].
В [46] углеродные нанотрубки (УНТ) синтезировали методом CVD с использованием в качестве катализатора водородсорбирующего сплава LaNi5. Обработку поверхности сплава раствором КОН использовали для создания каталитически активных мест роста УНТ. Согласно данным туннельной микроскопии, получающиеся нанотрубки не являются однослойными. Композит УНТ – водородсорбирующий сплав – с большой вероятностью также найдет применение при разработке реальных систем хранения водорода.
Ультразвуковая обработка ОНТ в азотной кислоте (5 М) приводит к внедрению в углеродный материал металлических частиц из материала прибора (например, сплава Ti-6Al-4V), концентрация которых зависит от времени облучения [47]. Наблюдающееся поглощение Н2 модифицированным таким образом углеродным материалом связывают со способностью Ti-содержащего сплава поглощать водород при комнатной температуре. Поглощение водорода при комнатной температуре не наблюдалось при замене материала ультразвуковой ванны, а именно при использовании стали вместо Ti-содержащего сплава.
На величину удельной поверхности и газосорбционную емкость углеродных материалов существенное влияние оказывает предварительная термическая обработка. В работах [48, 49] показано, что нагревание выше 600 K в вакууме ОНТ, предварительно подвергнутых кислотному травлению, ведет к выделению таких газов, как CH4, CO, CO2 и H2. В результате количества ксенона, адсорбируемого ими при 95 K значительно увеличивается. Образцы ОНТ, отожженные при 1073 K, поглощают в 20 раз больше Xe, чем образцы, прогретые при 623 K. Увеличение адсорбционной способности ОНТ авторы объясняют тем, что при высокотемпературном отжиге удаляются блокирующие карбоксильные группы, находящиеся на концах НТ и дефектах стенки, при сохранении молекулярной структуры ОНТ. Отмечается высокая вероятность того, что такая термообработка должна влиять и на величину адсорбционной емкости водорода.
В работах [50–53] изучена возможность аккумулировать водород в ОНТ и композитах ОНТ с Ni и политетрафторэтиленом (ПТФЭ) электрохимически, причем этот процесс обратим. Отметим, что обзор наиболее заметных экспериментальных и теоретических работ по электрохимической сорбции водорода УНТ представлен в работе [54].
Компьютерное моделирование взаимодействия атомов водорода или дейтерия с НТ показало, что при энергии до 100 эВ на атом закрытые углеродные нанотрубки могут служить ловушкой для легких атомов [55]. С целью определения максимальной водородсорбционной емкости НТ рассмотрено проникновение атомов водорода через стенку ОНТ при низкоэнергетическом столкновении стенка–атом [56]. В качестве модельного объекта выбраны ОНТ с диаметром 0.683 нм, состоящие из 150 атомов углерода. Оба конца ОНТ закрыты полусферами С60. Проанализированы различные случаи, возникающие при столкновении стенка ОНТ – атом водорода. Отмечается, что благоприятная для адсорбции область энергий лежит в интервале 1–3 эВ при условии, что удар атома водорода приходится на область вблизи вершины гексагона.
Расчеты [57] показывают, что при использовании оптимизированных значений энергий атомы водорода могут быть сохранены в ОНТ; введенные атомы водорода формируют молекулы водорода и конденсируются с образованием жидкой фазы. Знание благоприятных условий для имплантации атомов водорода внутрь ОНТ (образование комплексов Н@ОНТ и Н2@ОНТ) позволяет рассчитать максимальную водород-сорбционную емкость ОНТ при комнатной температуре [57]. Объемная плотность водорода, сохраненного в ОНТ, может достигать 132.4 кг/м3.
Максимальное содержание водорода в образцах углеродных нанотрубок, восстановленных дигидроантраценом при 623 K или литием в условиях модифицированного метода Берча, отвечает соответственно составам C9H–C10H и C8H [57, 58], что в несколько раз меньше, чем в системах, использующих физическую адсорбцию водорода при высоких давлениях. Водород в данном случае химически связан с углеродом, поскольку нагревание полученных водородсодержащих производных нанотрубок приводит к выделению водорода только при 773 K [58].
Для цилиндрических образцов (d ∼ 7 мм), полученных холодным прессованием смеси 10 мг одностенных нанотрубок (ОСНТ) и порошка золота (90 мг), проводили электрохимическую адсорбцию водорода, которая достигала 0.9 мас. %. [59]. Авторы отмечают, что при 293 K около половины водорода десорбируется из образцов в первые 10 ч выдержки, остальная часть – за ∼200 ч. В этой же работе показано, что при термодесорбции водорода из ОСНТ-образцов, при нагревании последних со скоростью ∼0.067 K/с (в области температур от 78 до 800 K), наблюдаются пики при ∼105, ∼136 и ∼300 K.
В [60] изучена сорбция водорода двумя типами многостенных нанотрубок (МСНТ) разной структуры. Образцы насыщали водородом в течение 5 ч при 4 МПа и 300 K (с последующим их охлаждением до 80 K) и изучали методом температурно-программируемой десорбции (ТПД) (при и ${v}$ = 0.03–0.08 K/с). Образцы первого типа (А) представляли собой сильноизогнутые нанотрубки с дефектными графеновыми слоями и частично заблокированными наноотверстиями. Большинство трубок имело закрытые концы. Внешний диаметр трубок, по оценке авторов, составлял 10–30 нм, внутренний ∼5–15 нм, удельная поверхность Sуд(А) ∼ 174 м2/г. Для образцов А наблюдали два ТПД-пика: в области 312 и 419 K. Первый пик появлялся и при повторных циклах адсорбции водорода и нагрева образцов, тогда как второй пик в повторных циклах не проявлялся.
Поглощение водорода образцами УНТ при 10 МПа и комнатной температуре изучено в работе [61]. Авторы использовали образцы двух типов: первый – S-УНТ, полученный при использовании кристаллического катализатора, и второй – F-УНТ, синтезированный с циркулирующим катализатором. Установлено, что отжиг образцов в температурном интервале 1800–2200°С повышает адсорбцию водорода с 1.81 до 3.98 для F-УНТ и с 0.65 до 0.81 мас. % для S-УНТ соответственно, причем адсорбция в исходных образцах составляла 1.29 и 0.73 мас. % соответственно.
Авторы [62] изучали сорбцию водорода МСНТ-образцами диаметром 10–40 нм (преимущественно с закрытыми концами нанотрубок) при 290 K и давлении Н2 3–10 МПа. Использовали два типа образцов: образцы А с выпрямленными высокоориентированными нанотрубками (Sуд(А) ∼ 60 м2/г) и образцы В с хаотичным расположением нанотрубок (Sуд(B) ∼ 27 м2/г). Для МСНТ-образцов А и В наблюдали пропорциональное увеличение количества адсорбированного водорода с увеличением его давления от 3 до 10 МПа, причем для образцов А оно составило 2.4, а для В – 0.6 мас. %.
В работе [63] определяли сорбционные характеристики спрямленных (ориентированных) нанотрубок диаметром 50–100 нм, синтезированных CVD-методом. Адсорбцию водорода проводили при температуре 295 K и давлении 0.1 или 1.0 МПа, используя как образцы без обработки, так и образцы, прогретые до 300°C с удалением остаточного катализатора. С использованием квадрупольной масс-спектроскопии и термогравиметрического анализа (ТГА) показано, что для образцов первого типа адсорбция водорода составила 5–7, а для второго – до 13 мас. %.
При исследовании адсорбции водорода УНТ и пористыми материалами, в частности, молекулярными ситами (МС), в [64] показано, что повышение их удельной проводимости увеличивает поглощение Н2. Установлено, что при высокой удельной проводимости, достигающей 0.97 Вт/(м K), адсорбция водорода составляет 17.3 и 15.6 мл/г для УНТ и МС соответственно.
С использованием термодинамики и кинетики исследована хемосорбция водорода углеродными нанотрубками, что позволило получить выражения для изотермы адсорбции и кинетики десорбции [65]. Разработаны методы получения параметров хемосорбции. Определена парциальная свободная энергия связи водорода с УНТ, составившая 3.6 эВ. Показано, что в процессе длительного отжига при повышенных температурах из УНТ удаляются остаточные продукты синтеза. Проведена оценка емкости углеродной нанотрубки по отношению к хемосорбированному водороду, которая дает величину 4 мас. %.
В работе [66] проведено молекулярно-динамическое моделирование процессов физической адсорбции водорода углеродными нанотрубками. Их взаимодействия описывались потенциалом Леннарда-Джонса, при этом квантовые эффекты не учитывались. Получены зависимости относительного массового содержания адсорбированного водорода от давления и температуры. Обнаружено, что при низких температурах возможно образование второго слоя адсорбированного водорода, что приводит к повышению его содержания в УНТ.
С использованием теории функционала электронной плотности (DFT) проведена оценка влияния на адсорбцию водорода таких факторов, как кривизна поверхности и присутствие атомов примеси [67]. Рассматривалась адсорбция молекул H2 на внутренней и внешней поверхностях чистых и легированных литием УНТ разного радиуса. Численные эксперименты проводились в пакете SIESTA в двух приближениях для обменно-корреляционного потенциала: GGA и LDA. Моделирование адсорбции водорода на поверхности чистых нанотрубок показало, что знак кривизны поверхности УНТ значительно влияет на энергию адсорбции, при этом для внутренней адсорбции величина Eадс в 2–5 раз больше, чем для внешней, и чем больше кривизна поверхности, тем больше это различие. Легирование литием позволяет увеличить энергию адсорбции молекулы водорода на 30–100 мэВ, при этом наименьшее влияние оказывается на сорбцию на внутренней поверхности, особенно для трубок малого радиуса (Eадс комплекса УНТ@Li увеличивается на ∼10% по сравнению с чистой УНТ (5.5), а для нанотрубки (9.9) этот показатель достигает уже 30%).
В [68] с использованием периодической модели Андерсона описана электронная подсистема для УНТ с адсорбированным водородом. В низкотемпературном режиме изучена объединенная динамика электронов и электромагнитного поля, а также получено уравнение, описывающее распространение ультракоротких оптических импульсов.
В обзоре [69] проанализированы работы по адсорбции и хранению водорода в таких углеродных наноструктурах как графит, графитовые нановолокна и ОСНТ. Измерение адсорбции проводили с использованием термодесорбционной спектроскопии. Авторы отмечают, что обратимым процесс адсорбции является только для ОСНТ, причем для открытых трубок адсорбционная способность существенно выше.
В [70] исследована адсорбция водорода в композите МСНТ и наночастиц Mn3O4 при 298 K и давлении водорода 4.0 MПa. Наноструктурные исследования исходных МСНТ и композита проведены с использованием рентгеновского анализа, ТГА, сканирующей электронной микроскопии (СЭМ) и просвечивающей электронной микроскопии (ПЭМ). Показано, что водород-адсорбционная способность повышается с 0.26 (для исходных МСНТ) до 0.94 мас. % для композита. Авторы объясняют этот эффект механизмом спилловера водорода от наночастиц Mn3O4 к МСНТ.
В работе [71] исследовали повышение адсорбционной способности МСНТ к водороду после нанесения наночастиц никеля методом лазерной абляции (ЛА). Показано, что ЛА индуцирует формирование пор вокруг МСНТ, причем наблюдается существенное преобладание пор малых размеров. Установлено, что максимальная адсорбционная емкость МСНТ по водороду достигает 0.6% (мас.) при нанесении путем ЛА 13% (мас.) никеля.
Адсорбция водорода в композитах наночастицы MnO–МСНТ, полученных методом восстановления in situ, исследована в [72]. Полученные образцы изучали методами рентгеноструктурного анализа, ТГА, СЭМ и ПЭМ. Установлено, что адсорбция водорода в композитах увеличивается в ∼3 раза: с 0.26 до 0.94 мас. %. Авторы связывают увеличение водород-адсорбционной способности композита с реализацией механизма спилловера при формировании наночастиц оксида Mn на внешней поверхности МСНТ. Помимо этого, композит проявляет значительную стабильность при циклической адсорбции–десорбции водорода.
Приведенные литературные данные показывают, что основная задача исследований адсорбции водорода в УНТ заключается в достижении ее максимальной величины. С этой целью проводят физико-химическую обработку УНТ, синтезируют их композиты с наночастицами различного состава и т.п. Для нашего исследования наиболее интересными вопросами, связанными с адсорбцией водорода, являются механизм его взаимодействия с УНТ и количественные характеристики.
Цель настоящей работы – обобщение и систематизация результатов исследований по разработке концепции наноразмерных мембранных реакторов нового поколения, с аккумулированным водородом и регулируемым объемом реакционной зоны [73–80]. Этими реакторами служат поры керамических мембран, в которых проводятся реакции некаталитического гидрирования с использованием водорода, предварительно адсорбированного в моно- и многослойных ориентированных углеродных нанотрубках из графенов, сформированных на их внутренней поверхности. Затем поры заполняют реагентом и проводят его гидрирование с использованием аккумулированного в ОУНТГ водорода. Также рассматривается принцип регулировки и контроля объема реакционной зоны НРМР, который заключается в том, что предварительно диаметр пор уменьшают до желаемого размера путем формирования на их поверхности нанокристаллитов пироуглерода (НКП) [81]. Таким образом, можно создавать нанореакторы молекулярных размеров и проводить реакции гидрирования в определенные положения, синтезируя новые химические соединения. Например, впервые появляется возможность провести селективное гидрирование нафталина в положения 2.3 и 7.8 путем уменьшения диаметра пор до значений 0.27–0.30 нм, что делает возможным лишь такую ориентацию молекул в порах, когда в силу стерических затруднений для гидрирования будут доступны только отмеченные положения.
Помимо этого, приведены результаты исследования адсорбции водорода в цилиндрических и планарных графеновых наноструктурах, сформированных на цеолитах ЦВМ и ЦВН. Сравнительный анализ механизмов адсорбции водорода в ОУНТГ и ЦПГНС позволил изучить взаимодействие подложки с графеновыми наноструктурами, синтезированными на ее поверхности, и впервые выявить ее влияние на адсорбцию водорода.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
ОУНТГ и ЦПГНС синтезировали при 800°С на установке с кварцевым реактором, используя в качестве пиролизуемого реагента сетевой метан по методике, описанной в [78]. ОУНТГ в порах ультрафильтрационных композиционных мембран “TRUMEM” (TiO2 + Cr2O3 и TiO2 + MgO на пористой стали), имевших форму дисков с D = = 47 мм, толщину селективного слоя ∼20 мкм и Dпор = 50 и 90 нм соответственно. Пористость ∼25–35%, площадь поверхности пор ∼1.7 и 1.9 м2. ЦПГНС на цеолитах ЦВМ и ЦВН. Первый имел величину мольного отношения SiO2/Al2O3 – 25 с “оксидной” формулой: l.2Na2O · Аl2О3 · 25SiO2 (4.43% натрия в пересчете на оксид). У цеолита типа ЦВН величина мольного отношения SiO2/Al2O3 составляла 55 с “оксидной” формулой 0.14Na2O · 0.86Н2O · Аl2О3 · 55SiO2 (0.25 мас. % оксида натрия). Предварительно цеолиты прогревали в вакууме (∼1.0 мм рт. ст.) при температуре формирования ЦПГНС – 800°С.
Методики проведения экспериментов и методы исследования исходных и конечных продуктов изложены в [73–80].
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Очевидно, что первым этапом при создании концепции НРМР гидрирования с аккумулированным в ОУНТГ водородом, является исследование их морфологии, водород-адсорбционных свойств и взаимозависимости этих характеристик. С этой целью были синтезированы ОУНТГ, причем количество углерода, необходимое и достаточное для образования его монослоя на поверхности пор, рассчитывали по формуле:
(1)
${{m}_{{{\text{м - ст}}{\text{.ОУНТГ}}}}} = \frac{{{{S}_{{{\text{ПВ}}}}}Mn}}{{{{S}_{{\text{c}}}}N}},$При выводе формулы были сделаны следующие допущения: ориентация наносимых графеновых фрагментов параллельна поверхности поры; количество конденсированных углеродных колец во всех графенах, сформированных на поровой поверхности, одинаково и равно 7. Отметим, что масса углерода, необходимая для образования монослоя на этих мембранах, согласно (1), составляет 2.6 и 2.9 мг соответственно. Ясно, что при нанесении на поровую поверхность мембраны массы углерода, рассчитанной по (1), мы получаем монослойные углеродные нанотрубки, впаянные в поры. При его уменьшении ОУНТГ трансформируются в отдельные монослоевые углеродные фрагменты, имеющие структуру графенов, а при его увеличении – произойдет формирование НКП.
Образование монослоя углерода на поровой поверхности мембран идентифицировали методом РФЭС путем сравнительного анализа спектров исходной мембраны (образец 2), мембраны, прогретой в вакууме при температуре нанесения пироуглерода (образец 3), и мембраны, на которую был нанесен графеновый монослой (0.0028 г, образец 1). Спектры анализировали с учетом положительной зарядки поверхности образцов за счет эмиссии электронов. Для этого при определении энергий связи, положение пиков в спектре смещали на величину ΔЕ, которую определяли по адсорбированному углероду (АС) в образце исходной мембраны (№ 2), поскольку в других образцах после термообработки (№ 3) или после нанесения монослоя графенов (№ 1) состояние углерода на поверхности неизвестно. В спектре этого образца (№ 2) определяли сдвиг пика АС относительно положения максимума пика кислорода в TiO2 (O1s – 529.75 эВ) (рис. 1а), и это значение использовали в образцах 1 и 3 для определения ΔЕ.
Рис. 1.
РФЭС высокого разрешения образцов 1–3: кислород O1s (a), титан Ti2p (б) и углерод C1s (в) при значении угла в 45°.

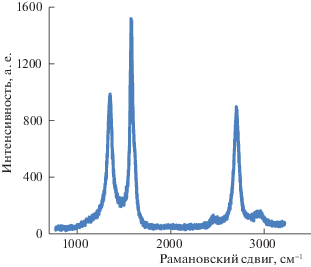
Анализ спектров показал, что пики титана совпадали во всех образцах (рис. 1б) и соответствовали диоксиду титана. Пики углерода одинаково расположены только для образцов 2 и 3, и они соответствуют АС, тогда как пик углерода в образце 1 смещен относительно двух других в сторону меньших энергий – 284.3 эВ (рис. 1в). Это свидетельствует о том, что на поверхности образца 1 присутствует пленка чистого углерода. То, что эта пленка имеет графеновую структуру, было показано методами КРС и ПЭМ. На рис. 2 приведен рамановский спектр синтезированных углеродных структур. Вид спектра в области 2400–3200 см–1 (узкая полоса 2Д в области 2700 см–1, а также справа и слева от нее широкие полосы) соответствует спектру графена с числом слоев ≥5. В то же время в образце, по-видимому, присутствует как примесь наноразмерный графит с размером кластера ∼5 нм.
Электронно-микроскопическое изображение с высоким разрешением углеродной пленки, нанесенной на мембрану, (рис. 3) показывает, что на оксидах, в виде шаров, из которых сформирован селективный слой мембраны, присутствуют структуры, состоящие из нескольких графеновых слоев.
Изложенное выше показывает, что разработанная методика синтеза позволяет получать графеновые структуры, которые можно синтезировать на поровой поверхности мембран как в виде отдельных фрагментов, так и в форме ОУНТГ. Помимо этого, в порах мембран формировали НКП, методика получения которых и их рентгенографическое исследование, показавшее, что они имеют совершенную графитовую структуру, приведены в [82].
Для определения способности графенов, ОУНТГ и НКП к адсорбции водорода и исследования ее количественных закономерностей, данные структуры насыщали Н2, а затем с использованием термогравиметрического анализа, совмещенного с масс-спектрометрическим анализом, определяли температуру его десорбции. На рис. 4 приведены типичные масс-спектры, полученные при исследовании мембраны, на которой были синтезированы ОУНТГ (а) и мембран, на которых были синтезированы НКП и отдельные графеновые фрагменты (б). При получении графенов количество осажденного наноуглерода было менее 0.3 от необходимого для образования монослоя (расчет по (1)). Отметим, что эти образцы насыщали водородом в одном автоклаве.
Рис. 4.
Изменение массы (1) и ионного тока (2) при m/e = 2 для мембраны, в порах которой синтезированы ОУНТГ (а) и графеновые фрагменты или НКП (б) и проведено их насыщение водородом.
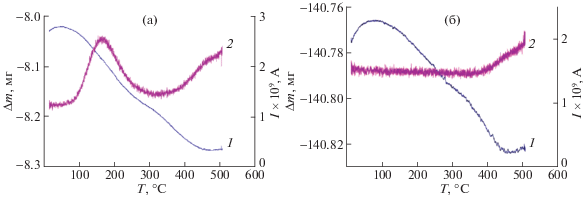
В первом случае (рис. 4а) наблюдается изменение ионного тока (2) для m/e = 2 (водород) при температуре 170–180°С, которая соответствует десорбции Н2 из ОУНТГ. Это сопровождается уменьшением массы образца 1, которое происходит в результате десорбции водорода и адсорбированной воды. Видно, что десорбция водорода заканчивается при ∼340°С (рис. 4а). В связи с этим при определении количества водорода, аккумулированного в ОУНТГ, его десорбцию проводили при 350°С. В то же время на масс-спектрах мембран, на которых были синтезированы НКП и отдельные графеновые фрагменты, пик ионного тока для m/e = 2 отсутствует (рис. 4б). Поскольку для этих структур масс-спектры идентичны, в работе приведен только один из них.
Определение количества адсорбированного в ОУНТГ водорода проводили с использованием хроматографического анализа. В табл. 1 приведены полученные результаты. Видно, что адсорбция достигает 52.1 см3/г или 1.5% от массы ОУНТГ. Отметим, что количество водорода, адсорбируемое при комнатной температуре обычными углеродными нанотрубками, составляет ∼0.3 или 4.0–6.0% от их массы [83–87].
Таблица 1.
Количество водорода, адсорбированного в ОУНТГ, Тдес = 350°С
| Образцы | Dпор, нм | m, мг | m1, мг | ${v}$, см3/г |
|---|---|---|---|---|
| 1 | 50 | 6.6 | 0.02 | 33.7 |
| 3 | » | 6.4 | 0.03 | 52.1 |
| 4 | » | 5.7 | 0.01 | 19.5 |
| 5 | » | 6.5 | 0.01 | 17.1 |
| 6 | » | 7.1 | 0.015 | 15.7 |
| 7 | » | 6.6 | 0.02 | 33.7 |
| 8 | 90 | 7.5 | 0.005 | 14.8 |
| 9 | » | 6.1 | 0.01 | 18.2 |
| 10 | » | 6.0 | 0.015 | 27.8 |
| 11 | » | 5.7 | 0.02 | 48.7 |
| 12 | » | 6.4 | 0.015 | 26.0 |
| 13 | » | 6.7 | 0.01 | 16.6 |
| 14 | » | 7.7 | 0.01 | 14.4 |
| 15 | » | 7.9 | 0.015 | 21.1 |
| Σ 98.0 | Σ 0.23 | Аср 27.0 |
В табл. 2 приведены результаты адсорбции и хранения водорода в ОУНТГ, а на рис. 5 – зависимость удельной адсорбции водорода в ОУНТГ от соотношения mн/mр, которое является отношением массы реально нанесенного углерода к рассчитанному по (1) количеству углерода, необходимого для получения монослоевого покрытия поровой поверхности, т.е. образованию ОУНТГ.
Таблица 2.
Адсорбция и хранение водорода в ОУНТГ (образцы 1–10), НКП (образцы 11–13) и графенах (образцы 14, 15); ${{P}_{{{{{\text{H}}}_{2}}}}}$ = 11.0–12.5 МПа
| №* | $m_{{\text{c}}}^{{{\text{*}}{\kern 1pt} {\text{*}}}}$, мг | $m_{{{{{\text{H}}}_{2}}}}^{{{\text{*}}{\kern 1pt} {\text{*}}}}$ × 102, мг | А***, % | $A_{{25}}^{{{\text{*}}{\kern 1pt} {\text{*}}{\kern 1pt} {\text{*}}}}$, % | $A_{{60}}^{{{\text{*}}{\kern 1pt} {\text{*}}{\kern 1pt} {\text{*}}}}$, % | Aуд × 103, мг/монослой |
|---|---|---|---|---|---|---|
| 1 | 2.4 | 1.6 | 11.7 | 11.2 | 13.7 | |
| 2 | 1.4 | 0.7 | 5.0 | 5.0 | 5.0 | 7.1 |
| 3 | 5.3 | 1.8 | 3.4 | 3.4 | 4.7 | |
| 4 | 18.6 | 9.4 | 5.4 | 5.4 | 5.1 | 7.8 |
| 5 | 19.6 | 4.5 | 2.3 | 2.3 | 2.3 | 4.1 |
| 6 | 2.0 | 2.8 | 14.0 | 12.9 | 11.0 | 23.7 |
| 7 | 2.2 | 2.6 | 11.8 | 11.0 | 10.5 | 7.2 |
| 8 | 2.4 | 1.3 | 5.4 | 5.4 | 10.0 | |
| 9 | 6.2 | 1.2 | 1.9 | 1.9 | 3.0 | |
| 10 | 2.0 | 1.5 | 7.5 | 7.4 | 11.5 | |
| 11 | 18.6 | – | ||||
| 12 | 12.7 | – | ||||
| 13 | 10.9 | – | ||||
| 14 | 0.73 | – | ||||
| 15 | 0.69 | – |
* – при получении образцов 1–5 использовали исходные мембраны с Dпор = 50 нм, а для образцов 6–10 – 90 нм; на образцах 3, 4, 5 и 9 синтезированы полислойные ОУНТГ;
Полученная кривая имеет максимум при соотношении mн/mр = 1.2.
Это свидетельствует о том, что при нанесении именно такого количества углерода на поровую поверхность мы получаем наиболее совершенную структуру ОУНТГ, обладающую максимальной адсорбционной способностью по водороду. Вероятно, при mн/mр = 1.2 углеродное покрытие поровой поверхности наиболее близко к монослоевому и содержит минимум дефектов. При увеличении этого соотношения, помимо монослоевого нанесения появляются области, где формируются двухслоевые кристаллиты, которые не способны адсорбировать водород. Когда значение mн/mр достигает ∼1.5–1.7 и выше, мы получаем графитовую структуру, у которой способность аккумулировать водород отсутствует (образцы 11–13 в табл. 2).
Аналогичную картину наблюдаем и при mн/mр < 1.2 (рис. 5). В этом случае на поверхности пор остаются участки, на которых углеродное покрытие отсутствует, оно становится фрагментарным. Нанесенный углеродный монослой имеет морфологию “островов”, а при достижении значения mн/mр ∼ 0.4–0.6 его водород-адсорбционная способность пропадает (образцы 14, 15 в табл. 2). Таким образом, отношение mн/mр можно рассматривать как численный фактор (обозначим его Ψ), характеризующий способность ОУНТГ адсорбировать и сохранять водород, т.е., если для синтезированных ОУНТГ выполняется соотношение:
то они обладают водород-адсорбционной способностью.Поскольку реальная поверхность пор больше, чем поверхность идеального цилиндра, за счет определенной извилистости, наличия различных структурных дефектов, являющихся местами с аномальным адсорбционным потенциалом [87], максимальная адсорбция водорода наблюдается при Ψ = 1.2.
Удельную адсорбцию водорода в ОУНТГ можно описать зависимостью:
где b > 0, c < 0.Таким образом, из трех, близких по морфологии наноструктур, адсорбировать и сохранять водород способны только ОУНТГ. Причина этого феномена, возможно, связана с тем, что ОУНТГ – замкнутая цилиндрическая структура. Молекулы водорода диффундируют по ее замкнутой поверхности, оставаясь адсорбированными в углеродной наноструктуре. Даже в области Ψ < 1.2 и до Ψ = 0.4 (рис. 5), когда структура ОУНТГ становится дефектной, и на поверхности пор появляются участки, не покрытые монослоем углерода, их водород-адсорбционная способность сохраняется. Видимо, при Ψ = 0.4 в ОУНТГ еще сохраняются отдельные области с замкнутой цилиндрической структурой, по которым происходит диффузия молекул водорода, при этом их удерживает в ОУНТГ высокая поверхностная энергия углеродной наноструктуры.
При значениях Ψ < 0.4 наноуглеродное покрытие поровой поверхности приобретает вид отдельных, не связанных между собой графеновых фрагментов, не способных адсорбировать водород (табл. 2, рис. 5). Видимо, в этом случае, поскольку площадь графенов невелика, их поверхностной энергии недостаточно для удержания молекул водорода. Способность адсорбировать водород исчезает и при Ψ > 1.7 (табл. 2, рис. 5). В этом случае на большей части поровой поверхности образуются НКП, у которых водород-адсорбционная способность отсутствует. При образовании нанокристаллитов существенно возрастает энергия межслоевого взаимодействия, а величина поверхностной энергии уменьшается.
Проведенное исследование морфологии углеродных наноструктур показало, что ОУНТГ являются графеновой структурой, способной адсорбировать и сохранять водород. Следовательно, каждую пору мембраны, на поверхности которой синтезирована ОУНТГ, и в ней адсорбирован водород, можно рассматривать как НРМР гидрирования. В связи с этим были проведены исследования некаталитического гидрирования децена-1 и нафталина в НРМР с использованием аккумулированного в ОУНТГ водорода.
Известно [88–90], что некаталитическое гидрирование ненасыщенных соединений происходит при высоких температурах, близких к температуре их деструкции. Полагая, что химическая активность водорода, аккумулированного в ОУНТГ, значительно выше, чем у молекулярного, максимальной температурой гидрирования децена-1 было выбрано значение 350°С, которое уменьшали до 300, 275 и 250°С. Небольшие интервалы уменьшения температуры (25°С) вполне оправданы, поскольку было важно определить минимальную, или близкую к ней, температуру, при которой реакция еще протекает, учитывая, что степень конверсии децена-1 невелика.
Хроматографический анализ продуктов реакции подтверждает указанное предположение, поскольку даже при 250°С происходит некаталитическое гидрирование децена-1 (табл. 3), причем содержание декана (∼0.35%) в исходном децене-1 учитывали при определении конверсии. В то же время при повторении опытов 3. 5 и 9, но с молекулярным водородом, который вводили в реактор в количестве, на порядок превышающем количество Н2, адсорбированного в ОУНТГ, гидрирования децена-1 не происходит (табл. 3, образцы 3*. 5* и 9*).
Таблица 3.
Некаталитическое гидрирование 1-децена в наноразмерных мембранных реакторах с использованием аккумулированного в ОУНТГ водорода (Δm – повышение содержания декана)
| № | Т, °С | τ, ч | ${{P}_{{{{{\text{H}}}_{2}}}}}$, МПа | Δm, % |
|---|---|---|---|---|
| 1 | 350 | 2.0 | 6.0 | 0.71 ± 0.02 |
| 2 | » | 3.0 | » | 0.99 ± 0.05 |
| 3 | » | 3.5 | » | 1.14 ± 0.05 |
| 4 | » | 6.5 | » | 1.40 ± 0.04 |
| 5 | » | 9.5 | » | 1.75 ± 0.02 |
| 6 | 300 | 6.0 | 6.0 | 0.31 ± 0.01 |
| 7 | » | 10.0 | » | 0.43 ± 0.02 |
| 8 | » | 14.0 | » | 0.53 ± 0.01 |
| 9 | » | 18.0 | » | 0.64 ± 0.01 |
| 10 | 275 | 7.0 | 6.0 | 0.13 ± 0.01 |
| 11 | » | 11.0 | » | 0.21 ± 0.02 |
| 12 | » | 15.0 | » | 0.29 ± 0.01 |
| 13 | » | 19.0 | » | 0.36 ± 0.02 |
| 14 | 250 | 8.0 | 6.0 | 0.08 ± 0.01 |
| 15 | » | 12.0 | » | 0.11 ± 0.01 |
| 16 | » | 16.0 | » | 0.16 ± 0.02 |
| 17 | » | 20.0 | » | 0.19 ± 0.01 |
| 3* | 350 | 3.5 | 6.0 | – |
| 5* | » | 9.5 | » | – |
| 9* | 300 | 18.0 | » | – |
При исследовании некаталитического гидрирования нафталина в НРМР водородом, аккумулированным в ОУНТГ, использовали 8%-й раствор нафталина в декане. Следует отметить, что при некаталитическом гидрировании как децена-1, так и нафталина, часть мембран использовали повторно, т.е. процедура насыщения водородом ОУНТГ повторялась неоднократно. Это показывает, что ОУНТГ могут многократно адсорбировать и десорбировать водород.
При гидрировании нафталина достаточно легко образуются 1,2-дигидронафталин, 1,2,3,4-тетрагидронафталин (тетралин) и декагидронафталин (декалин) [91]. В нашем случае, по данным хроматографического анализа, продуктом некаталитического гидрирования нафталина в НРМР при температуре 330–390°С был тетралин. Приведенные в табл. 4 результаты некаталитического гидрирования нафталина в НРМР с аккумулированным водородом показывают, что реакция, имеющая первый порядок, протекает при 370°С с образованием 1,2,3,4-тетрагидронафталина, причем уже при 330°С в реакционной смеси присутствуют следовые количества тетралина.
Таблица 4.
Некаталитическое гидрирование 8%-го раствора нафталина в декане в наноразмерных мембранных реакторах с использованием аккумулированного в ОУНТГ водорода (С – содержание тетралина, % от нафталина)
| № | Т, °С | τ, ч | ${{P}_{{{{{\text{N}}}_{2}}}}}$, МПа | С, % |
|---|---|---|---|---|
| 1 | 330 | 12.0 | 7.0 | Следы |
| 2 | 370 | 10.0 | 7.5 | 0.22 ± 0.02 |
| 3 | » | 16.0 | » | 0.40 ± 0.04 |
| 4 | 390 | 10.0 | 8.0 | 0.39 ± 0.04 |
| 5 | » | 16.0 | » | 0.61 ± 0.06 |
Кинетический анализ результатов некаталитического гидрирования децена-1 показал, что реакция имеет первый порядок. В табл. 5 приведены константы скорости при различных температурах и энергия активации, полученная из зависимости ln K – 1/Т (рис. 6). По уравнению Аррениуса с использованием экспериментальной энергии активации была рассчитана константа скорости для температуры 400°С. На рис. 6 ей соответствует верхняя точка, которая весьма удовлетворительно ложится на экспериментальную прямую. Рассчитанная с использованием этой константы конверсия децена-1 при 400°С и времени выдержки 3.5 ч составила 4.25%.
Таблица 5.
Константа скорости и энергия активации некаталитического гидрирования децена-1 водородом, аккумулированным в ОУНТГ
| Т, K | k × 108, с–1 |
|---|---|
| 623 | 80.7 |
| 573 | 11.8 |
| 548 | 5.3 |
| 523 | 2.7 |
| 673* | 344.2 |
Рис. 6.
Экспериментальная зависимость ln K – 1/Т для реакции некаталитического гидрирования децена-1 в наноразмерных мембранных реакторах с использованием аккумулированного в ОУНТГ водорода.

Данные по некаталитическому гидрированию нафталина позволили рассчитать константы скорости, составившие 6.3 × 10–8 и 12.6 × 10–8 с–1 при 643 и 663 K соответственно, и с использованием выражения:
(4)
${{E}_{{\text{a}}}} = \frac{{R~{{T}_{1}}~{{T}_{2}}}}{{{{T}_{2}} - {{T}_{1}}}}\ln \frac{{{{k}_{2}}}}{{{{k}_{1}}}},$Несомненно, что данные, полученные по двум точкам, как при расчете констант скорости, так и энергии активации, являются не вполне строгими. Тем не менее, они характеризуют параметры реакции и показывают, что некаталитическое гидрирование нафталина протекает уже при 370°С.
Приведенные результаты убедительно показывают, что водород, аккумулированный в ОУНТГ, имеет существенно более высокую активность по сравнению с молекулярным Н2. Действительно, энергия активации реакций некаталитического гидрирования олефинов, в частности этилена, молекулярным водородом составляет ∼180 кДж/моль, при этом на платиновом катализаторе, одном из лучших для этого процесса, – 40 кДж/моль [92], а в нашем случае – 94.5 и 123.5 кДж/моль для децена-1 и нафталина соответственно.
Принято считать, что при введении катализатора снижение энергии активации связано с изменением промежуточных стадий процесса (пути реакции) и уменьшением их числа [93]. В нашем случае можно полагать, что действуют два фактора: с одной стороны, отмеченное выше изменение пути реакции, а с другой – повышенная реакционная способность водорода, адсорбированного в одномерной углеродной наноструктуре.
Получить информацию, подтверждающую это предположение, можно путем рассмотрения структуры ОУНТГ в поре, которая является наноразмерным реактором, оценить количество адсорбированного в ней водорода, децена-1 и нафталина.
Ранее были приведены средние радиусы пор и площади поверхности использованных в работе мембран. Применив выражение:
где S – площадь поверхности пор, м2; r – средний радиус пор, м; V – объем пор, м3; можно вычислить V. Зная суммарный объем пор и полагая, что каждая пора имеет форму правильного цилиндра, высота которого равна толщине селективного слоя, можно рассчитать число пор в мембране. Проведенные расчеты показывают, что пористую структуру мембран с Dпор = 50 нм, которые использовали при проведении гидрирования децена-1 и нафталина, можно рассматривать как совокупность 5.5 × 1011 НРМР, каждый из которых имеет объем 3.9 × 10–14 см3. При этом площадь внутренней поверхности каждого НРМР составляет 3.1 × 10–8 см2, а их общий объем – 2.1 × 10–2 см3.Используя эти данные, можно определить количество реагентов (водорода, децена-1 и нафталина), загруженных в отдельную пору, т.е. в каждый наноразмерный мембранный реактор. Для расчета использовали мембрану, в ОУНТГ которой было аккумулировано 0.013 мг Н2, при гидрировании децена-1, и 0.015 мг при гидрировании нафталина, что примерно соответствует средней величине адсорбции в обоих случаях. Учитывая приведенные выше данные по количеству и объему НРМР, получаем, что при гидрировании децена-1 в каждом из них содержится 7.1 × 106 молекул водорода и 1.3 × 108 молекул децена-1, а при гидрировании нафталина 7.622 × 106 молекул водорода, 1.21 × 108 молекул декана и 9.03 × 106 молекул нафталина. Таким образом, реакция некаталитического гидрирования децена-1 с использованием аккумулированного водорода протекает при его содержании в реакционной зоне, в ∼20 раз меньшем, а в случае нафталина – в ∼1.2 раза меньшем, чем количество гидрируемого реагента. При этом даже при каталитическом гидрировании реакции проводят при давлении от 0.2–0.4 до 10 МПа [88], т.е. при значительном избытке водорода. Это еще раз подтверждает высокую активность Н2, адсорбированного в углеродной 2D-структуре.
Относительно высокой реакционной способности адсорбированного Н2 отметим следующее: в [94] была исследована кинетика реакции гетерогенного дегидрирования метана на поверхности мембран с селективным слоем из TiO2 + Cr2O3 в процессе формирования НКП. Было показано, что эти оксиды катализируют дегидрирование, причем их действие полностью прекращается при толщине пироуглеродного покрытия ∼2.0–2.5 нм. При гидрировании децена-1 и нафталина, проводимом в НРМР, катализаторы дегидрирования, оксиды Ti и Cr отделены от реакционной смеси монослоем графеновых фрагментов (2D-структура), которая, вероятно, неспособна полностью нивелировать их действие. При этом реакции гидрирования протекают при температуре 300–370°, типичной для реакций каталитического дегидрирования [89]. Таким образом, активность водорода, адсорбированного в гибридной углеродной наноструктуре, настолько высока, что некаталитическое гидрирование децена-1 и нафталина протекает, практически, в присутствии катализатора реакции дегидрирования при невысокой температуре и при содержании Н2 в реакционной зоне, меньшем, чем количество гидрируемого реагента.
Анализ результатов достаточно убедительно показывает, что реакция гидрирования протекает по механизму спилловера, реализующегося при каталитических процессах:
(6)
$\begin{gathered} {\text{Н}}_{2}^{{{\text{графен}}}} \to 2{{{\text{H}}}^{{{\text{графен}}}}} \rightleftarrows 2{{{\text{H}}}^{ + }} + 2{\text{e}}, \\ 2{\text{H}} + {\text{C}}{{{\text{H}}}_{3}}{{({\text{C}}{{{\text{H}}}_{2}})}_{7}}{\text{CH}}{\kern 1pt} = {\kern 1pt} {\text{C}}{{{\text{H}}}_{2}} \to \\ \to {\text{C}}{{{\text{H}}}_{3}}{{({\text{C}}{{{\text{H}}}_{2}})}_{7}}{\text{C}}{{{\text{H}}}_{2}}{\kern 1pt} - {\kern 1pt} {\text{C}}{{{\text{H}}}_{3}}, \\ 4{\text{Н}} + {{{\text{С}}}_{{10}}}{{{\text{Н}}}_{8}} \to {{{\text{С}}}_{{10}}}{{{\text{Н}}}_{{12}}}, \\ {\text{H}} + {\text{H}} \to {{{\text{H}}}_{2}}. \\ \end{gathered} $Действительно, после адсорбции водорода в ОУНТГ ξ-потенциал и заряд поровой поверхности возрастают с 2.2 до ~ 8 B и с 5.1 до ~ 17 Кл/м2, соответственно. Это, вероятно, связано с появлением электронов в реакции (6), причем ξ‑потенциал и заряд поровой поверхности имеют практически одинаковые значения, независимо от количества адсорбированного водорода. Можно полагать, что в обратимом процессе образования электронов и H+ (6) достигается равновесная концентрация.
Таблица 6.
Изменение параметров (r, нм) пористой структуры мембран в процессе пироуглеродной модификации метаном от 0 до 23 ч при Т = 800°C
| t, ч | 0 | 1 | 4 | 7 | 16 | 23 |
|---|---|---|---|---|---|---|
| rср | 25 | 24 | 20 | 16 | 7.1 | 3.1 |
| rd | 24.5 | 20 | 15.4 | 4.3 |
Механизм спилловера предполагает адсорбцию водорода на катализаторе, миграцию к молекуле гидрируемого реагента и собственно реакцию. В нашем случае диффузия молекул водорода и продуктов их диссоциативного разложения по поверхности ОУНТГ подтверждается приведенными выше результатами по зависимости адсорбции водорода в ОУНТГ от их морфологии. Как было показано, при значении фактора Ψ < 0.4–0.6 углеродный монослой вырождается в совокупность несвязанных между собой “островов”, и его способность адсорбировать водород пропадает. Это, вероятно, связано с тем, что когда ОУНТГ является замкнутой цилиндрической структурой, молекулы водорода и продукты их диссоциативного разложения диффундируют по ее поверхности, оставаясь адсорбированными в углеродной наноструктуре. Однако, при Ψ < 0.4–0.6 цилиндрическая структура ОУНТГ сменяется фрагментарной, и водород, адсорбирующийся на этих участках, диффундирует на оксидную поверхность поры и десорбируется.
Таким образом, можно считать, что механизм адсорбции является диссоциативным, при этом водород и продукты его диссоциативного разложения диффундируют по поверхности ОУНТГ. Некаталитическое гидрирование децена-1 и нафталина протекает по механизму спилловера, который реализуется в реакциях с использованием катализаторов. Вместе с этим, приведенные выше энергии активации для отмеченных реакций показывают, что ОУНТГ, т.е. углеродная наноструктура, обладает каталитическим эффектом.
Проведем сравнение этих результатов с данными [77], описывающими механизм адсорбции водорода в ЦПГНС. Было показано, что в этом случае адсорбция протекает по двум механизмам: ассоциативному (температура десорбции 250°С) и хемосорбционному (температура десорбции 450°С). Первый обусловлен взаимодействием водорода с гидроксильными группами, что приводит к изменению их структуры и образованию новой структуры, близкой к суперкислотному центру по схемам:
Второй механизм связан с координацией Н–Н по двойной связи С=О в карбонат-ионе. Это приводит к поляризации как связи Н+δ–Н–δ , так и С+δ=О–δ, причем реакция является обратимой. После нагрева образца до 450°С происходят десорбция водорода и снятие его координации с С=О-связью, что приводит к перераспределению электронной плотности в карбонат-ионах по схеме:
Видно, что активность водорода, адсорбированного в ЦПГНС, настолько высока, что он взаимодействует с подложкой, а именно с реакционноспособными структурами цеолитов с образованием сильных химических связей. Отметим, что суммарная адсорбция водорода в ЦПГНС по двум отмеченным механизмам составляет для ЦВМ ∼70 см3/г, а для ЦПГНС на ЦВН – ∼65 см3/г, причем количество хемосорбированного Н2 равно 21.9 и 19.5 см3/г соответственно.
Активность водорода, адсорбированного в ОУНТГ, не менее высока, что подтверждается некаталитическим гидрированием децена-1 и нафталина, но данная углеродная наноструктура синтезирована на поверхности оксидов, реакционная способность которых несравнимо ниже. Поэтому мы не наблюдаем каких-либо взаимодействий между ними, что подтверждается результатами рамановской спектроскопии.
Сравнение адсорбции водорода в ОУНТГ и ЦПГНС показывает, что подложка чрезвычайно сильно влияет на механизм и энергетику этого процесса. Водород, адсорбированный в ОУНТГ, синтезированных на оксидной поверхности мембран, не взаимодействует с подложкой. В то же время водород, аккумулированный в ЦПГНС, взаимодействует с различными химическими соединениями цеолитов, что приводит к реализации ассоциативного механизма адсорбции и хемосорбции. Таким образом, влияние подложки – весьма важный фактор, определяющий целевое использование аккумулируемого водорода (накопительная адсорбция, адсорбция для гидрирования и т.д.).
В рамках концепции создания НРМР изучена возможность варьирования объема их реакционной зоны. Такой подход открывает перспективу синтеза новых химических соединений. По литературным данным, среди известных гидропроизводных нафталина [95–103], отсутствуют 2,3-, 6,7-дигидронафталины и 2,3,6,7-тетрагидронафталин. Известно [88], что молекула нафталина имеет плоскую структуру, при этом ее размер по ординате (в двухмерной системе координат) составляет ∼0.278 нм, между положениями 1–4, 5–8, а по абсциссе ∼0.481 нм, между положениями 2–7, 3–6. Очевидно, что, если модифицировать пористую структуру мембраны путем нанесения НКП и получить поры с D ≤ 0.481 нм, то в силу стерических ограничений молекула нафталина будет ориентирована в поре таким образом, что доступными для реакции гидрирования будут только положения 2, 3, 6, 7.
Было исследовано изменение объема реакционной зоны у мембран при нанесении НКП на внутреннюю поверхность пор, которое отслеживали по уменьшению их радиуса в процессе модификации с использованием метода ДДП [104]. Изменение размера пор селективного слоя в процессе модификации представлено в табл. 6. Приведенные данные показывают, что в результате модификации в течение 23 ч радиус пор уменьшился с 25 до 3.1 нм. Очевидно, что, увеличивая время процесса, можно получать поры заданного размера. Однако метод ДДП, как и другие порометрические методы, имеет ограниченный диапазон применения и не может быть надежно использован для мембран с более мелкими порами. Поэтому для получения мембран с D ≤ 0.481 нм необходим другой метод контроля. В связи с этим была предложена формула, описывающая изменение радиуса пор rd в зависимости от массы нанесенных НКП:
где N – число Авогадро; S – площадь семи конденсированных шестичленных колец углерода (37.177 × 10–20 м2); D – расстояние между углеродными плоскостями в пироуглероде (3.44 Å); M – атомная масса углерода; Sp – площадь поверхности пор (1.7 м2); n – число атомов углерода в пяти конденсированных кольцах; r0 – радиус пор исходной мембраны.В табл. 6 приведены полученные по (1) значения радиусов rd. Видно, что сходимость с экспериментом вполне удовлетворительная. Таким образом, для мембран с мелкими порами, размер которых невозможно определить экспериментально, с использованием (1) можно рассчитать массу НКП, которую необходимо нанести на поровую поверхность для получения пор заданных размеров, в том числе с D ≤ 0.481 нм. Несомненно, что для этой работы будут использованы мембраны с существенно меньшими порами, например, фирмы “TAMI Industries” (ZrO2 + TiO2 на TiO2) с диаметром пор 1 кДа, что соответствует ∼10–15 нм.
ЗАКЛЮЧЕНИЕ
Разработана концепция наноразмерных мембранных реакторов гидрирования с аккумулированным водородом, в рамках которой:
− исследована морфология трех углеродных наноструктур: графенов, ОУНТГ и НКП;
− изучена их водород-адсорбционная способность и показано, что только ОУНТГ могут аккумулировать и сохранять водород;
− проведено количественное определение адсорбции водорода в ОУНТГ, достигающее ∼1.5% от их массы;
− изучены закономерности адсорбции водорода в ОУНТГ. Введено понятие Ψ-фактора и показано, что ОУНТГ способны адсорбировать водород, если сохраняется соотношение 0.4–0.6 < Ψ < < 1.5–1.7;
− предложена математическая зависимость, описывающая удельную адсорбцию водорода в ОУНТГ как функцию Ψ-фактора;
− проведена реакция некаталитического гидрирования децена-1 и нафталина в наноразмерных мембранных реакторах с использованием водорода, аккумулированного и сохраненного в углеродной наноструктуре, синтезированной на поверхности пор;
− установлена энергия активации для реакции гидрирования децена-1 (94.5 кДж/моль) и нафталина (123.5 кДж/моль), которая существенно меньше, чем для реакций некаталитического гидрирования молекулярным водородом;
− определено количественное соотношение водорода и децена-1, водорода и нафталина в отдельном НРМР и показано, что активность водорода, адсорбированного в гибридной углеродной наноструктуре, настолько высока, что некаталитическое гидрирование децена-1 протекает при температуре 250°С, нафталина – при 330°С, при содержании Н2 в реакционной зоне в ∼20 раз меньшем, чем количество децена-1, и в ∼1.2 раза меньшем, чем содержание нафталина и практически в присутствии катализатора реакции дегидрирования.
Полученные результаты показывают, что механизм адсорбции водорода в ОУНТГ, сформированных в порах мембран, является диссоциативным. При этом водород и продукты его диссоциации диффундируют по поверхности ОУНТГ, оставаясь адсорбированными в углеродной наноструктуре до тех пор, пока ее морфология не превратится в совокупность несвязанных между собой “островов”. Некаталитическое гидрирование децена-1 и нафталина водородом, адсорбированным в ОУНТГ, протекает по механизму спилловера, который типичен для реакций с использованием катализаторов. Учитывая, что энергии активации для этих реакций существенно ниже, чем для реакций некаталитического гидрирования молекулярным водородом, и в то же время сопоставима с энергией активации при гидрировании с использованием катализатора, можно полагать, что ОУНТГ, т.е. углеродная наноструктура, обладает значительным каталитическим эффектом.
Сравнение адсорбции водорода в ОУНТГ и ЦПГНС показывает, что подложка чрезвычайно сильно влияет на механизм и энергетику этого процесса. Водород, адсорбированный в ОУНТГ, синтезированных на оксидной поверхности мембран, не взаимодействует с подложкой. В то же время водород, аккумулированный в ЦПГНС, взаимодействует с различными химическими соединениями цеолитов, что приводит к реализации ассоциативного механизма адсорбции и хемосорбции. Таким образом, влияние подложки – весьма важный фактор, определяющий целевое использование аккумулируемого водорода (накопительная адсорбция, адсорбция для гидрирования и т.д.).
Изучена возможность создания НРМР с варьируемым объемом реакционной зоны. Показано, что данный подход позволит создавать нанореакторы молекулярных размеров и проводить реакции гидрирования в определенные положения, синтезируя новые химические соединения. Создание и развитие концепции НРМР направлено на формирование нового, химического, направления использования уникальных свойств углеродных наноструктур. Помимо более глубокого понимания закономерностей и механизма адсорбции, проводимые исследования показывают, что при аккумулировании водорода в ОУНТГ или ЦПГНС его химическая активность существенно возрастает и становится сравнимой с активностью в присутствии катализатора. Таким образом, эти наноструктуры помимо водород-адсорбционных свойств проявляют каталитический эффект в реакциях гидрирования. Вместе с тем, кроме водорода ОУНТГ способны адсорбировать и другие газы [48, 49], молекулы которых также будут активированы при взаимодействии с углеродной наноструктурой, что позволит проводить в более мягких условиях реакции окисления, нитрования, сульфирования и т.д. Помимо этого значимость исследования заключается в том, что открывает возможность синтеза новых соединений, углубленного понимания адсорбционных процессов, повышения активности катализаторов путем формирования на их поверхности графеновых структур, разработки методов формирования каталитически активных металлсодержащих центров в их структуре и т.д.
Продолжение и развитие данного направления научных работ, связанное с синтезом новой углеродной наноструктуры, а именно графдиновых нанотрубок в порах мембран, исследование их морфологии, водород-адсорбционных свойств и т.д. является весьма интересным и важным. Действительно, графдин содержит две сопряженные ацетиленовые связи. Поэтому можно ожидать, что графдиновые нанотрубки, синтезированные в порах мембран, будут адсорбировать водорода значительно больше, чем ОУНТГ, и его химическая активность будет существенно выше.
Работа выполнена в рамках Государственного задания ИНХС РАН.
Список литературы
Zhang W., Lu W-C., Zhang H-X. et al. // Carbon. 2018. V. 131. P. 137.
Dasgupta A., Rajukumar L.P., Rotella C. et al. // Nano Today. 2017. V. 12. P. 116.
Shekar S.C., Swathi R.S. // Carbon. 2018. V. 126. P. 489.
Algara-Siller G., Lehtinen O., Kaiser U. et al. // Nature. 2015. V. 519. № 7544. P. 443.
Guoxing Li, Yuliang Li, Huibiao Li, Yanbing Guo et al. // Chem. Commun. 2010. V. 46. P. 3256.
Kar R., Patel N.N., Chand N., Shilpa R.K. et al. // Carbon. 2016. V. 106. P. 233.
Shi J.-L., Wang H.-F., Zhu X., Chen C.-M. et al. // Ibid. 2016. V. 103. P. 36.
Wu S., Shen X., Zhu G. et al. // Ibid. 2017. V. 116. P. 68.
Gao X., Shen X. // Ibid. 2017. V. 125. P. 536.
Wang Q.-M., Yang Z.-Y. // Ibid. 2018. V. 138. P. 90.
Mortazavi B., Makaremi M., Shahrokhi M. et al. // Ibid. 2018. V. 137. P. 57.
Elias D.C., Nair R.R., Mohiuddin T.M.G. et al. // Science. 2009. V. 323. № 5914. P. 610.
Ibid. 2009. V. 323. № 5914. P. 589.
Li J., Xu J., Xie Z. et al. // Adv. Mater. 2018. V. 30. P. 1800548.
Si H.-Y., Mao C.-J., Zhou J.-Y. et al. // Carbon. 2018. V. 132. P. 598.
Yao Y., Jin Z., Chen Y. et al. // Ibid. 2018. V. 129. P. 228.
Shekar S.C., Swath R.S. // Ibid. 2018. V. 126. P. 489.
Li C., Lu X., Han Y. et al. // Nano Res. 2018. V. 11. № 3. P. 1714.
Pan Y., Wang Y., Wang L. et al. // Nanoscale. 2015. V. 7. P. 2116.
Gao L., Zhou X., Ding Y. // Chem. Phys. Lett. 2007. V. 434. № 4–6. P. 297.
Yang H., Heo J., Park S. et al. // Science. 2012. V. 336. № 6085. P. 1140.
Britnell L., Mishchenko A., Georgiou T. et al. // Ibid. Science. 2012. V. 335. № 6071. P. 947.
Simon J., Greiner M. // Nature. 2012. V. 483. № 7389. P. 282.
Chen C.F., Park C.H., Horng J. et al. // Ibid. 2011. V. 471. № 7340. P. 617.
Malko D., Neiss C., Viñes F. et al. // Phys. Rev. Lett. 2012. V. 108. P. 086804.
Li G., Li Y., Qian X. et al. // J. Phys. Chem. C. 2011. V. 115. P. 2611.
Dillon A.C., Jones K.M., Bekkedahl T.A. et al. // Nature. 1997. V. 386. P. 377.
Dillon A.C., Heben M.J. // Appl. Phys. A. 2001. V. 72. P. 133.
Bashkin I.O. // International Symposium on Metal Hydrogen Systems. Annecy. France. 2002. Abstracts of Reports. P. 28.
Browning D.J., Gerrard M.L., Laakeman J.B. et al. // Proceedings of the 13th World Hydrogen Energy Conference. Beijing. China. 2000. P. 580.
Bai X.D., Zhong D., Zhang G.Y. et al. // Appl. Phys. Lett. 2001. V. 79. P. 1552.
Hirscher M., Becher M., Halushka M. et al. // J. Alloys Compd. 2003. V. 356–357. P. 433.
Zhu H.W., Chen A., Mao Z.Q. et al. // J. Mater. Sci. Lett. 2000. V. 19. P. 1237.
Cheng H.M., Liu C., Fan Y.Y. et al. // Z. Metallkd. 2000. V. 91. P. 306.
Dillon A.C., Parilla P.A., Jones K.M. et al. // In Proceedings of the 1998 U.S.DOE Hydrogen Program Review. NREL/CP-570-25315.
Brown C.M., Yildirim T., Neumann D.A. et al. // Chem. Phys. Lett. 2000. V. 329. P. 311.
Rinzler A.G., Liu J., Dai H. et al. // Appl. Phys. A: Solids Surf. 1998. V. 67. P. 29.
Liu J., Rinzler A.G., Dai H.J. et al. // Science. 1998. V. 280. P. 1253.
Ye Y., Ahn C.C., Witham C. et al. // Appl. Phys. Lett. 1999. V. 74. P. 2307.
Bower C., Kleinhhammes A., Wu Y. et al. // Chem. Phys. Lett. 1998. V. 288. P. 481.
Liu C., Fan Y.Y., Liu M. et al. // Science. 1999. V. 286. P. 1127.
Chen Y., Shaw D.T., Bai X.D. et al. // Appl. Phys. Lett. 2001. V. 78. № 15. P. 2128.
Шульга Ю.М., Тарасов Б.П., Криничная Е.П. и др. // В сб. трудов “Фуллерены и фуллереноподобные структуры в конденсированных средах”. Минск, 2000. № 41.
Heben M.J., Dillon A.C., Genett T. et al. // Int. Symp. Metal–Hydrogen Systems. Oct. 1–6. 2000. Noosa. Australiya. Absracts. 2000. V. 2.
Dillon A.C., Heben M.J. // Appl. Phys. A. 2001. V. 72. P. 133.
Gao X.P., Qin X., Wu F. et al. // Chem. Phys. Lett. 2000. V. 327. P. 271.
Hirscher M., Becher M., Haluska M. et al. // Appl. Phys. A. 2001. V. 72. P. 129.
Kuznetsova A., Mawhinney D.B., Naumenko V. et al. // Chem. Phys. Lett. 2000. V. 321. P. 292.
Mawhinney D.B., Naumenko V., Kuznetsova A. et al. // Ibid. 2000. V. 324. P. 213.
Nutzenadel C., Zuttel A., Chartouni D. et al. // Electrochem. Solid-State Lett. 1999. № 2. P. 30.
Lee S.M., Park K.S., Choi Y.C. et al. // Synth. Metals. 2000. V. 113. P. 209.
Qin X., Gao X.P., Liu H. et al. // Electrochem. Solid-State Lett. 2000. № 3. P. 201.
Rajalakshmi N., Dhathathreyan K.S., Govindaraj A. et al. // Electrochim. Acta. 2000. V. 45. P. 4511.
Dai G.-P., Liu M., Wang M.-Z. et al. // New Carbon Mater. 2002. V. 17. P. 70.
Eltekov V. In “The 197-th Electrochemical Society Meeting”. Toronto. USA. Abstracts of Reports, 2000. P. 717.
Ma Y.C., Xia Y.Y., Zhao M.W. et al. // Phys. Rev. B. 2001. V. 6311. P. 5422.
Лобач А.С., Астахова А.С., Спицына Н.Г. // Всероссийский семинар “Наночастицы и нанохимия”. Черноголовка, 2000. С. 65.
Pekker S., Salvetat J.-P., Jakab E. et al. // Proc. of XIII Int. Winterschool “Electronic Properties of Novel Materials – Science and Technology of Molecular Nanostructures”. Ed. by H. Kuzmany, J. Fink, M. Mehring and S.R. Melville. N.Y.: AIP, 1999. P. 474.
Zuttel A., Sudan P., Mauron Ph. et al. // Int. J. Hydrogen Energy. 2002. V. 27. P. 203.
Lee H., Kang Y.-S., Kim S.-H. et al. // Appl. Phys. Lett. 2002. V. 80. P. 577.
Li X., Zhu H., Ci L. et al. // Carbon. 2001. V. 39. P. 2077.
Cao A., Zhu H., Zhang X. et al. // Chem. Phys. Lett. 2001. V. 342. P. 510.
Chen Y., Shaw D.T., Bai X.D. // Appl. Phys. Lett. 2001. V. 78. P. 2128.
Sun N., Zhang Q.-P., Yao Y. et al. // Ibid. 2018. V. 113. P. 103901.
Булярский С.В., Басаев А.С. // ЖТФ. 2009. Т. 79. Вып. 11. С. 50.
Ковалев В.Л., Якунчиков А.Н. // Изв. РАН. МЖГ. 2009. № 3. С. 167.
Аникина Е.В. // В сб. “VI Всероссийская конференция по наноматериалам с элементами научной школы для молодежи”. Москва, 22–25 ноября 2016. С. 598.
Belonenko M.B., Popov A.S., Lebedev N.G. et al. // Phys. Lett. A. 2011. V. 375. P. 946.
Hirscher M., Becher M., Haluska M. et al. // J. Alloys and Compounds. 2002. V. 330–332. P. 654.
Rather S. // Int. J. Hydrogen Energy. 2019. V. 44. P. 325.
Mehrabi M., Reyhani A., Parvin P. et al. // Ibid. 2019. V. 44. P. 3812.
Rather S. // Ibid. 2019. V. 44. P. 325.
Soldatov A.P., Tsodikov M.V., Bichkov V.Yu. et al. // Ibid. 2011. V. 36. № 1. P. 1264.
Солдатов А.П., Цодиков М.В., Паренаго О.П., Тепляков В.В. // Журн. физ. химии. 2010. Т. 84. № 12. С. 2298.
Солдатов А.П. // Там же. 2014. Т. 88. № 7–8. С. 1207.
Солдатов А.П., Паренаго О.П. // Докл. АН. 2014. Т. 456. № 5. С. 552.
Солдатов А.П., Бондаренко Г.Н., Сорокина Е.Ю. // Журн. физ. химии. 2015. Т. 89. № 2. С. 306.
Солдатов А.П., Кириченко А.Н., Татьянин Е.В. // Там же. 2016. Т. 90. № 7. С. 1038.
Солдатов А.П. // Там же. 2017. Т. 91. № 5. С. 897.
Солдатов А.П. // Там же. 2019. Т. 93. № 3. С. 398.
Солдатов А.П., Родионова И.А., Школьников Е.И. и др. // Там же. 2004. Т. 78. № 9. С. 1659.
Солдатов А.П., Родионова И.А., Паренаго О.П. // Там же. 2006. Т. 80. № 3. С. 500.
Shiraishi M., Takenobu T., Kataura H. et al. // Appl. Phys. A. 2004. V. 78. № 7. P. 947.
Ning G.Q., Wei F., Luo G.H. et al. // Ibid. 2004. V. 78. № 7. P. 955.
Poirier E., Chahine R., Benard P. et al. // Ibid. 2004. V. 78. № 7. P. 961.
Liu C., Fan Y.Y., Liu M. et al. // Science. 1999. V. 286. P. 1127.
Cheng Y.M., Yang Q.Y., Liu C. // Carbon. 2001. V. 39. P. 1447.
Чичибабин А.Е. Основные начала органической химии. Т. 1. Л.: ГНТИХЛ, 1953.
Гейтс Б.К., Кетцир Дж., Шуйт Г. Химия каталитических процессов. Пер. с англ. М.: Наука, 1981. 377с.
Боресков Г.К. Катализ. Вопросы теории и практики. Новосибирск, 1987.
Доналдсон Н. Химия и технология соединений нафталинового ряда. Пер. с англ. М.: ГНТИХЛ, 1963.
Токабе К. Катализаторы и каталитические процессы. М.: Наука, 1993.
Ганкин В.Ю., Ганкин Ю.В. Новая общая теория катализа. Л., 1991.
Солдатов А.П., Березкин В.В., Гонтарь И.В. и др. // Журн. физ химии. 2008. Т. 82. № 6. С. 1124.
Birch A.J. // J. Chem. Soc. 1944. P. 430.
Burnop V.C.E., Linstead R.P. // Ibid. 1940. P. 720.
Borsche W., Lange E. // Ann. 1923. V. 434. P. 219.
Graebe C., Guye P. // Ber. 1883. V. 16. P. 3028.
Huckel W. et al. // Ann. 1929. V. 474. P. 121.
Huckel W. et al. // Ibid. 1930. V. 477. P. 99.
Huckel W. et al. // Ber. 1933. V. 66. P. 563.
Criegel R., Schnorrenberg W. // Ann. 1949. V. 563. P. 93.
Huckel W., Naab H. // Ibid. 1933. V. 502. P. 136.
Школьников Е.И., Елкина И.Б., Волков В.В. Способ анализа пористой структуры. Пат. РФ. № 2141642. 1999.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии