Журнал физической химии, 2020, T. 94, № 4, стр. 624-628
Электрохимическое восстановление спироциклопентилмалонилпероксида в водной среде
М. Д. Веденяпина a, *, А. М. Скундин b, **, В. А. Виль a, ***, М. М. Казакова a, ****, Я. А. Барсегян a, *****
a Российская академия наук, Институт органической химии им. Н.Д. Зелинского
Москва, Россия
b Российская академия наук, Институт физической химии и электрохимии им. А.Н. Фрумкина
Москва, Россия
* E-mail: mvedenyapina@yandex.ru
** E-mail: askundin@mail.ru
*** E-mail: vera_vill@mail.ru
**** E-mail: frau.marinakazakova@yandex.ru
***** E-mail: yana-barsegyan@mail.ru
Поступила в редакцию 21.05.2019
После доработки 26.08.2019
Принята к публикации 10.09.2019
Аннотация
Проведено исследование электрохимического восстановления спироциклопентил-малонилпероксида в водной среде методом циклической вольтамперометрии на золотом стационарном электроде. На основании расчетов, произведенных по параметрам циклических вольтамперограмм, снятых при разных скоростях развертки, сделан вывод о двух одноэлектронных последовательных процессах восстановления исследуемого пероксида и предложена схема его катодного восстановления.
Развитие химии органических пероксидов обусловлено их высокой биологической активностью, что позволяет применять их в различных областях жизнедеятельности человека [1–3]. В медицинской химии органических пероксидов актуальны синтез и анализ таких соединений, обладающих антималярийной [4–6], противоопухолевой, антигельминтной и противовирусной активностью [7–10]. Поэтому синтез циклического пероксидного фрагмента привлекает в настоящее время повышенное внимание [11–18].
Биологическая активность пероксидов тесно связана с их окислительно-восстановительными свойствами. Поэтому электрохимические методы являются самыми востребованными для изучения свойств органических пероксидов [19–22]. Для этих соединений характерно наличие на циклических вольтамперограммах (ЦВА-кривых) необратимых пиков восстановления в широком интервале потенциалов [19, 20]. Изучение электрохимического восстановления природного пероксида Артемизинина (Qinghaosu), обладающего высокой противомалярийной активностью [4–6], а также родственных синтетических бициклических пероксидов методом ЦВА показало наличие на кривых необратимых пиков восстановления [20–22].
В настоящей работе синтезирован спироциклопентилмалонилпероксид и исследовано электрохимическое восстановление его в водной среде с помощью метода ЦВА. В качестве рабочего электрода использована золотая проволока. Изучение поведения золотого электрода в водном растворе синтезированного пероксида проведено с целью определения области потенциалов протекания этой реакции.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Спироциклопентилмалонилпероксид С7Н8О4 (1) получали по методике [23], его характеристики – с помощью спектроскопии 1H ЯМР и 13С ЯМР. Спектры ЯМР регистрировали на приборе “Bruker AM 300”.
Спироциклопентилмалонилпероксид (1) – белое кристаллическое твердое вещество, т.пл. = 39–40°С (41°C [24]). 1Н ЯМР (300.13 МГц, CDCl3, δ: 1.96–2.01 (m, 4H), 2.22–2.27 (m, 4H); 13C ЯМР (75.48 МГц, CDCl3, δ: 26.6, 37.6, 46.8, 175.6).Электрохимические исследования проводили в трехэлектродной ячейке. В качестве рабочего электрода использовали золотую проволоку диаметром 0.3 мм, погруженную в рабочий раствор на 0.5 см. Вспомогательным электродом служила таких же размеров платиновая проволока, а электродом сравнения – хлорсеребряный электрод с двойной мембраной (Ag|AgCl|КCl(3.5 М)). Рабочий и вспомогательный электроды перед началом работы обрабатывали смесью HNO3:HCl (1:3) и затем подвергали попеременной катодно-анодной поляризации в растворе 0.5 М H2SO4. Концентрация исследуемого пероксида составляла 0.02 моль/л. Используемые растворы готовили в день проведения эксперимента. Фоновым электролитом служил 0.05 М водный раствор Na2SO4. Эксперименты проводили при температуре 25°С в атмосфере аргона. Циклические вольтаммограммы (ЦВА) регистрировали при помощи потенциостата IPC-Compact, управляемого компьютером.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
При регистрации ЦВА соединения 1 на Au-электроде в интервале потенциалов Е от –1.5 до –0.5 В (рис. 1) получены необратимые катодные пики, высота которых при регистрации следующих циклов практически не уменьшалась. На катодной ветви зарегистрированы два пика в интервале потенциалов Е1 от –750 до 380 В и Е2 от –1350 до –830 В, а на анодной ветви откликов на ЦВА не выявлено. Мы предполагаем, что два максимума соответствуют двум последовательным процессам – присоединению одного и второго электронов.
Рис. 1.
ЦВА восстановления 1 на Au-электроде при различных скоростях сканирования потенциала v (50, 75, 100, 125, 150, 175, 200 мВ/с).
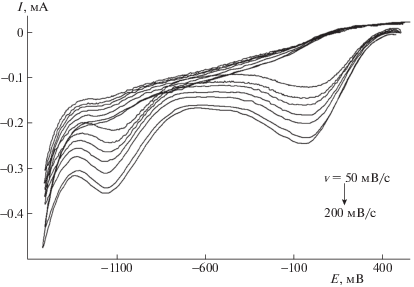
На рис. 1 приведены кривые ЦВА, полученные для различных скоростей сканирования потенциала от 50 до 200 мВ/с. Видно, что с увеличением скорости развертки потенциала оба катодных максимума смещаются в отрицательную область, а высота пиков Iр,с увеличивается. Из рис. 2 видно, что значения максимумов токов Iр,с для пика в интервале потенциалов Е1 ложатся на прямую в координатах Ip,с–${{{v}}^{{0.5}}}$, которая проходит через начало координат. Из этого следует, что восстановление пероксида в данном интервале потенциалов лимитируется стадией диффузионного подвода субстрата к поверхности электрода. Аналогичные зависимости наблюдались и для электрохимических превращений других пероксидов [25–27]. Следует отметить, что значения токов в максимуме, приведенные на рис. 2, были отсчитаны от фонового тока при соответствующих потенциалах. Эта поправка, как видно из рис. 1, невелика. С определенным приближением можно считать, что здесь применимо уравнение Рэндлса–Шевчика [28]:
(1)
${{I}_{{{\text{p,с}}}}} = 0.496S{{\alpha }^{{0.5}}}n_{{\text{a}}}^{{{\text{0}}{\text{.5}}}}nF{{c}_{0}}{{(FD{\text{/}}RT)}^{{0.5}}}{{{v}}^{{0.5}}},$Рис. 2.
Зависимость значений тока первого пика (Ip,с) ЦВА на рис. 1 от скорости сканирования потенциала.

Для определения коэффициента α можно воспользоваться двумя методами расчета. Во-первых, его можно рассчитать из зависимости потенциала максимума от логарифма скорости развертки [21, 22]:
(2)
$d{{E}_{{\text{p}}}}{\text{/}}d\lg {v} = --1.151 \times 0.0257{\text{/}}\alpha {{n}_{{\text{a}}}}.$Рис. 3.
Зависимость значений потенциалов первого пика (E1p) ЦВА на рис. 1 от скорости развертки потенциала.

В работе [25] для восстановления [1,2-бис(трет-бутилперокси)этил]бензола на платиновом электроде было получено αna = α = 0.14. Столь низкое значение коэффициента α было объяснено одновременным протеканием двух реакций – присоединения электрона к молекуле пероксида и разрывом в нем О–О-связи. Можно предполагать, что такое объяснение справедливо и для первого этапа восстановления спироциклопентилмалонилпероксида.
Уравнение (1) дает возможность рассчитать коэффициент диффузии реагирующего вещества с учетом известного значения коэффициента α. Если рабочий электрод – проволока диаметром 0.3 мм, погруженная на глубину 0.5 см, то площадь ее поверхности составляет 0.5 см2. Тогда из формулы (1) с учетом наклона прямой (рис. 2), составляющего 5.67 × 10–4 Ас1/2/В1/2, имеем коэффициент диффузии D = 1.8 × 10–5 cм2/c.
Второй катодный максимум отражает процесс восстановления продукта, образовавшегося в результате первого восстановительного процесса. Зависимость тока второго максимума от скорости сканирования потенциала (с учетом фонового тока при потенциалах этого максимума) приведена на рис. 4.
Рис. 4.
Зависимость значений тока второго пика (Ip,с) ЦВА на рис. 1 от скорости сканирования потенциала.

Угловой коэффициент линейной аппроксимированной функции на рис. 5 составляет 6.27 × × 10–4 Ас1/2/В1/2, что незначительно отличается от наклона соответствующей прямой для первого максимума. Такая близость значений угловых коэффициентов указывает на близость произведений c0D1/2α1/2 для исходного спироциклопентилмалонилпероксида и продукта его одноэлектронного восстановления на первом катодном максимуме. О значении коэффициента переноса α для процесса при втором максимуме можно также судить по форме второго максимума и по зависимости потенциала этого максимума от логарифма скорости развертки потенциала. Такая зависимость показана на рис. 5. Аппроксимация данных на рис. 5 также выполнена с помощью метода наименьших квадратов. Угловой коэффициент полученной линейной функции составляет 0.0675 В, и ему соответствует значение α = 0.57. Существенное отличие этой величины от коэффициента переноса в процессе первого максимума указывает на различие механизмов процессов присоединения первого электрона к молекуле 1, и присоединения второго электрона к продукту первичного восстановления 1. В данном случае процесс сводится к присоединению электрона, и значение α близко к классическому α = 0.5.
Рис. 5.
Зависимость значений потенциалов второго пика (E2p) ЦВА на рис. 1 от скорости развертки потенциала.

Продукт первичного восстановления пероксида 1 образуется в процессе восстановления при первом максимуме и сосредоточен в объеме раствора около поверхности электрода. Толщина этого слоя составляет примерно √πDt, где t – время прохождения максимума. В данном случае для скорости развертки потенциала 200 мВ/с значение t ≈ 3 с [29, 30].
Можно предположить, исходя из проведенных электрохимических исследований и расчетов, что переход электронов на связь О–О происходит по диссоциативному восстановительному механизму (Схема 1) [19–22]. При переносе электрона связь O–O расщепляется с образованием анион-радикала 2, который впоследствии восстанавливается на электроде во втором гетерогенном электронном переносе, что приводит к образованию дикарбоновой кислоты 3.
Таким образом, на основании расчетов, произведенных по параметрам ЦВА, снятых при разных скоростях развертки со спироциклопентилмалонилпероксида в водной среде на золотом стационарном электроде, можно сделать вывод о двух одноэлектронных последовательных процессах восстановления исследуемого пероксида в широком диапазоне потенциалов.
Работа выполнена при финансовой поддержке Министерства науки и высшего образования РФ.
Список литературы
Patnaik P. Peroxides, Organic. N.J.: John Wiley & Sons, Inc., 2006. P. 719–740.
The Chemistry of Peroxides / Ed. by Z. Rappoport. N.J.: John Wiley & Sons, 2006. 1440 p.
Klapötke T.M., Wloka T. Peroxides Explosived. N.J.: John Wiley & Sons, Ltd., 2009. 28 p.
Xu T., Feng Q., Jacob M.R., Avula B. et al. // Antimicrob. Agents Chemother. 2011. T. 55. № 4. P. 1611.
Tu Y.Y., Ni M.Y., Zhong Y.R. et al. // Yao Xue Xue Bao. 1981. V. 16. № 5. P. 366.
Miller L.H., Su X. // Cell. 2011. V. 146. № 6. P. 855.
Vil’ V.A., Yaremenko I.A., Ilovaisky A.I. et al. // Molecules. 2017. V. 22 (11). P. 1881. https://doi.org/10.3390/molecules22111881
Cowan N., Yaremenko I.A., Krylov I.B. et al. // Bioorg. Med. Chem. 2015. V. 23 (16). P. 5175.
Yaremenko I.A., Syroeshkin M.A., Levitsky D.O. et al. // Med. Chem. Res. 2017. V. 26 (1). P. 170.
Terent’ev A.O., Kutkin A.V., Troizky N.A. et al. // Synthesis. 2005. V. 13. P. 2215. https://doi.org/10.1055/s-2005-872093
Terent’ev A.O., Platonov M.M., Krylov I.B. et al. // Org. Biomol. Chem. 2008. V. 6 (23). P. 4435. https://doi.org/10.1039/b809661a
Terent’ev A.O., Borisov D.A., Semenov V.V. et al. // Synthesis. 2011. V. 13. P. 2091. https://doi.org/10.1055/s-0030-1260027
Terent'ev A.O., Sharipov M.Y., Krylov I.B. et al. // Org. Biomol. Chem. 2015. V. 13(5). P. 1439. https://doi.org/10.1039/c4ob01823k
Terent'ev A.O., Yaremenko I.A., Chernyshev V.V. et al. // J. Org. Chem. 2012. V. 77 (4). P. 1833. https://doi.org/10.1021/jo202437r
Gomes G.D., Yaremenko I.A., Radulov P.S. et al. // Angew. Chem. Int. Ed. 2017. V. 56 (18). P. 4955. https://doi.org/10.1002/anie.201610699
Vil’ V.A. Gomes G.D. Bityukov O.V. Lyssenko K.A. et al. // Ibid. 2018. V. 57(13). P. 3372–3376. https://doi.org/10.1002/anie.201712651
Yaremenko I.A., Terent’ev A.O., Vil’ V.A. et al. // Chem. Eur. J. 2014. V. 20 (32). P. 10160. https://doi.org/10.1002/chem.201402594
Terent’ev A.O., Yaremenko I.A., Vil’ V.A., Dembitsky V.M. et al. // Synthesis. 2013. V. 45. P. 246. https://doi.org/10.1055/s-0032-1317895
Stringle D.L.B., Magri D.C., Workentin M.S. // Chem. Eur. J. 2010. V. 16. P. 178–188.
Donkers R.L., Workentin M.S.// Ibid. 2001. 7. 18. P. 4012.
Magri D.C., Workentin M.S. // Ibid. 2008. V. 14. P. 1698.
Donkers R.L., Workentin M.S. // J. Am. Chem. Soc. 2004. V. 126. P. 1688.
Terent’ev A.O., Vil’ V.A., Gorlov E.S. et al. // Chemistry Select. 2017. V. 2 (11). P. 3334. https://doi.org/10.1002/slct.201700720
Griffith J.C., Jones K.M., Picon S. et al. // J. Am. Chem. Soc. 2010. V. 132 (41). P. 14409.
Веденяпина М.Д., Шарипов М.Ю., Терентьев А.О. и др. // Журн. физ. химии. 2016. Т. 90 (2). С. 290.
Веденяпина М.Д., Симакова А.П., Борисов Д.А. и др. // Конденс. среды и межфаз. гран. 2012. Т. 14. № 3. С. 297.
Веденяпина М.Д., Симакова А.П., Платонов М.М. и др. // Журн. физ. химии. 2013. Т. 87 (3). С. 418.
Хенце Г. Полярография и вольтамперометрия. М.: “БИНОМ. Лаборатория знаний”, 2008. 284 с.
Delahay P. // J. Am. Chem. Soc. 1953. V. 75. iss. 5. P. 1190−1196
Делахей П. Новые приборы и методы в электрохимии / Пер. с англ. под ред. Б.В. Эршлера. М.: Изд-во иностр. лит., 1957. 510 с.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии




