Журнал физической химии, 2020, T. 94, № 5, стр. 760-765
Каталитический синтез и исследование углерод-графеновых структур
А. А. Арбузов a, *, А. А. Володин a, Б. П. Тарасов a
a Российская академия наук, Институт проблем химической физики
Черноголовка, Россия
* E-mail: arbuzov@icp.ac.ru
Поступила в редакцию 17.07.2019
После доработки 17.07.2019
Принята к публикации 17.09.2019
Аннотация
Определены оптимальные условия получения, структура и особенности формирования углерод-графеновых композитов на никель-графеновых катализаторах. Предложен механизм формирования никель-углерод-графеновых композитов, который состоит из следующих стадий: восстановление оксида графита и ионов никеля; образование и рост кластеров Ni на восстановленном оксиде графита; каталитический пиролиз этилена на монокристаллах Ni, закрепленных на графеноподобном носителе; формирование и рост углеродных наноструктур на поверхности графеноподобного материала.
В последние годы особое внимание уделяется гибридным углерод-углеродным композитам, которые сочетают в себе преимущества двух или более наноуглеродных структур. При этом свойства углерод-графеновых композитов сильно зависят от структуры. В связи с этим большое количество работ посвящено теоретическим расчетам структуры и функциональных характеристик подобных материалов. Так, в работе [1] впервые была смоделирована структура “столбчатого графена”, состоящая из графеновых плоскостей, соединенных между собой короткими углеродными нанотрубками (УНТ). При помощи ab initio расчетов было определено, что описанный нанопористый материал может запасать до 41 г водорода в 1 см3 при нормальных условиях. В работе [2] методом молекулярной механики было исследовано влияние различных типов УНТ-графеновых структур на сорбцию метана. Согласно полученным авторами изотермам адсорбции метана, оптимальная конфигурация характеризуется расстоянием между графеновыми слоями в 1.2 нм, число которых равно 4.
Введение УНТ и углеродных нановолокон (УНВ), способных связывать между собой отдельные графеновые слои, может также значительно усилить функциональные свойства материалов на их основе. В совокупности эти достоинства позволяют создавать материалы на основе композитов УНТ(УНВ)/графен, которые могут быть использованы в качестве добавок к полимерным материалам и керамике [3, 4], в различных энергетических приложениях [5, 6], как носители катализаторов химических и электрохимических процессов [7, 8] и др. Методы получения таких композитов можно разделить на два основных подхода.
1. Добавка предварительно синтезированных УНТ или УНВ к графеновому материалу [9, 10]. Недостатком этого метода является сложность равномерного распределения УНТ(УНВ) на графеновой поверхности, а также отсутствие химической связи между ними. Для решения этих проблем используют функционализацию как графенового материала [11], так и УНТ(УНВ), которая позволяет устранить агрегацию УНТ и улучшить межфазную связь между УНТ(УНВ) и графеновым материалом. Так, окисление УНТ приводит к образованию кислородсодержащих функциональных групп, которые снижают тенденцию к агрегации УНТ в воде [12] и образуют водородные связи между УНТ и графеновым материалом (оксидом графита) [13]. Последующее восстановление смеси окисленных УНТ и оксида графита (ОГ) гидразином приводит к образованию C–N-связей между ними [14].
2. Синтез УНТ или УНВ на катализаторе, закрепленном на графеновой поверхности [15–18]. Известно, что одним из основных методов получения углеродных нанотрубок и нановолокон является каталитическое разложение углеродсодержащих газов (CH4, C2H4 и др.) или паров органических соединений (CH3OH, C6H6 и др.) [19]. В качестве катализаторов чаще всего используют металлы Ni, Fe, Co, Pt, закрепленные на различных подложках. В этом случае конечная структура композита УНТ(УНВ)/графен сильно зависит от равномерности распределения и размера частиц катализатора, которые можно контролировать, изменяя условия получения.
В данной работе приведены результаты по получению углерод-графеновых композитов синтезом УНВ разложением этилена на никелевом катализаторе, закрепленном на поверхности графеноподобного материала (ГПМ). Определены оптимальные условия получения, структура и особенности формирования.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Оксид графита получали окислением природного графита марки ГК-1 (размер частиц ∼30 мкм, содержание углерода не менее 99 мас. %, содержание золы не более 1 мас. %, ГОСТ 4404-78) перманганатом калия в смеси концентрированной H2SO4 с NaNO3 [20].
УНВ на поверхности ГПМ синтезировали каталитическим разложением этилена на никельсодержащих композитах, предварительно приготовленных лиофильной сушкой дисперсий ОГ в водном растворе Ni(CH3COO)2 или [NiL3]Cl2 (L ‒ этилендиамин). Для приготовления композитов водную суспензию ОГ и рассчитанное количество солей обрабатывали в ультразвуковой ванне в течение 60 мин. Полученную смесь переносили в грушевидную колбу объемом 1 л и замораживали, помещая колбу в сосуд Дьюара, наполненный жидким азотом. Затем при помощи вакуумного насоса (∼1 × 10–3 атм), снабженного азотной ловушкой, при комнатной температуре откачивали пары воды, образующиеся надо льдом, до полного высыхания смеси. Каталитическое разложение этилена проводили в кварцевом реакторе, помещенном в горизонтальную трубчатую печь, при атмосферном давлении и температуре 700°С. Полученные никельсодержащие композиты Ni(CH3COO)2/ОГ или [NiL3]Cl2/ОГ располагали на дне кварцевой лодочки, которую помещали в холодную зону реактора. Нагрев реактора осуществлялся в протоке аргона. По достижении рабочей температуры в реактор подавалась рабочая смесь газов в соотношении Ar(30 мл/мин):H2(100 мл/мин):C2H4(60 мл/мин). Затем кварцевую лодочку быстро перемещали в центральную (горячую) зону реактора. Время пиролиза варьировалось в интервале от 1 до 60 мин. После проведения синтеза лодочку перемещали в холодную зону реактора. Охлаждение образца до комнатной температуры проводили в потоке аргона. Таким образом, при использовании в качестве прекурсоров Ni(CH3COO)2/ОГ и [NiL3]Cl2/ОГ были получены композиты УНВ/Ni/ГПМ-1 и УНВ/Ni/ГПМ-2, соответственно.
Углерод-графеновые и никельсодержащие композиты охарактеризовывали комплексом физико-химических методов. Элементный состав определяли на CHNS/O элементном анализаторе Vario Micro cube Elementar GmbH. Построение изотерм адсорбции–десорбции азота при температуре –195.75°C и атмосферном давлении проводилось с использованием анализатора СОРБИ-MS. Микрофотографии исследуемых материалов получены при помощи сканирующего Zeiss LEO SUPRA 25 и просвечивающего JEM-2100 электронных микроскопов.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Оригинальность разработанного ранее метода получения никель-графеновых композитов одновременным восстановлением ОГ и Ni(II) из предварительно приготовленной водной суспензии композита Ni(CH3COO)2/ОГ заключается в возгонке воды из замороженной водной смеси ОГ с Ni(CH3COO)2 [21]. Это позволяет избежать образования пленки ОГ и осаждения больших кристаллов Ni(CH3COO)2. При нагревании в токе водорода при 700°C полученный композит Ni(CH3COO)2/ОГ не подвергается взрывообразному выделению газов, свойственному пленкам ОГ [22], что позволяет проводить эффективное восстановление как ОГ, так и Ni(II). Как отмечалось выше, конечная структура композита УНВ/ГПМ сильно зависит от равномерности распределения и размера частиц катализатора. Поэтому для исследования равномерности распределения никелевых наночастиц на поверхности ГПМ проводили восстановление композита Ni(CH3COO)2/ОГ при 700°С в потоке смеси H2:Ar. Таким образом, были получены композиты Ni/ГПМ, содержащие 5 мас. % никеля. Равномерность распределения Ni в полученном композите подтверждается СЭМ (рис. 1). По результатам анализа полученных микрофотографий было определено, что в композите Ni/ГПМ более 90% наночастиц Ni имеют размер в пределах 5–15 нм.
Ранее нами было показано, что при использовании различных первичных аминов функционализацию ОГ можно проводить одновременно с восстановлением [23, 24]. Так, кипячение ОГ с этилендиамином C2H8N2 в различных растворителях приводит к образованию графенового материала с привитыми к поверхности алифатическими фрагментами. Такая функционализация существенно снижает агрегацию графеновых листов, а также увеличивает количество центров роста металлических нанокристаллов за счет наличия поверхностных функциональных групп. Поэтому нанесение никельсодержащих наночастиц на поверхность ОГ проводили одновременно с функционализацией действием этилендиамина. Для этого к водной суспензии ОГ добавляли комплекс [NiL3]Cl2, приготовленный смешением водного раствора NiCl2 с избытком этилендиамина. Полученную смесь кипятили с обратным холодильником в течение 6 ч с последующим фильтрованием и отделением композита. В процессе такой обработки одновременно происходит восстановление и функционализация ОГ, что подтверждается результатами элементного анализа: С – 75.5, H – 1.9, N – 9.4, O – 11.7 мас. %. Однако из-за прочности этилендиаминового комплекса количество никеля, осажденного на поверхности ГПМ, составило 0.9 мас. %.
Для более полного осаждения Ni на ГПМ исходную водную суспензию ОГ с [NiL3]Cl2 обрабатывали ультразвуком при температуре 70°C в течение 1 ч. Полученную смесь сушили лиофильно. На рис. 2 представлены EDX-спектр (a) и СЭМ-микрофотография (б) полученного композита [NiL3]Cl2/ОГ. По результатам анализа количество осажденного никеля составило 5.5 мас. %, содержание других элементов: С – 50.8, N – 13.9, O – 24.6, Cl – 3.2 мас. %, остальное – водород.
Для получения однородных наноструктур с узким распределением по диаметрам необходимо предотвратить спекание каталитических частиц в процессе синтеза. Одним из путей решения данной проблемы является одновременное восстановление Ni2+ и каталитический пиролиз углеводорода (C2H4). При такой реализации процесса углеводород будет разлагаться на поверхности свежеобразованного металлического никеля с образованием углеродного нановолокна, препятствующего агломерации каталитических частиц. Кроме того, размер частиц катализатора можно регулировать скоростью разложения никелевого прекурсора: чем выше скорость разложения, тем мельче образующиеся частицы. С этой целью композиты ОГ с Ni(CH3COO)2 или [NiL3]Cl2 вводили в заранее разогретый до необходимой температуры реактор с рабочей смесью газов, что позволило получать однородные каталитические частицы с узким распределением по диаметрам. Рост УНВ контролировали варьированием продолжительности синтеза (1–60 мин). Восстановление ОГ в процессе синтеза подтверждается элементным анализом. При восстановлении ОГ в токе C2H4:H2:Ar атомарное соотношение C/O увеличивается с 1.5 для исходного ОГ до 20.7 и 21.2 для композитов УНВ/Ni/ГПМ-2 и УНВ/Ni/ГПМ-1 соответственно. Растет и относительное содержание водорода, что можно объяснить образованием C–H-связи на поверхности ГПМ при взаимодействии с H2. Осаждение углерода на Ni-катализаторе и рост УНВ в процессе пиролиза этилена подтверждаются увеличением атомарного соотношения C/Ni с увеличением времени синтеза. На рис. 3 представлены микрофотографии композитов УНВ/Ni/ГПМ-1 при разной длительности синтеза.
Рис. 3.
СЭМ-изображения композитов УНВ/Ni/ГПМ-1, полученных при длительности синтеза 1 (a) и 60 мин (б).

На листах ГПМ видны равномерно распределенные наночастицы Ni, размер которых составляет до 15 нм, а также выращенные УНВ. Их диаметр находится в пределах 5–20 нм, а длина увеличивается от 20 до 300 нм с увеличением времени синтеза от 1 до 60 мин. Металлические частицы Ni-катализатора, в основном, расположены на торцах углеродных волокон, диаметр которых совпадает с размером частиц никеля. Это свидетельствует о торцевом механизме роста волокон, когда каталитическая частица слабо закреплена на поверхности подложки и в процессе роста волокна она выносится на его свободный торец. Таким образом во время синтеза УНВ/Ni/ГПМ композитов одновременно протекают три процесса: (1) восстановление ОГ и Ni2+; (2) пиролиз C2H4 на образовавшемся Ni-катализаторе; (3) формирование и рост УНВ.
Аналогично были получены углерод-графеновые композиты с использованием в качестве прекурсора [NiL3]Cl2/ОГ. Длительность пиролиза составляла от 1 до 60 мин. На микрофотографиях композита УНВ/Ni/ГПМ-2, полученных с помощью сканирующего электронного микроскопа (рис. 4), видно, что синтезированные УНВ имеет меньший диаметр и более правильную форму по сравнению с УНВ, синтезированными на УНВ/Ni/ГПМ-1.
Анализ структуры полученных материалов был также проведен с помощью построения изотермы адсорбции–десорбции азота (рис. 5).
Рис. 5.
Изотерма адсорбции–десорбции азота (a) и гистограмма распределения пор (б) для композита УНВ/Ni/ГПМ-1.
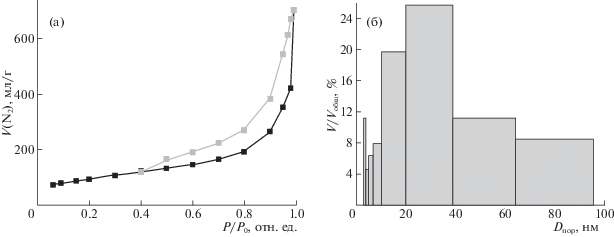
Форма кривой изотермы адсорбции–десорбции (рис. 5a) соответствует I–V типу по номенклатуре IUPAC с гистерезисом в области средних и высоких парциальных давлений. Из гистограммы распределения (рис. 5б) видно, что материалы имеют иерархическую структуру, содержащую макро- и мезопоры. Макропоры, вероятно, были сформированы изогнутыми листами ГПМ, тогда как мезопоры, объем которых составляет более 80%, связаны с выращенными на поверхности ГПМ нановолокнами.
На рис. 6 представлена схема предположительного механизма формирования никель-углерод-графеновых композитов, который состоит из следующих стадий: восстановление оксида графита и ионов никеля (I); образование и рост кластеров Ni на восстановленном оксиде графита (II); каталитический пиролиз C2H4 на монокристаллах Ni, закрепленных на графеноподобном носителе (III); формирование и рост углеродных наноструктур на поверхности графеноподобного материала (IV).
Cвязь металлической частицы с подложкой через углеродное волокно (M–УНВ-носитель) гораздо прочнее, чем непосредственное нанесение металла на поверхность носителя (М-носитель): при химическом восстановлении взаимодействие металла с поверхностью носителя происходит за счет образования мостиковых связей через гидроксильные, карбоксильные и другие кислородсодержащие группы. В случае ацетата никеля связь может также осуществляться по типу M–(O)-(носитель). Эта связь менее прочная, чем связь углеродного волокна с углеродной подложкой, поэтому металлическая частица оказывается на торце углеродного нановолокна.
Таким образом, описанные в работе методы позволяют получать трехмерные углерод-графеновые композиты с развитой поверхностью, которые могут быть использованы в качестве сорбентов газов и органических соединений. Показано, что в процессе синтеза металлическая наночастица выносится на торец УНВ. Такие свободные от углерода и находящиеся на концах УНТ(УНВ) металлические наночастицы возможно использовать в качестве эффективных катализаторов различных химических и электрохимических процессов.
Работа выполнена в рамках госзадания № 0089-2019-0007 и при поддержке РФФИ (проект № 19-03-01069).
Физико-химические исследования материалов выполнялись с использованием оборудования аналитических центров ИПХФ и НЦЧ РАН.
Список литературы
Dimitrakakis G.K., Tylianakis E., Froudakis G.E. // Nano Lett. 2008. V. 8. P. 3166.
Jiang H., Cheng X.-L. // J. Mol. Graphics Modell. 2018. V. 85. P. 223.
Chen J., Jia Ch., Wan Zh. // Synth. Met. 2014. V. 189. P. 69.
Liu Z., Qian Zh., Song J., Zhang Y. et al. // Carbon. 2019. V. 149. P. 181.
Feng J., Dong L., Li X. et al. // Electrochim. Acta. 2019. V. 302. P. 65.
Li J., Tang J., Yuan J. et al. // Chem. Phys. Lett. 2018. V. 693. P. 60.
Pham K.-C., McPhail D.S., Mattevi C. et al. // J. Electrochem. Soc. 2016. V. 163. P. F255.
Kumar D.K., Swami S.K., Dutta V. et al. // FlatChem. 2019. V. 15. P. 100105.
Tang Q., Sun M., Yu Sh., Wang G. // Electrochim. Acta. 2014. V. 125. P. 488.
Wang Y.-Sh., Yang Sh.-Y., Li Sh.-M. et al. // Electrochim. Acta. 2013. V. 87. P. 261.
Kotal M., Bhowmick A.K. // J. Phys. Chem. C. 2013. V. 117. P. 25865.
You B., Wang L., Yao L., Yang J. // Chem. Commun. 2013. V. 49. P. 5016.
Medhekar N.V., Ramasubramaniam A., Ruoff R.S. et al. // ACS Nano. 2010. V. 4. P. 2300.
Li J., Tang J., Yuan J. et al. // Chem. Phys. Lett. 2018. V. 693. P. 60.
Wang Ch., Cao M., Wang P. et al. // Appl. Cat. A: General. 2014. V. 473. P. 83.
Chen X., Chen X., Zhang F. et al. // J. Power Sources. 2013. V. 243. P. 555.
Tai Z., Yana X., Langa J., Xue Q. // J. Power Sources. 2012. V. 199. P. 373.
Тарасов Б.П., Арбузов А.А., Можжухин С.А. и др. // Журн. структ. химии. 2018. Т. 59. № 4. С. 867 https://doi.org/10.26902/JSC20180411
Тарасов Б.П., Мурадян В.Е., Володин А.А. // Изв. АН. Сер. хим. 2011. № 7. С. 1237.
Арбузов А.А., Мурадян В.Е., Тарасов Б.П. // Изв. АН. Сер. хим. 2013. № 9. С. 1962.
Арбузов А.А., Можжухин С.А., Володин А.А. и др. // Изв. АН. Сер. хим. 2016. № 8. С. 1893.
Арбузов А.А., Мурадян В.Е., Тарасов Б.П. и др. // Журн. физ. химии. 2016. Т. 90. № 5. С. 663. https://doi.org/10.7868/S0044453716050071
Клюев М.В., Арбузов А.А., Магдалинова Н.А. и др. // Журн. физ. химии. 2016. Т. 90. № 9. С. 1331. https://doi.org/10.7868/S0044453716090144
Арбузов А.А., Клюев М.В., Калмыков П.А. и др. Палладийсодержащий катализатор гидрирования и способ его получения. Пат. РФ 2551673 C1 // Б.И. 2015. № 15.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии






