Журнал физической химии, 2020, T. 94, № 5, стр. 772-777
Особенности гидрирования магния с Ni-графеновым покрытием
Б. П. Тарасов a, *, С. А. Можжухин a, А. А. Арбузов a, А. А. Володин a, Э. Э. Фокина a, П. В. Фурсиков a, М. В. Лотоцкий b, В. А. Яртысь c
a Российская академия наук, Институт проблем химической физики
Черноголовка, Россия
b Университет Западно-Капской провинции
Кейптаун, ЮАР
c Институт энергетических технологий
Челлер, Норвегия
* E-mail: tarasov@icp.ac.ru
Поступила в редакцию 22.07.2019
После доработки 22.07.2019
Принята к публикации 17.09.2019
Аннотация
Исследована кинетика процессов гидрирования композитов магния с графеноподобным материалом (ГПМ), на который нанесены частицы никеля (Ni/ГПМ), и дегидрирования композитов MgH2 + Ni/ГПМ. При использовании полученных результатов с математической обработкой кривых с помощью уравнения Авраами–Ерофеева выявлен механизм реакций. Установлено, что Ni/ГПМ значительно ускоряет скорости гидрирования Mg и разложения MgH2 в композите. Показано, что водород-аккумулирующий композит Mg + Ni/ГПМ обладает циклической стабильностью с быстрым и практически полным обратимым гидрированием.
Гидрид магния является перспективным материалом для хранения водорода из-за его высокой массовой (7.6 мас. % H2) и объемной (110 г H/л) обратимой водородоемкости [1–3]. Нами запатентованы способы получения никель-графенового катализатора гидрирования [4] и водород-аккумулирующих материалов на основе магния [5]. Оригинальность нашего метода формирования магниевых систем заключается в механохимической обработке в водороде магния с Ni-графеновым композитом. Такой подход позволяет устранить основные недостатки магния как водород-аккумулирующего материала: (1) плохая кинетика гидрирования из-за образования сплошного слоя гидрида, через который плохо диффундируют атомы водорода; (2) высокая температура гидрирования и дегидрирования; (3) спекание малых частиц магния при термическом разложении гидрида; (4) плохая теплопроводность гидрида магния, затрудняющая создание металлогидридного аккумулятора [1, 2, 6]. Композит из субмикронных частиц магния с Ni-графеновым покрытием обладает хорошей кинетикой гидрирования благодаря наличию на поверхности каталитических частиц Ni и малого размера частиц Mg/MgH2 и высокой теплопроводностью благодаря графеноподобной структуре углеродного материала; кроме того, частицы композита не спекаются при дегидрировании MgH2 благодаря покрытию углеродным материалом.
Исследование кинетики и механизма твердофазных химических реакций в системах “металл–водород” представляет особый интерес, поскольку дает результаты, позволяющие проводить направленный поиск материалов с улучшенными водород-сорбционными характеристиками. Цель данной работы – детальное изучение кинетики обратимого гидрирования частиц магния с Ni‑графеновым покрытием, выявление лимитирующих стадий и выяснение механизма протекающих процессов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для получения композитов использован порошок магния с размером частиц 0.5–1 мм и никель-графеновый катализатор, полученный совместным восстановлением Ni(II) и оксида графита по методике, подробно изложенной в [6, 7], и представляющий собой графеноподобный материал (ГПМ) с площадью удельной поверхности 600–650 м2/г с равномерно нанесенными на него наночастицами Ni, содержание которых составляло 25 мас. %. Композиты MgH2 с 10 мас. % Ni‑графенового катализатора (далее MgH2 + + Ni/ГПМ) приготовлены с помощью высокоэнергетического помола в шаровой мельнице “Пульверизетте-6” при начальном давлении водорода в размольном стакане 25 атм. Использован водород чистотой 99.9999% из металлогидридного лабораторного аккумулятора. Объем стального размольного стакана – 80 мл, соотношение масс стальных шаров к массе размалываемого материала – 40/1, скорость вращения в мельнице – 500 об./мин, время помола – 10 ч.
Фазовый состав и микроструктура полученных композитов исследованы с помощью рентгенофазового анализа и электронной микроскопии на рентгеновском дифрактометре ДРОН-УМ2 (излучение CuKα) и сканирующем электронном микроскопе Zeiss LEO SUPRA 25 соответственно.
Регистрация кинетических кривых десорбции и сорбции водорода проводилась в лабораторной установке типа Сивертса в диапазоне температур 300–350°C и давлений 1.2–5.5 атм. Давление водорода в начале и в конце дегидрирования составляло 1.2 и ≤1.3 атм соответственно, и, таким образом, условия процесса были близки к изобарическим. Математическая обработка полученных экспериментальных данных проводилась с помощью кинетического уравнения Авраами–Ерофеева вида:
где α – доля прореагировавшей фазы в данный момент времени t, A – асимптотическое значение α при t → ∞, k – константа скорости (обратная величина которой есть характерное время реакции), n – фактор Авраами.В качестве объектов сравнения использовались образцы гидрида магния и MgH2 + 10 мас. % ГПМ (далее MgH2 + ГПМ), приготовленные аналогично композитам MgH2 + Ni/ГПМ.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
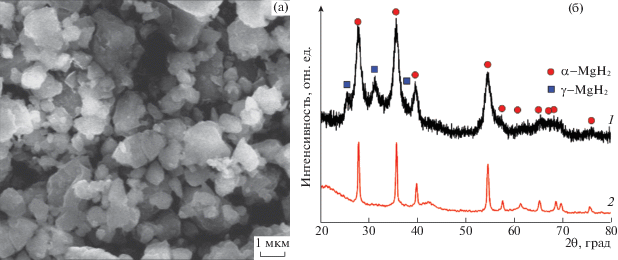
В композитах, полученных в ходе синтеза, согласно данным РФА, присутствуют две кристаллические фазы гидрида магния: α-MgH2 со структурой типа рутила и γ-MgH2 с орторомбической структурой. На рис. 1 приведены микрофотография и рентгенограмма композита. Положения дифракционных пиков (рис. 1б) соответствуют брегговским рефлексам фаз α-MgH2 и γ-MgH2 с параметрами элементарных ячеек а = 0.4515, с = = 0.3019 нм и а = 0.4526, b = 0.5448, с = 0.4936 нм соответственно, приведенным в работе [8]. Известно, что фаза γ-MgH2 метастабильна при условиях проведения циклов сорбции–десорбции водорода и, как было показано нами ранее [8, 9], исчезает после первой стадии дегидрирования. Размер частиц гидрида магния в синтезированных композитах MgH2 + ГПМ и MgH2 + Ni/ГПМ, как следует из данных сканирующей электронной микроскопии (СЭМ) (рис. 1a), лежит в диапазоне от 500 нм до нескольких мкм и заметно не меняется в ходе циклов десорбции и сорбции водорода [8, 9], в то время как размер областей когерентного рассеяния (ОКР) для фазы α-MgH2 растет. Так, после 10-го цикла сорбции водорода размер ОКР в направлении 110 составляет 30–40 нм (исходное значение 7–10 нм, рис. 1б). В образце сравнения MgH2 без добавок размер частиц резко увеличивается в ходе циклирования, что указывает на их спекание. Можно полагать, что введение в композиты ГПМ препятствует спеканию субмикронных частиц магния в условиях термического разложения гидрида.
Рис. 1.
Микрофотография СЭМ (а) и рентгенограммы (б) композита, полученного в ходе синтеза (1) и после проведения 10 циклов десорбции–сорбции водорода (2).
Уравнение Авраами–Ерофеева, которое мы используем для исследования механизма сорбции и десорбции водорода композитами, активно применяется при кинетическом моделировании реакций гидрирования и дегидрирования водород-аккумулирующих материалов на основе магния [10–16]. Известно [14], что в системах “металл–водород” реакции фазовых превращений могут контролироваться как механизмом зародышеобразования (нуклеации) и роста (З-Р), так и диффузией (ДФ). Вклад этих взаимодополняющих механизмов определяется численным значением фактора Авраами n: если 0.5 ≤ n < 1.0, то реакция контролируется только диффузией, если 2.5 ≤ n ≤ 4.0, то реакция протекает исключительно по механизму З-Р и, если значение n находится в диапазоне от 1.0 до 2.5, то оба механизма действуют параллельно. Например, при n = 1 имеет место как диффузия, определяемая геометрией, так и зародышеобразование, которое происходит на границах зерен [15].
На рис. 2 приведены кинетические кривые десорбции и сорбции водорода для композитов с добавками Ni/ГПМ и для образцов сравнения. Видно, что все кривые десорбции, а также кривые сорбции для образца Mg без добавок, хорошо аппроксимируются уравнением вида (1), в то время как для кривых сорбции водорода композитами Mg + ГПМ и Mg + Ni/ГПМ ситуация более сложная, и хорошая аппроксимация достигается с использованием уравнения (1), в котором правая часть состоит как минимум из двух слагаемых с различными наборами параметров: A1, k1, n1 и A2, k2, n2. Результаты аппроксимации приведены в табл. 1–3.
Рис. 2.
Кривые десорбции водорода при 350°C и 1 атм образцами MgH2 (1), MgH2+ГПМ (2) и MgH2+Ni/ГПМ (3) (а); кривые сорбции водорода при 5.5 атм и 300°C образцами Mg (1–3) и MgH2+Ni/ГПМ (4–6) на первом (1, 4), пятом (2, 5) и десятом (3, 6) циклах гидрирования (б); кривая 5 с рисунка “б” (1) и ее аппроксимация с использованием уравнения Авраами–Ерофеева с одним (2) и двумя (3) слагаемыми в правой части (в); кривые дегидрирования композита MgH2+Ni/ГПМ при температурах 320 (1), 330 (2), 340 (3) и 350°C (4) (г).
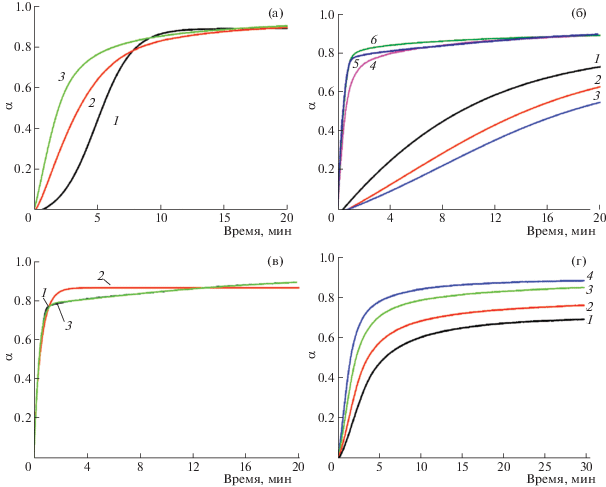
Таблица 1.
Результаты аппроксимации кинетических кривых дегидрирования композитов (рис. 2a)
| Кривая | Образец | A | k–1, мин | n | R2 |
|---|---|---|---|---|---|
| 1 | MgH2 | 0.8836(2) | 5.817(2) | 2.520(3) | 0.99983 |
| 2 | MgH2 + 10% ГПМ | 0.8820(4) | 4.22(1) | 1.241(3) | 0.99887 |
| 3 | MgH2 + 10% Ni/ГПМ | 0.8847(6) | 2.507(9) | 0.962(5) | 0.99355 |
Таблица 2.
Результаты аппроксимации кинетических кривых гидрирования Mg без добавок (рис. 2б, кривые 1–3)
| Кривая | Цикл | A | k–1, мин | n | R2 |
|---|---|---|---|---|---|
| 1 | 1 | 0.805(1) | 9.40(2) | 1.161(2) | 0.99964 |
| 2 | 5 | 0.777(2) | 13.74(5) | 1.384(3) | 0.99969 |
| 3 | 10 | 0.741(2) | 15.98(5) | 1.428(2) | 0.99984 |
Таблица 3.
Результаты аппроксимации кинетических кривых гидрирования композитов Mg+Ni/ГПМ (рис. 2б, кривые 4–6)
| Кривая | Цикл | Быстрая стадия | Медленная стадия | A1 + A2 | $\frac{{{{A}_{2}}}}{{{{A}_{1}} + {{A}_{2}}}}$ | R2 | ||||
|---|---|---|---|---|---|---|---|---|---|---|
| A1 | $k_{1}^{{ - 1}}$, мин | n1 | A2 | $k_{2}^{{ - 1}}$, мин | n2 | |||||
| 4 | 1 | 0.647(7) | 0.566(1) | 1.215(8) | 0.270(8) | 5.4(1) | 0.68(2) | 0.92 | 0.29 | 0.99968 |
| 5 | 5 | 0.764(3) | 0.474(1) | 1.33(1) | 0.188(7) | 14.3(9) | 0.50(2) | 0.95 | 0.20 | 0.99972 |
| 6 | 10 | 0.7860(8) | 0.422(1) | 1.261(3) | 0.148(4) | 14.8(4) | 1.24(3) | 0.93 | 0.16 | 0.99937 |
Ход кривых на рис. 2a и данные табл. 1 показывают, что введение добавок как ГПМ, так и Ni/ГПМ изменяет механизм реакции дегидрирования по сравнению с MgH2 без добавок: параметры Авраами существенно различаются между собой. Кроме того, композиты с добавками (рис. 2a, кривые 2 и 3) демонстрируют существенно более высокие скорости превращения в начале дегидрирования. При n = 2.5 дегидрирование образца MgH2 без добавок идет по механизму З-Р. Для композита с добавками ГПМ значение фактора Авраами n = 1.25 означает, что реакция зародышеобразования имеет нулевой порядок, а для композита с добавками Ni/ГПМ (n = 1) имеет место зародышеобразование на границах зерен. Для двух последних процессов вклад диффузии как фактора, ограничивающего общую скорость процессов, весьма вероятен, как это предполагается в работе [17]. Характерное время реакции становится очень малым, менее 6 мин для MgH2; введение добавок ГПМ уменьшает его примерно на 30%, а Ni/ГПМ – еще примерно в 1.7 раза.
При дегидрировании MgH2 без добавок частицы образующейся фазы магния спекаются во время образования агломератов, что существенно ухудшает кинетику поглощения водорода во время последующих циклов гидрирования (рис. 2б, кривые 1–3). Как видно из табл. 2, в результате циклирования предельное значение α для реакции превращения Mg в MgH2 падает с >0.8 до 0.75 (это – типичное значение для гидрирования Mg при более низких температурах, когда MgH2 не подвергается шаровому размолу [18]) после 10 циклов “дегидрирование–гидрирование”. Характерное время реакции и значение показателя Авраами увеличиваются с 9 до >15 мин и с 1.2 до 1.4 соответственно.
Как было показано в нашей работе [6], слои ГПМ покрывают частицы гидрида магния во время механохимической обработки, что предотвращает их агломерацию и спекание во время дегидрирования. Вследствие этого и каталитического действия наночастиц Ni скорость поглощения водорода композитами с добавками Ni/ГПМ высока как в течение первого, так и последующих циклов повторного гидрирования (рис. 2б, кривые 4–6). Причем предельное значение α увеличивается до 0.92–0.95 (это значение равно сумме А1 + А2 в табл. 3), и 80% гидрирования Mg достигается всего за 2–4 мин. Существенное различие значений констант скорости реакции гидрирования, k1$ \gg $ k2, для двух слагаемых в правой части уравнения Авраами–Ерофеева, которое хорошо описывает зависимость α от времени, свидетельствует о том, что гидрирование включает две стадии: быструю и медленную.
Отметим, что наблюдаемый характер изменения кинетических параметров повторного гидрирования для исследуемых образцов аналогичны таковым для нанокомпозитов MgH2–TiH2, полученных в результате шарового размола Mg + Ti в водороде [12]. Выполнение десяти циклов десорбции–сорбции приводит к постепенному уменьшению вклада медленной стадии, A2/(A1 + A2), с одновременным уменьшением характерного времени реакции для быстрой стадии (с 36 до 24 с) и увеличением характерного времени реакции (от 5 до 15 мин) для медленной. Значения показателя Авраами для быстрой стадии существенно не изменяются во время циклирования (n = 1.3), в то время как медленная стадия демонстрирует увеличение n от 0.5 (диффузионно-контролируемый процесс) до 1.2 (смешанный тип: З-Р и ДФ).
На рис. 2г показаны кинетические кривые дегидрирования для композита MgH2 с добавками Ni/ГПМ при четырех различных температурах в диапазоне 320–340°C, а константы скорости, k, представлены в табл. 4. Линейная аппроксимация зависимости lnk от 1/T дает значение энергии активации дегидрирования Ea= 76 ± 3 кДж (моль H2)–1, что заметно меньше приводимых в литературе значений энергий активации для реакций дегидрирования материалов на основе магния. Важно, однако, отметить, что для корректного расчета Ea значения k, которые были получены из серии изобарических экспериментов, должны быть умножены на зависящий от температуры поправочный коэффициент, представляющий собой отношение p(T)/p(T = 350°С), который учитывает термодинамические характеристики рассматриваемой системы “композит–водород”, а именно зависящее от температуры значение равновесного давления водорода P0 в системе. Так, для диффузионно-контролируемых реакций дегидрирования, которые имеют место для исследуемого материала (см. рис. 2а, кривая 3), в работе [17] предложено использовать следующее выражение для p(T): p = T(1 – (P/P0)1/2). Введение такой поправки в наши значения k дает Ea = 124 ± 1 кДж (моль H2)–1, что хорошо согласуется с данными других работ, например [19–22], в которых исследовались схожие системы: для MgH2 + 10% NiCl2 значение энергии активации дегидрирования составляет 121.3 кДж (моль H2)–1 (ср. со значением 160 кДж (моль H2)–1 для дегидрирования чистого MgH2 [18]).
Таблица 4.
Значения констант скорости дегидрирования композитов MgH2+Ni/ГПМ при различных температурах
| Кривая | T, °C | k, мин–1 | P0, атм | p(T)/p(T=350°С) | kкор, мин–1 |
|---|---|---|---|---|---|
| 1 | 320 | 0.3359 | 3.10 | 0.62 | 0.2089 |
| 2 | 330 | 0.4196 | 3.98 | 0.76 | 0.3196 |
| 3 | 340 | 0.5342 | 5.07 | 0.89 | 0.4739 |
| 4 | 350 | 0.7054 | 6.41 | 1.00 | 0.7054 |
Примечание. Значения k получены в результате аппроксимации кинетических кривых на рис. 2г, kкор – после умножения на поправочный коэффициент, P0 – равновесное давление, p(T)/p(T = 350°С) – поправочные коэффициенты, значение фактического давления для всех кривых P = 1.25 атм.
Таким образом, добавки ГПМ и, особенно, Ni/ГПМ значительно ускоряют скорости сорбции и десорбции водорода в композитах магния. Константа скорости реакции дегидрирования возрастает в 1.4 и 2.3 раза для Mg + ГПМ и Mg + + Ni/ГПМ соответственно по сравнению с Mg без добавок. Константа скорости гидрирования для композитов с добавками Ni/ГПМ в 15–37 раз выше, чем для образца без добавок. Для всех процессов эффект добавок выражается также в значительном уменьшении фактора Авраами, что указывает на геометрическое ограничение областей зародышеобразования (но при этом скорость данного процесса растет), а также на то, что вклад диффузии атомов Н становится лимитирующей стадией. Добавки Ni/ГПМ также улучшают циклическую стабильность, обеспечивая быстрое и практически полное повторное гидрирование в течение, по меньшей мере, десяти циклов. В ходе циклирования вклад “медленного” процесса в кинетику сорбции водорода уменьшается без снижения водородоемкости композита.
Работа выполнена при поддержке Минобрнауки Российской Федерации (Соглашение № 14.613.21.0087, уникальный идентификатор RFMEFI61318X0087) в рамках ФЦП-БРИКС (проект 064–RICS–MH).
М.В. Лотоцкий благодарит за поддержку Департамент науки и технологий (DST, проект KP6–S01/HySA) и Национальный научный фонд ЮАР (NRF, грант 109092), В.А. Яртысь – Исследовательский совет Норвегии (RCN; проект 285146).
Физико-химические исследования материалов выполнялись с использованием оборудования АЦКП и УНУ ИПХФ РАН и приборного парка научных организаций ЮАР и Норвегии.
Список литературы
Тарасов Б.П., Лотоцкий М.В., Яртысь В.А. // Рос. хим. журн. 2006. Т. 50. № 6. С. 34.
Лукашев Р.В., Клямкин С.Н., Тарасов Б.П. // Неорган. материалы. 2006. Т. 42. № 7. С. 803.
Tarasov B.P. // Int. J. Hydrogen Energy. 2011. V. 36. № 1. P. 1196.
Арбузов А.А., Можжухин С.А., Володин А.А., Фурсиков П.В., Тарасов Б.П. Никель-графеновый катализатор гидрирования и способ его получения. Патент 2660232 РФ // Б.И. 2018. № 19.
Арбузов А.А., Можжухин С.А., Володин А.А., Фурсиков П.В., Тарасов Б.П. Водород-аккумулирующие материалы и способ их получения. Патент 2675882 РФ // Б.И. 2018. № 36.
Тарасов Б.П., Арбузов А.А., Можжухин С.А. и др. // Журн. структур. химии. 2018. Т. 59. № 4. С. 867. https://doi.org/10.26902/JSC20180411
Клюев М.В., Арбузов А.А., Магдалинова Н.А. и др. // Журн. физ. химии. 2016. Т. 90. № 9. С. 1331.
Фурсиков П.В., Тарасов Б.П. // Изв. АН. Сер. хим. 2018. № 2. С. 193.
Арбузов А.А., Можжухин С.А., Володин А.А. и др. // Изв. АН. Сер. хим. 2016. № 8. С. 1893.
Denys R.V., Riabov A.B., Maehlen J.P. et al. // Acta Mater. 2009. V. 57. № 13. P. 3989.
Ouyang L.Z., Yang X.S., Zhu M. et al. // J. Phys. Chem. C. 2014. V. 118. № 15. P. 7808.
Lotoskyy M., Denys R., Yartys V.A. et al. // J. Mater. Chem. A. 2018. V. 6. P. 10740.
Ouyang L.Z., Cao Z.J., Wang H. et al. // J. Alloys Compd. 2014. V. 586. P. 113.
Ouyang L., Cao Z., Wang H. et al. // J. Alloys Compd. 2017. V. 691. P. 422.
Førde T., Maehlen J.P., Yartys V.A. et al. // Int. J. Hydrogen Energy. 2007. V. 32. P. 1041.
Lototskyy M., Goh J., Davids M.W. et al. // Int. J. Hydrogen Energy. 2019. V. 44. P. 6687. https://doi.org/10.1016/j.ijhydene.2019.01.135
Rudman P.S. // J. Appl. Phys. 1979. V. 50. № 11. P. 7195.
Stander C.M. // Z. Physik. Chemie Neue Folge. 1977. Bd. 104. S. 229.
Mao J., Guo Z., Yu X. et al. // Int. J. Hydrogen Energy. 2010. V. 35. № 10. P. 4569. https://doi.org/10.1016/j.ijhydene.2010.02.107
Fernández J.F., Sánchez C.R. // J. Alloys Compd. 2002. V. 340. P. 189. https://doi.org/10.1016/S0925-8388(02)00120-2
Yartys V.A., Lototskyy M.V., Akiba E. et al. // Int. J. Hydrogen Energy. 2019. V. 44. P. 7809. https://doi.org/10.1016/j.ijhydene.2018.12.212
Tarasov B.P., Arbuzov A.A., Mozhzhuhin S.A. et al. // Int. J. Hydrogen Energy. 2019. V. 44. P. 29212. https://doi.org/10.1016/j.ijhydene.2019.02.033
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии


