Журнал физической химии, 2020, T. 94, № 5, стр. 778-783
Квантово-химическое моделирование адсорбции краун-эфиров различной структуры на поверхностях лития и углерода
Г. З. Тулибаева a, О. В. Ярмоленко a, *, А. Ф. Шестаков a, b
a Российская академия наук, Институт проблем химической физики
Черноголовка, Россия
b Московский государственный университет им. М.В. Ломоносова, факультет фундаментальной физико-химической инженерии
Москва, Россия
* E-mail: oyarm@icp.ac.ru
Поступила в редакцию 29.07.2019
После доработки 29.07.2019
Принята к публикации 17.09.2019
Аннотация
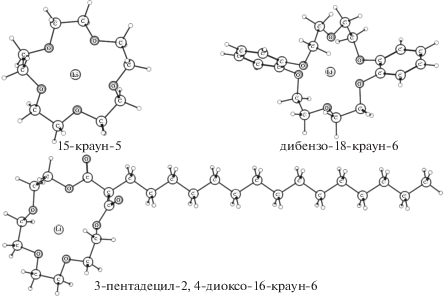
Проведены теоретические исследования процесса адсорбции краун-эфиров различной структуры (15-краун-5, дибензо-18-краун-6 и 3-пентадецил-2,4-диоксо-16-краун-5) на поверхность лития и углерода – основных материалов анода вторичных литиевых источников тока. С использованием функционала плотности РВЕ рассчитаны энергии адсорбции данных краун-эфиров и энергии связи иона лития с краун-эфиром в свободном и адсорбированном состояниях. Показано, что молекулы 15-краун-5 и 3-пентадецил-2,4-диоксо-16-краун-5 образуют плоские структуры, что способствует “стопочной” укладке последующих молекул краун-эфиров; для дибензо-18-краун-6 имеются стерические препятствия, поскольку одно из бензольных колец ориентируется перпендикулярно. Установлено, что 3-пентадецил-2,4-диоксо-16-краун-5 лучше остальных двух краун-эфиров способствует переносу иона лития из объема электролита к поверхности, как лития, так и углерода.
Краун-эфиры находят широкое применение благодаря своим свойствам координировать катионы металлов [1–4], в том числе в органической химии, в катализе, для разделения и регенерации металлов, как лекарственные препараты, антидоты, пестициды, для создания ион-селективных датчиков и мембран, при выращивании кристаллов, и т.д. Высокое сродство краун-эфиров к катионам щелочных металлов приводит к их захвату из сольватных комплексов в карбонатных растворителях [5–8]. Данные растворители участвуют в побочных реакциях на поверхности электродов с возникновением газообразных продуктов, что создает угрозу безопасности электрохимических устройств (вплоть до возгорания и даже взрыва).
Одно из решений этой проблемы состоит в устранении побочных реакций на электродах за счет создания защитного слоя, который пропускал бы только катионы Li+ и был бы непроницаем для молекул органического растворителя и анионов. Для этих целей перспективно использовать краун-эфиры. 15-краун-5 и дибензо-18-краун-6 хорошо известны в патентной литературе как компоненты электролитов для химических источников тока (ХИТ) [9–13], которые участвуют в образовании твердоэлектролитного слоя SEI (Solid Electrolyte Interphase) и обеспечивают безопасность ХИТ [14–18] для литиевых, натриевых и калиевых систем. Недавние результаты экспериментов по изучению влияния 15-краун-5 и дибензо-18-краун-6 на электрохимические процессы на поверхности углерода [19–22] также показывают положительный эффект данных добавок. В связи с этими явлениями проводятся теоретические работы по исследованию участия краун-эфиров (12-краун-4, 15-краун-5 и 18-краун-6) в адсорбции газообразных продуктов (CO2, CH4, N2) [23], изучению процессов адсорбции и диффузии катионов Li+, Na+, Mg2+, Ca2+ в слоях из молекул 12-краун-4 и 15-краун-5 [24], а также влиянию на перенос катионов Na+ и K+ 15-краун-5- и 18-краун-6-эфирами к поверхности углеродного анода [25].
Наиболее типичное свойство краун-эфиров – защита поверхности анода за счет образования координационных связей катиона щелочного металла в полости краун-эфира с поверхностными атомами металла [26–29].
Мы поставили задачу дизайна новой структуры краун-эфира, который мог адсорбироваться на поверхности, как лития, так и углерода.
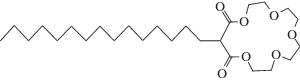
Известно, что энергия адсорбции n-углеводородов линейно растет с количеством CH2-звеньев. Поэтому была рассмотрена структура нового краун-эфира с длинным жирным остатком – 3-пентадецил-2,4-диоксо-16-краун-5 (пентадецил-2,4Д16К5):
Цель данной работы – теоретическое исследование процесса адсорбции нового краун-эфира, имеющего структуру поверхностно-активного вещества в сравнении с характеристиками 15-краун-5 (15К5) и дибензо-18-краун-6 (ДБ18К6), известными своим положительным эффектом на работу ХИТ.ТЕОРЕТИЧЕСКИЙ АНАЛИЗ
Для квантово-химических расчетов использовали неэмпирический обменно-корреляционный функционал PBE [30] и расширенный базис H [6s2p/2s1p], C, O [10s7p3d/3s2p1d], Li [10s7p3d/4s3p1d]. Все расчеты проводили с помощью программного комплекса ПРИРОДА [31] и вычислительных возможностей Межведомственного суперкомпьютерного центра РАН (г. Москва).
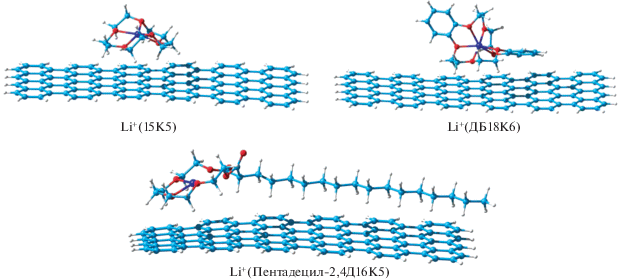
На рис. 1 представлены рассчитанные структуры комплексов иона лития с краун-эфирами. Средняя длина связи Li–O в комплексах Li+ с 15К5, ДБ18К6 и пентадецил-2,4Д16К5 равна 2.13, 2.14 и 2.25 Å соответственно. Расчет энергии связи иона лития с краун-эфиром показал, что для 15К5 и ДБ18К6 ее величина практически одинакова – 109.9 и 109.6 ккал/моль соответственно. Уменьшение энергии связи иона Li+ с пентадецил-2,4Д16К5 до 95.1 ккал/моль указывает, что по сравнению с остальными краун-эфирами он более эффективно способствует переносу иона лития из объема электролита к поверхности электрода.
Для детального изучения взаимодействия краун-эфиров с поверхностью анода был использован кластер из 72 атомов лития (рис. 2).
Рис. 2.
Рассчитанные структуры комплексов кластера лития Li72 с различными краун-эфирами. Приведены энергии присоединения (адсорбции) краун-эфиров к кластеру Li72 в ккал/моль.
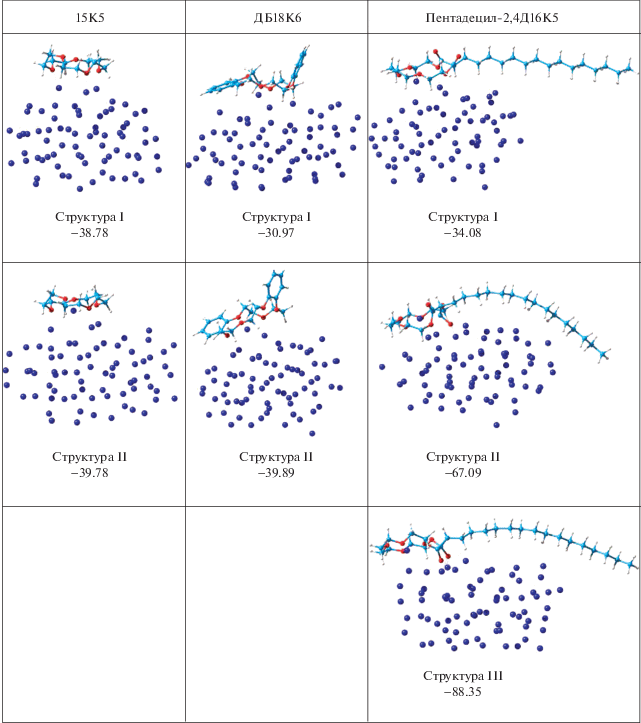
При моделировании процесса адсорбции краун-эфиров были рассмотрены структуры, когда полость краун-эфира остается незаполненной (структура I) и когда при адсорбции молекулы краун-эфира один из атомов кластера Li переходит в его полость, образуя связи с атомами кислорода краун-эфира (структуры II и III). Из сравнения средних длин связей Li–О между атомами кластера и атомами О краун-эфиров для структур I 15К5, ДБ18К6, пентадецил-2,4Д16К5 (1.95, 2.07, 2.08 Å соответственно) и энергий адсорбции для этих структур следует, что лучше всего адсорбируется 15К5.
Для 15К5 энергии структур I и II практически не отличаются, в то время как для ДБ18К6 переход к структуре II сопровождается выигрышем энергии 8.92 ккал/моль. Это означает, что иону Li+ гораздо легче покинуть полость 15К5, чем ДБ18К6. Для структур I, II и III с участием пентадецил-2,4Д16К5 сложно проводить сравнение энергий адсорбции, поскольку возможна различная ориентация карбонильных групп, вследствие чего образуются три прочные связи Li–Окарб с одним атомом О для структуры II, средняя длина 1.86 Å, и шесть связей с двумя атомами О для структуры III, средняя длина 1.92 Å, которые вносят большой вклад в энергию адсорбции. Наблюдаемый изгиб углеводородного остатка (рис. 2) также указывает на его вклад в понижение энергии системы.
Адсорбционные комплексы, полученные при заполнении полости краун-эфиров в структурах I, изображены на рис. 3. В случае 15К5 образуются две связи с кластером Li72 (средняя длина 2.03 Å), а в случаях ДБ18К6 и пентадецил-2,4Д16К5 только одна связь (2.05 и 1.98 Å соответственно). Средняя длина связи иона Li+ с атомами O в полости краун-эфира в комплексах с 15К5, ДБ18К6 и пентадецил-2,4Д16К5 равна 2.12, 2.05 и 2.21 Å соответственно.
Рис. 3.
Рассчитанные структуры адсорбированных комплексов краун-эфиров с координированным ионом Li+ на кластер Li72.
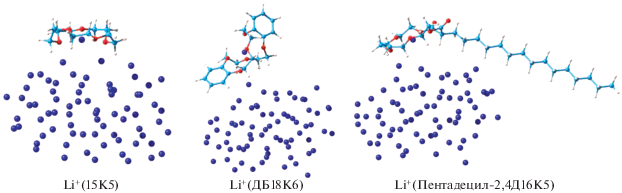
Из сравнения энергий адсорбции краун-эфиров с координированным ионом Li+ на кластер Li72: 18.93 ккал/моль (15К5), 16.15 ккал/моль (ДБ18К6), 25.80 ккал/моль (пентадецил-2,4Д16К5) следует заметное преимущество пентадецил-2,4Д16К5. Кроме того, из строения рассчитанных поверхностных комплексов видно, что молекулы 15К5 и пентадецил-2,4Д16К5 образуют плоские структуры, это способствует “стопочной” укладке последующих молекул краун-эфиров. Для ДБ18К6 из-за перпендикулярной ориентации одного из бензольных колец имеются стерические препятствия для оптимальной укладки, что будет затруднять перенос иона Li+ от одной молекулы краун-эфира к другой.
Следующий этап квантово-химического моделирования – изучение процесса адсорбции краун-эфиров на поверхность углерода. В качестве теоретической модели выбран лист графена (С108) с атомами H вместо оборванных C–C-связей. При этом было найдено, что 15К5 и ДБ18К6 имеют один вариант адсорбции, в то время как пентадецил-2,4Д16К5 может адсорбироваться тремя способами: только макроциклом (выигрыш энергии 1.9 ккал/моль), алкильным заместителем (выигрыш энергии 7.7 ккал/моль) и макроциклом и алкильным заместителем вместе (выигрыш энергии 4.1 ккал/моль).
В случае адсорбции комплекса иона Li+ с краун-эфиром (рис. 4), значение энергий адсорбции практически не зависит от способа присоединения пентадецил-2,4Д16К5 к поверхности углерода. Вычисленная энергия адсорбции комплексов Li+–краун-эфир на поверхности углерода равна 11.9, 9.0 и 16.6 ккал/моль для лигандов 15К5, ДБ18К6 и пентадецил-2,4Д16К5 соответственно. Из этих данных видна существенная роль углеводородного остатка для увеличения энергии адсорбции. Вместе с данными о большей подвижности катиона Li+ в комплексе с пентадецил-2,4Д16К5, это означает, что 3‑пентадецил-2,4-диоксо-16-краун-5 в сравнении с 15К5 и ДБ18К6 более эффективно способствует переносу иона лития из объема электролита к поверхности катода.
Рис. 4.
Рассчитанные структуры адсорбированных комплексов краун-эфиров с координированным ионом Li+ на поверхности углерода.
Таким образом, на основании результатов квантово-химического моделирования в качестве добавки в жидкий электролит для литиевых химических источников тока предложен новый краун-эфир – 3-пентадецил-2,4-диоксо-16-краун-5, имеющий структуру поверхностно-активного вещества. Согласно теоретическим исследованиям его адсорбционных свойств, эта добавка позволяет создавать защитный слой на поверхности, как металлического лития, так и углерода. В дальнейшем путем модификации размера полости краун-эфира, можно использовать данный подход для защиты поверхности анодов натриевых и калиевых систем.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (код проекта № 18-33-00312-мол_а).
Список литературы
Соловьев В.П., Цивадзе А.Ю. // Физикохимия поверхности и защита материалов. 2015. Т. 51. № 1. С. 1.
Dranka M., Zukowska G.Z., Jankowski P. et al. // J. Phys. Chem. C. 2017. V. 121. I. 48. P. 26713.
Biswas R., Ghosh P., Banerjee T. et al. // ACS Omega. 2018. V. 3. I. 2. P. 663.
Ichihashi K., Konno D., Date T. // Chem. Materials. 2018. V. 30. I. 20. P. 7130.
Sun G., Duan X.-X., Liu X.-S. et al. // Struct. Chem. 2017. V. 28. I. 3. P. 749.
Khoshnood R.S., Teymoori M., Hatami E., Balanezhad A.Z. // Russ. J. Phys. Chem. A. 2015. V. 89. № 9. P. 1560.
Jozwiak M., Madej-Kielbik L., Wasiak M., Jozwiak A. // J. Chem. Thermodynamics. 2017. V. 113. P. 321.
Тулибаева Г.З., Ярмоленко О.В., Шестаков А.Ф. // Изв. АН Сер. хим. 2009. Т. 58. № 8. С. 1542.
Luski S., Aurbach D., Powell B.R. et al. Lithium Ion Battery // Patent DE 102017113282. A1. Dec. 21. 2017.
Hwang J.Y., Ha H.Y. Redox Flow Battery Electrolyte Containing Crown Ether Additive and Manufacturing Method Thereof // Patent KR 2018001967. A. Jan. 05. 2018.
Omichi K., Brooks C., McKenney R. Liquid Electrolyte for Battery Using Crown Ether–Metal Halide Complex in Solvent // Patent EP 3336952. A1. Jun. 20. 2018.
Chae J.H., Kim J.S., Park D.I. et al. Sodium Secondary Battery Comprising Cathode and Anode with Significantly Improved output Efficiency and Stability, for Preventing Deterioration by Stably Maintaining Charge–Discharge Cycle Characteristics for Long Period of Time // Patent RU 2564258. C1. Sep. 27. 2015.
Omichi K., Brooks C., McKenney R. Liquid Electrolyte for Battery Using Crown Ether–Metal Halide Complex in Solvent // Patent EP 3336953. A1. Jun. 20. 2018.
Gentschev A.-C., Hain H., Scharner S., Stiaszny B. Lithium-Ion Batteries with Improved Safety Characteristics // Patent WO 2017216149. A1. Dec. 21. 2017.
Yang Y.-B., Liu Y.-X., Song Z. et al. // ACS Appl. Mater. Interfaces. 2017. V. 9. I. 44. P. 38950.
Scharner S., Stiaszny B., Gentschev A.-C., Hain H. Lithium-Ion Batteries with Improved Safety Characteristics // Patent DE 102016210562. A1. Dec. 14. 2017.
Hahn S., Widmaier M., Buehler E., Eckl T. Hybrid Supercapacitor Electrolyte with SEI Additives to Optimize Electrode–Electrolyte Interface Film for Improved Performance // Patent DE 102016217709. A1. Sep. 15. 2018.
Wang J., Zheng X., Fan Z. et al. Preparation Method of Dibenzo-18-crown-6 Grafted Polyvinyl Alcohol Microporous Membrane // Patent CN 108598531. A. Sep. 28. 2018.
Biswal M., Zhang X., Schilter D. et al. // J. Am. Chem. Soc. 2017. V. 139. I. 11. P. 4202.
Zhang H., Lerner M.M. // Inorg. Chem. 2016. V. 55. I. 17. P. 8281.
Domi Y., Doi T., Ochida M. et al. // J. Electrochem. Soc. 2016. V. 163. I. 14. P. A2849.
Ruiz D., Alegria A., Barroso-Bujans F. // Separation and Purification Technology. 2019. V. 213. P. 142.
Jamali S.H., Ramdin M., Becker T.M. et al. // J. Phys. Chem. B. 2017. V. 21. I. 35. P. 8367.
Wang W.-H., Gong C., Wang W. et al. // Solid State Ionics. 2017. V. 301. P. 176.
Gotoh K., Kunimitsu S., Zhang H. et al. // J. Phys. Chem. C. 2018. V. 122. I. 20. P. 10963.
Ярмоленко О.В., Ефимов О.Н. // Электрохимия. 2005. Т. 41. № 5. С. 646.
Ignatova A.A., Yarmolenko O.V., Tulibaeva, G.Z. et al. // J. Power Sources. 2016. V. 309. P. 116.
Yarmolenko O.V., Tulibaeva G.Z., Khatmullina K.G. et al. // Mendeleev Commun. 2016. V. 26. № 5. P. 407.
Игнатова А.А., Тулибаева Г.З., Ярмоленко О.В. и др. // Электрохимия. 2017. Т. 53. № 3. С. 330.
Perdew P., Burke K., Ernzerhof M. // Phys. Rev. Lett. 1996. V. 77. P. 3865.
Laikov D.N. // Chem. Phys. Lett. 1997. V. 281. P. 151.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии