Журнал физической химии, 2020, T. 94, № 5, стр. 796-802
Корреляция между характеристиками процессов газофазного и электрохимического гидрирования интерметаллических соединений
А. А. Володин a°, *, П. В. Фурсиков a, Э. Э. Фокина a, Б. П. Тарасов a
a Российская академия наук, Институт проблем химической физики
Черноголовка, Россия
* E-mail: alexvol@icp.ac.ru
Поступила в редакцию 04.09.2019
После доработки 04.09.2019
Принята к публикации 17.09.2019
Аннотация
Приведены основные методы определения характеристик процессов газофазного и электрохимического гидрирования интерметаллических соединений – перспективных материалов для металлогидридных аккумуляторов водорода и химических источников тока. Изложены общие принципы математической обработки экспериментальных данных и методы определения эффективного коэффициента диффузии водорода в металлогидридах. Показана возможность построения изотерм сорбции–десорбции в системах металл–водород по данным электрохимических измерений.
Гидридобразующие интерметаллиды активно используются для создания аккумуляторов и компрессоров водорода, тепловых насосов и Ni–MH источников тока [1–3]. Важнейшими характеристиками металлогидридных материалов являются данные о содержании водорода, обратимости, фазовом переходе (гистерезис, наклон плато, энтальпия и энтропия), циклической стабильности, кинетике гидрирования и диффузии водорода. При этом одно и то же свойство интерметаллида может отвечать разным характеристикам конкретных устройств: например, водородсорбционная емкость сплава (мас. % H) может определять объемную емкость аккумулятора водорода (л) и электрическую емкость Ni–MH источника тока (А ч). Эти характеристики определяются, в основном, газофазными и электрохимическими методами анализа.
Цель настоящей работы – сравнительный анализ и выявление корреляции между характеристиками процессов газофазного и электрохимического гидрирования интерметаллидов – перспективных материалов для создания высокоэффективных металлогидридных аккумуляторов водорода и химических источников тока.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Использовали интерметаллиды La2MgNi9, La1.5Nd0.5MgNi9 и Ti0.15Zr0.85La0.03Ni1.2Mn0.7V0.12Fe0.12, получаемые электродуговой плавкой в атмосфере аргона из смеси порошков соответствующих металлов с последующим отжигом при 950°C и закаливанием в холодной воде. Водородсорбционные характеристики определяли с помощью установки типа Сивертса. Гидрирование проводили в интервале температур 20–80°C и давлений 0.01–100 атм. Электрохимические измерения осуществляли в трехэлектродной ячейке с 9 M водным раствором КОН в качестве электролита, Ni(OH)2/NiOOH-противоэлектродом и Hg/HgO-электродом сравнения на потенциостатах ELINS P-40X + FRA24M и LAND CT2001A BatteryTester. Более подробно методики синтеза интерметаллидов и приготовления электродов описаны в работе [4].
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Водородсорбционные характеристики интерметаллидов
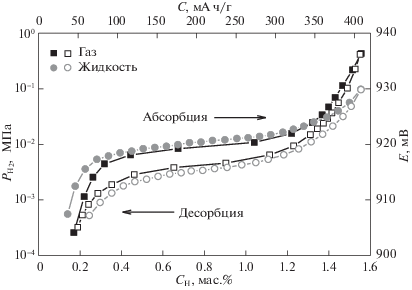
Для определения водородсорбционных характеристик интерметаллидов используют P–C–T- (давление–концентрация–температура) диаграммы. Изотермы “давление водорода–состав гидридной фазы” получают путем дозированной подачи или откачки водорода и измеряют разности равновесных давлений газа в известном объеме с контролируемой температурой и последующим расчетом поглощенного или десорбированного водорода [5–7]. В настоящей работе были построены изотермы сорбции–десорбции водорода, а также квазиравновесные кривые путем поэтапного заряда или разряда металлогидридных электродов в течение коротких периодов (30–60 мин) с последующей релаксацией (30–60 мин). Были использованы значения потенциалов, зафиксированные в конце периодов релаксации. Для сопоставления изотерм “давление водорода–состав гидрида” и “потенциал–состав гидрида” потенциал металлогидридного электрода в щелочном растворе, измеренный по отношению к электроду сравнения Hg/HgO, был преобразован в равновесное давление водорода согласно уравнению Нернста:
(1)
${{E}_{{{\text{eq}}}}}\, = \,{{E}_{0}} - \frac{{RT}}{{2F}}{\text{ln}}({{P}_{{{{{\text{H}}}_{{\text{2}}}}}}})\, = \, - {\kern 1pt} 0.932 - 0.0126\,{\text{ln}}({{P}_{{{{{\text{H}}}_{{\text{2}}}}}}}),$Значение емкости металлогидридного (MH) электрода было преобразовано в количественное содержание водорода в соответствии с уравнениями:
(3)
$w = \frac{{M{{r}_{{\text{H}}}}y}}{{\left( {M{{r}_{{\text{H}}}}y} \right) + M{{r}_{{\text{M}}}}}} \times 100\% ,$Так, на примере интерметаллида La2MgNi9 (рис. 1) можно наблюдать хорошее согласование значений водородсорбционной емкости, полученных при электрохимическом гидрировании путем кратковременного заряда и разряда, с данными газофазного гидрирования. Емкость по водороду в обоих случаях составила 1.55 мас. %. Из приведенных кривых следует, что для электрохимического заряда–разряда гистерезис несколько более выражен, чем для газофазного процесса. Очевидно, это может быть связано с процессами, протекающими на границе раздела фаз электрод–электролит. Гистерезис может быть уменьшен до определенного значения при использовании более низких плотностей тока, что увеличит время заряда–разряда и релаксации. Наблюдаемое различие не является ключевым для практического применения, так как оно невелико и не оказывает существенного влияния на общую обратимую емкость. Таким образом, представленный метод квазиравновесных кривых заряда–разряда позволяет смоделировать изотеры сорбции–десорбции в системе металл–водород (рис. 1).
Диффузия водорода в металлогидридах
Одна из важных характеристик интерметаллидов – коэффициент диффузии водорода в α-фазе (твердый раствор водорода в металлической решетке) и β-фазе (фаза гидрида), который (второй – в большей степени) определяет, в конечном итоге, скорость и эффективность работы различных устройств. Например, большое практическое значение имеет производительность Ni–MH-аккумулятора при высоких плотностях тока, а ее оптимизация требует знания эффективного коэффициента диффузии водорода в металлогидридном электроде на различных этапах заряда–разряда [8, 9].
Имеется большое количество исследований коэффициентов диффузии водорода при различных температурах как в металлах (Pt, Pd, V, Ti, Mg и др.) и интерметаллидах (Мg2Ni, TiFe, Zr2Ni и др.), так и в их гидридных фазах [10, 11]. Но класс материалов, для которых эти данные представлены, в основном ограничен металлами и соединениями, содержащими сравнительно небольшой набор элементов. К тому же их получение требует специальных исследований с использованием сложных экспериментальных методов (квазиупругое рассеяние нейтронов, импульсный ЯМР). В последнее время для электрохимических приложений активно исследуется большое число интерметаллидов, зачастую со сложными элементными составами, такими, например, как в нашей работе. Для них сведения о коэффициентах диффузии водорода нужны в узком интервале температур, и проведение исследований с применением сложных экспериментальных методов не всегда рационально. Здесь необходимые результаты могут быть получены уже в ходе электрохимических испытаний электродов с данными материалами, тем более что набор электрохимических методов отличается широким разнообразием.
Условно электрохимические методы можно разделить на потенциостатические, основанные на измерении тока во времени при контролируемом значении потенциала (хронамперометрия); гальваностатические, основанные на измерении потенциала во времени при контролируемом значении тока (хронопотенциометрия, метод частичного разряда); импедансометрические, основанные на измерении комплексного сопротивления электрохимической ячейки (импедансная спектроскопия); циклическая вольтамперометрия и ряд других, реже применяемых методов.
Потенциостатическая хронамперометрия
Вследствие простоты эксперимента и обработки полученных результатов наиболее распространена хронамперометрия. Для определения эффективного коэффициента диффузии водорода используется уравнение Коттрелла [12, 13]:
где I – ток, А; n – число электронов, участвующих в электрохимической реакции (1 для водорода); F – постоянная Фарадея (96485 Кл/моль); А – геометрическая площадь электрода, см2; С0 – начальная концентрация электроактивных частиц, моль/см3; DH – коэффициент диффузии водорода, см2/с; t – время, с.Эффективность работы металлогидридных электродов зависит от различных параметров, в том числе межфазных переходов, миграции водорода через поверхностный слой, диффузии водорода в объеме, а также преобразований из α-фазы твердого раствора в β-фазу гидрида металла. Эта сложная комбинация делает количественное применение традиционных нестационарных методов довольно неоднозначным при оценке коэффициента диффузии водорода в случае отклонения от уравнения Коттрелла. Эти отклонения могут быть связаны с нелинейной диффузией водорода по поверхности электрода, а также с зависимостью коэффициента диффузии от типов диффузии (поверхностная, объемная). В простейшем случае значение DH вычисляют по тангенсу угла наклона кривых i(t) или i(t–1/2) [14], что осложняется нелинейностью экспериментально полученных кривых. В работах [15, 16] были предложены некоторые улучшения, которые позволили получить модифицированное уравнение Коттрелла, успешно примененное для литиевых материалов и проводящих полимеров:
(5)
$\frac{1}{{I\sqrt t }} = \frac{{{{R}_{\Sigma }}}}{{\Delta E\sqrt t }} + \frac{{L\sqrt \pi }}{{\Delta Q\sqrt {{{D}_{{\text{H}}}}} }},$Мы применили эту модель расчета эффективного коэффициента диффузии водорода [17] для исследуемых интерметаллидов. Была использована техника потенциостатического заряда электродов с небольшим (0.02 В) шагом в интервале от –0.78 до –0.96 В. На первом этапе для каждой кривой i(t) были построены зависимости It1/2(lg t), позволяющие определить “максимум” и найти соответствующий временной интервал, необходимый для выполнения расчетов. Наблюдаемый максимум демонстрирует явные отклонения от линейной диффузии, а также наличие медленных процессов недиффузионного типа в определенных временных областях (включая влияние падения омического потенциала в растворе при больших токах). Область максимума является “коттрелловской” частью переходных процессов. Затем были построены графики 1/It1/2(1/t1/2) для учета отклонений от идеальной коттрелловской зависимости, вызванных омическими потерями, и для расчета коэффициента диффузии. Значение DH было рассчитано в соответствии с модифицированным уравнением Коттрелла (5). В табл. 1 представлены результаты измерений на примере интерметаллида La2MgNi9.
Таблица 1.
Значения DH, рассчитанные для La2MgNi9 при разных потенциалах заряда
| E, В | C, мА ч | SOC*, % | 1/I√t | tg | DH, см2/с |
|---|---|---|---|---|---|
| –0.78 | 1.70 | 3.76 | – | – | – |
| –0.80 | 1.55 | 7.17 | – | – | – |
| –0.82 | 1.57 | 10.6 | – | – | – |
| –0.84 | 1.71 | 14.5 | 24.5 | 223.4 | 1.31 × 10–11 |
| –0.86 | 2.06 | 19.0 | 14.9 | 184.0 | 1.25 × 10–11 |
| –0.88 | 3.58 | 26.8 | 10.6 | 155.5 | 5.63 × 10–12 |
| –0.90 | 7.56 | 43.5 | 6.37 | 149.5 | 1.29 × 10–12 |
| –0.92 | 25.7 | 100 | 2.18 | 138.7 | 1.22 × 10–13 |
Как видно из данных табл. 1, с увеличением степени заряда коэффициент диффузии водорода уменьшается, что связано с насыщением металлической частицы водородом и, как следствие, затруднением дальнейшей диффузии атомов водорода. Следует отметить, что для первых трех шагов потенциала коэффициент диффузии определить не удалось. Очевидно, что на этих этапах определение диффузии водорода выходит за рамки данного уравнения, тем не менее, их вклад в суммарный заряд электрода нельзя игнорировать.
Гальваностатический метод частичного разряда
Когда процесс разряда осуществляется при постоянном токе, логично предположить, что через поверхность электрода протекает постоянный поток водорода. В предположении, что концентрация водорода в объеме гидрида заряженного электрода одинакова, при известном радиусе частиц интерметаллида значение DH может быть рассчитано по уравнению [18]:
где а – радиус частиц интерметаллида, см; Q0 – начальная емкость заряженного электрода, А с; i – постоянный ток разряда, A; τ – время перехода, с, необходимое для того, чтобы концентрация водорода на поверхности электрода стала равной нулю и произошло резкое изменение потенциала, компенсирующее уменьшение поверхностной концентрации водорода для поддержания постоянного тока разряда.Уравнение (6) справедливо для больших времен перехода с малыми токами разряда. Поскольку за время перехода принимается отрезок времени до резкого изменения (перегиба) потенциала, очевидно, что за это время концентрация водорода на поверхности не успевает достигнуть значения, близкого к нулю. Поэтому, чем больше время перехода, тем равномернее протекает процесс и больше вероятность того, что концентрация водорода на поверхности электрода достигнет нулевого значения. Кроме того, при разряде низким током точка перегиба потенциала на разрядной кривой более ярко выражена по сравнению с кривыми разряда при высоких плотностях тока. Это указывает на то, что концентрация водорода на электроде с низкой скоростью разряда находится ближе к нулю, чем при более высоких скоростях, а рассчитанное значение DH – ближе к фактическому значению.
В настоящей работе мы использовали электрод с интерметаллидом La1.5Nd0.5MgNi9, который имеет емкость 400 мА ч/г при плотности тока 60 мА/г. Это значение было взято за 100%. Электрод полностью заряжали, а затем разряжали при 60 мА/г до определенной степени заряда (20, 40, 60, 80, 100%). Далее электрод разряжали при 15 мА/г до значения потенциала 0.7 В (полностью разряженный электрод). Результаты измерений и рассчитанный коэффициент диффузии (согласно уравнению (6)) представлены в табл. 2.
Таблица 2.
Значения DH, рассчитанные для La1.5Nd0.5MgNi9 с разной степенью заряда электродов
| SOC, % | Q0, мА с | τ, с | DH, см2/с |
|---|---|---|---|
| 20 | 39 780 | 26 340 | 2.31 × 10–9 |
| 40 | 68 796 | 45 569 | 1.41 × 10–9 |
| 60 | 98 928 | 65 513 | 9.49 × 10–10 |
| 80 | 129 744 | 85 983 | 8.07 × 10–10 |
| 100 | 170 748 | 113 261 | 7.30 × 10–10 |
Как видно из данных табл. 2, с увеличением степени заряда коэффициент диффузии водорода уменьшается. Однако это уменьшение незначительно и находится в пределах одного порядка. Рассчитанные значения DH хорошо согласуются с литературными данными. Так, в работе [19] для интерметаллида La2MgNi9 при разряде электрода со 100%-ной степенью заряда коэффициент диффузии водорода составил 7.10 × 10–10 см2/с, что практически полностью совпадает с полученным в настоящей работе.
Спектроскопия электрохимического импеданса
Метод импедансной спектроскопии отличается от потенциостатических и гальваностатических методов тем, что диффузионный процесс здесь оценивается для стационарного режима диффузии в предположении, что диффузия является стадией ограничения скорости переноса массы, не зависящей от времени. Мы использовали метод гальваностатической электрохимической импедансной спектроскопии (GEIS) в диапазоне частот от 1 кГц до 0.5 мГц с амплитудой тока 10 мА. Для исследований были выбраны четыре различных степени заряда электродов, включая 0 (полностью разряженный анод), 30, 70 и 100% (полностью заряженный анод). Коэффициент диффузии водорода рассчитывали по уравнению [20]:
(7)
${{D}_{{\text{H}}}} = {{\left( {\frac{{RT}}{{\sqrt 2 {{n}^{2}}{{F}^{2}}\delta AC}}} \right)}^{2}},$Площадь электроактивной поверхности электрода (A) оценивалась в предположении, что все частицы сплава в исследуемом электроде имеют сферическую форму и одинаковый размер, а вся их поверхность контактирует с электролитом [21, 22]. В табл. 3 приведены рассчитанные значения DH для интерметаллида Ti0.15Zr0.85La0.03Ni1.2Mn0.7V0.12Fe0.12 с разной степенью заряда.
Таблица 3.
Значения DH, рассчитанные для Ti0.15Zr0.85La0.03Ni1.2Mn0.7V0.12Fe0.12 с разной степенью заряда электродов
| Параметры | 0% SOC | 30% SOC | 70% SOC | 100% SOC |
|---|---|---|---|---|
| δ, Ом с–1/2 | 0.2040 | 0.02199 | 0.0250 | 0.02700 |
| DH, см2/с | 4.82 × 10–12 | 4.15 × 10–10 | 3.21 × 10–10 | 2.75 × 10–10 |
Из табл. 3 видно, что все значения DH, кроме полностью разряженного электрода, находятся в пределах одного порядка.
На рис. 2 приведены значения коэффициентов диффузии водорода, полученные методами импедансной спектроскопии, потенциостатической хронамперометрии и гальваностатического частичного разряда. Как видно из рис. 2, величины коэффициента диффузии водорода, полученные методом хронамперометрии, имеют довольно близкие значения для обоих интерметаллидов, в то время как при использовании двух других методов они существенно отличаются. В случае с методом частичного разряда такое различие данных для одного и того же интерметаллида связано с тем, что при разряде (десорбции) не требуется дополнительных затрат энергии на расширение кристаллической решетки интерметаллида, вследствие чего диффузия атомов водорода протекает значительно быстрее. Что касается импедансной спектроскопии, то данным методом оценивается стационарный режим диффузии, когда в системе протекают процессы самодиффузии, и полученные значения близки к таковым в методе частичного разряда. В пользу данного предположения свидетельствует и тот факт, что значения коэффициента диффузии водорода для методов импедансной спектроскопии и частичного разряда изменяются в пределах одного порядка, в то время как при использовании метода потенциостатического заряда они могут отличаться более чем на три порядка.
Рис. 2.
Значения DH при разной степени заряда электродов с интерметаллидами La1.5Nd0.5MgNi9 (1) и Ti0.15Zr0.85La0.03Ni1.2Mn0.7V0.12Fe0.12 (2), определенные методами потенциостатической хронамперометрии (1А и 2А), гальваностатического частичного разряда (1В) и импедансной спектроскопии (2С).
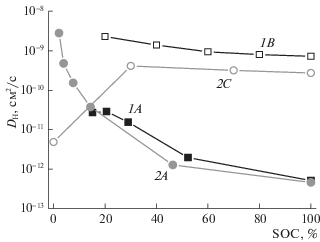
Следует отметить, что ни один из перечисленных методов не дает однозначного абсолютного значения коэффициента диффузии водорода и может использоваться только для приблизительной оценки DH. Тем не менее, значения, полученные с использованием этих методов, хорошо коррелируют друг с другом и литературными данными.
Электрохимические характеристики интерметаллидов
Для определения удельной емкости металлогидридных электродов используют зарядно-разрядные кривые. Процесс заряда или разряда проводят, как правило, при постоянном токе (гальваностатически) и фиксируют изменение потенциала во времени. Измерение завершают в момент, когда происходит резкое изменение (перегиб) потенциала. Значение времени переводят в удельную емкость, отнесенную к площади электрода или массе металлогидрида. На рис. 3 представлены типичные кривые разряда металлогидридных электродов с интерметаллидами La2MgNi9, La1.5Nd0.5MgNi9 и Ti0.15Zr0.85La0.03Ni1.2Mn0.7V0.12Fe0.12.
Рис. 3.
Удельная емкость MH-электродов (1 – La2MgNi9, 2 – La1.5Nd0.5MgNi9, 3 –Ti0.15Zr0.85La0.03Ni1.2Mn0.7V0.12Fe0.12) при плотности тока разряда 60 мА/г.

Используя кинетические кривые сорбции–десорбции водорода и уравнения (1)–(3), можно получить кривые заряда–разряда для электродов. Однако данные, полученные таким способом, будут несколько завышены вследствие того, что электрохимический процесс сорбции–десорбции водорода протекает при атмосферном давлении и часть водорода не участвует в процессе. Кроме того, на поверхности реальных электродов протекают побочные процессы, которые также снижают суммарную емкость электродов.
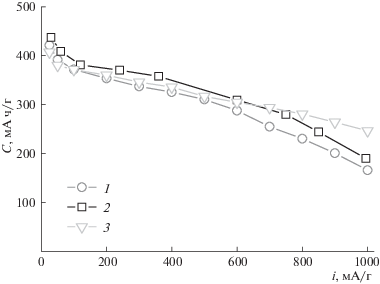
Еще одной из определяющих характеристик интерметаллидов служит производительность металлогидридных электродов при разных плотностях тока. Фактически она определяет время работы аккумулятора при разной степени нагрузки. В процессе измерения исследуемый электрод разряжают постоянным током, последовательно увеличивая его плотность, и строят зависимости максимальной емкости электрода при разных плотностях тока. Типичная зависимость удельной емкости электродов от плотности тока разряда представлена на рис. 4. Так, при увеличении плотности тока от 50 до 1000 мА/г емкость электродов снижается в целом на 60% от начального значения.
Рис. 4.
Зависимости удельной емкости электродов (1 – La2MgNi9, 2 – La1.5Nd0.5MgNi9, 3 – Ti0.15Zr0.85La0.03Ni1.2Mn0.7V0.12Fe0.12) от плотности тока разряда.
Таким образом, метод квазиравновесных кривых заряда–разряда позволяет смоделировать изотермы сорбции–десорбции в системе металл–водород. Значения водородсорбционной емкости интерметаллида La2MgNi9, полученные при электрохимическом гидрировании путем кратковременного заряда и разряда, хорошо согласуются с данными газофазного гидрирования и литературными данными. Значения коэффициента диффузии водорода при комнатной температуре, определенные методами потенциостатической хронамперометрии, гальваностатического частичного разряда и импедансной спектроскопии, хорошо коррелируют друг с другом и с литературными данными.
Исследование выполнено при финансовой поддержке Минобрнауки (соглашение № 14.613.21.0087, уникальный идентификатор RFMEFI61318X0087).
Список литературы
Tarasov B.P. // Int. J. Hydrogen Energy. 2011. V. 36. P. 1196. https://doi.org/10.1016/j.ijhydene.2010.07.002
Hannan M., Hoque M., Mohamed A. et al. // Renew. Sust. Energ. Rev. 2017. V. 69. P. 771. https://doi.org/10.1016/j.rser.2016.11.171
Yartys V.A., Lototsky M.V., Akiba E. et al. // Int. J. Hydrogen Energy. 2019. V. 44. P.7809. https://doi.org/10.1016/j.ijhydene.2018.12.212
Volodin A.A., Wan Ch., Denys R.V. et al. // Int. J. Hydrogen Energy. 2016. V. 41. P. 9954. https://doi.org/10.1016/j.ijhydene.2016.01.089
Тараcов Б.П., Лотоцкий М.В., Яртысь В.А. // Рос. хим. журн. 2006. Т. 50. № 6. С. 34.
Арбузов А.А., Можжухин С.А., Володин А.А. и др. // Изв. АН. Сер. хим. 2016. № 8. С. 1893.
Сон В.Б., Володин А.А., Денис Р.В. и др. // Изв. АН. Сер. хим. 2016. № 8. С. 1971.
Geng M., Han J., Feng F., Northwood D.O. // Int. J. Hydrogen Energy. 2000. V. 25. P. 203. https://doi.org/10.1016/S0360-3199(99)00046-4
Giza K. // Intermetallics. 2013. V. 34. P. 128. https://doi.org/10.1016/j.intermet.2012.11.014
Diffusion in Non-Metallic Solids (Part 1) / Ed. by D.L. Beke. Berlin: Springer, 1999. P. 44–61. ISBN: 3-540-62391-4.
Diffusion in Solids / Ed. by H. Mehrer. Berlin: Springer, 2007. P. 317–324. ISBN: 978-3-540-71486-6.
Cottrell F.G. // Z. Phys. Chem. 1903. Bd. 42. S. 385.
Myland J.C., Oldham K.B. // Electrochem. Comm. 2004. V. 6. P. 344. https://doi.org/10.1016/j.elecom.2004.01.013
Zheng G., Popov B.N., White R.E. // J. Electrochem. Soc. 1995. V. 142. P. 2695. https://doi.org/10.1149/1.2050076
Levi M.D., Markevich E., Aurbach D. // J. Phys. Chem. B. 2005. V. 109. P. 7420. https://doi.org/10.1021/jp0441902
Aurbach D., Levi M.D., Levi E. // Solid State Ionics. 2008. V. 179. P. 742. https://doi.org/10.1016/j.ssi.2007.12.070
Volodin A.A., Denys R.V., Tsirlina G.A. et al. // J. Alloys Compd. 2015. V. 645. P. S288. https://doi.org/10.1016/j.jallcom.2014.12.201
Giza K., Bala H., Drulis H. et al. // Int. J. Electrochem. Sci. 2012. V. 7. P. 9881. http://www.electrochemsci.org/papers/vol7/71009881.pdf.
Liao B., Lei Y.Q., Chen L.X. et al. // J. Power Sources. 2004. V. 129. P. 358. https://doi.org/10.1016/j.jpowsour.2003.11.044
Volodin A.A., Denys R.V., Wan C. et al. // J. Alloys Compd. 2019. V. 793. P. 564. https://doi.org/10.1016/j.jallcom.2019.03.134
Malifarge S., Delobel B., Delacourt C. // J. Electrochem. Soc. 2017. V. 164. P. E3329. https://doi.org/10.1149/2.0331711jes
De Vidts P., Delgado J., White R.E. // J. Electrochem. Soc. 1995. V. 142. P. 4006. https://doi.org/10.1149/1.2048454
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии