Журнал физической химии, 2020, T. 94, № 5, стр. 789-795
Фазовый состав и микроструктура сорбирующих водород композитов эвтектического сплава Mg–Ni с графеноподобным материалом
П. В. Фурсиков a, *, А. М. Слепцова a, b, С. А. Можжухин a, А. А. Арбузов a, В. Н. Фокин a, Э. Э. Фокина a, И. И. Ходос c, Б. П. Тарасов a
a Российская академия наук, Институт проблем химической физики
Черноголовка, Россия
b Московский государственный университет им. М.В. Ломоносова, Химический факультет
Москва, Россия
c Российская академия наук, Институт проблем технологии микроэлектроники и особо чистых материалов
Черноголовка, Россия
* E-mail: fpv@icp.ac.ru
Поступила в редакцию 17.07.2019
После доработки 17.07.2019
Принята к публикации 17.09.2019
Аннотация
Порошковые композиты прогидрированного эвтектического сплава Mg–Ni с 10 мас. % графеноподобного материала (ГПМ) сформированы механохимическим методом под давлением водорода 30 атм. Исследовано влияние добавок ГПМ, а также 10 циклов десорбции при 350°C и 1 атм и сорбции при 300°C и 10 атм водорода на фазовый состав и микроструктуру композитов. Показано, что композиты, полученные механохимическим методом (hbm-композиты) и подвергнутые циклам десорбции–сорбции водорода (dh-композиты), содержат кристаллические фазы: α-MgH2 со структурой типа рутила, гидрид Mg2NiH4 с разупорядоченной кубической структурой (pseudo-ht-Mg2NiH4) и твердый раствор водорода Mg2NiH≤0.3. Установлено, что в hbm-композитах с добавками ГПМ содержание фазы pseudo-ht-Mg2Ni выше, чем в композитах без углеродных добавок; в композитах частицы Mg2Ni(H) и Mg(H) имеют общую границу, и циклирование не влияет на данные особенности микроструктуры; наличие ГПМ способствует сохранению малых размеров частиц обеих фаз при циклировании.
Известно, что одно из наиболее перспективных соединений для обратимого хранения водорода в связанном состоянии – дигидрид магния MgH2,, так как среди гидридов металлов он имеет одно из самых больших значений содержания водорода – около 7.6 мас. % [1]. Это важно для создания компактных и безопасных аккумуляторов и генераторов водорода, которые могут быть использованы для питания водород-воздушных топливных элементов [2]. Однако у системы магний–водород имеются недостатки: высокая энтальпия образования MgH2 и низкая скорость выделения водорода из гидрида и поглощения водорода металлом [3]. Второй из них объясняется как медленной диффузией водорода в фазе дигидрида магния, так и высоким значением энергетического барьера (∼1 эВ) для реакции расщепления молекулы водорода на поверхности металла [4].
Для преодоления указанных недостатков в настоящее время в мире предлагается множество подходов [5–17] к получению новых водород-аккумулирующих композитных материалов на основе магния, где магниевые частицы имеют субмикронные или наноразмеры и изолированы друг от друга [14], а на их поверхности присутствуют различные каталитические добавки для снижения энергетического барьера реакции расщепления молекулы H2. Как разновидность данных подходов нами ранее были разработаны и исследованы наноструктурированные магниевые сплавы и композиты магния [4, 18], в которых каталитическими добавками служили 3d-переходные и редкоземельные металлы [19]. Данные металлы могут либо присутствовать в виде компонентов магниевых сплавов [18], либо вводиться в состав композиционных материалов на основе магния в виде различных соединений, например, оксидов [4], или в виде нанесенных на поверхность углеродного материала с графеноподобной структурой металлических наночастиц [20], например, никеля [15–17]. Такой углеродный материал, благодаря своей высокой удельной поверхности, протяженной 2D-структуре и хорошей теплопроводности, является не только эффективным носителем частиц катализатора, но и служит тем самым компонентом, который, как отмечено выше, обеспечивает “изолированность” магниевых частиц, предотвращая их спекание в ходе сорбции и десорбции водорода и увеличивая скорость этих процессов.
Представляет интерес использовать метод получения магниевых порошковых водородсорбирующих композитов, альтернативный примененному в работах [15–17]. Он заключается во введении добавок углеродного материала с графеноподобной структурой в магниевый сплав двойной эвтектики Mg–Ni, имеющий состав близкий к Mg89Ni11 и содержащий, наряду с фазой магния, гидридобразующую интерметаллическую фазу Mg2Ni. Как было показано в нашей работе [18], данный сплав, дополнительно модифицированный методом равноканального углового прессования (РКУП) с целью уменьшения размеров зерен магниевой фазы, обладает перспективными водородсорбционными свойствами. Для объяснения влияния никельсодержащих фаз и углеродных компонентов данных порошковых композитов на их водородсорбционные свойства необходимо детальное изучение микроструктуры композитов, пространственного распределения в них гидридобразующих фаз, а также эволюции этих характеристик в ходе сорбции и десорбции водорода. Данная работа посвящена исследованию фазового состава и особенностей микроструктуры композитов на основе эвтектического сплава Mg–Ni с добавками углеродного материала графеноподобной структуры, полученных механохимическим синтезом в атмосфере водорода.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Исходными компонентами для получения композитов служили модифицированный методом РКУП сплав Mg–Ni (процедура выплавки и модификации детально описана в [18]) и углеродный материал с графеноподобной структурой (далее ГПМ), полученный восстановлением оксида графита, с площадью удельной поверхности 600–620 м2/г. Методика синтеза и физико-химические характеристики ГПМ подробно описаны в [15].
Микроструктура и фазовый состав сплава Mg–Ni были охарактеризованы методами рентгенофазового анализа (РФА), а также сканирующей электронной микроскопии и рентгеноспектрального микроанализа (СЭМ-РСМА). Исследования металлографических шлифов сплава проводились на сканирующем автоэмиссионном электронном микроскопе Zeiss LEO SUPRA 35. Согласно результатам СЭМ-РСМА и РФА, сплав преимущественно имеет высокодисперсную эвтектическую микроструктуру и содержит только две кристаллические фазы: Mg и Mg2Ni. Содержание Mg в сплаве равно 85.4 ± 1.4 ат. %, что близко к эвтектической точке на фазовой диаграмме системы Mg–Ni (88.7 ат. %) [21]. Данный сплав Mg–Ni может поглощать 5.55 мас. % водорода с образованием гидридов MgH2 и Mg2NiH4, причем 3.65 мас. % водорода приходится на первую фазу.
Для приготовления композитов сплав предварительно измельчался в стружку в аргоновом боксе. Порошковые водородсодержащие композиты формировались механохимической обработкой смеси стружки сплава и ГПМ, взятых в массовом отношении ГПМ/сплав = 1/9, в планетарной шаровой мельнице Fritsch “Пульверизетте-6” при 400 об/мин и давлении водорода в размольном стакане 30 атм. Время помола составляло 10 ч, отношение массы мелющих стальных шаров к массе материала ∼50 : 1.
Синтезированные порошковые композиты подвергались 7–10 циклам десорбции–сорбции водорода, проводимым на лабораторной установке типа Сивертса в интервале температур 290–360°С. Сорбция проводилась при 10 атм H2 в течение 30 мин, десорбция – при 1 атм H2 в течение 30 мин. Для каждого образца последним был процесс сорбции водорода. По окончании измерений печь выключалась, и автоклав с образцом остывал до комнатной температуры в течение ∼3 ч под давлением водорода в системе 10 атм. Образцы для краткости обозначены следующим образом: hbm-M-N-C – композит сплав+ГПМ, непосредственно полученный в ходе механохимического синтеза; hbm-M-N – его аналог без добавки ГПМ; dh-M-N-С и dh-M-N – соответствующие образцы после циклов десорбции–сорбции водорода.
Фазовый состав композитов исследовался методом РФА на порошковых дифрактометрах ДРОН-УМ2 и ARL X’TRA при комнатной температуре (CuKα-излучение, 2θ = 20–80°). Поскольку порошковые рентгенограммы композитов характеризуются высоким уровнем фона, в особенности в области малых углов дифракции, и низким отношением сигнал/шум, то для удобства визуального восприятия и детального анализа рентгенограмм дифракционные пики на них аппроксимировались наборами функций типа pseudo-Voigt2 с соответствующим вычетом фона. Для аппроксимации использовались программные продукты “PowderCell” и “CMPR”. При анализе уширения пиков применялось соотношение Шеррера с учетом поправки на приборный вклад, который определялся по рентгенограмме отожженного корунда (Al2O3).
Микроструктура и морфология частиц композитов исследовались методами просвечивающей электронной микроскопии (ПЭМ) и электронной микродифракции (ЭМД) с использованием электронного микроскопа JEOL JEM-2100 при ускоряющем напряжении 200 кВ. При исследовании учитывалось происходящее под действием электронного пучка разложение (радиолиз) гидридных фаз в образцах.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Фазовый состав композитов
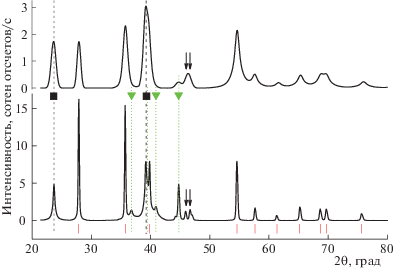
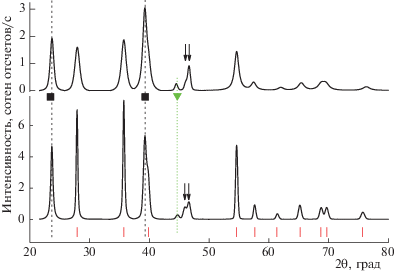
На рис. 1 и 2 представлены дифрактограммы композитов, непосредственно полученных в ходе механохимического синтеза, и их dh-аналогов. Следует отметить, что на всех ренгенограммах отсутствуют пики, указывающие на наличие в образцах кристаллической фазы непрогидрированного магния. Соответственно во всех образцах присутствует кристаллическая фаза α-MgH2 со структурным типом рутила. Поэтому для удобства анализа результатов на рис. 1 и 2 внизу проставлены вертикальные штрихи, отвечающие положениям брегговских рефлексов данной фазы, относительная интенсивность которых превосходит значение 0.05.
Кристаллической фазы γ-MgH2, имеющей структурный тип α-PbO2, не обнаружено нигде, даже в образцах непосредственно после помола. Поскольку эта фаза метастабильна при нормальных условиях, то ее отсутствие вполне естественно в dh-композитах. Наличие γ-MgH2 было отмечено во многих образцах гидрида магния, полученных при механохимическом помоле в шаровой мельнице в схожих условиях, в том числе и с углеродными добавками [15]. По-видимому, фаза γ-MgH2 в образцах hbm-M-N и hbm-M-N-C рентгеноаморфна.
На дифрактограммах композитов также отсутствуют признаки, указывающие на наличие в образцах кристаллической фазы никеля. Ее присутствие в dh-композитах могло бы свидетельствовать о частичном гидрогенолизе фазы Mg2Ni в циклах десорбции–сорбции водорода или об окислении магния в сплаве примесями кислорода. Отметим, что число таких циклов в данной работе было сравнительно небольшим, и отсутствие на дифрактограммах пиков никеля еще не свидетельствует о том, что образования какого-то количества его кристаллической фазы, а также рентгеноаморфной, не происходит вовсе. Здесь следует заметить, что ряд авторов (см., например, [22]) каталитические свойства Mg2Ni связывают с наличием на его поверхности частиц никеля, образующихся на начальном этапе взаимодействия интерметаллида с водородом и/или при окислении Mg2Ni следами кислорода в размольном стакане.
Другие общие для обеих дифрактограмм характерные признаки на каждом из рис. 1 и 2, помимо нижних штрихов, отмечены также пунктирными линиями. Некоторые из таких признаков на верхних дифрактограммах проявлены слабо и не могут быть уверенно различимы вследствие большой ширины пиков, их перекрывания и малого отношения сигнал/шум. В этом случае пересечения пунктирных линий с верхней рентгенограммой не производится.
Еще одна общая важная особенность всех дифрактограмм композитов – наличие весьма интенсивных пиков при углах дифракции ∼23.5° и 39°. Второй из них расположен довольно близко от отстоящего чуть дальше к 40° пику (200) α-MgH2, поэтому в тех случаях, когда пики сильно уширены, как, например, в образцах hbm-M–N и hbm-M–N–C, они сильно перекрываются, давая очень широкий асимметричный пик немного левее 40°. Эти два пика, отмеченные на рис. 1 и 2 знаком черного квадрата, принадлежат второй кристаллической гидридной фазе, имеющейся в образцах, и довольно хорошо соответствуют по своему положению наиболее интенсивным рефлексам (111) и (220) фазы Mg2NiH4 с высокотемпературной кубической модификацией (п.г. Fm-3m, № 225) со структурой антифлюорита, обозначаемой далее как ht-Mg2NiH4, которая, как известно, переходит в низкотемпературную моноклинную модификацию в диапазоне температур 210–245°C [23].
Присутствие псевдовысокотемпературной фазы Mg2NiH4 в образцах, дифрактограммы которых регистрировались при комнатной температуре, можно объяснить тем, что получение истинной низкотемпературной кристаллической фазы Mg2NiH4 с моноклинной структурой (lt-Mg2NiH4), как неоднократно упоминалось в литературе (см., например, [24, 25]), сопряжено с большими экспериментальными затруднениями, вызванными в том числе и тем, что фазовый переход ht-Mg2NiH4 в lt-Mg2NiH4 проходит в диапазоне температур 210–245°C [23] весьма медленно. В нашем же случае как hbm-композиты, так и их dh-аналоги имеют одну важную общую характеристику процедуры их получения, что уже было подчеркнуто выше в экспериментальной части. Так, по завершении помола в мельнице локальный разогрев частиц композита, вызванный механическими ударами шаров, может достаточно быстро уменьшаться вследствие отвода тепла через стенки размольного стакана, когда вращение прекращается и стакан контактирует с внешней средой. Также и автоклав, в котором образцы подвергались dh-циклированию, по окончании процедуры измерений остывал после выключения нагревателя, по-видимому, достаточно быстро для того, чтобы в полученных композитах высокотемпературная фаза ht-Mg2NiH4 могла оказаться “замороженной”.
Однако на дифрактограммах композитов есть признаки, заставляющие сомневаться в присутствии истинной кубической фазы ht-Mg2NiH4 в образцах. Во-первых, теоретическая дифрактограмма (построенная для такой фазы с учетом параметра элементарной ячейки и дробных координат атомов в ней) показывает, что правее 46° должен иметься интенсивный одиночный рефлекс (311). На экспериментальных дифрактограммах в указанном месте пика, отвечающего такому рефлексу, нет. На его месте находятся два пика небольшой интенсивности, отмеченные на рис. 1 и 2 стрелками, лучше всего различимые на дифрактограмме образца dh-M-N и перекрывающиеся, в той или иной степени, с остальными. Далее, профиль самого левого пика при 23.5° выглядит необычно. Лучше всего это заметно на дифрактограмме образца dh-M-N: пик узкий, но сильно уширен у своего основания. Также по совокупности признаков мы не можем утверждать и о присутствии в образцах истинной низкотемпературной фазы lt-Mg2NiH4: в противном случае в районе 23–24° должна быть пара хорошо разделенных интенсивных пиков. Данное затруднение разрешается, если принять во внимание результаты работы [26], где отмечена подобная особенность на дифрактограммах образцов гидридов Mg2NiH4, полученных в ходе процедуры, схожей с используемой в настоящей работе. Авторы описывают такую фазу как псевдовысокотемпературный гидрид Mg2NiH4 с разупорядоченной кубической структурой (далее – “pseudo-ht-Mg2NiH4”).
Еще одна общая характеристика дифрактограмм композитов – присутствие на них пиков, отвечающих гексагональной фазе (п.г. № 180) твердого раствора Mg2NiH≤0.3. На рис. 1 и 2 эти пики помечены треугольниками. Присутствие фазы твердого раствора наиболее заметно в образце dh-M-N (рис. 2). Поэтому на данном рисунке штриховой линией в районе углов дифракции 38–40° дополнительно обозначено угловое положение рефлекса (200) этой фазы, который лежит весьма близко к также находящимся в указанном диапазоне рефлексам (200) и (220) фаз α-MgH2 и pseudo-ht-Mg2NiH4 соответственно.
Для объяснения различий в фазовом составе композитов и выяснения роли добавок ГПМ необходимо учитывать поведение фазы Мg2Ni в процессах сорбции–десорбции водорода при тех условиях их проведения, которые использовались в настоящей работе. В литературе часто сообщается (см., например, [27], и относящиеся к системе “Mg2Ni–H2” ссылки в работе [3]) о том, что взаимодействие Mg2Ni с водородом протекает медленно (это связано с тем, что Mg2NiH4 является комплексным гидридом) и процесс гидрирования интерметаллида сопровождается существенной перестройкой кристаллической структуры его металлической подрешетки [3]. По-видимому, вследствие этого, наряду с более часто упоминаемым значением равновесного давления для плато на изотерме сорбции Pравн = 3.1–3.4 атм при 300°C для системы Mg2Ni–H2 [3, 27] в литературе встречаются сообщения о существенно более высоких значениях Pравн. Так, например, авторы [28] приводят экспериментальные данные, из которых следует, что при той же температуре значение Pравн не ниже, чем 10 атм.
Учитывая данное обстоятельство, можно объяснить первое существенное различие в дифрактограммах композитов (рис. 1 и 2). Так, при сравнении образцов, полученных непосредственно после помола, и тех, которые подвергались dh-циклированию, видно, что во вторых содержание фазы pseudo-ht-Mg2NiH4 заметно меньше, а соответственно фазы Mg2NiH≤0.3 заметно больше, чем в первых. Причина этого, по-видимому, в различии давления водорода в размольном стакане (30 атм) и в установке Сивертса, в которой проходило dh-циклирование (температура не ниже 300°C и давление, не превышающее 10 атм), а также в более длительном времени помола (10 ч) в сравнении с 20–30 мин для полуцикла сорбции в установке Сивертса. Таким образом, в условиях проведения циклов сорбция–десорбция водорода фаза Mg2Ni, которая содержится в композитах, не гидрируется полностью. Схожие сведения о наличии в системе (Mg + Mg2Ni)–водород заметного количества непрогидрированной фазы Mg2Ni при 20 атм H2 и 380°C сообщают авторы [29], проводившие исследования фазового состава методом рентгеновской дифракции in situ. В нашем случае автоклав с образцом остывал с 300°C до комнатной температуры довольно быстро, и при этом не все количество фазы Mg2Ni успевало превратиться в гидрид.
Еще одно отличие в дифрактограммах композитов – пики dh-образцов существенно ýже пиков hbm-образцов. Это свидетельствует о том, что dh-циклирование вызывает рост размеров областей когерентного рассеяния (ОКР) в кристаллической решетке фаз гидридов. Однако данный рост заметно меньше в композитах, содержащих ГПМ. Так, анализ уширения профилей дифракционных пиков показал, что, например, в dh-образцах размер ОКР фазы α-MgH2 в направлении (110) увеличивается до >100 и до 66 ± 8 нм по сравнению с 15 ± 2 и 12 ± 2 нм в hbm-образцах без и с добавками ГПМ соответственно.
Также, сравнительный анализ дифрактограмм композитов, особенно dh-M-N-C (ср. нижние дифрактограммы на рис. 1 и 2), однозначно свидетельствует в пользу еще одного эффекта введения углеродных добавок: в образцах, содержащих ГПМ, заметно выше относительная интегральная интенсивность пиков, отвечающих фазе pseudo-ht-Mg2NiH4. Таким образом, наличие ГПМ в композитах благоприятствует более полному превращению фазы Mg2Ni в гидрид при наводораживании образцов.
Микроструктура композитов
Данные электронной микродифракции (рис. 3, справа), полученные с участка образцов композитов, имеющего площадь поперечного сечения ∼1 мкм2, указывают на совместное присутствие на таком малом участке фаз MgH2 и Mg2NiH4. Вследствие малых размеров частиц и низкой степени кристалличности образующихся при радиолизе образца новых фаз и продуктов их взаимодействия с газами в камере микроскопа соответствующая им дифракционная картина будет весьма диффузна. Это не позволяет четко выделить на электронограмме их признаки, за исключением ГЦК-фазы MgO, первые два основных кольца которой отмечены пунктирными дугами на рис. 3 (справа). На микрофотографиях ПЭМ образца (рис. 3, слева) видны два визуально различных типа областей, находящихся в непосредственном контакте: один, таким образом, соответствует фазе гидрида интерметаллида, другой – фазам гидрида магния и оксида магния. Исследования ПЭМ для dh-образцов композитов показывают, что данная топологическая особенность их микроструктуры в целом сохраняется в ходе циклов десорбции и повторной сорбции водорода. Присутствие ГПМ на участках такого масштаба может способствовать тому, что в композитах обеспечивается хорошая теплопроводность и снижается возможность спекания металлических частиц при циклировании.
Рис. 3.
Изображение ПЭМ (слева) и электронная микродифрактограмма (справа) образца hbm-M-N. Цифрами 1–4 обозначены дифракционные кольца, соответствующие первым четырем пикам на верхней рентгенограмме на рис. 1.

Учет особенностей микроструктуры композитов сплава Mg–Ni важен при исследовании их водородсорбционных свойств. В литературе имеются представления о механизме положительного влияния фаз различных никельсодержащих интерметаллидов (см., например, [1, 2] для случая LaNi5) на процессы взаимодействия с водородом фазы магния. Это влияние заключается в том, что такие активные фазы, на поверхности которых имеются каталитические центры, облегчающие диссоциацию молекулы H2 на атомы, обеспечивают каналы транспорта атомов H через поверхность раздела активной фазы и фазы магния. При этом более эффективному проявлению каталитических свойств Mg2Ni в процессах взаимодействия изучаемых композитов с водородом благоприятствуют установленные топологические особенности (взаимное расположение фаз и элементов) их микроструктуры, а именно, высокое значение площади контакта фаз Mg и Mg2Ni.
Таким образом, полное гидрирование интерметаллической фазы Mg2Ni в композитах на основе эвтектического сплава Mg–Ni достигается при высокоэнергетическом помоле в мельнице порошка сплава при 30 атм H2 в течение нескольких часов. После дегидрирования синтезированных образцов и насыщения их водородом при 10 атм H2 и 300°C, повторения подобной процедуры в течение 10 циклов и последующего остывания до комнатной температуры при 10 атм H2 в композитах содержится заметное количество фазы твердого раствора водорода в интерметаллиде Mg2NiH≤0.3. В обоих случаях фаза магния полностью превращается в α-MgH2, а фаза гидрида интерметаллида в наводороженных образцах, находящихся при комнатной температуре, присутствует в виде псевдовысокотемпературного Mg2NiH4 с разупорядоченной кубической структурой. При этом добавки ГПМ способствуют достижению более полного гидрирования фазы Mg2Ni и сохранению наноструктурированного состояния частиц композита в ходе циклирования. Существенно не изменяющиеся в ходе циклирования топологические особенности микроструктуры композитов, в которых совместно находятся в непосредственном контакте частицы магния, интерметаллида и ГПМ, имеющие характерные размеры менее 1 мкм, способствуют улучшению водородсорбционных свойств материалов.
Работа выполнена в рамках Госзадания № 0089-2019-0007 и при поддержке РФФИ (грант № 18-03-01156-а). Исследования методами просвечивающей электронной микроскопии и рентгенофазового анализа выполнены с использованием оборудования Аналитических центров коллективного пользования ИПХФ и НЦЧ РАН.
Список литературы
Тарасов Б.П., Лотоцкий М.В., Яртысь В.А. // Рос. хим. журн. 2006. Т. 50. № 6. С. 34 .
Tarasov B.P. // Int. J. Hydrogen Energy. 2011. V. 36. № 1. P. 1196.
Yartys V.A., Lototskyy M.V., Akiba E. et al. // Int. J. Hydrogen Energy. 2019. V. 44. № 15. P. 7809.
Фурсиков П.В., Тарасов Б.П. // Изв. АН. Сер. хим. 2018. № 2. С. 193.
Webb C.J. // J. Phys. Chem. Solids. 2015. V. 84. P. 96.
Zhang J., Zhu Y., Yao L. et al. // J. Alloys Compd. 2019. V. 782. P. 796.
Crivello J.-C., Dam B., Denys R.V. et al. // Appl. Phys. A. 2016. V. 122. № 2. P. 97.
Crivello J.-C., Denys R.V., Dornheim M. et al. // Appl. Phys. A. 2016. V. 122. № 2. P. 85.
Zhang J., Zhu Y., Zang X. et al. // J. Mater. Chem. A. 2016. V. 4. № 7. P. 2560.
Wang H., Lin H.J., Cai W.T. et al. // J. Alloys Compd. 2016. V. 658. P. 280.
Rusman N.A.A., Dahari M. // Int. J. Hydrogen Energy. 2016. V. 41. № 28. P. 12108.
Yu X., Tang Z., Sun D. et al. // Prog. Mater. Sci. 2017. V. 88. P. 1.
Sun Y., Shen Ch., Lai Q. et al. // Energy Storage Mater. 2018. V. 10. P. 168.
Zhang J., Yan S., Qu H. // Int. J. Hydrogen Energy. 2018. V. 43. № 3. P. 1545.
Арбузов А.А., Можжухин С.А., Володин А.А. и др. // Изв. АН. Сер. хим. 2016. № 8. С. 1893.
Тарасов Б.П., Арбузов А.А., Можжухин С.А. и др. // Журн. структ. химии. 2018. Т. 59. № 4. С. 867. https://doi.org/10.26902/JSC20180411
Tarasov B.P., Arbuzov A.A., Mozhzhuhin S.A. et al. // Int. J. Hydrogen Energy. 2019. V. 44. № 55. P. 29212. https://doi.org/10.1016/j.ijhydene.2019.02.033
Фурсиков П.В., Борисов Д.Н., Тарасов Б.П. // Изв. АН. Сер. хим. 2011. № 9. С. 1816.
Tarasov B.P., Fursikov P.V., Borisov D.N. et al. // J. Alloys Compd. 2007. V. 446–447. P. 183.
Клюев М.В., Арбузов А.А., Магдалинова Н.А. и др. // Журн. физ. химии. 2016. Т. 90. № 9. С. 1331. https://doi.org/10.7868/S0044453716090144
Nayeb-Hashemi A.A., Clark J.B. // Bull. Alloy Phase Diagr. 1985. V. 6. № 3. P. 238.
Schlapbach L., Shaltiel D., Oelhafen P. // Mater. Res. Bull. 1979. V. 14. № 9. P. 1235.
Hayashi S., Hayamizu K., Yamamoto O. // J. Chem. Phys. 1983. V. 79. № 11. P. 5572.
Blomqvist H., Rönnebro E., Noréus D. et al. // J. Alloys Compd. 2002. V. 330–332. P. 268.
Blomqvist H., Noréus D. // J. Appl. Phys. 2002. V. 91. № 8. P. 5141.
Noréus D., Olsson L.G. // J. Chem. Phys. 1983. V. 78. № 5. P. 2419.
Reilly J.J., Wiswall, Jr. R.H. // Inorg. Chem. 1968. V. 7. № 11. P. 2254.
Schefer J., Fischer P., Hälg W. et al. // J. Less-Common Met. 1980. V. 74. № 1. P. 65.
Tran X.Q., McDonald S.D., Gu Q.F. et al. // J. Alloys Compd. 2015. V. 636. Supp. C. P. 249.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии