Журнал физической химии, 2020, T. 94, № 6, стр. 850-854
Топология ликвидусов систем NaBr–Na2SO4–Na2CO3 и KBr–K2CO3–K2SO4
В. И. Сырова a, *, И. К. Гаркушин a, Е. И. Фролов a, А. А. Финогенов a
a Самарский государственный технический университет
Самара, Россия
* E-mail: vera.iv.syrova@mail.ru
Поступила в редакцию 29.07.2019
После доработки 06.10.2019
Принята к публикации 12.11.2019
Аннотация
Проведен теоретический анализ топологии ликвидусов систем NaBr–Na2CO3–Na2SO4, KBr‒K2CO3–K2SO4. По методу Мартыновой–Сусарева рассчитаны координаты точки минимума на моновариантной кривой в системе NaBr–Na2CO3–Na2SO4. Проведено планирование эксперимента для исследования систем методом дифференциально-термического анализа. Определены температура плавления, состав солевой смеси, отвечающей минимуму на моновариантной кривой системы NaBr–Na2CO3–Na2SO4. Доказано отсутствие точек нонвариантного равновесия в системе KBr–K2CO3–K2SO4. Системы NaBr–Na2CO3–Na2SO4, KBr–K2CO3–K2SO4 не были ранее изучены и представляют интерес, поскольку их компоненты обладают рядом ценных свойств, таких как, термическая стойкость, возможность использования в качестве традиционных растворителей других солей в широком диапазоне температур.
Cоли калия и натрия применяются в качестве металлургических флюсов для очистки металлов и их сплавов; предохранения поверхности металлов от окисления; сварки и пайки металлов [1]. Ионные расплавы могут быть использованы для получения ряда неорганических веществ и выращивания монокристаллов [2].
Смеси солей используются в качестве расплавляемых электролитов химических источников тока и теплоаккумулирующих материалов [3–8]. Применение находят смеси отвечающие нонвариантным составам или точкам минимума трехкомпонентных систем. Выявление характера взаимодействия в системах требует наличия данных по фазовым равновесиям в солевых системах. Анализ рядов систем позволяет значительно уменьшить время эксперимента и предположить характер топологии ликвидусов систем [9–12].
В данной работе рассмотрены системы с минимумом и непрерывным рядом твердых растворов [13–15].
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Проведен анализ топологии ликвидусов ряда Na(Наl)–Na2CO3–Na2SO4 Наl – F, Cl, Br изображенного на рис. 1, который показывает, что все треугольники составов представлены одним симплексом. В системе NaF–Na2CO3–Na2SO4 вследствие образования соединения Na3FSO4 образуются две нонвариантные точки – эвтектика E и точка выклинивания R. В системе NaСl–Na2CO3–Na2SO4 образуется тройной минимум, следовательно, и в системе NaBr–Na2CO3–Na2SO4 также прогнозируется образование тройного минимума на кривой моновариантных равновесий.
Расчет минимума по методу Мартыновой–Сусарева [16] показал температуру плавления 549°С и состав смеси, отвечающий тройному минимуму: NaBr – 54.9 мол. %, Na2SO4 – 19.4 мол. %, Na2CO3 – 25.7 мол. %.
Анализ ряда K(Наl)–K2CO3–K2SO4 Наl – F, Cl, Br показывает, что в первой системе KF–K2CO3–K2SO4 образуется два симплекса, вследствие образования соединений конгруэнтного типа плавления K3FSO4 и K3FСO3 в двухкомпонентных системах KF–K2SO4, KF–K2CO3. В системе KСl–K2CO3–K2SO4 отмечено отсутствие тройной точки нонвариантных равновесий. Поверхность кристаллизации представлена двумя полями: поле твердых растворов между сульфатом калия и карбонатом калия, и поле хлорида калия. На кривой моновариантного равновесия отсутствует минимум. В системе KBr–K2CO3–K2SO4 также прогнозируется наличие двух полей кристаллизации и отсутствие минимума на кривой моновариантных равновесий.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Дифференциальный термический анализ (ДТА) проводили на установке в стандартном исполнении [17]. Использована комбинированная платино-платинородиевая термопара. Исходные предварительно обезвоженные реактивы были следующих квалификаций: NaBr – “ч.”, Na2SO4 – “х.ч.”, Na2CO3 – “х.ч.”. Температуры плавления исходных веществ соответствовали справочным данным [18]. Исследования проводили в стандартных платиновых микротиглях. Все составы – мольные доли, выраженные в %, температуры – в °C. Индифферентным веществом служил свежепрокаленный Al2O3 марки “ч.д.а.”. Масса навесок 0.25 г. Точность взвешивания составов ±0.0001 г. на электронных аналитических весах HR 300.
Все двухкомпонентные системы были исследованы ранее [19, 20]. В табл. 1 приведены данные по двойным системам. Данные по исследованным ранее системам рассмотренных рядов взяты из [19, 21, 22].
Таблица 1.
Характеристики нонвариантных точек в двухкомпонентных системах в системах NaBr–Na2CO3–Na2SO4 и KBr–K2CO3–K2SO4
| Система | Характер точки | Содержание компонентов, мол. % | Тпл, °C | Источник | |
|---|---|---|---|---|---|
| 1 | 2 | ||||
| NaBr–Na2SO4 | Эвтектика | 62.0 | 38.0 | 625 | [19] |
| NaBr–Na2CO3 | Эвтектика | 62.5 (55) | 37.5 (45) | 613 (630) | [20] |
| Na2SO4–Na2CO3 | НРТР с минимумом | 43.0 | 57.0 | 824 | [19] |
| KBr–K2SO4 | Эвтектика | 81.7 | 18.4 | 682 (673) | [19] |
| KBr–K2CO3 | Эвтектика | 47.0 | 53.0 | 626 (630) | [19] |
| K2SO4–K2CO3 | НРТР | – | – | – | [19] |
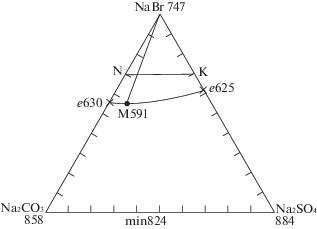
Cистема NaBr–Na2CO3–Na2SO4. Треугольник состава представлен на рис. 2. В двухкомпонентной системе Na2SO4–Na2CO3 наблюдается образование непрерывного ряда твердых растворов с минимумом (min).
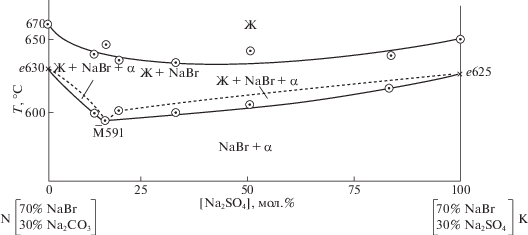
Для определения координат минимальной точки был выбран и исследован методом ДТА политермический разрез N [Na2CO3 – 30%, NaBr – 70%]–K [Na2SO4 – 30%, NaBr – 70%], T–x-диаграмма которого приведена на рис. 3.
Из Т–х-диаграммы определена температура плавления состава минимума 591°С. Исследованием разреза NaBr–$\bar {M}$–M (рис. 4) с постоянным соотношением Na2SO4 : Na2CO3 в точке минимума, соединяющего полюс кристаллизации NaBr с проекцией минимума на плоскость разреза NK, определен состав смеси, отвечающей минимуму М (мол. %): NaBr – 55.0, Na2SO4 – 8.0, Na2CO3 – 37.0.
Система KBr–K2CO3–K2SO4. Треугольник состава представлен на рис. 5. В двухкомпонентной системе K2CO3–K2SO4 образуется непрерывный ряд твердых растворов между компонентами.
Для подтверждения отсутствия нонвариантного равновесия был выбран и исследован методом ДТА политермический разрез H [K2CO3 – 20%, KBr – 80%]–T [K2SO4 – 20%, KBr – 80%], T–x-диаграмма которого приведена на рис. 6. Изучение разреза доказало отсутствие нонвариантного равновесия и устойчивость бинарных твердых растворов между K2CO3 и K2SO4.
Таким образом, проведен теоретический анализ топологии ликвидусов систем NaBr–Na2CO3–Na2SO4 и KBr–K2CO3–K2SO4 на основе топологии ликвидусов в рядах NaНаl–Na2CO3–Na2SO4 и KНаl–K2CO3–K2SO4 Наl – (F, Cl, Br). Впервые исследованы трехкомпонентные системы NaBr–Na2CO3–Na2SO4 и KBr–K2CO3–K2SO4. В системе NaBr–Na2CO3–Na2SO4 отмечено образование тройного минимума с условно нонвариантным равновесием Ж $ \rightleftarrows $ NaBr + α. В системе KBr–K2CO3–K2SO4 доказано отсутствие нонвариантного равновесия. Минимальные поля кристаллизации в озвученных системах принадлежат KBr и NaBr. Теоретический анализ топологии ликвидусов систем подтвержден данными ДТА. Проведенный анализ позволяет провести прогноз топологии ликвидусов в системах MI–M2CO3–M2SO4 (M – Na, K), поверхность кристаллизации которых будет представлена двумя полями с минимумом в системе NaI–Na2CO3–Na2SO4 и с отсутствием нонвариантного равновесия в системе KI–K2CO3–K2SO4.
Сравнение расчетных данных по методу Мартыновой–Сусарева с экспериментальными показывает, что среднее отклонение по составу равно 7.6%.
Работа выполнена в рамках базовой части государственного задания Самарского государственного технического университета (проект 2020 года).
Список литературы
Делимарский Ю.К., Барчук Л.П. Прикладная химия ионных расплавов. Киев: Наукова думка, 1988. 192 с.
Делимарский Ю.К. Ионные расплавы в современной технике. М.: Металлургия, 1981. 112 с.
Энтальпия плавления солевых эвтектик / Чернеева Л.И., Родионова Е.К., Мартынова Н.М. и др. Обзоры по теплофизическим свойствам веществ. М.: Ин-т высоких температур АН СССР, 1980. № 3. 56 с.
Васина Н.А., Грызлова Е.С., Шапошникова С.Г. Теплофизические свойства многокомпонентных солевых систем. М.: Химия, 1984. 112 с.
Зарецкий С.А., Сучков В.Н., Животинский П.Б. Электрохимическая технология неорганических веществ и химические источники тока: учебник для учащихся техникумов. М.: Высш. школа, 1980. С. 211–213.
Коровин Н.В. Новые химические источники тока. М.: Энергия, 1978. 194 с.
Коровин Н.В. Электрохимическая энергетика. М.: Энергоатомиздат, 1991. 264 с.
Химические источники тока: Справочник / Под ред. Н.В. Коровина, А.М. Скундина. М.: Изд-во МЭИ, 2003. 740 с.
Гаркушин И.К., Игнатьева Е.О., Бехтерева Е.М., Бамбуров В.Г. Физико-химическое взаимодействие в системах из галогенидов, хроматов, молибдатов и вольфраматов лития, натрия и калия. Екатеринбург: РИО УрО РАН, 2013. 169 с.
Громаков С.Д. О некоторых закономерностях равновесных систем. Казань: Изд-во КГУ, 1961. 602 с.
Воздвиженский В.М. Общие закономерности в строении диаграмм состояния металлических систем. М.: Наука, 1973. С. 103–109.
Замалдинова Г.И., Гаркушин И.К., Парфенова С.Н. // Журн. неорган. химии. 2012. Т. 57. Вып. 6. С. 961.
Хачатурян А.Г. Теория фазовых превращений и структура твердых растворов. М.: Наука, 1974. С. 328.
Захаров А.М. Диаграммы состояния двойных и тройных систем. М.: Металлургия, 1990. 240 с.
Минделькорн Л. Нестехиометрические соединения. М.: Химия, 1971. С. 608.
Мощенская Е.Ю. Программный комплекс для моделирования фазовых диаграмм “состав–температура” и “состав–ток” в физико-химическом анализе солевых и металлических систем. Свидетельство об официальной регистрации программы для ЭВМ № 2006612377 от 05.09.2006.
Егунов В.П. Введение в термический анализ. Самара: ПО “СамВен”, 1996. 270 с.
Термические константы веществ: Справочник / Под ред. В.П. Глушко // М.: ВИНИТИ, 1981. Вып. X. Ч. 2. 300 с.
Диаграммы плавкости солевых систем. Ч. III / Под ред. В.И. Посыпайко, Е.А. Алексеевой. М.: Металлургия, 1977. 204 с.
Воскресенская Н.К. Справочник по плавкости систем из безводных неорганических солей / Н.К. Воскресенская, Н.Н. Евсеева, С.И. Беруль, И.П. Верещетина. М.-Л.: Изд-во АН СССР, 1961. Т. I. 845 с.
Диаграммы плавкости солевых систем. Тройные системы / Под. ред. В.И. Посыпайко, Е.А. Алексеевой. М.: Химия, 1977. 328 с.
ACerS-NIST. Phase Equilibria Diagrams. CD-ROM Database. Version 3.1.0. American Ceramic Society. National Institute of Standards and Technology.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии