Журнал физической химии, 2020, T. 94, № 6, стр. 837-843
Состав гидросольватов при экстракции азотной кислоты в системе HNO3–H2O–Д2ЭГФоК
В. В. Туманов a, *, П. А. Стороженко a, И. В. Столярова a
a Государственный научно-исследовательский институт химии и технологии элементоорганических соединений
105118 Москва, Россия
* E-mail: neijivlad@mail.ru
Поступила в редакцию 24.06.2019
После доработки 16.09.2019
Принята к публикации 17.09.2019
Аннотация
Исследованы роль воды при экстракции азотной кислоты в системе HNO3–H2O–Д2ЭГФоК (PC88-A, P507, Ionquest 801) и состав образующихся гидросольватов для дальнейшего использования полученных данных в моделировании промышленных экстракционных процессах. Рассчитаны зависимости растворимости воды в экстрагенте от ее активности в водной фазе, содержание растворенной и гидратной воды в органической фазе при разных концентрациях азотной кислоты в равновесной водной фазе, получены ИК-спектры экстрактов. Рассчитаны составы гидросольватов в системе HNO3–H2O–Д2ЭГФоК. Выявлено, что вода участвует в экстракции азотной кислоты, однако ее участие в области высоких концентраций незначительно. Определены составы гидросольватов: (HL)2 · 2HNO3 · Н2О (<5 М азотной кислоты в водной фазе) и HL · HNO3 · 0.2Н2О (>5 М азотной кислоты в водной фазе).
Последние десятилетия активно ведутся исследования в области экстракционных процессов. Одним из наиболее широко используемых классов органических веществ, применяемых в экстракции являются фосфорорганические соединения, широко используемые не только в лабораторной практике но и в промышленных экстракционных процессах.
Экстракционные процессы сильно зависят от технологических условий, среды, а так же имеют сложные физико-химические механизмы, в связи с чем возникает необходимость изучения процессов, происходящих в экстракционных системах.
Одним из таких неизбежных побочных процессов является соэкстракция как примесных компонентов, так и составляющих водной фазы (минеральные кислоты, вода, образование третьей фазы) и т.д. [1–9]. Крайне важно понимать процессы, проходящие в процессе экстракции (комплексообразование, димеризация экстрагента, сольватация и т.д.).
В работах [10–12] рассматривался процесс экстракции азотной кислоты трибутилфосфатом. Азотная кислота в органической фазе может находиться в сольватах состава (HNO3)x(TBP)y в соотношениях 3 : 1, 2 : 1, 1 : 1 и 2 : 1, из чего следует, что азотная кислота эффективно экстрагируется в органическую фазу, но вместе с тем в работе [12] указывается, что в области низких концентраций азотной кислоты характерен состав сольвата 1 : 1, в области средних и высоких 2 : 1, а азотная кислота образует линейный димер, который крайней связью Н–О связан с фосфорильной группой Р=О.
В работе [13] исследовалась экстракция азотной кислоты октил(фенил)-N,N-диизобутилкарбомоилметилфосфин оксидом (СМРО). Описаны образующиеся комплексы в системе HNO3–H2O–CMPO : (HNO3)(H2O)(CMPO)2, (HNO3)(CMPO), (HNO3)(CMPO)2, (HNO3)(CMPO)3.
Так же рассмотрена экстракция азотной кислоты ди-2-этилгексилфосфорной кислотой (Д2ЭГФК) [14]. Описаны сольваты состава (НА)2 : (HNO3) = 1 : 2, а так же составы гидросольватов (НА)2(Н2О)2(HNO3) и (НА)2(Н2О)2(HNO3)2.
Однако, в литературе нет данных по экстракции азотной кислоты ди-2-этилгексилфосфоновой кислотой (Д2ЭГФоК, EHEHPA, РС-88А и т.д.), которая широко используется в экстракционных процессах. Имеются лишь данные о том, что азотная кислота участвует в процессе экстракции редкоземельных металлов [15].
Целью работы было исследование экстракции азотной кислоты ди-2-этилгексилфосфоновой кислотой для определения роли воды и азотной кислоты в процессах димеризации ФОК, и об участии воды в процессах комплексообразования, протекающих в органической фазе.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В ходе исследований использовали азотную кислоту (HNO3) марки “ос. ч.” 18-4 (ГОСТ 11125-84), ди-2-этилгексилфосфоновая кислота техн. (Daihachi Chemical Industry Co. Ltd., Japan), гидрооксид калия (КОН) марки “х. ч.” (ГОСТ 24363-80), бензол марки ЧДА (ГОСТ 5955-75). Анализ экстрактов проводили в ГНИИХТЭОС: содержание воды определяли методом Фишера на приборе Metrohm Titrino Coulometer 831 KF (Metrohm, Швейцария), содержание лития в водной фазе до и после экстракции определяли на приборе ICP-MS Agilent 7900, ИК-спектры Д2ЭГФоК сняты до и после экстракции на ИК-спектрометре Nikolet 380 в Центре коллективного пользования им. Д.И. Менделеева.
Эквивалентные количества водной и органической фаз контактировали до установления равновесия в системе (5 мин). По завершению разделения фаз проводили анализ экстрактов.
Данные по экстракции азотной кислоты и составе сольватов Д2ЭГФК и Д2ЭГФоК были взяты из работ [14] и [16] соответственно и были проверены контрольными опытами.
Зависимость содержания воды в органической фазе от ее активности в водной фазе в системе Н2О–Д2ЭГФоК–LiCl определяли в равновесных условиях [5, 14, 17]. Содержание воды в органической фазе определяли методом Фишера. Степень извлечения лития в органическую фазу определяли путем анализа концентрации лития в исходном растворе и в водной фазе после экстракции.
В то же время проводили определение содержания воды в экстрактах в системе Н2О–Д2ЭГФоК–HNO3 при различной концентрации азотной кислоты в равновесной водной фазе. Расчеты констант взаимодействия рассчитывали на основании характеристических уравнений, как описано в работах [18, 19], используя данные работ [20–22] об активности воды в растворах хлорида лития и азотной кислоты.
ИК-спектры Д2ЭГФоК сняты до и после экстракции для определения возможного механизма и участия воды в процессе экстракции по изменению спектра экстрактов с увеличением концентрации азотной кислоты. Данные для интерпретации спектров были взяты из работы [23].
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Ранее нами было обнаружено, что Д2ЭГФоК лучше экстрагирует азотную кислоту по сравнению с Д2ЭГФК [16]. Это может быть связано с различием в строении молекул Д2ЭГФК и Д2ЭГФоК, и большей активностью фосфорильной группы –Р=О [15, 23]. Так же определены составы сольватов и электропроводность экстрактов.
Из экспериментальных данных по экстракции в системе Н2О–Д2ЭГФоК–LiCl и данных об активности воды в системе Н2О–LiCl из работы [18], найдено количество воды, которое переходит в органическую фазу, в зависимости от ее активности в водной фазе. Полученные данные представлены в табл. 1. В процессе контакта фаз хлорид лития не экстрагировался в Д2ЭГФоК.
Таблица 1.
Зависимость содержания воды в органической фазе от ее активности в системе Н2О–Д2ЭГФоК–LiCl
| СLiCl, моль/л | ${{С}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}$, моль/л | ${{a}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}$ |
|---|---|---|
| 0 | 0.5514 | 1.000 |
| 1 | 0.7773 | 0.964 |
| 2 | 0.7044 | 0.921 |
| 3 | 0.6323 | 0.870 |
| 4 | 0.5691 | 0.812 |
| 5 | 0.5271 | 0.747 |
| 6 | 0.4410 | 0.679 |
| 7 | 0.3788 | 0.610 |
| 8 | 0.3272 | 0.540 |
Основываясь на полученных данных, данных об активности воды в растворах азотной кислоты [20–22], а так же методиках описанных в работах [18–21] была рассчитана зависимость растворимости воды в органической фазе от ее активности в водной фазе в системе Н2О–Д2ЭГФоК–HNO3 (рис. 1). Используя полученные данные о содержании воды и кислоты в органической фазе, а так же, используя данные об активности воды и методики из работ описанных выше, были определены зависимости концентрации общей и растворенной воды в органической фазе от содержания азотной кислоты в равновесной водной фазе (рис. 2), а также гидратной воды в органической фазе от содержания в ней азотной кислоты (рис. 3).
Рис. 1.
Растворимость воды в Д2ЭГФоК в зависимости от ее активности в водной фазе в системе Н2О–Д2ЭГФоК–HNO3.

Рис. 2.
Зависимость концентрации общей (1) и растворенной (2) воды в органической фазе от концентрации азотной кислоты в равновесной водной фазе в системе Н2О–Д2ЭГФоК–HNO3.

Рис. 3.
Зависимость концентрации гидратной воды в органической фазе от концентрации азотной кислоты в органической фазе в системе Н2О–Д2ЭГФоК–HNO3.

На рис. 2 и 3 видно, что графики имеют заметный перегиб в точке содержания азотной кислоты в органической фазе порядка 1.4 М. Так же наблюдается перегиб в области 0.7 М азотной кислоты в органической фазе.
При концентрации азотной кислоты в органической фазе 0–1.4 М виден перегиб в точке, соответствующей концентрации 0.7 М, что говорит о том, что димер экстрагента (HA)2 диссоциирует на мономер НА, так как характер зависимости говорит о росте концентрации свободного экстрагента [15, 24], о существовании димера и его диссоциации с ростом кислотности раствора говорится в работе [15], однако можно видеть, что среднее значение тангенса угла наклона сохраняется в районе 0.5, что говорит о том, что азотная кислота находится в гидросольвате с водой в соотношении HNO3(о) : H2O(о) = 2 : 1, отсюда следует, что состав гидросольвата можно представить в виде 2(HL)2 · 2HNO3 · Н2О. В дальнейшем соотношение содержания азотной кислоты и экстрагента при средних 0.4–1.0 М (≅5–6.2 М в водной фазе) и высоких 1.0–3.4 М концентрациях азотной кислоты в органической фазе (6.2–14.9 М в водной фазе) меняется на (HL)2(o) : HNO3(o) = 1 : 2 либо в случае сольвата, образованного мономером HL(o) : HNO3(o) = 1 : 1. Первый перегиб можно объяснить увеличивающейся экстракцией азотной кислоты, и, как следствие, гидратной воды, а так же диссоциацией димера, о возможности которой говорится в работе китайских коллег. В области средних концентраций состав гидросольвата имеет вид (HL)2 · 2HNO3 · Н2О.
При концентрации азотной кислоты в органической фазе выше 1.4 М (∼8.0 М в водной фазе) состав гидросольвата меняется. Тангенс угла наклона прямой равен 0.15 ≈ 0.2, что говорит о незначительном участии гидратной воды в дальнейшем образовании сольватов и гидросольватов, так как исходя из полученной зависимости состав сольвата имеет вид 5HL · 5HNO3 · Н2О или же HL · HNO3 · 0.2Н2О, что в свою очередь говорит о нахождении в органической фазе как растворенной, так и гидратной воды. Такое значительное содержание азотной кислоты наряду с малым содержанием гидратной воды можно объяснить фактом образования цепных димеров азотной кислоты, которые связаны с фосфорильной группой P=O в молекуле экстрагента, вода же может присоединяться к ассиметрично стоящей связи N=O во внутренней сфере димера (HNO3)2 [23].
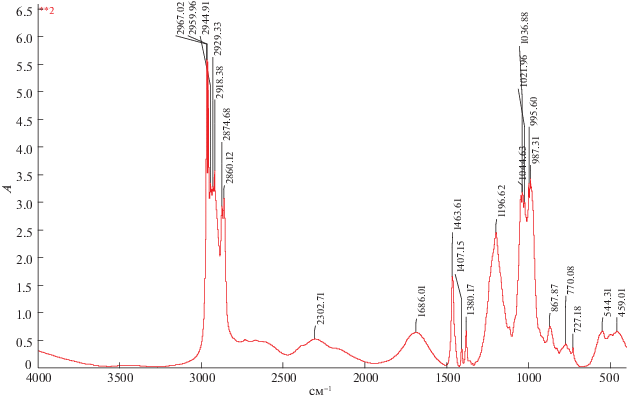
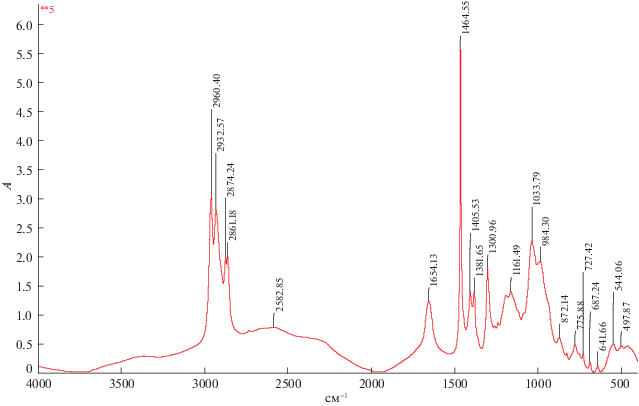
Для исследования взаимодействия азотной кислоты с Д2ЭГФоК в органической фазе проведено ИК-спектроскопическое исследование органической фазы после экстракции азотной кислоты, чистого экстрагента и экстрагента после контакта с водой. Концентрация азотной кислоты в исследуемых образцах составила 0.4–2.5 моль/л. ИК-спектры Д2ЭГФоК до и после контакта с водой и водными растворами азотной кислоты представлены на рис. 4–9.
Основываясь на литературных данных о ИК-спектрах ТБФ с азотной кислотой [12], а так же работах [23–25], где снимали ИК-спектр фосфорорганических соединений было установлено, что пик при 727 см–1 относится к маятниковым колебаниям CH2-групп, полоса в области 980–780 см–1 относится к колебаниям C–C связи. На ИК-спектре присутствуют деформационные колебания метильной группы – CH3: пик при 1380 см–1 соответствует симметричному колебанию, пик при 1463 см–1 – асимметричному. Валентные колебания метильной группы – CH3 соответствует пику при 2965 см–1.
Сопоставляя спектры Д2ЭГФоК до и после контакта с водой, обнаружено, что два пика деформационного колебания поглощенной воды при 1464 и 1686 см–1, в исходном экстрагенте отсутствуют валентные колебания воды в диапазоне 2918–2960 см–1, это означает, что в исходном экстрагенте содержится растворенная вода.
Полоса поглощения при 1196 см–1 соответствует колебанию фосфорильной группы P=O, полоса при 1035 см–1 – колебанием одинарной связи P–O–C, а поглощение в области 1035–868 см–1 относится к группе P–OH. Полоса поглощения при 1300 см–1 относится к экстрагированной азотной кислоте, а также полоса при ∼1650 см–1, но здесь также присутствует пик поглощенной воды – происходит наложение пиков.
При увеличении концентрации азотной кислоты в Д2ЭГФоК наблюдается смещение пика P=O в область более низких частот. Смещение пика наблюдается при концентрации азотной кислоты в органической фазе примерно равной концентрации димера Д2ЭГФоК [(HL)2(o) : HNO3](o) = 1 : 1. Данный факт подтверждает выдвинутые предположения, азотная кислота присоединяется непосредственно к фосфорильной группе либо через молекулу воды. Смещение наблюдается также в области поглощенной воды, что указывает на участие молекул воды в механизме экстракции азотной кислоты. Смещения на 4–5 см–1 в области P‒O–C- и P–OH-групп указывает, что их влияние на экстракционную способность незначительно.
Таким образом, установлено, что Д2ЭГФоК эффективно экстрагирует азотную кислоту. Определено содержание воды в экстрактах, рассчитано содержание гидратной и растворенной воды в органической фазе, выдвинуты предположения о составе гидросольватов в органической фазе. При низких концентрациях азотной кислоты в равновесной водной фазе (до 5 моль/л) гидросольваты имеют состав (HL)2 · 2HNO3 · Н2О, при более высоких концентрациях (выше 5 моль/л) HL · HNO3 · 0.2Н2О (5HL · 5HNO3 · Н2О), что указывает на незначительное участие воды в образовании сольватов в области высоких концентраций азотной кислоты в органической фазе.
Данный факт можно объяснить с точки зрения образования водородных связей между молекулами экстрагента (по причине меньшего смещения электронной плотности к кислороду в связях Р‒О–С и, следовательно, усилению сольватообразующей связи Р=О), кислоты (а также образования ее димеров, присоединяющихся к связи Р=О) и воды.
Получены ИК-спектры экстрактов азотной кислоты различной концентрации. Обнаружено, что экстрагируется не только азотная кислота, но так же и вода. Образование сольватов в области низких концентраций азотной кислоты идет с участием экстрагированной (гидратной) воды, участие которой в сольватообразовании в области высоких концентраций азотной кислоты незначительно.
Список литературы
Анпилогова Г.Р., Баева Л.А., Нугуманов Р.М. и др. // Журн. неорган. химии. 2018. Т. 63. № 8. С. 1065.https://doi.org/10.1134/S0044457X18080020
Туранов А.Н., Карандашев В.К., Яркевич А.Н. и др. // Там же. 2018. Т. 63. № 3. С. 382.https://doi.org/10.7868/S0044457X18030200
Смотров М.П., Черкасов Д.Г., Ильин К.К. // Там же. 2017. Т. 62. № 3. С. 375.https://doi.org/10.7868/S0044457X17030163
Борисова Н.Е., Сафиулина А.М., Книжников В.А. // Там же. 2017. Т. 62. № 2. С. 254.https://doi.org/10.7868/S0044457X17020039
Костикова Г.В., Кутепова О.А., Резник А.М. // Там же. 2018. Т. 63. № 2. С. 265.https://doi.org/10.7868/S0044457X18020216
Ying D., Riwen L., Zhirong L. et al. // J. Radioanal. Nucl. Chem. 2018. V. 318. № 3. P. 2079. https://doi.org/10.1007/s10967-018-6292-4
Yaoyang L., Yang G., Zheng W. et al. // Ibid. 2018. V. 318. № 3. P. 2087. https://doi.org/10.1007/s10967-018-6261-y
Rama Swami K., Venkatesan K.A., Antony M.P. // Ind. Eng. Chem. Res. 2018. V. 53. № 40. P. 13490. https://doi.org/10.1021/acs.iecr.8b02396
Xu D., Shah Z., Cui Y. et al. // Hydrometallurgy. 2018. V. 180. P. 132. https://doi.org/10.1016/j.hydromet.2018.07.005
McLachlan F., Greenough K., Geist A. et al. // Solvent Extr. Ion Exch. 2016. V. 34. № 4. P. 334. https://doi.org/10.1080/07366299.2016.1156414
Brown J., Carrott M.J., Fox O.D. et al. // IOP Conf. Ser.: Mater. Sci. Eng. 2010. V. 9. № 1. P. 1. https://doi.org/10.1088/1757-899X/9/1/012075
Ferraro J., Borkowski M., Chiarizia R. et al. // Solvent Extr. Ion Exch. 2001. V. 19. № 6. P. 334. https://doi.org/10.1081/sei-100107614
Belair S., Labet A., Marie C. et al. // Ibid. 2005. V. 23. № 4. P. 481. https://doi.org/10.1081/SEI-200068435
Михайличенко А.И., Волченкова Н.Г. // Журн. неорган. химии. 1969. Т. 14. № 12. С. 3369.
Zhang J., Zhao B., Schreiner B. Separation Hydrometallurgy of Rare Earth Elements. Springer International Publ., 2016. https://doi.org/10.1007/978-3-319-28235-0
Салаватов Н.А., Туманов В.В., Михайличенко А.И. // Успехи в химии и хим. технологии. 2016. Т. 30. № 3.
Демин С.В., Шокурова Н.А., Демина Л.И. и др. // Журн. неорган. химии. 2018. Т. 63. № 8. С. 1065.https://doi.org/10.1134/S0044457X18080020
Robinson R.A., Stokes R.H. Electrolyte Solutions: Second Revised Edition. Dover Publications, Inc., 2012.
Розен А.М., Сабаев И.Я., Шокин И.Н. // Журн. неорган. химии. 1964. Т. 9. С. 1455.
Robinson R.A. // Trans. Faraday Soc. 1945. V. 41. № 0. P. 756. https://doi.org/10.1039/tf9454100756
Davis W., de Bruin H.J. // J. Inorg. Nucl. Chem. 1964. V. 26. № 6. P. 1069. https://doi.org/10.1016/0022-1902(64)80268-2
Ochkin A.V., Merkushkin A.O., Nekhaevskii S.Yu. et al. // Radiochemistry. 2018. V. 60. № 5. P. 534. https://doi.org/10.1134/S1066362218050107
Passimourt N., Potin P. Pat. US № 4812297A. 1988. Atochem, Puteaux, France.
Kahler E.J. Pat. US № 2925320A. 1956. Pennwalt Corp.
Jaeger R.De., Gleria M. Phosphazenes: A Worldwide Insight. New York: Nova Science Publ., 2011. V. 2. P. 1047.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии