Журнал физической химии, 2020, T. 94, № 6, стр. 829-836
Адсорбция анионов высших карбоновых кислот на магнии из слабощелочных водных растворов
В. А. Огородникова a, Ю. И. Кузнецов a, *, Н. П. Андреева a, А. Ю. Лучкин a, А. А. Чиркунов a
a Российская академия наук, Институт физической химии и электрохимии
им. А.Н. Фрумкина
Москва, Россия
* E-mail: kuznetsov@ipc.rssi.ru
Поступила в редакцию 21.06.2019
После доработки 11.07.2019
Принята к публикации 17.09.2019
Аннотация
Методом отражательной эллипсометрии in situ изучена адсорбция натриевых солей высших карбоксилатов на окисленном магнии. Показано, что свободная энергия адсорбции олеилсаркозината (ОсН) и линолеата (ЛиН) натрия >55 кДж/моль, что позволяет предполагать хемосорбцию карбоксилатов на окисленной поверхности магния. Измерением спектров электрохимического импеданса, вольтамперометрических и коррозионных испытаний показано, что на “чистом” и оксидированном магнии наилучшими защитными свойствами обладает олеат натрия (ОлН). Высокие защитные свойства ОлН подтверждены испытаниями пластин Mg в условиях влажной атмосферы с ежесуточной конденсацией влаги на них. Предварительная пассивация химически оксидированного Mg в водном растворе 16 ммоль/л ОлН обеспечивает защиту от появления первого коррозионного поражения в течение 92–96 ч.
Магний и его сплавы высоко востребованы в технике, поскольку они обладают уникальной комбинацией физико-механических свойств. Магний – самый легкий металл с плотностью ∼1.7 г/см3, которая ниже таковой для Al ∼2.7 г/см3, Ti ∼4.5 г/см3 и Fe ∼7.9 г/см3 [1]. Магний по распространенности среди элементов земной коры занимает восьмое место, поэтому его сплавы имеют хорошие ресурсы для широкого использования на практике. К полезным их свойствам относятся: удельная прочность, жесткость, хорошая демпфирующая способность, превосходная обрабатываемость, отличные литейные свойства и невысокая теплоемкость. Однако низкая коррозионная стойкость препятствует широкому применению сплавов Mg на практике, поэтому требуется проводить антикоррозионную обработку их поверхности [2].
На сегодняшний день одним из наиболее эффективных способов придания антикоррозионной защиты сплавам Mg является создание барьерного покрытия на их поверхности для изолирования основного материала от окружающей среды. Это достигается формированием одного из типов покрытий: конверсионного (КП), в том числе полученного анодированием или микродуговым оксидированием (МДО, ПЭО) или лакокрасочного покрытия. Согласно [3, 4] в настоящее время доступно большое количество технологий бесхроматных КП для сплавов Mg, которые имеют свои достоинства и ограничения. Интересной стратегией разработки новых и более экологичных КП для Mg сплавов является обработка сплава природными органическими кислотами, которые образуют нерастворимые соли с магнием. В работе [4] рассмотрена ванилиновая (4-гидрокси-3-метоксибензойная кислота C8H8O4) на сплаве AZ31 в качестве замены токсичного хроматирования. Такое КП, сформированное на поверхности Mg, обладает рядом преимуществ: экологическая чистота, ингибирование анодного растворения металла, снижение тока коррозии, способность улучшать адгезию и защитные свойства полимерных покрытий.
Использование ингибиторов (ИК) является одним из перспективных направлений в повышении коррозионной стойкости Mg. Например, известно [2], что деканоат натрия в растворе с нейтральным pH понижает скорость коррозии и обеспечивает пассивацию Mg.
Среди органических ИК доминируют поверхностно-активные вещества. Так, авторами [5] исследовано влияние 151 органического соединения на коррозионное поведение девяти сплавов Mg. В этой работе выявлен ряд новых ИК с эффективностью защиты, сравнимой и даже превышающей эффективность хромата.
Особого внимания заслуживает борьба с коррозией сплавов Mg, стимулируемой растворением из них электроположительных примесей металлов, которые осаждаются на поверхности, становясь катодами. В связи с этим интересна способность ИК связывать такие катионы, например железа, в комплексы [5, 6]. В этом отношении наиболее эффективными и универсальными среди исследованных соединений зарекомендовали себя натриевые соли производных пиридиндикарбоновых и салициловых кислот.
Не снижается интерес к пассивации водными растворами органических ИК сплавов Mg с образованными в атмосфере оксидными пленками [7–9] или КП, полученными методом ПЭО [10, 11]. В качестве таких ИК использовали натриевые соли высших карбоновых кислот: олеиновой (ОлК), стеариновой (СК), тридекановой (ТДК). Особенно интересны олеат натрия (ОлН), олеилсаркозинат натрия (ОсН) и ИФХАН-25 [7–9].
Использование алкилкарбоксилатов в качестве ИК не только эффективно для снижения коррозии металлов, но и экологически относительно безопасно. Цель настоящей статьи состоит в выяснении особенностей адсорбции некоторых высших алкилкарбоксилатов на Mg и формирования ими пассивирующих слоев, устойчивых в агрессивной влажной атмосфере.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Все исследования проводили на техническом магнии, Мг90 следующего состава: Mg – 99.9%, Fe – до 0.04%, Mn – до 0.03%, Al – до 0.02%, Ni – до 0.001%, Cu – до 0.004%, Si – до 0.009%, Сl – до 0.005%.
В качестве ИК исследовали натриевые соли карбоновых кислот: олеат (ОлН, (СН3(СН2)7СН=СН(СН2)7СООNa), линолеат (ЛиН, CH3(CH2СН=СН)3(CH2)7COONa), стеарат (СН, CH3–(CH2)16COONa), лаурилсаркозинат (ЛсН, С15Н28N1Na1O3) и олеилсаркозинат натрия (ОсН, СН3(СН2)7СН=СН(СН2)7СОN(CH3)СН2COONa). Растворы ОсН, ЛиН, СН готовили нейтрализацией соответствующей кислоты эквимолярным количеством NaOH. Растворы ОлН и ЛсН готовили из реактивов. Все реактивы марки “ч.”.
Защитную пленку ИК формировали выдержкой электрода в водном (ОсН, ОлН, ЛиН и ЛсН) растворе ИК с концентрацией Син = 16 ммоль/л при комнатной температуре (t). В случае СН пленка ИК наносилась из водно-спиртового раствора при t = 55°С.
Электрохимические исследования проводили на цилиндрических электродах из технического Mg, армированных в эпоксидную смолу, с площадью рабочей поверхности 0.75 см2. Поляризационные кривые Мг90 снимали в стеклянной ячейке с разделенными электродными пространствами с помощью потенциостата IPC-Pro MF (РФ). Потенциалы (Е) Мг90 измеряли относительно хлорсеребряного электрода сравнения, пересчитывали на стандартную водородную шкалу. Вспомогательный электрод – Pt.
Электрод для электрохимических исследований зачищали на наждачной бумаге разной зернистости и обезжиривали ацетоном. Были проведены две серии опытов. В первом случае анодные и катодные поляризационные кривые Мг90 снимали в боратном буферном растворе с pH 9.2, содержащем 1 ммоль/л NaCl без и с добавкой 8 или 16 ммоль/л ИК. Электрод погружали в боратный буфер, содержащий одну из добавок ингибитора, выдерживали в нем 15 мин до установления потенциала свободной коррозии Екор, затем включали поляризацию со скоростью развертки 0.2 мВ/с.
В другом случае поляризационные кривые снимали с предварительно сформированной адсорбционной пленкой ИК. Пленку получали двумя способами:
1) Зачищенный и обезжиренный электрод выдерживали 10 мин в растворе ИК и 60 мин сушили на воздухе.
2) Электрод оксидировали 1.5 ч в растворе 5.0 М NaOH, промывали дистиллированной водой и 60 мин сушили на воздухе. Высушенный оксидированный электрод выдерживали 10 мин в растворе ИК и снова сушили на воздухе.
После такой подготовки образец погружали в фоновый раствор и сразу включали анодную поляризацию со скоростью развертки 0.2 мВ/с.
Из поляризационных кривых определяли потенциал локальной депассивации Епт. О защитных свойствах пассивной пленки судили по разности ΔЕ = $Е_{{{\text{пт}}}}^{{{\text{ин}}}}$ – $Е_{{пт}}^{{фон}}$, где $Е_{{пт}}^{{фон}}$ и $Е_{{{\text{пт}}}}^{{{\text{ин}}}}$ – величины Епт, измеренные для электрода без обработки ИК и с ней.
Адсорбцию ОсН и ЛиН на техническом Mg исследовали in situ методом отражательной эллипсометрии в боратном растворе с рН 11.2, содержащем 0.05 М Na2B4O7 · 10H2O + 0.1 М NaOH. Измерения эллипсометрических углов ∆ и Ψ были сделаны на ручном эллипсометре фирмы Rudolph Research в ячейке, служащей для одновременного проведения электрохимических и эллипсометрических исследований. Источник излучения – гелий-неоновый лазер с длиной волны λ = 640 нм, угол падения света на образец 68.5°. Для обеспечения стабильной поверхности (неизменность эллипсометрических улов ∆ и Ψ) магниевый электрод подвергали специальной предварительной пассивации. Для этого зачищенный, отполированный и обезжиренный электрод химически оксидировали в растворе 5.0 М NaOH в течение 1.5 ч. Затем электрод переносили в рабочий раствор (боратный раствор рН 11.2), где он выдерживался еще 17 ч. После такой обработки поверхность электрода сохраняла зеркальный блеск. Через 17 ч электроду задавали с помощью потенциостата потенциал, отрицательнее потенциала свободной коррозии Екор на 20 мВ. После стабилизации значений углов ∆ и Ψ, в ячейку добавляли концентрат ингибитора. Для каждой концентрации ИК (Син) проводили измерения угла ∆ во времени до тех пор, пока угол переставал меняться. Для каждой Син получали изменение угла
где ∆ – текущее значение угла, полученное после введения в раствор добавки ингибитора, ∆0 – исходное значение. Таким образом была получена экспериментальная зависимость δ∆ от Син, т.е. изотерму δ∆ – ƒ(Син), которую зависимость перестраивали в изотерму адсорбции Θ – ƒ(ln C). Эта изотерма описывается полным уравнением Темкина, предложенным в [12]:(2)
$\Theta = \frac{1}{f}\ln \frac{{1 + {{n}^{{ - 1}}}{{B}_{{\max }}}(C - {{C}_{0}})}}{{1 + {{n}^{{ - 1}}}{{B}_{{\min }}}(C - {{C}_{0}})}}.$Расчет толщин пассивирующих пленок выполнен по программе на интернет-ресурсе http:// www.ccn.yamanashi.ac.jp/~kondoh/ellips_e.html.
Коррозионные испытания проводили при периодической конденсации влаги на неоксидированных и химически оксидированных прямоугольных образцах 20 × 30 × 5 мм. Пластины для коррозионных испытаний готовили, как и для электрохимических исследований. Подготовленные образцы подвешивали в стеклянных ячейках заполненных 40–50 мл дистиллированной водой при t = 40–50°С. Ячейки с образцами помешали в сушильный шкаф, в котором в течение 8 ч поддерживалась t = 40 ± 2°С, затем нагрев отключали, обеспечивая таким образом конденсацию влаги на поверхности образцов (ГОСТ 9.308-85). Образцы осматривали ежечасно, фиксируя время появления первых коррозионных поражений.
Для получения спектров электрохимического импеданса (СЭИ) использовали потенциостат IPC PRO-MF и анализатор частотного отклика FRA (РФ). Эксперимент проводили в трехэлектродной ячейке, с неразделенным электродным пространством. Электродом сравнения служил двухключевой хлоридсеребряный электрод, вспомогательным электродом платина, а электролитом – боратный буферный раствор рН 9.2 содержащий 1 мМ хлорида натрия. Электроды для спектроскопии электрохимического импеданса подготавливали аналогично как для электрохимических и коррозионных исследований. Обработанный образец помещали в ячейку с электролитом, выдерживали 15 мин до стабилизации Екор, фиксировали потенциал и получали спектры в диапазоне частот от 0.01–100 000 Гц при амплитуде колебаний потенциала 0.01 В.
При расчете параметров СЭИ использовали эквивалентную схему, широко применяемую для описания импедансных спектров магниевых сплавов [13]
где Rs – сопротивление раствора объемного электролита между вспомогательным и рабочим электродами; Rs не влияет на электродные процессы и его величина зависит от проводимости испытательной среды и геометрии ячейки, Rsl – сопротивление пленки поверхностных слоев (оксидных и ингибиторных), Rst – поляризационное сопротивление, характеризующее электрохимическую кинетику коррозионного процесса.В эквивалентной схеме вместо чистых емкостей использовались элементы постоянной фазы (Q), обусловленные определенной степенью неоднородности поверхностных пленок и электрохимического двойного слоя [14]. Qsl – элемент постоянной фазы характеризующий емкость поверхностных пленок: оксидных или ингибиторных. Qdl – компонент модели, который выражает емкость электрического двойного слоя дефектах пленки.
Обработку результатов и расчет значений полученных данных проводили при помощи программы Dummy Circuits Solver (version 2.1). Соответствие экспериментальных данных расчетным составляло не менее 97%. Степень защиты магниевого электрода вычисляли по формуле:
где Rфон и Rинг – общее сопротивление межфазного взаимодействия “Мг90 – электролит”, включающая Rst и Rsl, до после пассивации электрода, соответственно. Все приведенные в статье величины являются результатами усреднения 5–10 независимых опытов.ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Измерение адсорбции ингибитора из фонового раствора эллипсометрическим методом, позволяет оценить прочность связи его с поверхностью метала. К сожалению, из-за высокой реакционной способности Мg измерение адсорбции ИК эллипсометрическим методом на нем возможно лишь в случае стабильного пассивного состояния поверхности электрода, которое достигалось путем оксидирования по описанной выше методике.
На рис. 1а представлены экспериментальные зависимости (–δΔ) от ln Cин для ОсН и ЛиН в боратном растворе с рН 11.2. Адсорбция карбоксилатов начинается в области низких Син (2.2–5.5) × × 10–10 моль/л и проявляется в изменении угла Δ. После достижения определенной Син Δ перестает изменяться и на кривых можно выделить плато, отвечающее формированию условного монослоя ингибитора со степенью заполнения поверхности Θ = 1. Однако при дальнейшем увеличении Син угол ∆ меняется, что свидетельствует о дальнейшей адсорбции ингибитора. Согласно ранее полученной изотерме адсорбции ОлН [15] условный монослой в этом случае формировался при С = = (0.42–1.58) × 10–6 моль/л.
Рис. 1.
Зависимости изменения эллипсометрического угла (–δΔ) (а) и степени заполнения (θ) (б) от In Син для: 1 – ОсН, 2 – ЛиН.
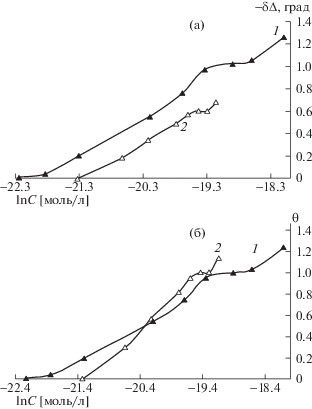
Из линейной зависимости между экспериментально определяемыми изменениями угла ∆ и степенью заполнения (Θ) поверхности электрода частицами ИК были построены изотермы адсорбции этих ингибиторов Θ – ƒ(ln C). Они приведены на рис. 1б.
В табл. 1 приведены значения ($ - \Delta G_{{{\text{a}},\min }}^{ \circ }$), ($ - \Delta G_{{{\text{a}},\max }}^{ \circ }$), коэффициент f, Вmax и Bmin, полученные по формулам (2), (3).
Таблица 1.
Зависимость логарифма коэффициентов распределения (log Р), а также параметров f, ($ - \Delta G_{{{\text{a}},\min }}^{ \circ }$), ($ - \Delta G_{{{\text{a}},\max }}^{ \circ }$) от химической структуры карбоксилатов. Значения lg P получены по программе ACDLABS
| Ингибитор | lg P | Вi,max, моль–1 | Bi,min, моль–1 | ($ - \Delta G_{{{\text{a}},\min }}^{ \circ }$), кДж/моль | ($ - \Delta G_{{{\text{a}},\max }}^{ \circ }$), кДж/моль | f |
|---|---|---|---|---|---|---|
| ОлН | 7.70 | 1.59 × 1010 | 3.65 × 109 | 53.65 | 57.22 | 1.47 |
| ОсН | 7.00 | 2.15 × 1011 | 3.57 × 1010 | 59.20 | 63.58 | 1.8 |
| ЛиН | 6.50 | 5.21 × 1010 | 1.36 × 1010 | 56.86 | 60.12 | 1.31 |
Как видно из рис. 1а ОсН начинает адсорбироваться раньше, чем ЛиН, поэтому у него большая свободная энергия адсорбции.
Из величин углов Δ и Ψ определили толщины монослоев ИК. Поскольку толщина монослоя ОсН δ = 1.2–1.5 нм, а длина молекулы lм = 2.5 нм, можно предположить, что молекула адсорбируется наклонно к поверхности под углом 36.9°. На окисленном Мг90 ЛиН, имеющий lм = 2.4 нм формирует монослой с δ = 0.9 нм, поэтому угол его наклона вероятно составляет 66°.
Ранее показано [9, 15], что ОлН является одним из перспективных ИК Мg-сплавов в нейтральных и слабощелочных средах. На рис. 2 представлена поляризационная кривая в боратном буфере с рН 9.2, содержащем 8 мМ ОлН. В этом случае этот ИК не только замедляет катодную реакцию и увеличивает Екор (на 0.15 В), но и обеспечивает широкую область потенциалов, в которой Mг90 находится в пассивном состоянии.
Рис. 2.
Анодные и катодные поляризационные кривые технического магния без химического оксидирования в боратном буфере с рН 9.2, содержащем 1 мМ NaCl без ИК (1) и после добавления 8 ммоль/л ИК: 2 – ОлН; 3 – ОсН; 4 – ЛиН, и 16 мМ ИК 2* – ОлН; 3* – ОсН; 4* – ЛиН.

При введении 8 ммоль/л ОсН и ЛиН в боратный раствор с рН 9.2 Екор увеличивается на 0.024 и 0.092 В соответственно, но лишь в случае раствора ЛиН можно заметить некоторое увеличение поляризуемости электрода, которое свидетельствует о замедлении обеих электрохимических реакций. С увеличением Син с 8 до 16 мМ наблюдается усиление защитного эффекта (рис. 2). Оно проявляется в увеличении Екор и поляризуемости электрода Мг90 в растворах ОсН и ЛиН. На анодной поляризационной кривой с добавкой 16 мМ ОлН длина пассивного участка больше, чем при введении в раствор 8 мМ ОлН.
Пассивирующее действие водных растворов ИК изучали при Син = 16 мМ. Продолжительность формирования адсорбционных слоев на Мг90 с оксидной пленкой, образованной на воздухе (рис. 3а) или оксидированной в щелочи (рис. 3б) составляла 10 мин. Обработанный таким методом электрод помещался в боратный раствор с рН 9.2 и немедленно подвергался поляризации.
Рис. 3.
Анодные и катодные поляризационные кривые технического магния без (а) и после химического оксидирования (б) в боратном буфере с рН 9.2, содержащем 1 мМ NaCl без предварительной адсорбции (1) и после нее из 16 мМ растворов ИК в течение 10 мин: 2 – ОлН, 3 – ОсН, 4 – ЛиН, 5 – СН, 6 – ЛсН.

Пленка ЛиН обеспечивает больший сдвиг начального потенциала (Ен) электрода (–0.92 В), чем ОлН. На анодной поляризационной кривой появляется область с маленькими плотностями тока, которая как и в нейтральном буфере [9], так и в ББР с рН 9.2 по протяженности меньше, чем для ОлН. В то же время, как показано выше, присутствие ЛиН в фоновом электролите не приводило к появлению пассивного участка. Возможно при предварительной обработке за время сушки происходит сшивание молекул ЛиН по двойным связям, а при введении ЛиН в раствор этого не происходит.
При обработке неоксидированного Mg в растворах 16 мМ ЛсН и СН, на анодных поляризационных кривых не наблюдается замедления интенсивного анодного растворения, происходит смещение Eн в анодную сторону на 50 и 159 мВ, соответственно.
Заметно уступает ОлН в ингибировании анодного растворения Мg и другой анионный ПАВ – ОсН, также содержащий в углеводородной цепи одну двойную связь и 17 атомов углерода. Различие между этими ИК заключается в большей гидрофобности анионов ОлН по сравнению с анионами ОсН. Гидрофобность молекул исследуемого соединения можно оценить используя логарифм коэффициента распределения в системе октанол-вода двух несмешивающихся жидкостей, lg Р [16]. Он помогает рассчитать характеристику гидрофобности аниона, lg D с учетом pKa соответствующей кислоты [17] и pH раствора:
Эти величины могут быть рассчитаны с помощью ресурса ACD/I-Lab (https://ilab.acdlabs.com/). Для олеиновой кислоты и олеилсаркозина значения lg Р составляют 7.70 и 7.0; lg D при рН 7.4 соответственно 5.10 и 3.61, а при рН 9.2–3.3 и 2.6. Однако гидрофобность не играет определяющую роль в защите Мg. На это указывает тот факт, что адсорбционная пленка СН, обладающего наибольшей гидрофобностью из исследованных нами карбоксилатов: lg Р = 8.23 и lg D = 5.62 (рН 7.4) и 4.06 (рН 9.2), значительно уступает в эффективности защиты аналогичным пленкам, сформированным ОлН и мало отличается от ОсН. Большая эффективность защиты Мг90 ОлН и ЛиН, возможно связана со способностью их молекул сшиваться на поверхности благодаря наличию в них двойной связи. После обработки раствором наименее гидрофобного ЛсН (lg Р = 4.33) защитный эффект практически отсутствует.
Эллипсометрическим методом ex-situ показано, что если магниевые электроды предварительно оксидировать 1.5 ч в 5.0 М NaOH, то на поверхности образуется окидно-гидроксидная пленка толщиной ≈80 нм. После обработки оксидированного Мг90 растворами ИК наблюдаемая картина несколько меняется (рис. 3б). Величина Ен оксидированного электрода существенно положительнее, чем для электрода, не подвергавшемуся щелочному оксидированию, т.е. –1.13 В вместо –1.57 В. Это указывает на защитное действие оксидно-гидроксидной пленки. Последующая обработка раствором ОлН мало сказывается на величине Ен, но делает более протяженной область потенциалов пассивного состояния. Оно нарушается лишь при Епт ≈ –0.69 В, тогда как в отсутствии оксидирования адсорбция ОлН обеспечивала Епт = –0.85 В. Заметно улучшилось защитное действие пленки ЛиН, что проявилось в снижении плотности тока в области потенциалов пассивного состояния. Защитное действие адсорбционных пленок ЛсН, СН и ОсН снизилось, что проявилось в уменьшении Ен до –1.42, –1.43 и –1.36 В соответственно. Возможно это связанно с тем что при обработке в их растворах происходит частичное растворение оксидно-гидроксидного слоя.
В условиях периодической конденсации влаги на образцах Mg с естественно образованной оксидной пленкой первые признаки коррозии появляются уже через τкор = 30–60 мин. На зачищенном Mg наименее эффективным ИК является ЛсН (τкор = 2 ч). В 4 раза эффективней пленки образованные ОсН, СН и ЛиН (τкор = 8 ч). Предварительная обработка такого Mg в водном растворе 16 мМ ОлН, является самой эффективной, обеспечивая защиту до τкор = 18–20 ч (табл. 2). Толщина пленки ОлН после такой обработки Mg в 16 мМ водном растворе без последующей промывки составляет ≈60–62 нм.
Таблица 2.
Результаты коррозионных испытаний Мг90 при периодической конденсации влаги
| № | Состав пассивирующего раствора | pH | t, °С | τ, ч | |
|---|---|---|---|---|---|
| 1 | Без обработки | зачищенный | – | – | 0.5–1 |
| оксидированный | 17–20 | ||||
| 2 | 16 мМ ОлН | зачищенный | 8 | 20 | 18–20 |
| оксидированный | 92–96 | ||||
| 3 | 16 мМ ОсН | зачищенный | 8 | 20 | 8 |
| оксидированный | 43 | ||||
| 4 | 16 мМ ЛсН | зачищенный | 20 | 2 | |
| оксидированный | 33.5 | ||||
| 5 | 16 мМ ЛиН | зачищенный | 9.4 | 20 | 8 |
| оксидированный | 25 | ||||
| 6 | 16 мМ СН | зачищенный | 55 | 8 | |
| Из водно-спиртового раствора | оксидированный | 20.5 | |||
Оксидно-гидроксидная пленка толщиной 80 нм сформированная в растворе 5 М NaOH, обладает защитным эффектом соизмеримым с таковым для ОлН на Мг90 (τкор = 17–20 ч). При последующей обработке оксидированного Мг90 в водно-спиртовом растворе 16 мМ СН на поверхности образуется неравномерный белый налет, который легко удаляется фильтровальной бумагой. Величина τкор для оксидированных образцов, покрытых пленкой СН, составляет 20.5 ч. Некоторое усиление защиты обеспечивают пленки ЛиН, ЛсН и ОсН, соответственно τкор = 25, 33 и 43 ч. Обработка оксидированного Mg водным раствором 16 мМ ОлН обеспечивает намного лучшую защиту τкор = 94 ± 2 ч.
СЭИ – широко известный метод исследования поверхности, используемый для исследований магния и его сплавов. Он дает возможность изучать механизм и кинетику электродных процессов, а также характеристики пассивных пленок, с минимальным воздействием на них. Спектры ЭИ, полученные для образцов Мг90, зачищенных, окисленных, а также пассированных ОлН представлены на рис. 4.
Рис. 4.
Диаграммы Найквиста технического магния в боратном буфере с рН 9.2, содержащем 1 мМ NaCl: 1 – без обработки, 1* – после предварительного оксидирования в 5М NaOH, 2 – после пассивации зачищенного Мг90 в водном растворе 16 мМ ОлН, 2* – после пассивации предварительно оксидированного Мг90 в водном растворе 16 мМ ОлН.

Образцы Мг90 после окисления и/или пассивации в растворе ОлН имеют больший радиус годографа, по сравнению с необработанными, что свидетельствует об их большей коррозионной стойкости. Рассчитанные номиналы представлены в табл. 3. Для окисленных и/или запассивированных образцов существенно возрастает Rct, что обусловливает снижение скорости электродных процессов. Увеличивается также Rsl, что может свидетельствовать об увеличении толщины защитного слоя и увеличении его стойкости в растворе.
Таблица 3.
Рассчитанные номиналы электродов Мг90 в ББР с 1 мМ NaCl рН 9.2
| Образец | Rct, Ом см2 | CPEdl, Т | ndl, Ф | Rsl, Ом см2 | CPEsl, Т | nsl, Ф | Rr, Ом см2 | Z1 | Z2 |
|---|---|---|---|---|---|---|---|---|---|
| Мг90 зачищенный | 16.48 | 0.003 | 0.62516 | 200.83 | 3.9 × 10–5 | 0.875 | 36.635 | – | – |
| Мг90 оксидированный | 23 | 5.3 × 10–4 | 0.90000 | 300.21 | 5.2 × 10–5 | 0.812 | 29.619 | 32.77 | – |
| 16 мМ ОлН на зачищенном Мг90 | 4803 | 1.4 × 10–5 | 0.57935 | 1391.00 | 1.5 × 10–6 | 0.963 | 43.382 | 96.49 | – |
| 16 мМ ОлН на оксидированном Мг90 | 5741 | 1.1 × 10–5 | 1 | 6880.60 | 1.8 × 10–5 | 0.607 | 14.197 | 98.28 | 97.44 |
Оксидирование электродов приводит к незначительному увеличению Rct и возрастанию Rsl в 1.5 раза. Это свидетельствует о снижении скорости коррозионных процессов. Фиксировали также незначительное снижение Qdl: это свидетельствует о снижении доли электрохимически активной поверхности Мg. Незначительное увеличение Qsl является следствием увеличения толщины слоя оксида магния в процессе щелочного оксидирования. Величины n позволяют предположить, что на зачищенном образце скорость коррозии определяется диффузией реагентов и продуктов коррозии соответственно к поверхности и от нее. Однако оксидирование приводит к снижению доли диффузионных процессов на поверхности электрода.
Обработка чистых и оксидированных электродов Мг90 ОлН повышает Rct в сотни раз. Это указывает на высокую степень торможения электродных процессов. Значения Qdl уменьшаются в сравнении с фоновыми на 2 порядка – позволяя утверждать о сильном снижении площади электрохимической активной поверхности. Причем значения n позволяют утверждать, что на электродах, пассивированных ОлН без предварительного окисления поверхности существенный вклад в торможение вносят диффузионные процессы, а на предварительно окисленных электродах, запассивированных ОлН вклад диффузионных процессов менее значим.
В случае формирования ингибиторных пленок существенно увеличивается значение Rsl (которое в данном случае интегрально описывает поверхностные оксидно-ингибиторные слои), причем, на предварительно окисленных образцах их величины существенно больше чем на неокисленных. Значения Qsl также несколько уменьшаются. Следовательно защитный эффект пленки ингибитора на предварительно сформированном оксиде превосходит защиту ингибитора на поверхности Мг90 без окисления.
Значение nst позволяет предполагать наличие диффузионных процессов протекающих в поверхностных слоях. Однако, в случае обработки ингибитором на окисленной поверхности – их вклад существенно выше, чем при пассивации магния без предварительного окисления в щелочном растворе.
Проведенные исследования позволяют утверждать, что наилучшее защитное действие проявляет вариант пассивации Мг90 с предварительным окислением его поверхности в щелочном растворе, это коррелирует с коррозионными и вольтамперометрическими данными.
Таким образом, величины свободной энергии адсорбции ОсН и ЛиН ($ - G_{{{\text{a}},\max }}^{ \circ }$) > 55 кДж/моль, поэтому можно предположить их хемосорбцию на окисленной поверхности Mg. Обработка оксидированного Мг90 в водном растворе 16 мМ ОлН, эффективно ингибирует его анодное растворение в боратном растворе, содержащем хлорид ионы и замедляет появление атмосферной коррозии даже в условиях ежесуточной конденсации влаги на образцах. Предварительное окисление поверхности Mg в щелочном растворе усиливает пассивирующее действие водными растворами ИК, в частности наиболее эффективного из них – олеата натрия.
Работа выполнена при финансовой поддержке РНФ грант № 17-13-01413 “Фундаментальные аспекты формирования сверхтонких пассивирующих пленок органических соединений на металлах при защите от атмосферной коррозии”.
Список литературы
Kainer K.U. Magnesium – Alloys and Technology. Wiley, 2003.
Mesbah A., Juers C. et al. // Solid State Sciences. 2007. V. 9. P. 322.
Chen X.B., Easton M.A., Birbilis N. // Woodhead Publishing Limited. 2013. P. 282. https://doi.org/10.1533/9780857098962.2.282
Guilherme Pazini Abatti, Alfredo T., Nunes Pires et al. // J. Alloys and Compounds. 2018. V. 738. P. 224. https://doi.org/10.1016/j.jallcom.2017.12.115
Lamaka S.V., Vaghefinazari B., Di Mei et al. // Cor. Sci. 2017. V. 128. P. 224. https://doi.org/10.1016/j.corsci.2017.07.011
Lamaka S.V., Höche D., Petrauskas R.P. et al. // Electrochem. Commun. 2016. V. 62. P. 5–8. https://doi.org/10.1016/j.elecom.2015.10.023
Kuznetsov Yu.I. Organic Inhibitors of Corrosion of Metals. New York: Plenum Press, 1996. 283 p.
Кузнецов Ю.И. // Коррозия: материалы, защита. 2017. № 1. С. 1.
Семилетов А.М., Кузнецов Ю.И., Чиркунов А.А. // Коррозия: материалы, защита. 2016. № 7. С. 25.
Олейник С.В., Руднев В.C., Кузенков Ю.А. и др. // Там же. 2015. № 10. С. 39.
Олейник С.В., Руднев В.C., Кузенков Ю.А. и др. // Там же. 2016. № 12. С. 29.
Агафонкина М.О., Андреева Н.П., Кузнецов Ю.И. и др. // Журн. физ. химии. 2017. Т. 91. № 8. С. 1294.
Calado L.M., Taryba M.G., Carmezim M.J. et al. // Corrosion Science. 2018. V. 142. P. 12–21. https://doi.org/10.1016/j.corsci.2018.06.013
Zhang L.J., Fan J.J., Zhang Z. et al. // Electrochimica Acta. 2007. V. 52. I. 17. P. 5325–5333. https://doi.org/10.1016/j.electacta.2006.12.083
Огородникова В.А., Кузнецов Ю.И., Андреева Н.П. // Коррозия: материалы, защита. 2018. № 5. С. 27.
Hansch C., Leo A. Correlation Analysis in Chemistry and Biology. New York: J. Wiley, 1981.
Scherrer R.A., Howard S.M. // Med. Chem. 1977. V. 20. P. 53.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии



