Журнал физической химии, 2020, T. 94, № 6, стр. 947-950
Взаимодействие натрия с диметилацетамидом как причина нестабильности в работе натрий-ионного аккумулятора
М. Д. Веденяпина a, *, Т. Л. Кулова b, **, Ю. О. Кудряшова b, c, ***, А. М. Скундин b, ****, О. Р. Малышев a, *****, Л. М. Глухов a, ******
a Российская академия наук, Институт органической химии им. Н.Д. Зелинского
Москва, Россия
b Российская академия наук, Институт физической химии и электрохимии им. А.Н. Фрумкина
Москва, Россия
c Национальный исследовательский университет “МЭИ”
Москва, Россия
* E-mail: mvedenyapina@yandex.ru
** E-mail: tkulova@mail.ru
*** E-mail: yulia.kudryashova@mail.ru
**** E-mail: askundin@mail.ru
***** E-mail: enantiomers69@gmail.com
****** E-mail: elektron77@mail.ru
Поступила в редакцию 05.07.2019
После доработки 05.07.2019
Принята к публикации 03.09.2019
Аннотация
Присутствие диметилацетамида (ДМАА) в составе электролитов натрий-ионного аккумулятора разрушает пассивную пленку на электродах и приводит к протеканию ряда реакций, не связанных с электрохимическим процессом, что нужно учитывать при создании таких аккумуляторов. Введение ДМАА в состав электролита аккумулятора сильно увеличивает проводимость полимерной мембраны, разделяющей катодное и анодное пространство, но при этом установлено, что в присутствии металлического натрия безводный ДМАА подвергается самоконденсации по схеме конденсации Кляйзена с протеканием последующих реакций. Для объяснения причин электрохимической нестабильности растворов перхлората натрия в смешанных растворителях, содержащих ДМАА, проведены измерения методом ИК-спектроскопии.
В работе [1] при исследовании возможности создания низкотемпературных аккумуляторов с отрицательным электродом из металлического натрия и с электролитом на основе модифицированной мембраны “нафион” оценена электрохимическая стабильность растворов перхлората натрия в смешанных органических растворителях. Исследованы растворы в бинарных смесях этиленкарбонат (ЭК)−диметилацетамид (ДМАА), ЭК–пропиленкарбонат (ПК) и ЭК–тетрагидрофуран (ТГФ), трехкомпонентных смесях ЭК–диэтилкарбонат (ДЭК)–ДМАА и ПК–ДМАА–ТГФ и в четырехкомпонентной смеси ЭК–ПК–ТГФ–ДМАА. Интерес к смесям, содержащим ДМАА, обусловлен тем обстоятельством, что еще ранее было установлено, что растворы солей натрия в таких смесях характеризуются повышенной электропроводностью [2]. Кроме того, в литературе были сообщения о том, что добавки ДМАА в стандартный электролит литий-ионного аккумулятора – раствор LiPF6 в смеси ЭК–ДЭК–диметилкарбонат оказывает стабилизирующее действие при повышенных температурах [3]. Однако в [1] было обнаружено, что все растворы, содержащие ДМАА, обладают пониженной электрохимической стабильностью и окисляются при относительно невысоких анодных потенциалах.
Сделано предположение, что компонентом, подвергающимся электроокислению, является ДМАА. Отмечено также, что склонность ДМАА к электроокислению зависит от качественного состава смеси, и наиболее устойчивым является раствор в четырехкомпонентном растворителе. Кроме того, при исследовании растворов перхлората натрия в смешанных растворителях было отмечено еще одно явление. При погружении металлического натрия в раствор NaClO4 в смеси ПК–ДМАА–ТГФ начиналось изменение окраски раствора: он становился красным, затем красно-бурым и интенсивность окраски со временем увеличивалась. При этом возрастала вязкость раствора, пока он не осмолялся до полного затвердевания.
При взаимодействии натрия с другими ДМАА-содержащими растворами наблюдались такие же явления, но с гораздо меньшими скоростями. Высказано предположение о комплексообразовании при взаимодействии натрия с ДМАА [4–6]. Более интенсивное взаимодействие натрия с раствором NaClO4 в смеси ПК–ДМАА–ТГФ по сравнению с другими растворами объяснялось тем обстоятельством, что во всех остальных растворах присутствовал этиленкарбонат. Известно, что при контакте натрия (так же, как и лития) с растворами солей в алкилкарбонатах на его поверхности мгновенно образуется пассивная пленка, получившая название sold electrolyte interphase (SEI). Эта пленка обладает проводимостью по ионам щелочного металла, и ее свойства зависят от природы алкилкарбоната. (Именно воздействием ДМАА на такую пленку авторы [3] объясняют стабилизирующий эффект). Вероятно, в растворах, содержащих ЭК, образуется тонкая, плотная и практически беспористая (бездефектная) пленка. Довольно быстро она прекращает (или кардинально тормозит) доступ растворителя к поверхности натрия. В растворах, содержащих только ПК, образуется рыхлая пористая SEI, не защищающая поверхность натрия от взаимодействия с раствором. Настоящая работа посвящена более подробному изучению взаимодействия металлического натрия с ДМАА.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для исследования взаимодействия натрия (Sigma-Aldrich) c ДМАА (Sigma-Aldrich, anhydrous, 99.8%) и идентификации продуктов этого взаимодействия образцы натрия массой около 1 г помещали в герметичную емкость с чистым ДМАА и выдерживали в течение определенного времени. Все эти операции проводили в перчаточном боксе (ЗАО “Спектроскопические системы”, Россия) с контролируемой атмосферой аргона. Содержание кислорода и паров воды в боксе не превышало 10 ppm. После взаимодействия натрия с ДМАА непрореагировавшие остатки натрия извлекали из жидкости, помещали ее в герметичный сосуд и направляли на исследования методами ИК-спектроскопии. ИК-спектры НПВО (ATR) образцов измеряли на ИК-Фурье-спектрометре NicoletiS50 (встроенная приставка НПВО, кристалл – алмаз) с разрешением 4 см–1 и количеством сканирований 32.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Сразу после контакта натрия с ДМАА (первоначально ДМАА был бесцветный) цвет растворителя начинал меняться и спустя 1 ч ДМАА приобрел желто-коричневую окраску. Увеличение времени взаимодействия натрия с ДММА приводило к изменению окраски вплоть до коричневого цвета.
На рис. 1 приведены ИК-спектры, снятые в чистом ДМАА (рис. 1а) и в ДМАА после контакта с металлическим натрием в течение 1 ч (рис. 1б).
Рис. 1.
ИК-спектры НПВО (ATR) N,N-диметилацетамида (а) и N,N-диметилацетамида после контакта с металлическим натрием (б).

Полоса 3528 cм–1 может быть отнесена к валентным колебаниям ОН-групп молекул воды комплекса ДMАA·H2O. В спектре чистого ДМАА эта полоса очень слабая, а после контакта с металлическим натрием исчезает вовсе. Полосы в области от 3010 до 2820 см–1 относятся к валентным асимметричным и симметричным колебаниям С–Н-связей в (С)СН3- и N(CH3)-группах. Видно, что после контакта ДМАА с натрием в спектре образца в этой области появляются новые полосы, однозначное отнесение которых проблематично. Особенно сильно изменяется участок ИК-спектра в области от 1632 до 470 см–1, что свидетельствует об интенсивном образовании новых соединений. Можно предполагать, что в присутствии металлического натрия ДМАА подвергается самоконденсации по схеме конденсации Кляйзена [7–10]:
Продукты такой конденсации сами по себе довольно реакционноспособны и могут участвовать в дальнейших превращениях, что и объясняет значительное усложнение ИК-спектров.
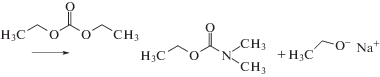
В системах, содержащих алкиленкарбонаты или алкилкарбонаты, возможна аналогичная конденсация ДМАА с этиленкарбонатом или с пропиленкарбонатом:
На основании изменения ИК-спектров ДМАА при его контакте с металлическим натрием сделан вывод о возможном протекании его самоконденсации по схеме конденсации Кляйзена с возможным протеканием последующих реакций.
Работа выполнена при финансовой поддержке Министерства науки и высшего образования РФ.
Список литературы
Kulova T.L., Skundin A.M., Chekannikov A. et al. // Batteries. 2018. V. 4. Article № 61. https://doi.org/10.3390/batteries4040061
Voropaeva D.Y., Novikova S.A., Kulova T.L. et al. // Solid State Ionics. 2018. V. 324. P. 28.
Xu M., Hao L., Liu Y. et al. // J. Phys. Chem. C. 2011. V. 115. P. 6085.
Roux B., Karplus M. // J. Phys. Chem. 1991. V. 95. P. 4856.
Roux B., Karplus M. // J. Am. Chem. Soc. 1993. V. 115. P. 3250.
Klassen J.S., Anderson S.G., Blades A.T. et al. // J. Phys. Chem. 1996. V. 100. P. 14218.
Tundo P., Musolino M., Aricò F. // Green Chem. 2017. https://doi.org/10.1039/C7GC01764B
Babudri F., Ciminale F., Nunno L. et al. // Tetrahedron. 1982. V. 38. P. 557.
Babudri F., Nunno L., Florio S. // J. Heteroc. Chem. 1981. V. 18. P.1273.
Hoffmann R.V., Huizenga D.J. // J. Organ. Chem. 1991. V. 56. P. 6435.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии