Журнал физической химии, 2021, T. 95, № 10, стр. 1585-1590
Кинетика сорбции катионов кадмия и кобальта сорбентом на основе фосфата титана
М. В. Маслова a, *, П. Е. Евстропова a
a Российская академия наук, ФИЦ КНЦ Институт химии и технологии редких элементов и минерального
сырья им. И.В. Тананаева
Мурманская область, Апатиты, Россия
* E-mail: maslova@chemy.kolasc.net.ru
Поступила в редакцию 09.02.2021
После доработки 09.02.2021
Принята к публикации 14.02.2021
Аннотация
Исследованы закономерности кинетики сорбции ионов кадмия и кобальта из модельных растворов на неорганическом сорбенте на основе фосфата титана в зависимости от температуры раствора. Получены экспериментальные зависимости для описания кинетики ионного обмена, которые отражают три разновидности механизмов обмена: обмен на их поверхности, диффузия ионов в объем сорбента и гетерогенная ионообменная реакция с образованием новой фазы. Определены значения коэффициентов внутренней диффузии, константы скорости ионного обмена и кажущиеся энергии активации для внешней и внутренней диффузии. Для объяснения различия скоростей реакции адсорбции для кадмия и кобальта оценены эффективный радиус и степень дегидратации адсорбированных ионов.
В связи с быстрым развитием таких отраслей, как производство металлических покрытий, предприятия цветной металлургии, электронная промышленность, химические заводы и предприятия по производству аккумуляторов и т.д., сточные воды тяжелых металлов все чаще напрямую или после разведения сбрасываются в окружающую среду, создавая серьезные проблемы для почв и водных ресурсов. В отличие от органических загрязнителей, тяжелые металлы не поддаются биологическому разложению и имеют тенденцию накапливаться в организме человека посредством пищевой цепи. Многие ионы тяжелых металлов, как известно, токсичны или канцерогенны [1]. Очистка сточных вод и питьевой воды от катионов тяжелых металлов – одна из важнейших задач прикладной химии. Для удаления загрязняющих веществ из водных сред используются различные методы и процессы очистки, такие как осаждение, коагуляция, химическое окисление, фотокатализ, ионный обмен, адсорбция и т.д., но выбор методов очистки основан на концентрации загрязняющих веществ, а также экологической и экономической целесообразности обработки [2].
Ионообменный процесс – экологически безопасный метод, поскольку не требует дополнительных реагентов, что снижает возможность образования вторичных загрязнений. С точки зрения экономической привлекательности, простота получения сорбента и его низкая стоимость играют важную роль.
Ранее в Институте химии КНЦ РАН разработан метод синтеза фосфата титана (ФТ) из кристаллического титансодержащего прекурсора сульфата титанила и аммония – (NH4)2TiO(SO4)2 ⋅ ⋅ 2H2O. В отличие от существующих методов синтеза, основанных на осаждении из титансодержащих растворов, взаимодействие кристаллической соли титана с фосфорной кислотой обеспечивает получение фосфата титана состава TiO(OH)H2PO4 ⋅ 2H2O в одну стадию. Простота синтеза ФТ, доступность и невысокая стоимость прекурсора, который является полупродуктом переработки практически любого титансодержащего сырья, предопределяют перспективность его использования в качестве ионообменного материала. При реализации ионообменных процессов на практике необходимо учитывать кинетические свойства сорбента, определяющие возможность селективного поглощения сорбтива за время контакта с сорбентом. Знание скоростьопределяющей стадии дает важную информацию для проектирования и выбора оптимальных условий организации полномасштабного процесса сорбции.
Цель данной работы – изучение кинетики сорбции ионов кобальта и кадмия из водных растворов новым фосфатом титана. Для оценки сорбционных свойств ФТ было важно сравнить кинетику сорбции ионов с различными ионными радиусами и гидролитическим поведением для понимания роли эффектов гидратации ионов в специфичности сорбции.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для работы использовали солевую форму фосфата титана. С этой целью ФТ превращали в натриевую форму путем обработки 0.1 М раствором карбоната натрия в течение 24 ч. Полученный Na-замещенный TiO(OH)H2PO4 ⋅ 2H2O использовали после промывки водой и сушки при 60°C.
Кинетику сорбции катионов свинца и цинка изучали при 25, 45 и 65°С методом ограниченного объема из водных растворов солей нитратов металлов. Концентрация металла в растворе составляла ~10–2 моль л–1, объем раствора, контактирующего с сорбентом – 40 мл, навеска сорбента – 0.2 г. Сорбцию проводили при рН 6.5, исходные растворы термостатировали при заданной температуре с точностью ±1 К в течение 40 мин, затем вводили сорбент. Процесс сорбции вели при интенсивном перемешивании, скорость вращения мешалки составляла 300 об мин–1. Методом отдельных навесок через определенные интервалы времени устанавливали характер изменения концентрации раствора, находящегося в контакте с сорбентом до установления равновесия. Концентрацию сорбата во всех точках объема раствора и непосредственно у поверхности сорбента при данных скоростях считали постоянной, т.е. рассматривали диффузию из хорошо перемешиваемого раствора.
Сорбционную емкость сорбента (q, ммоль г–1) рассчитывали по формуле:
где Сисх и Сравн – исходная и равновесная концентрации металла в растворе, ммоль л–1; V – объем раствора, мл; m – навеска сорбента, г.Степень достижения равновесия в системе F рассчитывали как
где Сt – количество сорбированного вещества в момент времени t, ммоль г–1; Сe – количество сорбированного вещества в состоянии равновесия, ммоль г–1.Концентрацию металлов в фильтрате после проведения сорбционных экспериментов определяли методом атомно-адсорбционной спектрометрии на спектрометре AAS 300 Perkin-Elmer. Для определения среднего размера частиц сорбента проводили ситовой анализ, для работы использовали фракцию сорбента с размером частиц 1 мм.
Для моделирования кинетики сорбции катионов кобальта и кадмия на ФТ использовали диффузионные модели Бойда [3], модели псевдопервого порядка Лагергрена [4], псевдовторого порядка Хо и Маккея [5], модель Еловича [6].
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Как показали данные химического анализа Na-замещенного фосфата титана, продукт содержит 38.2% TiO2 и 33.8% P2O5, что соответствует молярному соотношению TiO2 : P2O5 = 1 : 0.5. Содержания TiO2 и P2O5, рассчитанные на формулу TiO(OH)H2PO4 ⋅ 2H2O, составляют 37.4 и 33.2% соответственно, что подтверждает состав синтезированного фосфата титана. Удельная поверхность образца составляет 127.9 м2 г–1, общий объем пор 0.26 см3 г–1 и средний диаметр пор 7.2 нм. Согласно кривой распределения пор по размерам, полученное соединение можно отнести к мезопористым материалам.
Кинетические кривые процесса сорбции исследуемых катионов в зависимости от температуры представлены на рис. 1. Ход кинетических кривых свидетельствует о нескольких периодах сорбции. Согласно полученным результатам, наиболее интенсивно сорбция протекает в начальный момент времени, далее скорость сорбции замедляется. Влияние температуры на извлечение кадмия и кобальта указывает на наличие затруднений, которые связаны с лимитированием диффузии катиона в порах сорбента. Кинетические кривые сорбции при малых временах контакта фаз представляют собой прямые, а затем искривляются. Согласно данным [7], это свидетельствует о том, что и диффузия ионов через пленку раствора, и диффузия в зерне сорбента вносят свой вклад в общую скорость процесса.
Рис. 1.
Кинетика сорбции катионов Cd2+ и Co2+ на фосфате титана при различных температурах внешнего раствора. Концентрация Cd2+ – 9 ммоль/л, Co2+ – 10 ммоль/л.
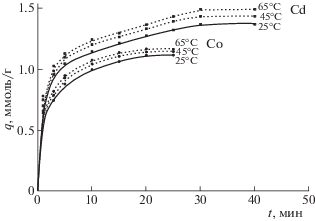
Равновесие в системе достигается за 20–30 мин в зависимости от температуры раствора. Кинетика катионов кадмия более медленная, равновесие достигается за 30 мин при всех выбранных температурах процесса, что обусловлено крупным размером катиона и маленькой гидратной оболочкой, но сорбционная емкость по катиону кадмия выше, чем по кобальту.
Максимальная ионообменная емкость Еmax, рассчитанная на основе изотерм сорбции, составляет 1.12 ммоль г–1 для Со2+ и 1.38 ммоль г–1 для Cd2+. Различие сорбционной емкости ионов кобальта и кадмия объясняется различием размеров их гидратных оболочек. Кристаллический ионный радиус Cd2+ (99 pm) больше, чем Co2+ (78 pm), поэтому радиус гидратной оболочки Cd2+ будет меньше, чем у Co2+. По величине удельной поверхности и предельной сорбции катиона стронция оценивали посадочную площадку S и радиус R сорбированного катиона:
где Sуд – удельная поверхность сорбента, м2 г–1; Emax – максимальная сорбционная емкость по катиону стронция, ммоль г–1; NA – число Авогадро, моль–1.Эффективный радиус адсорбированного иона rsorb рассчитывали следующим образом:
Радиус Стокса рассчитывали по уравнению: где z – заряд иона металла, F – постоянная Фарадея, η – вязкость воды при 25°C, λ° – эквивалентная проводимость иона в бесконечно (предельно) разбавленном водном растворе при 25°C.Расчетные значения радиуса Стокса для Cd2+ и Co2+ при 25°C составляют 304 и 340 pm, а эффективные радиусы адсорбированных ионов – 191 и 213 pm соответственно. Больший эффективный радиус сорбированного иона Co2+ обусловливает меньшую сорбционную емкость по сравнению с ионом Cd2+ за счет того, что ион занимает большую посадочную площадку. Эффективные радиусы сорбированных ионов меньше их радиусов Стокса и больше кристаллохимических радиусов. Очевидно, что сорбция ионов сопровождается частичным обезвоживанием их гидратных оболочек. Степень дегидратации $\alpha $ адсорбированных ионов оценивали следующим образом:
(6)
$\alpha ,{\text{\% }} = \frac{{4{\text{/}}3\pi (r_{{{\text{aq}}}}^{3} - ~r_{{\text{s}}}^{3})}}{{4{\text{/}}3\pi (r_{{{\text{aq}}}}^{3} - ~r_{{{\text{cr}}}}^{3})}} = \frac{{r_{{{\text{aq}}}}^{3} - r_{{\text{s}}}^{3}}}{{r_{{{\text{aq}}}}^{3} - r_{{{\text{cr}}}}^{3}}},$Повышение температуры приводит к увеличению дегидратации, что, в свою очередь, увеличивает диффузию ионов и облегчает их адсорбцию на поверхности фосфата титана (рис. 1).
Для выяснения механизма взаимодействия катионов металлов с фосфатом титана использовали диффузионные модели Бойда. Установлено, что для экспериментальных данных, соответствующих сорбции в течение первых 5 мин, зависимость, построенная в координатах –ln(1 – F) от t, линейна (рис. 2). Высокие значения коэффициента корреляции R2 (0.996–0.998) указывают на то, что диффузия в пленке влияет на скорость процесса в начальный период времени, поскольку при F > 0.7 наблюдается отклонение от линейности.
Рис. 2.
Анализ кинетических кривых сорбции кадмия (a) и кобальта (б) в координатах уравнения пленочной диффузии.

Константа скорости по модели внешней диффузии k может быть определена по наклону линейной зависимости (табл. 1).
Таблица 1.
Кинетические параметры пленочной диффузионной модели сорбции Сd2+ и Co2+ на фосфате титана при различных температурах
| Параметр | Cd2+ | Co2+ | ||||
|---|---|---|---|---|---|---|
| Т, °С | 25 | 45 | 65 | 25 | 45 | 65 |
| k, мин–1 | 0.179 | 0.183 | 0.188 | 0.168 | 0.173 | 0.176 |
| R2 | 0.996 | 0.999 | 0.999 | 0.997 | 0.999 | 0.997 |
| Ea, кДж моль–1 | 1.29 | 1.35 | ||||
Зависимость константы скорости от температуры описывается уравнением Аррениуса [8]:
и в логарифмической форме: где Eа – энергия активации, R – универсальная газовая постоянная, Т – абсолютная температура, А – аррениусовский предэкспоненциальный множитель (постоянная).Рассчитанные константы скорости и значения энергии активации стадии внешней диффузии приведены в табл. 1. Из полученных результатов можно сделать вывод, что повышение температуры раствора приводит к увеличению скорости внешней диффузии. Более гидратированная оболочка кобальта вызывает большие стерические помехи, что подтверждается более медленной скоростью внешней диффузии для Co2+ по сравнению с Cd2+. Повышение температуры сопровождается обезвоживанием гидратной оболочки, что, в свою очередь, уменьшает стерическое и электростатическое взаимодействие между ионами и упрощает их сорбцию на поверхности фосфата титана. Увеличение скорости сорбции с температурой подтверждает, что радиус иона и размер его гидратной оболочки влияют на процесс сорбции.
Для описания кинетики сорбции с учетом внутридиффузионного механизма использована модель гелевой диффузии Бойда. Следуя этой модели, зависимость Bt от времени t [5] должна представлять прямую линию, которая проходит через начало координат. Коэффициент Бойда B может быть определен по наклону линии, а эффективный коэффициент диффузии Di может быть вычислен согласно уравнению:
где r – средний радиус частиц сорбента, м. Внешняя диффузия для исследуемых катионов происходит в течение первых 5 мин, поэтому принимается, что стадия внутренней диффузии длится все остальное время. Полученные в виде прямых линий графики не пересекают начало координат (рис. 3). Отсутствие такого пересечения свидетельствует о том, что диффузия в порах частиц сорбента не единственная лимитирующая скорость стадия. Не исключено, что химические реакции также могут влиять на скорость сорбции, контролируя кинетику взаимодействия сорбат–сорбент. Рассчитанные кинетические коэффициенты внутренней диффузии B и эффективные коэффициенты диффузии Di, характеризующие диффузионный транспорт растворенного вещества в порах сорбционной системы, приведены в табл. 2. Отсутствие пересечения линейной зависимости Bt от t с началом координат может быть связано с влиянием внешнедиффузионных процессов и вносить некоторую ошибку в оценку Di.Рис. 3.
Анализ кинетических кривых сорбции кадмия (a) и кобальта (б) в координатах уравнения гелевой диффузии Бойда.

Таблица 2.
Кинетические параметры гелевой диффузионной модели Бойда сорбции Сd2+ и Co2+ на фосфате титана при различных температурах
| Параметры | Cd2+ | Co2+ | ||||
|---|---|---|---|---|---|---|
| Т, °С | 25 | 45 | 65 | 25 | 45 | 65 |
| Di × 10–10, м2 с–1 | 1.72 | 1.97 | 2.17 | 3.82 | 4.89 | 6.66 |
| B, мин–1 | 0.104 | 0.117 | 0.129 | 0.227 | 0.291 | 0.396 |
| R2 | 0.998 | 0.998 | 0.999 | 0.989 | 0.997 | 0.998 |
| Ea, кДж моль–1 | 1.34 | 1.43 | ||||
Для оценки затруднений массопереноса ионов в порах рассчитаны значения коэффициента самодиффузии ионов Cd2+ и Co2+ в воде при 25°С по формуле [9]:
где R – газовая постоянная, T – температура, K; λ – предельная электропроводность растворенного вещества, F – число Фарадея, z – заряд иона.Рассчитанные коэффициенты самодиффузии для ионов кадмия и кобальта составляют 7.15 × × 10–10 и 7.19 × 10–10 м2 с–1 соответственно. Найденные нами приближенные значения Di свидетельствуют о незначительном диффузионном сопротивлении при сорбции исследуемых ионов, что обусловлено мезопористой структурой сорбента. Причинами торможения диффузии на стадии массопереноса в порах могут быть затруднения в подвижности электростатического или стерического характера, вызванные взаимодействием как ионов сорбата между собой или с ионами десорбируемого катиона, так и с поверхностью сорбента.
С использованием эффективных коэффициентов диффузии рассчитаны значения энергии активации сорбционного процесса по уравнению, аналогичному уравнению Аррениуса [4]:
где Еа – энергия активации, кДж моль–1; D – постоянная, м2 с–1; R – газовая постоянная, Дж моль–1; T – температура, K. Рассчитанные значения энергии активации Ea для Cd2+ и Co2+ характерны для диффузии ионов в порах сорбента [10].Для того, чтобы определить вклад химического взаимодействия в общую скорость процесса, были применены модели реакций псевдопервого, псевдовторого порядка и модель Еловича. Уравнение псевдопервого порядка правильно описывает сорбционные характеристики, если существенное влияние оказывает диффузия в пленке. Уравнение псевдовторого порядка позволяет учитывать взаимодействия сорбат–сорбент, а также межмолекулярные взаимодействия адсорбированных частиц. Модель Еловича рассматривает процесс адсорбции на энергетически неоднородной поверхности и то, как сорбция и десорбция влияют на кинетику поглощения растворенного вещества. Следует отметить, что десорбционные процессы оказывают значительное влияние при приближении к равновесию. Поскольку синтезированный фосфат титана обладает неоднородной пористой структурой, указанная модель может адекватно оценивать процесс адсорбции на гетерогенной поверхности сорбента.
Результаты анализа выбранных моделей приведены в табл. 3. Очевидно, что для модели псевдопервого порядка значения сорбционной емкости qe, найденные из уравнения зависимости lg(qe – – qt) от t, отличаются от определенных из эксперимента qexp. На основании этого можно сделать заключение, что реакция псевдопервого порядка не является адекватной для описания изучаемого процесса.
Таблица 3.
Кинетические параметры сорбции катионов Cd2+ и Co2+ на фосфате титана в зависимости от температуры внешнего раствора
| Модель | Параметры | Cd2+ | Co2+ | ||||
|---|---|---|---|---|---|---|---|
| 298 K | 318 K | 338 K | 298 K | 318 K | 338 K | ||
| Псевдо- первого порядка |
qexp, ммоль г–1 | 1.28 | 1.44 | 1.50 | 1.12 | 1.15 | 1.17 |
| k1, мин–1 | 0.0345 | 0.0483 | 0.0509 | 0.0698 | 0.0873 | 0.0919 | |
| qcal, ммоль г–1 | 3.91 | 3.95 | 3.96 | 1.75 | 1.79 | 1.83 | |
| R2 | 0.959 | 0.879 | 0.795 | 0.986 | 0.878 | 0.898 | |
| Псевдо- второго порядка |
k2, г ммоль–1 мин–1 | 0.402 | 0.408 | 0.411 | 0.606 | 0.611 | 0.638 |
| qe, ммоль г–1 | 1.32 | 1.48 | 1.53 | 1.15 | 1.21 | 1.23 | |
| R2 | 0.999 | 0.996 | 0.995 | 0.998 | 0.998 | 0.998 | |
| Еловича | α, ммоль г–1 мин–1 | 18.567 | 19.590 | 20.491 | 16.493 | 17.548 | 20.189 |
| β, ммоль мг–1 | 5.273 | 5.100 | 5.000 | 5.994 | 5.841 | 5.692 | |
| R2 | 0.992 | 0.995 | 0.991 | 0.978 | 0.983 | 0.981 | |
Модель псевдовторого порядка адекватно описывает кинетику сорбции исследуемых ионов металлов. Все коэффициенты регрессии R2 > 0.99. Рассчитанные по этой модели значения сорбционной емкости очень хорошо согласуются с экспериментальными данными.
Для модели Еловича R2 составляет более 0.97, что подтверждает применимость этой модели. Константы скорости сорбции в 4–5 раз выше, чем константы десорбции. С повышением температуры скорость сорбции увеличивается, а десорбции – уменьшается, что в целом, находится в согласии с экспериментальными данными для внутренней диффузии и кинетической модели реакции псевдовторого порядка. Таким образом, стадия химического взаимодействия ионов кадмия и кобальта также вносит вклад в общую скорость процесса. Разделить же вклад диффузии и химической стадии на основании применения формальных кинетических уравнений достаточно сложно.
Из проанализированных кинетических данных следует, что механизм сорбции катионов тяжелых металлов на ФТ имеет сложный характер, при этом влияние может оказывать как структура сорбента, так и взаимодействие в системе сорбент–сорбат. Синтезированный продукт обладает высокой сорбционной емкостью по отношению к катионам Cd2+ и Co2+, а благодаря мезопористой структуре обеспечивается высокая скорость массопереноса. Равновесие в системе раствор–сорбент устанавливается достаточно быстро, в течение 20–30 мин. В начальный период времени (5 мин) общая скорость контролируется диффузией в пленке. После заполнения сорбента сорбатом на 70% внутренняя диффузия в порах является лимитирующей стадией. На начальной стадии сорбции увеличение потока ионов через пленку происходит за счет высокой концентрации растворенного вещества. Это приводит к уменьшению константы скорости внешней диффузии, вызванной стерическими или электростатическими препятствиями для адсорбции гидратированных ионов. Энергия активации вследствие потери воды в гидратной оболочке ионов металлов увеличивается. Значения эффективных коэффициентов диффузии достаточно высоки ((1–7) × 10–10 м2 с–1), что свидетельствует о незначительном диффузионном сопротивлении при сорбции исследуемых ионов и обусловлено мезопористой структурой сорбента. В скорость сорбционного процесса вносят вклад как диффузионное лимитирование (внутри- и внешнедиффузионное), так и скорость химической стадии адсорбции. Полученные результаты показывают, что на кинетику сорбции влияют и взаимодействие сорбат–сорбент, и взаимодействие сорбат–сорбат.
Исследования выполнены при финансовой поддержке Российского научного фонда в рамках научного проекта № 17-19-01522 П.
Список литературы
Lauwerys R., Lison D. // Sci. Total Environ. 1994. V. 150. P. 1.
Muya F.N., Sunday C.E. et al. // Water Sci. Technol. 2016. V. 73. P. 983.
Viegas R.M.C., Campinas M. et al. // Adsorption 2014. V. 20.
Ho Y.S., Ng J.C.Y. et al. // Sep. Purif. Rev. 2000. V. 29. P. 189.
Douven S., Paez C.A. et al. // J. Colloid Interface Sci. 2015. V. 448. P. 437.
Kołodyńska D., Gęca M. et al. // Nanoscale Research Letters. 2018. V. 13. P. 1.
Blachnio M., Budnyak T. et al. // Langmuir. 2018. V. 34. № 6. P.2258.
Moon B., Jun N. et al. // Polymers. 2019. V. 11. P. 136.
Элькинд К.М., Трунова И.Г. // Труды Нижегородского государственного технического университета им. Р.Е. Алексеева. 2013. № 4 (97). С. 272.
Harris S. // J. Phys. A. Math. Gen. 1977. V. 10. P. 1905.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии


