Журнал физической химии, 2021, T. 95, № 11, стр. 1696-1704
Взаимодействие урацила с L-гистидином в водном буферном растворе в интервале температур 288.15–313.15 К
a Российская академия наук, Институт химии растворов им. Г.А. Крестова
153045 Иваново, Россия
* E-mail: tey@isc-ras.ru
Поступила в редакцию 31.03.2021
После доработки 31.03.2021
Принята к публикации 26.04.2021
Аннотация
Методами денсиметрии и дифференциальной сканирующей калориметрии изучены взаимодействия урацила (Ura) с гетероциклической аминокислотой, L-гистидином (His), в водном буферном растворе (рН 7.4). Получены экспериментальные значения плотности и удельной теплоемкости урацила в буферном растворе в присутствии и отсутствии аминокислоты в интервале температур (288.15–313.15) К. Концентрация Ura изменялась от 0.004 до 0.032 моль кг–1 при постоянной концентрации His (0.0125 моль кг–1). Определены кажущиеся молярные параметры урацила (φVUra, ϕCp) в буферном растворе и в буферном растворе, содержащем аминокислоту. Показано, что взаимодействие His с Ura сопровождается образованием между ними молекулярного комплекса. Выявлено, что парциальные молярные свойства переноса ($^{\varphi }V_{{{\text{Ura}}}}^{^\circ }$, $^{\phi }C_{p}^{^\circ }$) урацила из буфера в буферный раствор аминокислоты имеют положительные значения в изученном интервале температур. Полученные результаты обсуждаются на основе использования модели Гэрни.
Взаимодействия между лекарственными средствами, в состав которых входят гетероциклические соединения, и макромолекулярными белками имеют важное значение в многокомпонентных физиологических средах, таких как кровь, клеточные мембраны, внутри- и межклеточные флюиды и т.д. Изучение механизмов и движущих сил образования между ними комплексов, лежащих в основе молекулярных процессов транспортировки лекарств, доставки их к клеткам-мишеням, относится к приоритетным задачам химии, биологии и фармакологии. Необходимым этапом является исследование физико-химических свойств модельных соединений биомакромолекул в водных растворах прежде, чем приступать к исследованию более сложных систем. Основания нуклеиновых кислот и их производные могут использоваться в качестве противоопухолевых, антибактериальных и противовирусных препаратов [1, 2]. Урацил является структурным элементом широкого круга биологически значимых молекул (РНК, пиримидин, птеридин, фолиевая кислота, флавин и др.). Молекулы урацила содержат донорные и акцепторные группы, способные к образованию водородной связи [3–5].
До сих пор актуальны исследования поведения аминокислот, молекулы которых содержат полярную боковую цепь [6–10]. К их числу относится гетероциклическая аминокислота L-гистидин, характеризующаяся наличием имидазольной функциональной группы, которая может служить как донором, так и акцептором образования водородных связей, и проявлять свойства как кислоты, так и основания в зависимости от диапазона pH. Гистидиновые остатки идентифицируются как активные сайты для ~50% всех белковых ферментов [11, 12]. Данная аминокислота является предшественником в биосинтезе гистамина, способствует росту и восстановлению тканей. Гистидин – составная часть многих витаминных комплексов; он используется при лечении глазных заболеваний, ревматоидных артритов, аллергий, язв и анемии [13].
Исследования водных растворов белков, нуклеиновых кислот и их производных в присутствии различных добавок (электролитов, органических растворителей, ПАВ и др.) проводятся разными методами [14–17]. Кислотно-основные свойства нуклеиновых оснований и аминокислот влияют на стабильность образуемых ими комплексов и конъюгатов [2, 16, 18–20]. Однако до сих пор недостаточно изучены взаимодействия указанных соединений в условиях физиологических значений рН среды при различных температурах.
Ранее [21] методами калориметрии растворения и УФ-спектроскопии было показано образование молекулярного комплекса между L-гистидином и Ura в водном буферном растворе. Как известно, такие термодинамические свойства, как объем и теплоемкость, чувствительны к структурным изменениям в растворах, происходящих на молекулярном уровне [22, 23]. Задачей настоящего исследования является использование методов денсиметрии и дифференциальной сканирующей калориметрии для выявления особенностей межмолекулярных взаимодействий His с Ura в водном фосфатном буферном растворе (рН 7.4) в широком интервале температур и концентраций. В литературе отсутствуют данные по плотности и теплоемкости системы L-гистидин–урацил–буфер.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали L-гистидин (Sigma-Aldrich, Japan, CAS 63-91-2) и урацил (Sigma, CAS 66-22-8). Содержание основного вещества составляло >99%. Аминокислоту сушили в вакуумном шкафу при 343 К, а Urа – при 410.15 К в течение 48 ч непосредственно перед использованием. Исследования проводили в водных буферных растворах (рН 7.4), содержащих NaH2PO4 и Na2HPO4, что приближает среду к условиям реальных биологических систем. Значения рН растворов фиксировали цифровым рН-метром Mettler Toledo, модель Five-Easy. Все растворы приготовлены весовым методом, используя весы Sartorius-ME215S (с точностью взвешивания 1 × × 10–5 г). Концентрацию урацила варьировали в пределах (0.0041–0.0324) моль кг–1 при фиксированной концентрации аминокислоты (0.0125 ± ± 0.0002 моль кг–1). Низкие концентрации Ura использовались в связи с его низкой растворимостью [19].
Измерения плотности исследуемых растворов выполнены на цифровом вибрационном денсиметре (model DMA-5000M, Anton Paar, Австрия) при температурах (288.15, 298.15, 303.15, 308.15 и 313.15) K. Два встроенных платиновых термометра Pt100 в сочетании с элементами Пельтье обеспечивали термостатирование образца внутри ячейки с погрешностью 5 × 10–3 К. Стандартная погрешность измерения плотности исследуемых растворов не превышала 0.00005 г см–3.
Для измерения удельной теплоемкости (cp) смесей Ura-буфер и Ura-His-буфер использовали дифференциальный сканирующий микрокалориметр SCAL-1 (“Биоприбор”, Пущино, Россия), оснащенный термоэлементами Пельтье, двумя измерительными стеклянными ячейками с внутренним объемом 0.377 см3, а также компьютерным терминалом и программным обеспечением для вычисления удельной теплоемкости. Интегральная чувствительность детектора калориметра составляет 33.218 нВт/мВ, калибровочная мощность – 25 мкВт, скорость сканирования – 1 К/мин, постоянная времени – 20 с. Прибор, детальное описание которого приведено в [24], был ранее протестирован по теплоемкости водных растворов хлорида натрия, рекомендованного в качестве стандарта для сканирующей калориметрии растворов [25]. Стандартная погрешность измерения удельной теплоемкости исследованных растворов находилась в пределах ±7 × 10–3 Дж К–1 г–1. Измерения удельной теплоемкости исследуемых растворов выполнены при температурах (288.15, 293.15, 298.15, 303.15, 308.15 и 313.15) K.
Полученные экспериментальные данные по плотности (ρ) и удельной теплоемкости (cp) исследуемых растворов приведены в табл. 1 и 2. Как видно из таблиц, значения ρ уменьшаются с температурой и возрастают с концентрацией Ura, в то время как температурные и концентрационные изменения значений cp носят противоположный характер.
Таблица 1.
Плотность (ρ) водных буферных растворов урацила (Ura) и водных буферных растворов, содержащих урацил и L-гистидин (His), при разных концентрациях и температурах
| m, моль кг–1 | 288.15 К | 298.15 K | 303.15 K | 308.15 K | 313.15 K |
|---|---|---|---|---|---|
| Система: Ura–буфер | |||||
| 0 | 1029.289 | 1026.562 | 1024.859 | 1023.023 | 1021.012 |
| 0.0040 | 1029.506 | 1026.767 | 1025.057 | 1023.215 | 1021.200 |
| 0.0070 | 1029.648 | 1026.912 | 1025.197 | 1023.353 | 1021.333 |
| 0.0099 | 1029.784 | 1027.040 | 1025.325 | 1023.475 | 1021.446 |
| 0.0126 | 1029.893 | 1027.148 | 1025.425 | 1023.579 | 1021.550 |
| 0.0150 | 1029.988 | 1027.242 | 1025.524 | 1023.672 | 1021.645 |
| 0.0201 | 1030.199 | 1027.434 | 1025.715 | 1023.861 | 1021.831 |
| 0.0250 | 1030.380 | 1027.626 | 1025.890 | 1024.025 | 1021.984 |
| 0.0300 | 1030.565 | 1027.799 | 1026.065 | 1024.194 | 1022.161 |
| Система: Ura–His–буфер | |||||
| 0 | 1029.829 | 1027.165 | 1025.529 | 1023.695 | 1021.643 |
| 0.0040 | 1030.035 | 1027.363 | 1025.719 | 1023.875 | 1021.814 |
| 0.0070 | 1030.177 | 1027.501 | 1025.857 | 1024.003 | 1021.938 |
| 0.0100 | 1030.300 | 1027.623 | 1025.976 | 1024.119 | 1022.055 |
| 0.0125 | 1030.394 | 1027.716 | 1026.067 | 1024.207 | 1022.144 |
| 0.0147 | 1030.484 | 1027.799 | 1026.147 | 1024.288 | 1022.223 |
| 0.0199 | 1030.674 | 1027.995 | 1026.341 | 1024.472 | 1022.405 |
| 0.0249 | 1030.875 | 1028.188 | 1026.532 | 1024.652 | 1022.573 |
| 0.0275 | 1031.026 | 1028.339 | 1026.658 | 1024.782 | 1022.688 |
| 0.0299 | 1031.230 | 1023.485 | 1026.805 | 1024.928 | 1022.822 |
Таблица 2.
Удельная теплоемкость (cp) водных буферных растворов урацила и водных буферных растворов, содержащих урацил и L-гистидин, при разных концентрациях и температурах
| m, моль кг–1 | 288.15 K | 293.15 K | 298.15 K | 303.15 K | 308.15 K | 313.15K |
|---|---|---|---|---|---|---|
| Система: Ura–буфер | ||||||
| 0 | 4.0159 | 4.0181 | 4.0215 | 4.0259 | 4.0306 | 4.0354 |
| 0.0040 | 4.0137 | 4.0156 | 4.0184 | 4.0225 | 4.0268 | 4.0311 |
| 0.0042 | 4.0136 | 4.0156 | 4.0183 | 4.0224 | 4.0267 | 4.0309 |
| 0.0071 | 4.0122 | 4.0138 | 4.0164 | 4.0201 | 4.0242 | 4.0281 |
| 0.0072 | 4.0121 | 4.0137 | 4.0163 | 4.0200 | 4.0241 | 4.0280 |
| 0.0098 | 4.0109 | 4.0125 | 4.0147 | 4.0181 | 4.0219 | 4.0256 |
| 0.0099 | 4.0108 | 4.0123 | 4.0147 | 4.0181 | 4.0219 | 4.0256 |
| 0.0162 | 4.0086 | 4.0098 | 4.0115 | 4.0147 | 4.0179 | 4.0216 |
| 0.0163 | 4.0085 | 4.0098 | 4.0114 | 4.0146 | 4.0178 | 4.0215 |
| 0.0205 | 4.0066 | 4.0077 | 4.0097 | 4.0122 | 4.0152 | 4.0184 |
| 0.0207 | 4.0065 | 4.0077 | 4.0093 | 4.0121 | 4.0151 | 4.0186 |
| 0.0312 | 4.0037 | 4.0046 | 4.0060 | 4.0078 | 4.0104 | 4.0127 |
| 0.0318 | 4.0035 | 4.0044 | 4.0058 | 4.0077 | 4.0102 | 4.0124 |
| 0.0324 | 4.0032 | 4.0043 | 4.0056 | 4.0074 | 4.0099 | 4.0120 |
| Система: Ura–His–буфер | ||||||
| 0 | 4.0371 | 4.0431 | 4.0492 | 4.0538 | 4.0591 | 4.0639 |
| 0.0041 | 4.0359 | 4.0417 | 4.0477 | 4.0523 | 4.0577 | 4.06247 |
| 0.0071 | 4.0337 | 4.0396 | 4.0456 | 4.0504 | 4.0558 | 4.0604 |
| 0.0098 | 4.0326 | 4.0385 | 4.0441 | 4.0497 | 4.0548 | 4.0595 |
| 0.0164 | 4.0295 | 4.0349 | 4.0409 | 4.0461 | 4.0518 | 4.0560 |
| 0.0207 | 4.0267 | 4.0329 | 4.0383 | 4.0444 | 4.0489 | 4.0536 |
| 0.0257 | 4.0248 | 4.0312 | 4.0364 | 4.0419 | 4.0464 | 4.0517 |
| 0.0318 | 4.0237 | 4.0299 | 4.0346 | 4.0404 | 4.0447 | 4.0496 |
| 0.0324 | 4.0235 | 4.0296 | 4.0341 | 4.0401 | 4.0443 | 4.0495 |
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В зависимости от рН среды аминокислота и урацил могут находиться в различных ионных состояниях. Гистидин является основной аминокислотой с гетероциклической полярной боковой цепью. При разных значениях рН His может образовывать три разных протонированных комплекса [26, 27]. Ранее показано, что в случае водных растворов с рН 7.4 L-гистидин существует, прежде всего, как цвиттерион, при этом вероятность наличия его катионной формы ([H2L]+) составляет менее 5% [21, 28]. Урацил представляет собой пиримидиновое основание, обладающее ароматическими свойствами и способное к таутомерии в виде лактамной или лактимной форм [29]. Установлено, что в нейтральной среде преобладает лактамная форма, которая переходит в моноанион при повышении pH (рН ≥ 9.52) [19, 29]. В условиях выбранной буферной среды (рН 7.4) урацил находится в нейтральной молекулярной форме [30]. Таким образом, при обсуждении движущих сил процесса образования комплекса между His и Ura следует рассматривать цвиттерионы аминокислоты и молекулы урацила в качестве их доминирующих форм, присутствующих в водном буферном растворе (рН 7.4).
Объемные свойства растворов
Кажущийся мольный объем Ura (φV) вычислен с использованием экспериментальных данных по плотности и уравнения:
где ρ0 и ρ – плотности растворителя и раствора (г см–3), m – моляльная концентрация Ura (моль кг–1), М – молекулярная масса Ura. Растворителем в бинарных водных растворах (Ura–буфер) является буферный раствор, а в тройных системах (Ura – аминокислота–буфер) – буферный раствор аминокислоты (His) (с фиксированной концентрацией 0.0125 моль кг–1). На рис. 1 представлены концентрационные зависимости кажущихся мольных объемов Ura φV = f(m) в бинарной и тройной системах, соответственно, при разных температурах. Форма полученных изотерм может свидетельствовать о связывании растворенных веществ в комплекс [23, 31, 32]. Определена стехиометрия образуемого молекулярного комплекса, фиксируемая по максимуму на концентрационной зависимости кажущегося мольного объема Ura в трехкомпонентной системе урацил–аминокислота–буфер (рис. 1б). Максимальные значения φV приходятся на концентрацию mUra = = 0.0249 моль кг–1, которая соответствует молярному соотношению 1His : 2Ura. Зависимости стехиометрии образуемого комплекса от температуры не обнаружено.Рис. 1.
Концентрационные зависимости кажущихся мольных объемов урацила (Vφ) в водном буферном растворе (а) и водном буферном растворе L-гистидина (б) при температурах: 1 – 288.15 K, 2 – 298.15 K, 3 – 303.15 K, 4 – 308.15 K, 5 – 313.15 К (mHis = 0.0125 ± 0.0002 моль кг–1).

Концентрационные зависимости φV = f(m) хорошо аппроксимируются полиномами второй и третьей степени, соответственно, для бинарной (Ura–буфер) и тройной (Ura–Phe–буфер) систем:
(2)
$^{\varphi }V = {}^{\varphi }V^\circ + {{B}_{1}}{{m}_{{{\text{Ura}}}}} + {{B}_{2}}m_{{{\text{Ura}}}}^{2},$(3)
$^{\varphi }V = {}^{\varphi }V^\circ + B_{1}^{'}{{m}_{{{\text{Ura}}}}} + B_{2}^{'}m_{{{\text{Ura}}}}^{2} + B_{3}^{'}m_{{{\text{Ura}}}}^{3},$Таблица 3.
Предельные кажущиеся мольные объемы (φV°) урацила и значения его производной по температуре (∂φV°/∂T)p в водном буферном растворе и водном буферном растворе с аминокислотой (His) при разных температурах
| T, K | Ura−буфер | Ura−Hisa−буфер | ||
|---|---|---|---|---|
| ${}^{\phi }V_{{{\text{Ura}}}}^{^\circ }$ × 106, м3 моль–1 |
(∂φV°/∂T)p × 106, м3моль–1 K–1 |
${}^{\phi }V_{{{\text{Ura}}}}^{^\circ }$ × 106, м3 моль–1 |
(∂φV°/∂T)p × 106, м3 моль–1 K–1 |
|
| 288.15 | 55.77 ± 0.41 | 0.252 ± 0.110 | 57.45 ± 0.33 | 0.133 ± 0.120 |
| 298.15 | 58.12 ± 0.39 | 0.282 ± 0.098 | 59.97 ± 0.28 | 0.398 ± 0.117 |
| 303.15 | 60.01 ± 0.36 | 0.297 ± 0.101 | 62.40 ± 0.30 | 0.531 ± 0.126 |
| 308.15 | 61.52 ± 0.28 | 0.312 ± 0.101 | 65.62 ± 0.29 | 0.663 ± 0.124 |
| 313.15 | 62.85 ± 0.31 | 0.326 ± 0.106 | 68.97 ± 0.24 | 0.796 ± 0.121 |
Кажущиеся мольные объемы переноса (ΔtrφV°) при бесконечном разбавлении для Ura из буфера в буферный раствор аминокислоты вычислены по соотношению:
(4)
$\begin{gathered} {{\Delta }_{{{\text{tr}}}}}{}^{\varphi }V^\circ = {}^{\varphi }V^\circ ({\text{Ura}}{\kern 1pt} --{\kern 1pt} {\text{His}}{\kern 1pt} --{\kern 1pt} {\text{буфер}}) - \\ - \;{}^{\varphi }V^\circ ({\text{Ura}}{\kern 1pt} --{\kern 1pt} {\text{буфер}}). \\ \end{gathered} $Температурные зависимости парциальных мольных объемов φV° урацила в буфере и буферном растворе аминокислоты, представленные на рис. 2, описываются уравнением:
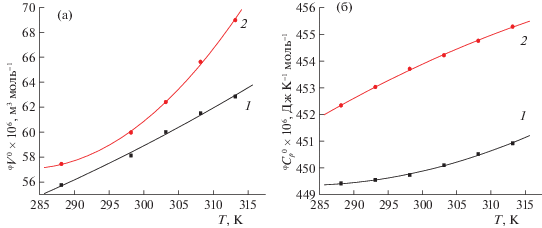
где α, β и γ – константы, T – температура. Значения (∂φV°/∂T)p и (∂2φV°/∂T2)p были получены путем дифференцирования уравнения (5). В табл. 3 приведены рассчитанные первые производные (∂φV°/∂T)p, положительные значения которых указывают на высвобождение электрострикционно сжатой воды из гидратных сфер His и Ura в раствор в процессе их связывания в комплекс, что сопровождается увеличением объема системы. Показано, что величины (∂φV°/∂T)p проявляют тенденцию к повышению с температурой как в бинарной (Ura–буфер), так и в тройной (Ura–His–буфер) системах.Рис. 2.
Температурные зависимости парциальных мольных объемов φV° (а) и парциальных мольных теплоемкостей $^{\phi }C_{p}^{^\circ }$ (б) при бесконечном разбавлении для урацила в буфере (1) и в водном буферном растворе, содержащем 0.0125 моль кг–1 L-гистидина (2).
На основе использования уравнения Хеплера [40]:
(6)
${{(\partial C_{p}^{^\circ }{\text{/}}\partial P)}_{T}} = - T{{({{\partial }^{2}}{}^{\varphi }V^\circ {\text{/}}\partial {{T}^{2}})}_{p}},$Теплоемкостные свойства растворов
Значения кажущейся молярной теплоемкости урацила (ϕCp) в буфере и буферном растворе с гистидином определены из экспериментальных данных удельной теплоемкости с использованием уравнения (7):
где сp и $с_{p}^{^\circ }$ – удельные теплоемкости, соответственно, раствора и растворителя (Дж К–1 г–1), m – моляльная концентрация растворенного вещества Ura (моль кг–1), M – молярная масса Ura (г моль–1). Значения ϕCp урацила получены как функция его концентрации при постоянной концентрации аминокислоты (0.0125 ± 0.0002 моль кг–1). Погрешность определения ϕCp не превышает 2%.Анализ полученных данных показал, что концентрационные изменения значений ϕCp урацила в буферном растворе близки к линейным и могут быть выражены уравнением:
а изотермы ϕCp для тройной системы Ura–His–буфер аппроксимируются полиномом второй степени:(9)
${}^{\phi }{{C}_{p}} = {}^{\phi }C_{p}^{^\circ } + A_{1}^{'}{{m}_{{{\text{Ura}}}}} + A_{2}^{'}m_{{{\text{Ura}}}}^{2}$Рис. 3.
Концентрационные зависимости кажущихся мольных теплоемкостей урацила (ϕCp) в водном буферном растворе (а) и водном буферном растворе L-гистидина (б) при температурах: 1 – 288.15 K, 2 – 293.15 K, 3 – 298.15 K, 4 – 303.15 K, 5 – 308.15 K, 6 – 313.15 K (mHis = 0.0125 ± 0.002 моль кг–1).

Как видно из табл. 4, значения парциальной молярной теплоемкости ($^{\phi }C_{p}^{^\circ }$) урацила положительны для исследуемых систем и возрастают с температурой в интервале (288.15–313.15) К. По-видимому, нуклеиновое основание (Ura), имеющее в своей структуре гидрофильные и гидрофобные группы, индуцирует структурирование растворителя, как за счет гидрофобной гидратации, так и взаимодействия с растворенной аминокислотой [41, 42]. Увеличение $^{\phi }C_{p}^{^\circ }$ с температурой может указывать на то, что взаимодействия между молекулами растворенных веществ сильнее, чем межмолекулярная водородная связь между молекулами воды.
Таблица 4
. Предельные кажущиеся мольные теплоемкости ($^{\phi }C_{p}^{^\circ }$) урацила и значения его производной по температуре ${{({{\partial }^{\varphi }}C_{p}^{^\circ }{\text{/}}\partial T)}_{p}}$ в водном буферном растворе и водном буферном растворе с аминокислотой (His) при разных температурах
| T, K | Ura−буфер | Ura−Hisa−буфер | ||
|---|---|---|---|---|
| $^{\phi }C_{p}^{^\circ }$, ДжK–1 моль–1 |
(${{\partial }^{\phi }}C_{p}^{^\circ }$/∂T)p, ДжK–2 моль–1 |
$^{\phi }C_{p}^{^\circ }$, ДжK–1 моль–1 |
(${{\partial }^{\phi }}C_{p}^{^\circ }$/∂T)p, ДжK–2 моль–1 |
|
| 288.15 | 449.42 ± 0.03 | 0.0203 ± 0.005 | 452.34 ± 0.09 | 0.1411 ± 0.010 |
| 293.15 | 449.55 ± 0.04 | 0.0368 ± 0.005 | 453.04 ± 0.06 | 0.1314 ± 0.009 |
| 298.15 | 449.73 ± 0.03 | 0.0533 ± 0.007 | 453.71 ± 0.09 | 0.1217 ± 0.011 |
| 303.15 | 450.10 ± 0.04 | 0.0698 ± 0.007 | 454.22 ± 0.08 | 0.1120 ± 0.010 |
| 308.15 | 450.52 ± 0.04 | 0.0863 ± 0.009 | 454.76 ± 0.09 | 0.1023 ± 0.012 |
| 313.15 | 450.92 ± 0.04 | 0.1028 ± 0.009 | 455.29 ± 0.08 | 0.0928 ± 0.015 |
В исследуемых растворах при изменении концентрации Ura происходят структурные превращения, обусловленные изменениями гидрофобных, гидрофильных и электростатических взаимодействий, приводящих, в конечном итоге, к связыванию Ura с His. Обычно положительный вклад в величину кажущейся молярной теплоемкости растворенного вещества дают эффекты дегидратации и увеличения степеней свободы и интенсивности молекулярных движений, что ведет к разрушению структуры раствора. В то же время, эффекты ассоциации и гидратации, образование более упорядоченных структур, сопровождающиеся уменьшением степеней свободы молекул растворенных веществ, приводят к отрицательному вкладу в значения ϕCp [45, 46]. Как показано на рис. 3, с увеличением концентрации Ura наблюдается понижение значений кажущейся молярной теплоемкости. По-видимому, в случае растворения Ura в водном буферном растворе и водном буферном растворе, содержащем полярную гетероциклическую аминокислоту (His), можно говорить о преобладании вклада от эффекта гидрофобного структурирования среды и образования молекулярного комплекса Ura с His в общую теплоемкость раствора.
Структурные изменения, происходящие в растворе в процессе связывания Ura с His, можно объяснить на основе использования модели Гэрни о перекрывания ко-сфер молекул растворенных веществ, как это было показано выше при интерпретации объемных свойств [36, 47]. Изменение парциальной мольной теплоемкости (${{\Delta }_{{{\text{tr}}}}}C_{p}^{^\circ }$) при переносе Ura из буфера в буферные растворы с аминокислотой определено по соотношению:
(10)
$\begin{gathered} {{\Delta }_{{{\text{tr}}}}}C_{p}^{^\circ } = {}^{\phi }C_{p}^{^\circ }({\text{Ura}}{\kern 1pt} --{\kern 1pt} {\text{His}}{\kern 1pt} --{\kern 1pt} {\text{буфер}}) - \\ - \;{}^{\phi }C_{p}^{^\circ }({\text{Ura}}{\kern 1pt} --{\kern 1pt} {\text{буфер}}). \\ \end{gathered} $Температурные зависимости парциальной мольной теплоемкости ($^{\phi }C_{p}^{^\circ }$) при бесконечном разбавлении описываются полиномом второй степени как для бинарной (Ura–буфер), так и тройной (Ura–His–буфер) систем (рис. 2):
Здесь Т – температура (К), a, b1 и b2 – константы. Значения полученных первых производных ${{({{\partial }^{\phi }}C_{p}^{^\circ }{\text{/}}\partial T)}_{p}}$ приведены в табл. 4. Видно, что для исследуемого пиримидинового нуклеинового основания значения ${{({{\partial }^{\phi }}C_{p}^{^\circ }{\text{/}}\partial T)}_{p}}$ положительны, что подтверждает полярный характер молекул Ura [41, 49]. Следует отметить, что для тройной системы Ura–His–буфер наблюдаются более высокие значения ${{({{\partial }^{\phi }}C_{p}^{^\circ }{\text{/}}\partial T)}_{p}}$ по сравнению с бинарной системой Ura–буфер из-за присутствия аминокислоты, содержащей как полярные, так и неполярные фрагменты в молекуле.Таким образом, методами денсиметрии и ДСК определены плотности и удельные теплоемкости буферных растворов, содержащих урацил и L-гистидин в интервале температур 288.15–313.15 К. Вычислены кажущиеся и парциальные молярные свойства (φV, ϕCp) урацила, а также предельные кажущиеся молярные свойства переноса Ura из буферного раствора в буферный раствор с аминокислотой. Показано, что функции φV = f(m) и ϕCp = f(m) имеют нелинейный характер. Полученные данные позволили обнаружить структурные изменения в водных буферных растворах Ura с His, соответствующие образованию между ними молекулярного комплекса.
Определены параметры ${{({{\partial }^{\phi }}C_{p}^{^\circ }{\text{/}}\partial T)}_{p}}$, (∂φV°/∂T)p и (∂2φV°/∂T2)p для Ura в водном буферном растворе и водном буферном растворе аминокислоты. Выявленная тенденция в изменении их значений при различных температурах показывает, что буферные системы с Ura и His более структурированы, чем буферные растворы урацила. Полученные результаты показывают, что исследуемое нуклеиновое основание (Ura), имеющее в своей структуре гидрофильные и гидрофобные группы, индуцирует структурирование растворителя, как за счет гидрофобной гидратации, так и вследствие взаимодействия с растворенной гетероциклической аминокислотой (His) в буферном растворе.
Наблюдаемые положительные значения свойств переноса Ura из буфера в буферный раствор с His ($\Delta V_{{{\text{tr}}}}^{^\circ }$, ${{\Delta }_{{{\text{tr}}}}}C_{p}^{^\circ }$) при изученных температурах являются результатом компенсации отрицательных и положительных вкладов в их величину, соответственно, от гидрофобных взаимодействий аполярных фрагментов молекул Ura с His и от ион-гидрофильных взаимодействий цвиттерионов His с полярными группами Ura и образования водородных связей.
Измерения плотности и удельной теплоемкости выполнены на оборудовании центра коллективного пользования “Верхневолжский региональный центр физико-химических исследований” ИХР РАН (http://www.isc-ras.ru/ru/struktura/ckp).
Список литературы
Wettergren Y., Carlsson G., Odin E., Gustavsson B. // Cancer. 2012. V. 6. P. 2935.
Bakkialakshmi S., Chandrakala D. // Spectrochim. Acta. Part A. 2012. V. 88. P. 2.
Cheng A.C., Frankel A.D. // J. Am. Chem. Soc. 2004. V. 126. P. 434.
Jones S., Daley D.T.A., Luscombe N.M. et al. // Nucleic Acids Rec. 2001. V. 29. P. 943.
Ribeiro R.F., Marenich A.V., Cramer Ch.J., Truhlar D.G. // Phys. Chem. Chem. Phys. 2011. V. 13. P. 10908.
Yasuda Y., Tochio N., Sakurai M., Nitta K. // J. Chem. Eng. Data. 1998. V. 43. P. 205.
Nain A.K., Pal R., Sharma R.K. // J. Mol. Liq. 2012. V. 165. P. 154.
Jardine J.J., Call T.G., Patterson B.A. et al. // J. Chem. Thermodynamics. 2001. V. 33. P. 1419.
Riyazuddeen, Altamash T. // Thermochimica Acta. 2010. V. 501. P. 72.
Banipal T.S., Singh K., Banipal P.K. // J. Solution Chem. 2007. V. 36. P. 1635.
Hansena A.L., Kaya L.E. // PNAS. 2014. P. E1705. (www.pnas.org/cgi/doi/10.1073/pnas.1400577111)
Oya-Ohta Y., Ochi T., Komoda Y., Yamamoto K. // Mutation Research. 1995. V. 326. P. 99.
Чернова Р.К., Варыгина О.В., Березкина Н.С. // Изв. Сарат. ун-та. Нов. сер. Сер. Химия. Биология. Экология. 2015. Т. 15. № 4. С. 15.
Hunter K.C., Millen A.L., Wetmore S.D. // J. Phys. Chem. B. 2007. V. 111. P. 1858.
Boeckx B., Maes G. // Ibid. B. 2012. V. 116. P. 11890.
Banipal T.S., Kaur N., Banipal P.K. // J. Chem. Thermodynamics. 2016. V. 95. P. 149.
Smirnov V.I., Badelin V.G. // J. Mol. Liq. 2017. V. 229. V. 198.
Bell-Upp P., Robinson A.C., Whitten S.T. et al. // Biophys. Chem. 2011. V. 159. P. 217.
Balodis E., Madekufamba M., Trevani L.N., Tremaine P.R. // Geochim. Cosmochim. Acta. 2012. V. 93. P. 182.
Khalil M.M., Fazary A.E. // Monatshefte für Chemie. 2004. V. 135. P. 1455.
Tyunina E.Yu., Badelin V.G., Mezhevoi I.N. // J. Mol. Liq. 2019. V. 278. P. 505. https://doi.org/10.1016/j.molliq.2019.01.092
Bhat R., Ahluwalia J.C. // J. Phys. Chem. 1985. V. 89. P. 1099.
Terekhova I.V., De Lisi R., Lazzara G. et al. // J. Therm. Anal. Cal. 2008. V. 92. P. 285.
Tyunina E.Yu., Badelin V.G., Mezhevoi I.N. // J. Soltion Chem. 2017. V. 46. P. 249.
Clarke E.C.W., Glew D.N. // J. Phys. Chem. Ref. Data. 1985. V. 14. P. 490.
Miao Y., Cross T.A., Fu R. // J. Magnetic Resonance. 2014. V. 245. P. 105.
Bretti C., Cigala R.M., Giuffrè O. et al. // Fluid Phase Equilibr. 2018. V. 459. P. 51.
Тюнина Е.Ю., Баделин В.Г., Курицына А.А. // Журн. физ. химии. 2020. Т. 94. № 4. С. 557. https://doi.org/10.1134/S0036024420040226
DeMember J.R., Wallace F.A. // J. Am. Chem. Soc. 1975. V. 97. P. 6240.
Badeline V.G., Tyunina E.Yu., Mezhevoi I.N., Tarasova G.N. // Russ. J. Phys. Chem. A. 2015. V. 89. P. 2229.
Zielenkiewicz W., Pietraszkiewicz O., Wszelaka-Rylic M. et al. // J. Solution Chem. 1998. V. 27. P. 121.
Terekhova I.V., Kulikov O.V. // Mendeleev Comm. 2002. V. 3. P. 1.
Lepori L., Gianni P. // J. Solution Chem. 2000. V. 29. P. 405.
Shahidi F., Farrell P.G. // J. Chem. Soc., Faraday Trans. 1981. V. 77. P. 963.
Franks F. Water: A comprehensive treatise. V. 3. New York: Plenum Press, 1973.
Gurney R.W. Ionic processes in solution. New York: McGraw Hill, 1953.
Banipal T.S., Kaur N., Banipal P.K. // J. Chem. Thermodynamics. 2015. V. 82. P. 12. https://doi.org/10.1016/j.jct.2014.10.015
Bhuiyan M.M.H., Hakin A.W., Liu J.L. // J. Solution Chem. 2010. V. 39. P. 877.
Tyunina E.Yu., Badelin V.G., Mezhevoi I.N. // J. Mol. Liq. 2019. V. 278. P. 505. https://doi.org/10.1016/j.molliq.2019.01.092
Hepler L.G. // Can. J. Chem. 1969. V. 47. P. 4613.
Hadži S., Lah J. // BBA − General Subjects. 2021. V. 1865. P. 129774.
Kishore N., Ahluwalia J.C. // J. Solution Chem. 1990. V. 19. P. 51.
Zielenkiewicz W., Zielenkiewicz A., Grolier J.-P.E. et al. // J. Solution Chem. 1992. V. 21. P. 1.
Васильев В.П. Термодинамические свойства растворов электролитов. М.: Высш. школа. 1982.
Lat`isheva V.A. // Russ. Chem. Rev. 1973. V. XLII. P. 1757.
Madan B., Sharp K.A. // J. Phys. Chem. B. 2001. V. 105. P. 2256.
Banipal P.K., Banipal T.S., Ahluwalia J.C., Lark B.S. // J. Chem. Thermodynamics. 2002. V. 34. P. 1825.
Lark B.S., Patyar P., Banipal T.S., Kishore N. // J. Chem. Eng. Data. 2004. V. 49. P. 553.
Szemińska J., Zielenkiewicz W., Wierzchowski K.L. // Biophys. Chem. 1979. V. 10. P. 409.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии


