Журнал физической химии, 2021, T. 95, № 2, стр. 165-169
Фазовые равновесия в системах диантипирилметан–органическая кислота–хлороводород–вода
О. С. Кудряшова a, b, *, А. М. Елохов a, c
a Естественнонаучный институт Пермского государственного национального
исследовательского университета
Пермь, Россия
b Пермский государственный аграрно-технологический университет им. академика Д.Н. Прянишникова
Пермь, Россия
c Пермский государственный национальный исследовательский университет
Пермь, Россия
* E-mail: oskudr@psu.ru
Поступила в редакцию 10.03.2020
После доработки 15.06.2020
Принята к публикации 23.06.2020
Аннотация
Представлены результаты изучения совместной растворимости компонентов в системах диантипирилметан–органическая кислота (пирокатехин, салициловая, бензойная)–хлороводород–вода. Показано, что на величину области расслаивания влияет растворимость, сила (Kа) органической кислоты и температура. В системе с пирокатехином область расслаивания расширяется в интервале от 1.95 до 9.10 мас. %. HCl. Дальнейший рост концентрации кислоты приводит к сужению области расслаивания, и при 24.25 мас. % HCl она незначительна. В системах с салициловой и бензойной кислотой область расслаивания существует при концентрации HCl от 3.0 до 4.9 мас. % и расширяется с ростом температуры. При концентрации HCl 20.0 и 24.0 маc. % расслаивание не наблюдается. Исходя из величин констант кислотности, пирокатехин является более слабой кислотой, чем салициловая и бензойная, поэтому исчезновение расслаивания в первом случае происходит при более высокой концентрации хлороводородной кислоты. Анализ диаграмм состояния позволил установить влияние концентрации HCl на величину области расслаивания, количественное соотношение фаз в системах, а также оптимизировать температурно-концентрационные параметры процесса экстракции.
Проблема повышения безопасности экстракционных процессов может быть решена использованием систем без органического растворителя, причиной расслаивания которых является химическое взаимодействие компонентов водного раствора. При смешении водных растворов антипирина и пирокатехина [1], резорцина [2] или трихлоруксусной кислоты [3] расслаивание обусловлено ограниченной растворимостью образующихся химических соединений в воде.
Фазовые равновесия и экстракционные свойства систем вода–антипирин–органическая кислота рассмотрены в работах [4, 5]. Область расслаивания в этих системах замкнута, имеет две критические точки и граничит с полями ненасыщенных растворов. Увеличение температуры приводит к росту растворимости и степени диссоциации образующихся соединений, поэтому все рассматриваемые системы имеют верхнюю тройную критическую точку. Увеличение силы органической кислоты снижает концентрацию неорганической кислоты, при которой существует расслаивание.
Конденсированные производные антипирина – диантипирилалканы так же обладают способностью образовывать расслаивающиеся системы [6]. Диантипирилалканы, как более сильные, чем антипирин, основания, являются более эффективными экстракционными реагентами и позволяют расширить круг извлекаемых элементов. Количественное извлечение металлов в органическую фазу обеспечивается образованием хелатных соединений и более низкой растворимостью диантипирилалканов и их комплексов по сравнению с антипирином [7–11].
Оптимизацию условий экстракционных процессов в указанных системах проводят на основании фазовых диаграмм систем, анализ которых позволяет сделать выводы о границах области расслаивания, характере взаимодействия компонентов и количественном соотношении фаз в системе [12].
В работе исследована совместная растворимость компонентов в четверных системах диантипирилметан–органическая кислота (пирокатехин, салициловая, бензойная)–хлороводород–вода.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использованы: диантипирилметан (ДАМ “ч.д.а.”), ТУ 6-09-3835-77, пирокатехин “ч.” ТУ 6-09-4025-83, салициловая кислота “ч.д.а.”, ГОСТ 624-70, бензойная кислота “ч.д.а.” ГОСТ 10521-78, концентрированная хлороводородная кислота “х.ч.” ГОСТ 3118-77. Пирокатехин дополнительно очищали возгонкой. Растворы хлороводородной кислоты необходимой концентрации готовили растворением концентрированной кислоты в дистиллированной воде ($n_{{\text{D}}}^{{25}}$ = 1.3325). Концентрацию растворов контролировали по плотности и показателю преломления.
Растворимость изучена при 25 и 50°С изотермическим методом сечений [13]. Он основан на измерении показателя преломления жидкой фазы смеси известного состава при заданной температуре. Смеси располагались в определенной последовательности на выбранных сечениях треугольника состава. Пробирки со смесями термостатировали при заданной температуре до установления равновесия (постоянство показателя преломления жидкой фазы смесей во времени). Время термостатирования зависело от состава системы и устанавливалось экспериментально. На основании полученных данных строили зависимости показателя преломления от содержания одного из компонентов и по изломам на графике определяли составы, отвечающие фазовым переходам. Точки излома определяли графической интерполяцией, используя линейную аппроксимацию отдельных участков полученных зависимостей. Точность определения растворимости описанным методом равна 0.5 мас. %. Навески компонентов общей массой 5,0000 г набирали на аналитических весах с точностью ±0.15 мг. Показатель преломления жидкой фазы измеряли на рефрактометре ИРФ‑454Б с точностью ±1 × 10–4. Растворимость индивидуальных веществ в воде приведена в табл. 1 и хорошо согласуется со справочными данными [15, 16].
Таблица 1.
Растворимость индивидуальных веществ в воде и константы кислотности при 25°С
| ДАМ | Салициловая кислота | Бензойная кислота | Пирокатехин |
|---|---|---|---|
| Растворимость, мас. % | |||
| 0.04 (0.044*) | 0.20 (0.25**) | 0.28 (0.34**) | 42.70 (41.73**) |
| Константа кислотности (Kа) [14] | |||
| – | 1.07 × 10–3 | 6.17 × 10–5 | 3.55 × 10–10 |
Система ДАМ–пирокатехин–хлороводород–вода
Система ДАМ–хлороводород–вода изучена визуально-политермическим методом А.Д. Шевелевой [17]. Установлено, что диантипирилметан образует с хлороводородом два соединения: ДАМ ⋅ HCl и ДАМ ⋅ 2HCl. Первое растворяется инконгруэнтно, второе – конгруэнтно и является менее растворимым. В системе пирокатехин – вода (HCl) наличие соединений не установлено. При 25°С система пирокатехин–ДАМ является твердофазной.
Изучены фазовые равновесия в разрезах ДАМ–пирокатехин–раствор хлороводорода (1.95, 2.70, 4.95, 9.10 и 24.25 маc. %) при 25°С. Растворимость пирокатехина снижается с повышением концентрации HCl, а кривая растворимости ДАМ – проходит через максимум, что объясняется образованием соединений ДАМ ⋅ HCl и ДАМ ⋅ 2HCl [15], обладающих разной растворимостью (табл. 2).
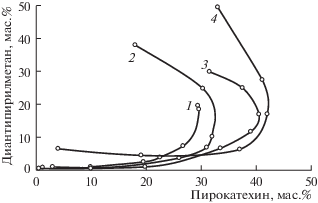
Фазовая диаграмма разреза ДАМ–пирокатехин–9.10% раствор HCl представлена на рис. 1, диаграммы остальных изученных разрезов являются подобными и отличаются величиной области расслаивания. Области кристаллизации пирокатехина, ДАМ и монотектического равновесия занимают значительную часть треугольника состава. Область расслаивания во всех разрезах располагается около вершины треугольника, соответствующей раствору хлороводорода и расширяется при росте концентрации HCl от 1.95 до 9.10 мас. % (рис. 1, 2). Дальнейшее увеличение концентрации HCl приводит к сужению области расслаивания, и при 24.25 мас. % HCl она незначительна.
Рис. 1.
Фазовая диаграмма разреза ДАМ–пирокатехин – 9.1 раствор HCl при 25°С. Фазовые области: I – расслаивания, II – гомогенная, III – монотектическая, IV – кристаллизации ДАМ, V – кристаллизации пирокатехина, VI – эвтоническая (две твердые фазы + + эвтонический раствор).
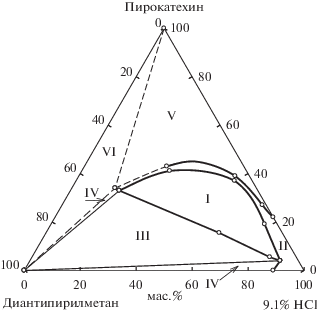
Рис. 2.
Границы области расслаивания в разрезах ДАМ–пирокатехин–HCl–вода; 1 – 1.95, 2 – 2.7, 3 – 4.95, 4 – 9.1 маc. % HCl в воде.
Экстракционная способность системы ДАМ–пирокатехин–вода–HCl изучена на примере межфазного распределения Fe(III), Cu(II), Мо(VI) с использованием модельных растворов (табл. 3). Концентрацию компонентов экстракционной системы рассчитывали так, чтобы получить достаточный для анализа объем органической фазы при минимальной концентрации реагентов. Содержание распределяемых элементов в экстракте и рафинате определяли комплексонометрическим титрованием по стандартным методикам [18]. При минимальной концентрации хлороводородной кислоты наблюдается количественное извлечение Cu(II) и Fe(III), с ростом содержания HCl степень извлечения всех изученных элементов уменьшается.
Системы ДАМ–салициловая (бензойная) кислота–хлороводород–вода
Фазовые равновесия в системе салициловая кислота–вода подробно исследованы многими авторами [19, 20]. Бинодальная кривая метастабильной области расслаивания имеет верхнюю критическую точку при температуре 89.1°С (34 мас. % салициловой кислоты). Кривая кристаллизации кислоты над областью расслаивания имеет практически горизонтальный участок от 15 до 65 мас. % салициловой кислоты.
Исследование оконтуривающих тройных систем ДАМ–салициловая (бензойная) кислота–вода показали, что большую часть фазовых диаграмм занимает область гетерогенных смесей с твердой фазой. Область расслаивания крайне незначительна и имеет метастабильный характер. При стоянии расслаивающиеся смеси кристаллизуются.
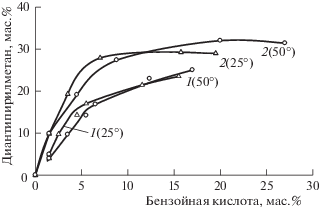
В четырехкомпонентных системах изучены разрезы ДАМ–салициловая (бензойная) кислота–раствор хлороводорода (2.0, 3.0, 4.9, 20.0 и 24.0 мас. % HCl) при 25 и 50°С. В целом, топология фазовых диаграмм изученных разрезов подобна системе ДАМ–пирокатехин–хлороводород–вода. В качестве примера представлена фазовая диаграмма ДАМ–бензойная кислота – 4.9% раствор HCl при 25°С (рис. 3). В отличие от системы с пирокатехином области с твердыми фазами занимают большую часть треугольника состава. Область расслаивания обнаружена в разрезах при концентрации хлороводородной кислоты от 3.0 до 4.9 мас. %. Она расширяется с ростом температуры (рис. 4, 5). При более высоких концентрациях хлороводородной кислоты (20.0 и 24.0 мас. %) расслаивание не наблюдается, а растворимость салициловой и бензойной кислоты в солянокислых растворах ДАМ составляет менее 1 мас. %. В большинстве случаев нижний органический слой представляет собой достаточно вязкую жидкость. Вязкость снижается с повышением температуры.
Рис. 3.
Фазовая диаграмма разреза ДАМ–бензойная кислота–4.9% раствор HCl при 25°С. Фазовые области: I – расслаивания, II – гомогенная, III – монотектическая, IV – кристаллизации ДАМ, V – кристаллизации бензойной кислоты, VI – эвтоническая (две твердые фазы + эвтонический раствор).
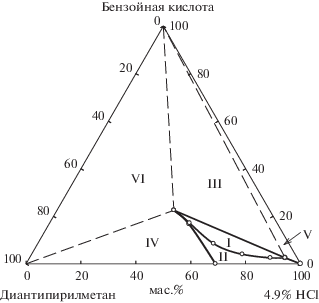
Рис. 4.
Границы области расслаивания в разрезах ДАМ–салициловая кислота–HCl–вода; 1 – 3.0, 2 – 4.9 мас. % HCl в воде при 25 (Δ) и 50 (○) °С.
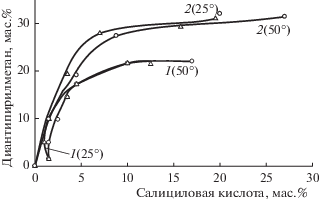
Рис. 5.
Границы области расслаивания в разрезах ДАМ–бензойная кислота–HCl–вода; 1 – 3.0, 2 – 4.9 мас. % HCl в воде при 25 (Δ) и 50 (○) °С.
Исследование экстракционной способности систем ДАМ–салициловая (бензойная) кислота–хлороводород–вода [7–11] выявило их преимущества по сравнению с классической жидкостной экстракцией:
• возможность нагрева повышает скорость расслаивания фаз и экстракции;
• за счет высокой концентрации реагента в органической фазе создаются условия для извлечения малоустойчивых комплексов металлов;
• концентрирование определяемых элементов происходит в фазе меньшего объема.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В изученных системах область расслаивания располагается около ребра тетраэдра, соответствующего HCl–H2O. При сравнении экспериментальных данных установлено, что на величину области расслаивания влияет растворимость органической кислоты. При 25°С в системе с пирокатехином, растворимость которого в воде значительно выше растворимости бензойной и салициловой кислоты (табл. 1), область расслаивания больше. В системах с бензойной и салициловой кислотой, растворимость которых в воде практически одинакова, области расслаивания близки по площади как при 25°С, так и при 50°С. С повышением температуры до 50°С в этих системах область расслаивания увеличивается. Рост концентрации хлороводородной кислоты приводит к увеличению области расслаивания, но в определенном интервале: в системе с пирокатехином – до 9.1 мас. % HCl, в системах с салициловой и бензойной кислотой – до 4.9 мас. % HCl. При более высоких концентрациях HCl расслаивание или отсутствует, или является метастабильным. Исходя из величин констант кислотности, пирокатехин является более слабой кислотой, чем салициловая и бензойная (табл. 1), поэтому исчезновение расслаивания в первом случае происходит при более высокой концентрации хлороводородной кислоты.
Установленные закономерности подтверждаются ранее полученными данными. Например, растворимость нафталин-2-сульфокислоты в воде при 25°С составляет 43.2 мас. %, что практически совпадает с растворимостью пирокатехина, и области расслаивания в системах ДАМ–нафталин-2-сульфокислота–вода и ДАМ–пирокатехин–вода сопоставимы по размерам [6, 21]. В четырехкомпонентной системе ДАМ–нафталин-2-сульфокислота–HCl–вода область расслаивания также увеличивается до определенной концентрации хлороводородной кислоты (1 моль/л), при дальнейшем росте концентрации HCl, как и в изученных системах, она уменьшается.
Полученные фазовые диаграммы позволяют оптимизировать процессы жидкостной экстракции как по температуре, так и по составу и концентрации компонентов.
Работа выполнена при финансовой поддержке Министерства науки и высшего образования Российской Федерации (заявка 2018-0858).
Список литературы
Денисова С.А., Кудряшова О.С., Леснов А.Е. и др. // Журн. орган. химии. 2007. Т. 77. № 11. С. 1794. Denisova S.A., Kudryashova O.S., Lesnov A.E. et al. // Russ. J. Gen. Chem. 2007. V. 77. № 11. Р. 1794. https://doi.org/10.1134/S1070363207110023
Журавлев Е.Ф. // Уч. зап. Молотовск. ун-та. 1954. Т. 8. № 3. С. 3.
Петров Б.И., Яковлева Т.П., Чукин В.М. и др. // Журн. неорган. химии. 1994. Т. 39. № 5. С. 855.
Петров Б.И., Леснов А.Е., Денисова С.А. // Изв. Алтайского гос. ун-та. 2003. № 3 (29). С. 028.
Петров Б.И., Леснов А.Е., Денисова С.А. // Журн. аналит. химии. 2015. Т. 70. № 6. С. 563. https://doi.org/10.7868/S0044450215040179
Петров Б.И., Леснов А.Е., Денисова С.А. // Изв. Алтайского гос. ун-та. 2004. № 3 (33). С. 30.
Дегтев М.И., Аликина Е.Н., Порошина Н.В. // Вестн. Пермского ун-та. Сер.: Химия. 2011. № 1 (1). С. 51.
Аминджанов А.А., Дегтев М.И., Юминова А.А. и др. // Изв. АН Республики Таджикистан. Отделение физ.-мат., хим., геолог. и техн. наук. 2014. № 1 (154). С. 76.
Дегтев М.И., Попова О.Н., Юминова А.А. // Журн. физ. химии. 2014. Т. 88. № 7–8. С. 1239. https://doi.org/10.7868/S0044453714080081
Дегтев М.И., Аликина Е.Н., Юминова А.А. и др. // Вестн. Пермского ун-та. Сер.: Химия. 2016. № 1 (21). С. 78.
Чегодаева С.В., Дегтев М.И., Аликина Е.Н. // Там же. 2016. № 2 (22). С. 63.
Яковлева Т.П., Леснов А.Е., Петров Б.И. и др. Избранные главы ФХА. Пермь 2003 г. Ч. 1. С. 135.
Никурашина Н.И., Мерцлин Р.В. Метод сечений. Приложение его к изучению многофазного состояния многокомпонентных систем. Саратов: Саратовск. ун-т, 1969. 121 с.
Лурье Ю.Ю. Справочник по аналитической химии. М.: Химия, 1971. С. 249.
Коган В.Б., Фридман В.Г., Кафаров В.В. Справочник по растворимости. М.-Л., 1969. Т. 1.
Петров Б.И., Живописцев В.П., Кислицын И.А., Волкова М.А. // Журн. аналит. химии. 1977. Т. 32. № 8. С. 1487.
Шевелева А.Д. // Уч. зап. Молотовского ун-та. 1955. Т. 9. № 4. С. 133.
Шварценбах Г., Флашка Г. Комплексонометрическое титрование. М.: Химия, 1970. 360 с.
Alexeew W. // J. Für Praktische Chemie. 1882. V. 25. P. 518.
Goto A. et al. // J. Phys. Chem. Ref. Data. 2011. V. 40. № 1. P. 1.
Петров Б.И., Денисова С.А., Леснов А.Е. и др. // Журн. аналит. химии. 1998. Т. 53. № 3. С. 287.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии


