Журнал физической химии, 2021, T. 95, № 2, стр. 170-176
Термодинамические свойства расплавов систем Gd–Sn и Gd–Sn–Ni
В. С. Судавцова a, *, М. А. Шевченко a, В. Г. Кудин b, Н. В. Подопригора a, А. С. Козорезов a, Л. А. Романова a, М. И. Иванов a
a Национальная академия наук Украины, Институт проблем материаловедения
Киев, Украина
b Киевский национальный университет имени Тараса Шевченко
Киев, Украина
* E-mail: sud.materials@ukr.net
Поступила в редакцию 02.03.2020
После доработки 02.03.2020
Принята к публикации 23.06.2020
Аннотация
Методом изопериболической калориметрии определены энтальпии смешения жидких сплавов систем Gd–Sn во всем интервале концентраций при 1873, 1640 и 1510 K и Gd–Sn–Ni вдоль лучевого сечения с постоянным соотношением атомных долей олова и никеля: хSn/хNi = 0.68/0.32 при 1873 ± 5 K до xGd ∼ 0.25. Установлено, что расплавы изученной системы Gd–Sn образуются с выделением большого количества теплоты ($\Delta {{{\rm H}}_{{\min }}}$= –68.4 ± 0.4 кДж/моль при xSn = 0.45). С помощью “геометрических” и “аналитической” модели Редлиха–Кистера–Муджиану выполнены расчеты ΔН расплавов тройной системы Gd–Sn–Ni из аналогичных данных для двойных граничных подсистем при 1873 K. Согласно полученным результатам, минимальная энтальпия смешения указанных тройных расплавов установлена для сплава Gd0.55Sn0.45. Показано, что исследованные нами экспериментально и расcчитанные по модели Редлиха–Кистера–Муджиану с тройным вкладом L = 500 кДж/моль энтальпии смешения расплавов Gd–Sn–Ni удовлетворительно согласуются между собой.
Лантаноиды (Ln) в настоящее время широко используются как легирующие добавки к разным металлам, в том числе и к олову. Поэтому для определения оптимальных условий выплавки таких лигатур и их применения требуются сведения об их физико-химических свойствах. Следует отметить, что данных по термодинамическим свойствам в широких интервалах концентраций расплавов системы Ln–Sn очень мало. Что же касается расплавов Gd–Sn, то их термодинамические свойства изучены при небольших содержаниях Gd, хотя они важны для установления закономерностей в энергетике сплавообразования систем Ln–Sn. В связи с этим в данной работе впервые исследованы энтальпии смешения компонентов расплавов системы Gd–Sn в широком интервале концентраций, а для расширения представлений о характере взаимодействия в этой системе смоделированы другие термодинамические свойства по модели идеальных ассоциированных растворов (ИАР), а также рассчитаны и проверены энтальпии смешения расплавов системы Gd–Sn–Ni по известным моделям.
Исследование термохимических свойств жидких сплавов системы Gd–Sn мы выполнили методом калориметрии по методике, описанной нами ранее [1]. Учитывая высокую реакционную способность и температуру плавления Gd (1586 K), термодинамические свойства сплавов изучали в молибденовых тиглях при 1873 K в интервале концентраций 0 < xSn < 0.23, а в интервале 0.63 < < xSn < 0.78 и 0.78 < xSn < 1 – в корундовых, футерованных оксидом иттрия при 1640 и 1510 K соответственно. Калибровку калориметра осуществляли в начале опыта тем же металлом, который находился в тигле (Sn или Gd), в середине и в конце – вольфрамом. При изучении расплавов системы Gd–Sn–Ni калориметр калибровали и в начале опыта вольфрамом. Для обработки результатов использовали энтальпии нагревания Gd, Sn, Ni и W от 298 K до температуры опыта из [2]. Металл (Gd, Sn) или сплав (Sn0.68Ni0.32) в тигле имел массу 2.5–3 г, а образцы, вводимые в тигель, – в пределах 0.02–0.06 г. Начальная температура образцов 298 K. Эти повторные калибровки позволили проследить изменение константы калориметра (т.е. его эффективной теплоемкости), которая в течение всей серии плавно возрастала в ∼1.5 раза, благодаря увеличению массы сплава в тигле.
Парциальные энтальпии смешения компонентов ($\Delta {{\overline H }_{i}}$) рассчитывали по уравнению
Интегральные энтальпии смешения расплава рассчитаны по рекуррентному уравнению
Парциальные и интегральные энтальпии смешения расплавов системы Gd–Sn при 1510–1873 K, исследованные нами экспериментально и аппроксимированные по модели идеальных ассоциированных растворов (ИАР) данные приведены на рис. 1.
Рис. 1.
Парциальные и интегральные энтальпии смешения расплавов системы Gd–Sn при 1510–1873 K, исследованные нами экспериментально (точки) и аппроксимированные по модели ИАР (линии).
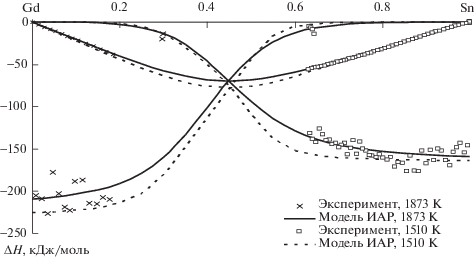
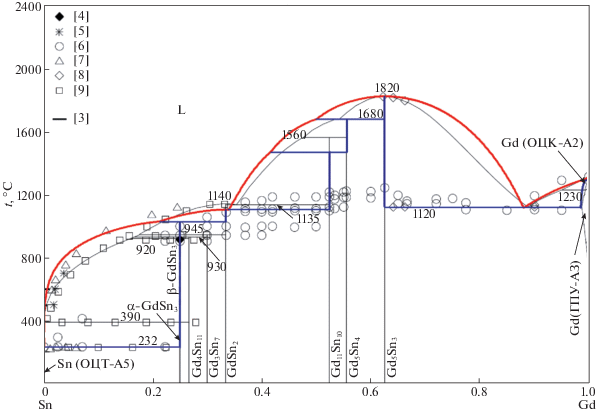
Ясно, что изученные расплавы образуются с большими экзотермическими эффектами смешения ($\Delta {{{\rm H}}_{{\min }}}$= –68.4 ± 0.4 кДж/моль при xSn = 0.45), указывающими на сильную энергию взаимодействия между разноименными компонентами, что коррелирует с диаграммой состояния системы Gd–Sn (рис. 2), которая оптимизирована в [3] и рассчитана нами.
Видно, что компоненты этой системы образуют семь интерметаллических соединений, а ликвидус при 0.12 < xSn < 0.65 в основном не исследован. Из рис. 1 видно, что минимальное значение ∆H жидких расплавов соответствует области концентраций, где существуют наиболее тугоплавкие фазы GdmSnn (Тпл = 1833–2093 K). Также видно, что с повышением температуры тепловые эффекты смешения расплавов Gd–Sn становятся менее экзотермичными, что согласуется с данными для расплавов аналогичных систем.
Следует отметить, что интегральные энтальпии смешения расплавов системы Gd–Sn при 1510–1873 K, полученные из $\Delta {{\overline H }_{{{\text{Sn}}}}}$, согласуются с полученными из $\Delta {{\overline H }_{{{\text{Gd}}}}}$ и наоборот в изученных интервалах составов. Погрешности изученных парциальных энтальпий смешения компонентов определяли как удвоенные среднеквадратичные отклонения экспериментальных точек относительно сглаживающих кривых.
Интегральные и парциальные энтальпии смешения жидких или переохлажденных жидких сплавов системы Gd–Sn при 1873 K, аппроксимированные по модели ИАР при округленных концентрациях, приведены в табл. 1.
Таблица 1.
Интегральные и парциальные энтальпии смешения (кДж/моль) жидких или переохлажденных сплавов системы Gd–Sn при 1873 K, аппроксимированные по модели ИАР
| xSn | ΔH | ΔHGd | ΔHSn |
|---|---|---|---|
| 0 | 0 | 0 | 209.9 ± 6.0 |
| 0.1 | –20.7 | –0.367 | –203.7 |
| 0.2 | –40.5 | –2.827 | –191 |
| 0.3 | –57.7 | –13.84 | –160 |
| 0.4 | –68.4 ± 0.4 | –46.08 | –101.8 |
| 0.5 | –68.4 | –94.06 | –42.66 |
| 0.6 | –59.3 | –129.1 | –12.79 |
| 0.7 | –46.1 | –145.4 | –3.531 |
| 0.8 | –31.3 | –152.9 | –0.888 |
| 0.9 | –15.8 | –156.9 | –0.143 |
| 1 | 0 | 159.3 ± 4.0 | 0 |
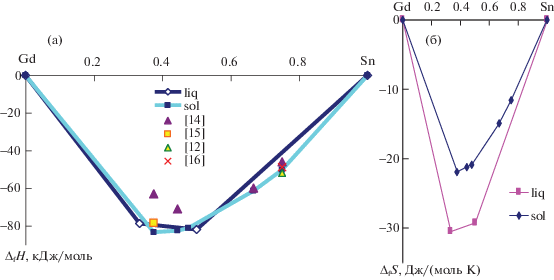
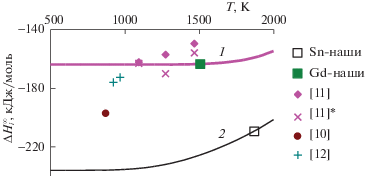
С использованием собственных и литературных значений первых парциальных энтальпий смешения Gd и Sn и модель ИАР показано, что они несущественно зависят от температуры (рис. 3).
Рис. 3.
Температурные зависимости первых парциальных энтальпий смешения компонентов в жидких или переохлажденных жидких сплавах системы Gd–Sn (1 – $\Delta \overline H _{{{\text{Gd}}}}^{\infty }$, 2 – $\Delta \overline H _{{{\text{Sn}}}}^{\infty }$), рассчитанные по модели ИАР; сопоставление с литературными данными (только для $\Delta \overline H _{{{\text{Gd}}}}^{\infty }$). Кроме $\Delta \overline H _{{{\text{Gd}}}}^{\infty }$ представлены также средние значения $\Delta {{\overline H }_{{{\text{Gd}}}}}$ в исследованном концентрационном интервале с пометкой [11]*. Обачно $\left| {\Delta \overline H _{i}^{{({{x}_{i}} > 0)}}} \right| < \left| {\Delta \overline H _{i}^{\infty }} \right|$, но в данном случае наблюдаем обратное явление.
Используя модель ИАР [13], мы также оценили активности компонентов и мольные доли наиболее стабильных ассоциатов в расплавах системы Gd–Sn (рис. 4). При этом использовали как полученные нами термохимические данные, так и литературные (энтальпии образования интерметаллидов GdmSnn, диаграмма состояния). Для расчетов выбрали два ассоциата GdSn и Gd2Sn.
Рис. 4.
Активности Gd, Sn и мольные доли ассоциатов в жидких или переохлажденных жидких сплавах Gd–Sn при 1873 K, согласно модели ИАР.
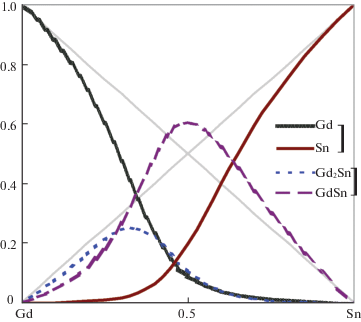
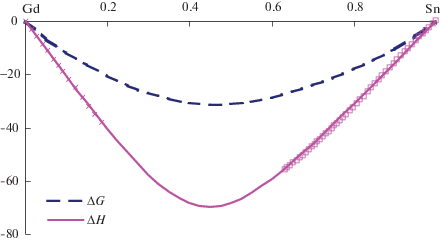
Видно, что активности Gd и Sn в расплавах проявляют очень большие отклонения от закона Рауля, и в них преобладает ассоциат GdSn. Вычисленные из этих данных энергии Гиббса смешения жидких сплавов системы Gd–Sn представлены на рис. 5. Учитывая значения энергии Гиббса и энтальпии смешения этих расплавов, рассчитали энтропию смешения в минимуме (≅‒20 Дж/(моль K)), что не согласуется с положительными величинами в [3], но коррелирует с данными для других систем Ln–Sn.
Рис. 5.
Энергии Гиббса и энтальпии смешения (кДж/моль) жидких сплавов системы Gd–Sn, вычисленные по модели ИАР при 1873 K.
Энтальпии и энтропии образования соединений и ассоциатов системы Gd–Sn при 1873 K рассчитали по модели ИАР (рис. 6).
Видно, что рассчитанные по модели ИАР термодинамические свойства промежуточных фаз согласуются с литературными данными.
Рассчитанные линии ликвидуса и солидуса диаграммы состояния (рис. 2) хорошо согласуются с приведенными в [3–8]. Это подтверждает достоверность полученных нами методом калориметрии и расчетами по модели ИАР термодинамических данных (рис. 1, 4–6).
Таким образом, экспериментально исследованные энтальпии смешения сплавов системы Gd–In являются значительными экзотермическими величинами во всем интервале концентраций. Рассчитанные по модели ИАР активности компонентов, энергии Гиббса и энтропии смешения сплавов этой системы, а также ее диаграмма состояния находятся в согласии с большинством литературных данных. На основе собственных и литературных данных впервые получена оптимизированная термодинамическая модель сплавов системы Gd–In в широком концентрационно-температурном интервале.
В промышленности чаще всего используются многокомпонентные сплавы. Поэтому целесообразно было определить термохимические свойства расплавов системы Sn–Ni–Gd, полная диаграмма состояния и термохимические свойства фаз которой, в том числе и жидкой, не исследованы. Но их исследование – сложная экспериментальная задача, поэтому еще с конца 50-х гг. прошлого столетия начали разрабатываться методики их расчета по аналогичным данным для двойных граничных подсистем. В связи с этим мы использовали известные “геометрические” Бонье–Кабо, Тупа, Колера [17–19] и “аналитическую модель” Редлиха–Кистера–Муджиану [20], чтобы прогнозировать термодинамические свойства расплавов системы Sn–Gd–Ni. Для энтальпий образования расплавов системы Ni–Gd использовали данные [21] (ΔHмин = –43.1 ± 1.8 кДж/моль при хGd = 0.38).
Полученные результаты по этим моделям отличаются, но согласно всем моделям, минимальные энтальпии смешения указанных тройных расплавов приходятся на сплав Gd0.55Sn0.45. Это неудивительно, потому что он близок к самым тугоплавким фазам из всех трех ограничивающих подсистем.
Для примера на рис. 7 приведены парциальные и интегральные изоэнтальпии смешения расплавов системы Gd–Sn–Ni при 1873 K, рассчитанные по модели Колера [19].
Рис. 7.
Парциальные и интегральные изоэнтальпии смешения расплавов системы Gd–Sn–Ni при 1873 K, рассчитанные по модели Колера (а, б) и Редлиха–Кистера–Муджиану с тройным вкладом 500 кДж/моль (в).
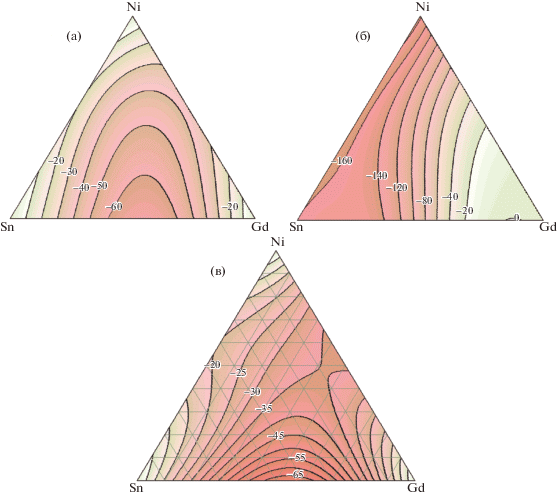
Отметим, что близкие зависимости к рис. 7а, 7б, получены и по другим “геометрическим” и “аналитической” модели моделям [17–19, 20] (рис. 7в). Для проверки, какая из моделей наилучшим образом описывает природу расплавов системы Gd–Sn–Ni при 1873 K, мы изучили энтальпии смешения расплавов лучевого сечения с хSn/хNi = 0.68/0.32 (рис. 8, 9).
Рис. 8.
Интегральные и парциальные энтальпии смешения расплавов лучевого сечения с хSn/хNi = 0.68/0.32 при 1873 K (точки – эксперимент, линии – аппроксимация).
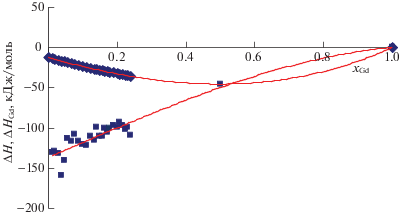
Рис. 9.
Интегральные энтальпии смешения расплавов лучевого сечения с хSn/хNi = 0.68/0.32 при 1873 K (точки – эксперимент, линии – апроксимация и расчет по модели Редлиха–Кистера–Муджиану [20]).
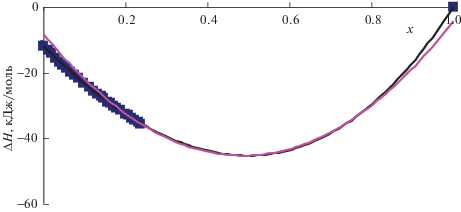
Следует отметить, что исследованные нами экспериментально и расcчитанные по модели Редлиха–Кистера–Муджиану [20] с тройным вкладом L = 500 кДж/моль энтальпии смешения удовлетворительно согласуются между собой (рис. 8), поэтому в дальнейшем мы можем последнюю модель использовать для расчетов энтальпий смешения расплавов подобных систем.
Список литературы
Судавцова В.С., Шевченко М.А., Иванов М.И. и др. // Журн. физ. химии. 2017. Т. 91. № 6. С. 937.
Dinsdale A.T. // Calphad. 1991. V. 15 (4). P. 319.
Kim J., Jung In-Ho // Calphad. 2016. V. 55. Pt 2. December. P. 134.
Percheron-Guegan A., Achard J.C., Bacha A. et al. // Proc. 10-th Rare Earth Research Conf., Carefree., AZ. 1973. P. 1046. U.S. Atomic Energy Commission Technical Information Center, Oak Ridge, TN. 1973. Цит. пo [20]=Borzone G., Borsese A., Ferro R. // Z. anorg. allgem. Chem. 1983. B. 601. № 6. S. 199.
Кулагина Н.Г., Баянов А.П. // Журн. физ. химии. 1974. Т. 48. № 1. С. 233.
Liu Ling-gi, Zheng Jian-xuan (C.S. Cheng) // Acta Phys. Sin. 1984. V. 33. № 8. P. 1155.
Кулагина Н.Г., Баянов А.П., Кулагин Н.М. // Изв. АН СССР. Металлы. 1985. № 3. P. 211–216.
Еременко В.Н., М.В. Буланова, Марценюк П.С. // Фазовые равновесия, структура и свойства сплавов. Киев: Наук. думка, 1990. С. 70–100.
Palenzona A., Cirafici S. // J. Phase Equilibria. 1991. V. 12. № 6. P. 690.
Кулагина Н.Г. Термодинамика взаимодействия редкоземельных металлов с оловом: Автореф. дис. … канд. хим. наук. Свердловск, 1980. 21 с.
Sommer F., Schott J., Krull H.-G. // J. Less-Common Metals. 1988. V. 144. P. 53.
Bacha A., Chatillon-Colinet C., Percheron A., Mathieu J.-C. // Compt. Rend. Acad. Sci. 1972. V. C274. № 7. S. 680.
Шевченко М.А., Иванов М.И., Березуцкий В.В., Судавцова В.С. // Журн. физ. химии. 2016. Т. 90. № 1. С. 3.
Colinet C., Pasturel A., Percheron-Guegan A., Achard J.C. // J. Less-Common Metals. 1984. V. 102. № 2. P. 167.
Meschel S.V., Kleppa O.J. // J. Alloys Compd. 1996. V. 238. P. 180.
Palenzona A. // Thermochimica Acta. 1973. V. 5. № 4. P. 473.
Bonnier E., Caboz R. // Compt. Rend. Acad. Sci., Paris. 1960. V. 250. № 3. P. 527.
Toop G.W. // Trans. Metallurg. Soc. of AIME. 1965. V. 233. P. 850.
Kohler F., Findenegg G.H. // Monatshefte für Chemie. 1965. V. 96. Iss. 4. P. 1228. https://doi.org/10.1007/BF00904272
Muggianu Y.M., Gambino M., Bros J.P. // J. de Chimie Physique et de Physico-Chimie Biologique. 1975. V. 72. P. 83.
Николаенко И.В., Власова О.В. // Расплавы. 1992. № 4. С. 12–18.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии