Журнал физической химии, 2021, T. 95, № 2, стр. 247-255
ReaxFF молекулярно-динамическое моделирование крекинга компонентов вакуумного газойля в присутствии нанокластера никеля
Р. Х. Шаяхметова a, *, Э. М. Хамитов b
a Башкирский государственный университет
г. Уфа, Республика Башкортостан, Россия
b Уфимский институт химии Российской академии наук
г. Уфа, Республика Башкортостан, Россия
* E-mail: shyakhmetovarh@gmail.com
Поступила в редакцию 25.03.2020
После доработки 08.07.2020
Принята к публикации 13.07.2020
Аннотация
Проведено ReaxFF молекулярно-динамическое моделирование крекинга парафинового, нафтенового и ароматического компонентов вакуумного газойля в присутствии и в отсутствие наночастицы Ni468. Установлено, что наблюдаемые пути деструкции углеводородов при термическом воздействии не противоречат реальным механизмам термического крекинга; энтальпии реакций термической деструкции модельных компонентов полученные в ReaxFF с силовыми полями CHO и NiCH коррелируют с определенными методом квантовой химии в DFT-приближении ub3lyp/6-31g(d,p). По результатам ReaxFF молекулярно-динамического моделирования изучены механизмы адсорбции и деструкции парафинового, нафтенового и ароматического компонентов вакуумного газойля на поверхности наночастицы Ni468. Рассчитаны их энтальпии адсорбции и дегидрирования, а также энергии активации дегидрирования на поверхности наночастицы никеля. Выполнена симуляция крекинга в многокомпонентной системе, состоящей из 93 молекул углеводородов и нанокластера Ni468, определены все пути деструкции исходных углеводородов.
Современная нефтеперерабатывающая промышленность имеет тенденцию к углублению переработки нефти. Наука предлагает большое разнообразие путей увеличения нефтеотдачи, один из них – наногетерогенный катализ [1]. В ряде работ предлагается использование наночастиц металлов [2–4]. Наночастицы металлов – класс материалов с уникальными физическими и химическими свойствами [2, 3, 5–11]. Известно, что разложение 2-этилгексаноата никеля (2ЭГН) в среде вакуумного газойля (ВГ) приводит к образованию наночастиц никеля размером 10–90 нм. При крекинге ВГ в присутствии 2ЭГН наблюдается высокий выход дистиллята, изменение структурно-группового состава продуктов, по сравнению с термическим крекингом при аналогичных условиях, что указывает на каталитических характер превращений [4].
Наночастицы никеля содержат множество поверхностных дефектов, которые отсутствуют на идеальной поверхности кристалла никеля (111). Эти дефекты играют важную роль в катализе реакций на поверхности частиц. Экспериментальное изучение образующихся в тяжелой нефтяной фракции наночастиц никеля сложны из-за трудности отделения нанофрагментов катализатора от нефтепродуктов и их последующего физико-химического исследования. Теоретическое изучение влияния нанокластеров никеля на крекинг вакуумного газойля возможно методами квантовой химии [12], но оно чрезвычайно трудоемко. К тому же невозможно моделировать нанокластеры металлов размерами ~10 нм. Молекулярная динамика с силовыми полями ReaxFF [13, 14] – это сравнительно новый подход, который позволяет моделировать реакционные события в больших многокомпонентных системах. Методы, основанные на квантовой механике, дают ценные и важные знания о системе, но требуют колоссальных машинных ресурсов для исследования больших систем, содержащих атомы переходных металлов. Метод классической молекулярной динамически позволяет изучать эволюцию больших многокомпонентных систем, но бессилен в описании химических взаимодействий. Метод ReaxFF был разработан для преодоления недостатков приведенных выше подходов. ReaxFF – это межатомный потенциал, который неявно описывает реакционные взаимодействия, основан на высокоточных расчетах теории функционала плотности. В настоящее время разработаны силовые поля ReaxFF для множества систем [15–18], в частности для углеводородных смесей в присутствии различных металлов [19–22].
В данной работе с целью изучения влияния наноразмерных суспензий никеля на крекинг тяжелых нефтяных фракций проведено моделирование деструкции модельных компонентов вакуумного газойля в присутствии и в отсутствие нанокластера никеля.
МЕТОДИЧЕСКАЯ ЧАСТЬ
Расчеты проводили в одноименном модуле ReaxFF программного пакета ADF [13] с использованием силовых полей C/H/O [23] и C/H/Ni [19]. Силовое поле C/H/Ni включает параметры, описывающие взаимодействия C–C, C–H, C–Ni, H–Ni и Ni–Ni, подходит для моделирования адсорбции, разложения, реформации и десорбции углеводородов катализируемых поверхностями, частицами или атомами никеля [24]. Для молекулярно-динамических расчетов был выбран нанокластер Ni468 величиной 21 Å в диаметре, с доступной для растворителя поверхностью 2470 Å2 (площадь рассчитана в программе MGLtool/PMV [25]). Данная структура была получена в работе [26] путем обрезки фрагмента кристалла никеля с гранецентрированной кубической решеткой Предварительно молекулы исследуемых веществ подвергали процедуре минимизации энергии методом сопряженных градиентов, с параметром сходимости 0.5 ккал/моль/Å. Далее проводили молекулярно-динамические (MD) симуляции без реактивных итераций в NVT- и NPT-ансамбле для уравновешивания систем при температуре 298 K (константа затухания 100 фс), давлении 0.1 мПА (константа затухания 500 фс), временной шаг 0.25 фс.
Поиск переходного состояния проводили с помощью скрипта Nudged Elastic Band (NEB) в ReaxFF. Где проводилась интерполяция и оптимизация 30 координат с константой упругости 0.1 Хартри/Бор и расчет потенциальной энергии при 298 K. Визуализацию результатов расчетов проводили с помощью VMD [27].
Обычно для термической деструкции углеводородов необходимо время от микросекунды до миллисекунды, но для моделирования временная шкала обычно ограничена несколькими наносекундами из-за вычислительных затрат. Поэтому применение ReaxFF требует существенного повышения температуры моделирования для ускорения реактивных событий. Хотя повышение температуры ускоряет различные реакции, оно также меняет относительные скорости различных путей реакции. Таким образом, хотя конкретный путь может быть доминирующим при низкой температуре, он может быть лишь одной из многих доступных альтернатив при более высокой температуре. Для оценки адекватности полученных энергий активации были приведены аналогичные данные, рассчитанные с помощью квантовой химии при 298 K. Квантово-химические расчеты проводили с использованием программного пакета Gaussian09 [28], в приближении ub3lyp/6-31g(d,p).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Мономолекулярное моделирование деструкции парафинового, нафтенового и ароматического компонентов прямогонного газойля
Вакуумный газойль – сложная смесь парафиновых, нафтеновых, ароматических углеводородов. В работе [29] методом многомерной хроматографии с сверхкритическим CO2 и последующей двумерной хроматографией был определен групповой состав вакуумного газойля и распределение групп углеводородов по числу атомов углерода. На основании этих данных в качестве модельного парафинового компонента был выбран пентоказан (C25H52), нафтенового – гептадецилциклогексан (C23H46), ароматического – пентадецилбензол (C21H36).
При симуляции мономолекулярной деструкции пентакозана, пентадецилбензола, гептадецилциклогексана при температурах 1973–3173 K были получены следующие реакции инициирования (табл. 1). При термическом крекинге углеводородов происходит гомолитический разрыв С–С-связей, который происходит без активационного барьера, поэтому энергия активации рассмотренных реакций инициирования равна энтальпии реакции. Деструкция парафинового компонента происходит путем разрыва С–С-связи в случайном месте (табл. 1, реакции 1–6). При симуляции крекинга нафтенового компонента наблюдается расщепление боковых цепей и разрыв цикла (табл. 1, реакции 8–17). Пентадецилбензол подвергается крекингу подобно нафтеновым углеводородам, длинные парафиновые боковые цепи нестабильны, как и боковые цепи нафтенов, однако ароматический цикл не подвергается деструкции ((табл. 1, реакции 19–27). Наблюдаемые реакции не противоречат реальным механизмам термического крекинга углеводородов.
Таблица 1.
Реакции инициирования модельных компонентов прямогонного газойля, время при котором происходит реакция (τ), энтальпии реакций рассчитанные в ReaxFF с силовыми полями CHO, NiCH и в DFT-приближении ub3lyp/6-31g(d,p) методом квантовой химии (кДж/моль)
| № | T, K | τ, пс | Реакция | ΔHReaxFF (CHO) | ΔHReaxFF (NICH) | ΔHDFT |
|---|---|---|---|---|---|---|
| 1 | 2273, 2473 | 21.29 | C25H52 = C14H29 + C11H23 | 331.6 | 316.7 | 344 |
| 2 | 2573, 3173 | 6.63 | C25H52 = C19H39 + C6H13 | 331.4 | 316.9 | 343.8 |
| 3 | 2673, 2873 | 15.38 | C25H52 = C20H41 + C5H11 | 331.6 | 316.5 | 346.8 |
| 4 | 2773 | 1.71 | C25H52 = C22H45 + C3H7 | 332.5 | 316.9 | 348.3 |
| 5 | 2973 | 8.65 | C25H52 = C21H43 + C4H9 | 331.3 | 317.9 | 346 |
| 6 | 3073 | 1.25 | C25H52 = C15H31 + C10H21 | 331.5 | 316.6 | 347.4 |
| 7 | C25H52 = C25H51 + H | 436.9 | 389.2 | 406.4 | ||
| 8 | 2073 | 20.13 | C23H46 = C6H11 + C17H35 | 314.3 | 301.4 | 332.3 |
| 9 | 2273 | 3.43 | разрыв С–С-связи в 3 положении цикла |
313.2 | 291.7 | 356.4 |
| 10 | 2473 | 4.59 | C23H46 = C7H13 + C16H33 | 326.3 | 311.2 | 343.6 |
| 11 | 2573 | 11.80 | разрыв С–С-связи в 1 положении цикла |
295.6 | 266.3 | 333.1 |
| 12 | 2673 | 11.09 | C23H46 = C10H19 + C13H27 | 331.1 | 316 | 347.5 |
| 13 | 2773 | 4.45 | C23H46 = C20H39 + C3H7 | 332.1 | 316.5 | 348.4 |
| 14 | 2873 | 6.05 | разрыв С–С-связи во 2 положении цикла |
313.7 | 283.9 | 349.1 |
| 15 | 2973 | 4.48 | C23H46 = C11H21 + C12H25 | 331.1 | 315.6 | 347.5 |
| 16 | 3073 | 0.86 | C23H46 = C15H29 + C8H17 | 331.3 | 316.2 | 347.5 |
| 17 | 3173 | 2.36 | C23H46 = C17H33 + C6H13 | 331.1 | 316.4 | 347.5 |
| 18 | C23H46 = C23H45 + H | 436.3 | 386.8 | 407.6 | ||
| 19 | 1973 | 31.55 | C21H36 = C19H31 + C2H5 | 334.8 | 326.9 | 346 |
| 20 | 2173, 2473, 2773 | 34.06 | C21H36 = C7H7 + C14H29 | 275.5 | 269.4 | 291.5 |
| 21 | 2273, 2673 | 1.53 | C21H36 = C13H19 + C8H17 | 331.4 | 317.2 | 347.6 |
| 22 | 2373 | 7.89 | C21H36 = C20H33 + CH3 | 357.9 | 341.3 | 359.6 |
| 23 | 2573 | 8.36 | C21H36 = C16H25 + C5H11 | 331.5 | 317.1 | 347.4 |
| 24 | 2873 | 0.33 | C21H36 = C18H29 + C3H7 | 332.3 | 317.2 | 348.5 |
| 25 | 2973 | 5.56 | C21H36 = C14H21 + C7H15 | 331.6 | 317.6 | 347.6 |
| 26 | 3073 | 3.90 | C21H36 = C17H27 + C4H9 | 331 | 318.4 | 347.4 |
| 27 | 3173 | 0.34 | C21H36 = C15H23 + C6H13 | 331.4 | 317.7 | 347.5 |
| 28 | C21H36 = C21H35 + H | 507.1 | 486.7 | 465.2 |
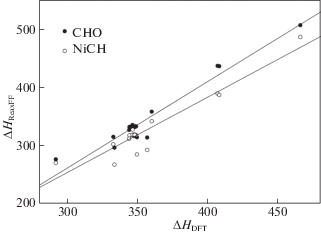
Энтальпии реакций термической деструкции модельных компонентов, полученные в ReaxFF с силовыми полями CHO и NiCH, коррелируют с определенными методом квантовой химии в DFT-приближении (рис. 1). Коэффициенты корреляции для силовых полей CHO и NiCH равны 0.97 и 0.95 соответственно.
Моделирование деструкции парафинового, нафтенового и ароматического компонентов прямогонного газойля на поверхности нанокластера Ni468
При симуляции одной молекулы модельного компонента прямогонного газойля на поверхности никеля при температуре 1773 K получены следующие реакции инициирования (рис. 2–4). Ранее в нашей работе [30] было показано, что при контакте парафинового углеводорода с нанокластером Ni468 происходит физическая адсорбция посредством межмолекулярного взаимодействия атома Ni и атома H углеводородного скелета. Далее происходит диссоциативная хемосорбция путем разрыва C–H-связи и образования σ-связей Ni–C и Ni–H. Изменения энтальпии при физической адсорбции и дегидрировании пентакозана на поверхности наночастицы никеля равны ‒48.4 и 19.8 кДж/моль соответственно. Энергия активации дегидрирования пентоказана на поверхности наночастицы равна 23.8 кДж/моль (рис. 2), что значительно ниже энергии активации при гомолитическом разрыве C–H-связи в молекуле пентоказана (389.2 кДж/моль, табл. 1, реакция 7). Разрыв связей C–C обычно включает отрыв одного или двух атомов C от более длинной углеводородной цепи, в то же время происходит их связывание с поверхностью наночастицы никеля [24].
Рис. 2.
Относительные потенциальные энергии при дегидрировании пентакозана на поверхности Ni468, NEB расчет в ReaxFF с силовым полем NiCH при 298 K.
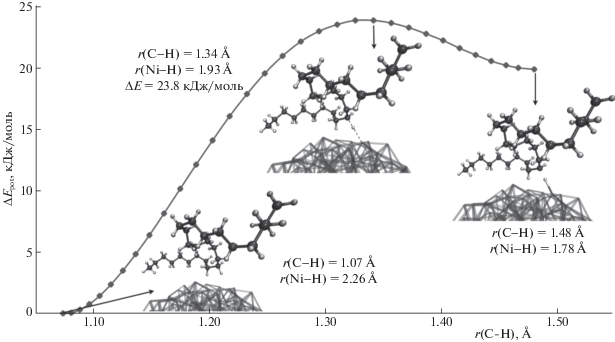
Рис. 3.
Относительные потенциальные энергии при дегидрировании гептадецилциклогексана на поверхности Ni468, NEB расчет в ReaxFF с силовым полем NiCH при 298 K.
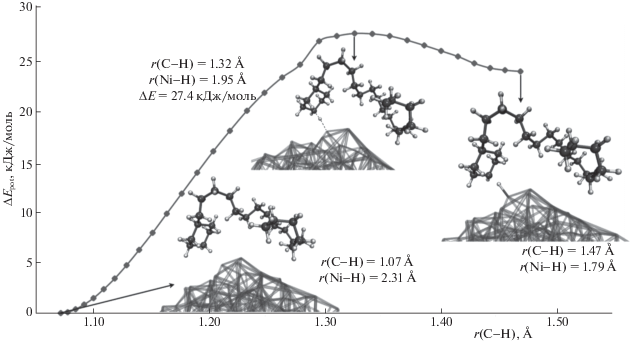
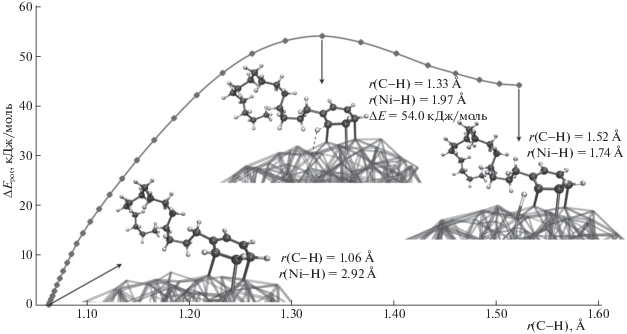
Рис. 4.
Относительные потенциальные энергии при дегидрировании пентадецилбензола на поверхности Ni468, NEB расчет в ReaxFF с силовым полем NiCH при 298 K.
Другими словами, когда фрагмент углеводорода полностью дегидрируется на поверхности никеля, наночастица Ni действует как Pac-Man из одноименной компьютерной игры, поглощая атомы углерода [29]. Однако неизвестно, с какой степенью происходит деструкция углеводородов на поверхности нанокластеров никеля при крекинге прямогонного газойля, содержащего ультрадисперсную суспензию никеля. В работе [4] наблюдается незначительное укрупнение наночастиц никеля в процессе эксперимента, поэтому можно предположить, что на поверхности наночастиц происходит в большей степени дегидрирование углеводородов.
Гептадецилциклогексан подобно алканам, хемосорбируется на поверхности наночастицы посредством разрыва C–H-связи. В условиях моделирования межмолекулярное взаимодействие и последующий разрыв C–H-связи происходят в положении 3 цикла. Изменения энтальпии при физической адсорбции и дегидрировании гептадецилциклогексана на поверхности наночастицы никеля равны –48.3 и 23.6 кДж/моль соответственно. Энергия активации дегидрирования гептадецилциклогексана на поверхности наночастицы (27.4 кДж/моль, рис. 2) значительно ниже энергии активации при гомолитическом разрыве C–H-связи в молекуле гептадецилциклогексана (386.8 кДж/моль, табл. 1, реакция 18).
Адсорбция пентадецилбензола на наночастице никеля происходит посредством π-орбиталей бензольного кольца, приводя к геометрии параллельной к поверхности (рис. 4). Изменения энтальпии при хемосорбции и дегидрировании пентадецилбензола на поверхности наночастицы никеля равны –125.0 и 44.1 кДж/моль соответственно. Энергия активации дегидрирования пентадецилбензола на поверхности наночастицы равна 54.0 кДж/моль (рис. 2), что значительно ниже энергии активации при гомолитическом разрыве C–H-связи в молекуле пентадецилбензола (486.7 кДж/моль, табл. 1, реакция 28).
Многокомпонентная симуляция
Вакуумный газойль состоит на 22.4% из н-алканов, на 16.6% из мононафтенов и на 11.3% из моноароматики [29]. Исходя их этого была построена система, содержащая 38 молекул пентакозана, 31 молекулу гептадецилциклогексана, 24 молекулы пентадецилбензола и нанокластер Ni468 (рис. 5). Симуляцию проводили при 2000 K в течение 100 пс. Расходование большей части исходных молекул углеводородов происходит в течение 25 пс.
Рис. 5.
Четырехкомпонентная система из 93 молекул углеводородов и нанокластера Ni468; a – исходная система, бокс размером 50 × 50 × 50 Å, б – система после NVT и NPT эквилибрации при 298 K, бокс размером 42.97 × 2.36 × 40.93 Å, в – система после 100 пс реактивной симуляции при 2000 K.

В табл. 2–5 приведены все пути деструкции исходных компонентов модельной системы: хемосорбция на поверхности наночастицы (табл. 2), гомолитический разрыв С–С-связей в молекулах, не контактирующих с наночастицей (табл. 3), реакции развития цепи (табл. 4) и реакции дегидрирования (табл. 5). Место разрыва связи в боковых цепях указано как Cn, место обрыва в цикле – Сn(ring).
Таблица 2.
Гетерогенные реакции инициирования исходных компонентов модельной системы (Cn и Сn(ring) – места разрыва связи)
| № | Реакция | Cn | τ,пс |
|---|---|---|---|
| 1 | C25H52 = C25H51(ad) + H(ad) | C11 | 0.46 |
| 2 | C25H52 = C25H51(ad) + H(ad) | C7 | 0.55 |
| 3 | C25H52 = C25H51(ad) + H(ad) | C7 | 2.39 |
| 4 | C25H52 = C25H51(ad) + H(ad) | C1 | 2.41 |
| 5 | C25H52 = C25H51(ad) + H(ad) | C6 | 2.93 |
| 6 | C25H52 = C25H51(ad) + H(ad) | C3 | 3.26 |
| 7 | C25H52 = C25H51(ad) + H(ad) | C10 | 3.63 |
| 8 | C25H52 = C25H51(ad) + H(ad) | C25 | 3.85 |
| 9 | C25H52 = C25H51(ad) + H(ad) | C11 | 4.29 |
| 10 | C25H52 = C25H51(ad) + H(ad) | C1 | 7.43 |
| 11 | C25H52 = C25H51(ad) + H(ad) | C2 | 9.45 |
| 12 | C25H52 = C25H51(ad) + H(ad) | C1 | 13.85 |
| 13 | C25H52 = C25H51(ad) + H(ad) | C2 | 14.79 |
| 14 | C23H46 = C23H45(ad) + H(ad) | C7 | 0.64 |
| 15 | C23H46 = C23H45(ad) + H(ad) | C3(ring) | 1.74 |
| 16 | C23H46 = C23H45(ad) + H(ad) | C3(ring) | 1.78 |
| 17 | C23H46 = C23H45(ad) + H(ad) | C3(ring) | 1.91 |
| 18 | C23H46 = C23H45(ad) + H(ad) | C8 | 2.98 |
| 19 | C23H46 = C23H45(ad) + H(ad) | C3 | 3.70 |
| 20 | C23H46 = C23H45 + H(ad) | C9 | 4.59 |
| 21 | C23H46 = C23H45(ad) + H(ad) | C1(ring) | 6.3 |
| 22 | C23H46 = C23H45(ad) + H(ad) | C3(ring) | 6.33 |
| 23 | C23H46 = C23H45 + H(ad) | C2 | 7.70 |
| 24 | C23H46 = C23H45(ad) + H(ad) | C3(ring) | 11.16 |
| 25 | C23H46 = C23H45 + H(ad) | C11 | 30.35 |
| 26 | C21H36 = C21H35(ad) + H(ad) | C1 | 0.64 |
| 27 | C21H36 = C21H35(ad) + H(ad) | C6 | 1.13 |
| 28 | C21H36 = C21H34(ad) + 2H(ad) | C11C12 | 3.01 |
| 29 | C21H36 = C21H35(ad) + H(ad) | C1 | 4.88 |
| 30 | C21H36 = C21H35(ad) + H(ad) | C1 | 5.48 |
| 31 | C21H36 = C21H35(ad) + H(ad) | C15 | 9.56 |
| 32 | C21H36 = C21H35(ad) + H(ad) | C4(ring) | 13.05 |
| 33 | C21H36 = C21H35(ad) + H(ad) | C7 | 13.45 |
| 34 | C21H36 = C21H35(ad) + H(ad) | C15 | 20.65 |
| 35 | C21H36 = C21H35(ad) + H(ad) | C4(ring) | 27.28 |
Таблица 3.
Реакции инициирования исходных компонентов, происходящие за счет гомолитического разрыва С–С-связи
| № | Реакция | Cn | τ, пс |
|---|---|---|---|
| 1 | C25H52 = C13H27 + C12H25 | C12C13 | 6.59 |
| 2 | C23H46 = C6H11 + C17H35 | C1(ring)C1 | 3.69 |
| 3 | C23H46 = C18H35 + C5H11 | C12 | 7.15 |
| 4 | C23H46 = С–С разрыв в цикле | С1(ring) | 10.90 |
| 5 | C23H46 = C14H27 + C9H19 | C8 | 24.28 |
| 6 | C21H36 = C19H31 + C2H5 | C13-C14 | 3.51 |
| 7 | C21H36 = C13H19 + C8H17 | C7 | 17.28 |
Таблица 4.
Реакции инициирования исходных компонентов, которые способствуют развитию цепи радикальных процессов
| № | Реакция | Cn | τ, пс |
|---|---|---|---|
| 1 | C25H52 + H = C25H51 + H2 | C25 | 5.83 |
| 2 | C25H52 + C26H33 = C25H51 + C26H34 | C6 | 7.55 |
| 3 | C25H52 + H = C25H51 + H2 | C7 | 8.93 |
| 4 | C25H52 + H = C25H51 + H2 | C1 | 11.11 |
| 5 | C25H52 + C22H31 = C25H51 + C22H32 | C4 | 12.21 |
| 6 | C25H52 + C25H51 = C25H51 + C25H52 | C4 | 13.58 |
| 7 | C25H52 + H = C25H51 + H2 | C12 | 14.4 |
| 8 | C25H52 + C25H49 = C25H51 + C25H50 | C13 | 17.25 |
| 9 | C25H52 + C4H7 = C25H51 + C4H8 | C13 | 18.08 |
| 10 | C25H52 + H = C25H51 + H2 | C2 | 18.45 |
| 11 | C25H52 + C7H13 = C25H51 + C7H14 | C6 | 18.66 |
| 12 | C25H52 + C9H10 = C25H51 + C9H11 | C2 | 22.53 |
| 13 | C25H52 + C21H35 = C25H51 + C21H36 | C11 | 24.79 |
| 14 | C25H52 + C13H22 = C25H51 + + C13H21 + H2 | C12 | 28.34 |
| 15 | C25H52 + C21H32 + C25H51 + C21H33 | C12 | 30.53 |
| 16 | C25H52 + C23H19 = C25H51 + C23H20 | C8 | 58.51 |
| 17 | C25H52 + C17H27 = C25H51 + + C17H27 + H2 | C1 | 73.14 |
| 18 | C23H46 + H = C23H45 + H2 | C1 | 5.86 |
| 19 | C23H46 + H = C23H45 + H2 | C8 | 6.5 |
| 20 | C23H46 + C21H31 = C23H45 + C21H32 | C11 | 14.6 |
| 21 | C23H46 + C12H18 = C23H45 + C12H19 | C17 | 16.23 |
| 22 | C23H46 + H = C23H45 + H2 | C2(ring) | 20.24 |
| 23 | C23H46 + C3H7 = C23H45 + C3H8 | C3(ring) | 29.03 |
| 24 | C23H46 + C15H29 = C23H45 + C15H30 | C3 | 33.69 |
| 25 | C21H36 + H = C21H35 + H2 | C4 | 0.88 |
| 26 | C21H36 + H = C21H35 + H2 | C7 | 4.26 |
| 27 | C21H36 + H = C21H35 + H2 | C12 | 6.3 |
| 28 | C21H36 + C11H21 = C21H35 + C11H22 | C13 | 11.7 |
| 29 | C21H36 + H = C21H35 + H2 | C4(ring) | 15.79 |
| 30 | C21H36 + C7H10 = C21H35 + C7H11 | C10 | 22.24 |
Таблица 5.
Реакции дегидрирования с участием исходных молекул модельной системы
| № | Реакция | Cn | τ,пс |
|---|---|---|---|
| 1 | C25H52 = C25H50 + H2 | C3C4 | 5.34 |
| 2 | C25H52 = C25H50 + H2 | C4C5 | 12.14 |
| 3 | C25H52 = C25H50 + H2 | C5C6 | 13.09 |
| 4 | C25H52 + C21H36 = C25H51 + + C21H35 + H2 | C13 | 13.49 |
| 5 | C25H52 = C25H50 + H2 | C7C8 | 17.53 |
| 6 | C25H52 = C25H50 + H2 | C1C20 | 18.15 |
| 7 | C25H52 = C25H50 + H2 | C8C9 | 18.24 |
| 8 | C23H46 = C23H44 + H2 | C6C7 | 1.93 |
| 9 | 2C23H46 = 2C23H45 + H2 | C3C16 | 4.9 |
| 10 | C23H46 + C23H42 = C23H45 + + C23H41 + H2 | C3(ring) | 21.48 |
| 11 | C23H46 = C23H44 + H2 | C3C4 | 25.51 |
| 12 | C23H46 = C23H44 + H2 | C2C3(ring) | 26.94 |
| 13 | C23H46 + C6H11 = C23H45 + + C6H10 + H2 | C2(ring) | 32.04 |
| 14 | C21H36 = C21H34 + H2 | C3C4 | 10.99 |
| 15 | C21H36 = C21H34 + H2 | C13C14 | 4.99 |
| 16 | C21H36 = C21H35 + H | C15 | 12.98 |
| 17 | C21H36 + C25H50 = C21H35 + + C25H49 + H2 | C1 | 12.2 |
| 18 | C21H36 = C21H34 + H2 | C14C15 | 19.31 |
В табл. 6 приведены данные по исходным молекулам (Ni468 C25H52, C23H46, C21H36), продуктам их деструкции, десорбированных с поверхности никеля и образующихся без участия нанокластера. Продукты классифицированы как категории C1, C2, C3 и т.д., где Cn представляет собой количество атомов С в углеводородном фрагменте. Самыми популярными продуктами после водорода являются – С25, С21, С23, С3, С2. Также с поверхности никеля десорбируется большое количество радикалов водорода. Из-за того, что в ReaxFF для определения связей используется обрезание порядка связи, равное 0.3, сложно определить точное количество радикалов водорода в модельной системе. В частности, некоторое количество атомов водорода хемосорбировано на поверхности никеля, другая часть H˙ десорбируется с поверхности наночастицы и определяется программой в составе других молекулярных фрагментов. Большое количество молекул водорода обусловлено высокой температурой симуляции.
Таблица 6.
Молекулярные фрагменты наблюдаемые при реактивной симуляции в многокомпонентной системе, где N – количество появлений в течение 100 пс, Nср – среднее количество молекулярных фрагментов этого типа относительно общего количества в одном кадре, усредненное по времени
| Фрагмент | N | Nср, % | Фрагмент | N | Nср, % | Фрагмент | N | Nср, % |
|---|---|---|---|---|---|---|---|---|
| Ni468 | 1 | 2.27 | С5 | 44 | 2.53 | С19 | 27 | 0.80 |
| C21H36 | 23 | 2.74 | С4 | 44 | 2.37 | С15 | 21 | 0.64 |
| C23H46 | 31 | 3.25 | С6 | 43 | 1.86 | С1 | 14 | 0.63 |
| C25H52 | 38 | 4.59 | С7 | 33 | 1.29 | С8 | 22 | 0.62 |
| H2 | 537 | 56.33 | С13 | 34 | 1.21 | С11 | 29 | 0.59 |
| С25 | 59 | 2.81 | С9 | 38 | 1.09 | С17 | 16 | 0.48 |
| С21 | 49 | 2.50 | С10 | 34 | 0.96 | С20 | 15 | 0.38 |
| С23 | 37 | 1.92 | С16 | 35 | 0.87 | С14 | 11 | 0.27 |
| С3 | 58 | 2.62 | С12 | 30 | 0.86 | С24 | 4 | 0.07 |
| С2 | 38 | 2.59 | С18 | 29 | 0.84 | С22 | 2 | 0.02 |
ЗАКЛЮЧЕНИЕ
Проведено молекулярно-динамическое моделирование крекинга парафинового, нафтенового и ароматического компонентов вакуумного газойля в присутствии и отсутствии наночастицы Ni468. Наблюдаемые пути деструкции углеводородов при термическом воздействии не противоречат реальным механизмам термического крекинга. Энтальпии реакций термической деструкции модельных компонентов полученные в ReaxFF с силовыми полями CHO и NiCH коррелируют с определенными методом квантовой химии в DFT-приближении ub3lyp/6-31g(d,p).
По результатам ReaxFF молекулярно-динамического моделирования изучены механизмы деструкции парафинового, нафтенового и ароматического компонентов вакуумного газойля на поверхности наночастицы Ni468. При контакте парафинового углеводорода с нанокластером Ni468 происходит физическая адсорбция посредством межмолекулярного взаимодействия атома Ni и атома H углеводородного скелета. Далее происходит диссоциативная хемосорбция путем разрыва C–H-связи и образования σ-связей Ni–C и Ni–H. Изменения энтальпии при физической адсорбции и дегидрировании пентакозана на поверхности наночастицы никеля равны –48.4 и 19.8 кДж/моль соответственно. Энергия активации дегидрирования пентоказана на поверхности наночастицы равна 23.8 кДж/моль. Разрыв C–C-связей происходит по механизму Pac-Man [29] и обычно включает отрыв одного или двух атомов C от более длинной углеводородной цепи, в то же время происходит их связывание с поверхностью наночастицы никеля [24]. Так как в работе [4] наблюдается незначительное укрупнение наночастиц никеля в процессе эксперимента, можно предположить, что на поверхности наночастиц никеля в процессе крекинга вакуумного газойля происходит в большей степени дегидрирование углеводородов.
Гептадецилциклогексан подобно алканам, хемосорбируется на поверхности наночастицы посредством разрыва C–H-связи. В условиях моделирования сорбция произошла в области нафтенового цикла, далее наблюдался разрыв C–H-связи в положении 3 цикла. Изменения энтальпии при физической адсорбции и дегидрировании гептадецилциклогексана на поверхности наночастицы никеля равны –48.3 и 23.6 кДж/моль соответственно. Энергия активации дегидрирования гептадецилциклогексана на поверхности наночастицы равна 27.4 кДж/моль.
Адсорбция пентадецилбензола на наночастице никеля происходит посредством π-орбиталей бензольного кольца, приводя к расположению, параллельному к поверхности. Изменения энтальпии при хемосорбции и дегидрировании пентадецилбензола на поверхности наночастицы никеля равны –125.0 и 44.1 кДж/моль соответственно. Энергия активации дегидрирования пентадецилбензола на поверхности наночастицы равна 54.0 кДж/моль.
В результате симуляции крекинга в многокомпонентной системе, содержащей 38 молекул пентакозана, 31 молекулу гептадецилциклогексана, 24 молекулы пентадецилбензола и нанокластер Ni468 установлены все пути деструкции исходных углеводородов. В условиях моделирования наблюдаются следующие реакции с участием исходных молекул: хемосорбция на поверхности наночастицы, гомолитический С–С-разрыв связей молекул, не контактирующих с наночастицей, реакции развития цепи и реакции дегидрирования.
По результатам моделирования показано, что наличие нанокластеров никеля при крекинге углеводородов вакуумного газойля приводит к накоплению атомарного и молекулярного водорода, углеводородных фрагментов с длиной цепи от 1 до 25 атомов углерода. Предположено, что каталитический эффект от присутствия нанокластеров никеля при крекинге вакуумного газойля обусловлен образованием Н˙, Н2, что способствует реакциям переноса атома водорода, насыщения и гидрогенолиза.
Исследование выполнено при финансовой поддержке РФФИ в рамках научного проекта № 18-33-00851. Коллектив авторов благодарит ЦКП “Химия” УфИХ УФИЦ РАН за возможность использования кластерного суперкомпьютера.
Список литературы
Khadzhiev S.N. // Petroleum Chemistry. 2016. V. 56. № 6. P. 465.
Alkhaldi S., Husein M.M. // Energy & Fuels. 2014. V. 28. № 1. P. 643.
Hashemi R., Nassar N.N., Pereira Almao P. // Ibid. 2014. V. 28. № 2. P. 1338.
Мустафин И.А., Абдуллин М.Ф., Судакова О.М. и др. // Нефтехимия. 2018. Т. 58. № 3. P. 275.
Fan Y., Wu Y., Clavel G. et al. // ACS Applied Energy Materials. 2018. V. 1. № 9. P. 4554.
Du Y., Chen H., Chen R., Xu N. // Applied Catalysis A: General. 2004. V. 277. № 1. C. 259.
Jiang Z.-J., Liu C.-Y., Sun L.-W. // J. Phys. Chem. B. 2005. V. 109. № 5. P. 1730.
Inwati G.K., Rao Y., Singh M. // ACS Omega. 2017. V. 2. № 9. C. 5748.
Huff C., Long J.M., Heyman A., Abdel-Fattah T.M. // ACS Applied Energy Materials. 2018. V. 1. № 9. P. 4635.
Ramirez O., Bonardd S., Saldías C. et al. // ACS Applied Materials & Interfaces. 2017. V. 9. № 19. P. 16561.
Shi L., Liu M., Liu L. et al. // Langmuir. 2014. V. 30. № 44. P. 13456.
Ilyina M.G., Khamitov E.M., Galiakhmetov R.N. et al. // J. Mol. Graphics and Modelling. 2017. V. 72. P. 106.
van Duin A.C.T., Goddard W.A., Islam M.M. et al. // Book ReaxFF / Editor. Theoretical Chemistry, Vrije Universiteit, Amsterdam, The Netherlands: SCM, 2016.
Senftle T.P., Hong S., Islam M.M. et al. // Npj Computational Materials. 2016. V. 2. P. 15011.
Keith J.A., Fantauzzi D., Jacob T., van Duin A.C.T. // Phys. Rev. B. 2010. V. 81. № 23. P. 235404.
Islam M.M., Ostadhossein A., Borodin O. et al. // Phys. Chem. Chem. Phys. 2015. V. 17. № 5. P. 3383.
Huygh S., Bogaerts A., van Duin A.C.T., Neyts E.C. // Computational Materials Science. 2014. V. 95. P. 579.
Ostadhossein A., Rahnamoun A., Wang Y. et al. // J. Phys. Chem. Lett. 2017. V. 8. № 3. P. 631.
Mueller J.E., van Duin A.C.T., Goddard W.A. // J. Phys. Chem. C. 2010. V. 114. № 11. P. 4939.
Chenoweth K., van Duin A.C.T., Persson P. et al. // Ibid. 2008. V. 112. № 37. C. 14645.
Raju M., Ganesh P., Kent P.R.C., van Duin A.C.T. // J. Chem. Theory and Computation. 2015. V. 11. № 5. P. 2156.
Zhang W., van Duin A.C.T. // J. Phys. Chem. B. 2018. V. 122. № 14. P. 4083.
van Duin A.C.T., Dasgupta S., Lorant F., Goddard W.A. // J. Phys. Chem. A. 2001. V. 105. № 41. P. 9396.
Mueller J.E.S. Energetics and Reactions of Hydrocarbons on Nickel. Dissertation (Ph.D.), California Institute of Technology. http://resolver.caltech.edu/CaltechTHESIS:05262010-132424180.
Sanner M.F. // J. Mol. Graph. Model. 1999. V. 17. № 1. C. 57.
Mueller J.E., van Duin A.C.T., Goddard W.A. // J. Phys. Chem. C. 2010. V. 114. № 12. P. 5675.
Humphrey W., Dalke A., Schulten K. // J. Mol. Graphics. 1996. V. 14. № 1. P. 33.
Frisch M.J., Trucks G.W., Schlegel H.B., Scuseria G.E., Robb M.A., R., Scalmani G., Barone V., Mennucci B., Petersson G.A., Nakatsuji H., Caricato M., Li X., Hratchian H.P., Izmaylov A.F., Bloino J., Zheng G., Sonnenberg J.L., Hada M., Ehara M., Toyota K., Fukuda R., Hasegawa J., Ishida M., Nakajima T., Honda Y., Kitao O., Nakai H., Vreven T., Montgomery J., J.A., Peralta J.E., Ogliaro F., Bearpark M., Heyd J.J., Brothers E., Kudin K.N., Staroverov V.N., Kobayashi R., Normand J., Raghavachari K., Rendell A., Burant J.C., Iyengar S.S., Tomasi J., Cossi M., Rega N., Millam J.M., Klene M., Knox J.E., Cross J.B., Bakken V., Adamo C., Jaramillo J., Gomperts R., Stratmann R.E., Yazyev O., Austin A.J., Cammi R., Pomelli C., Ochterski J.W., Martin R.L., Morokuma K., Zakrzewski V.G., Voth G.A., Salvador P., Dannenberg J.J., Dapprich S., Daniels A.D., Farkas Ö., Foresman J.B., Ortiz J.V., Cioslowski J., Fox D.J. Cheeseman J. Gaussian 09, Revision C.1. ‒ Wallingford CT: Gaussian, Inc., 2009.
Qiu Z., Song L., Zhao J., Li Z., Yang J. // Angewandte Chemie International Edition. 2016. V. 55. № 34. P. 9918.
Шаяхметова Р.Х., Хамитов Э.М., Мустафин А.Г. // Вестн. Башкирск. ун-та. 2019. Т. 24. № 2. С. 351.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии