Журнал физической химии, 2021, T. 95, № 3, стр. 418-425
Гидриды интерметаллидов: магнитные свойства и катализ
a Московский государственный университет имени М.В. Ломоносова,
Химический факультет
119234 Москва, Россия
* E-mail: chern5@inbox.ru
Поступила в редакцию 06.08.2020
После доработки 06.08.2020
Принята к публикации 10.09.2020
Аннотация
Показано, что гидриды интерметаллидов (ГИ) представляют собой сложные динамические системы. Процессы десорбции и диссоциативной адсорбции водорода на ГИ являются скорость определяющими стадиями при гетерофазном обмене водорода газовой фазы и гидрида. Окислительная обработка ГИ приводит к обогащению поверхности более благородным металлом, что наряду с гетерофазным обменом водорода определяет уникальные каталитические свойства системы.
Известно, что одним из основных недостатков, применяемых в настоящее время промышленных катализаторов гидрогенизационных процессов, является низкая концентрация активного водорода на поверхности катализатора. Это обуславливает невысокую стабильность катализаторов и приводит к необходимости использования в гидрогенизационных процессах высоких давлений водорода. Применение высоких давлений значительно усложняет процесс, а в случае тяжелых нефтяных фракций делает его нерентабельным.
Как показали проведенные нами исследования, весьма перспективными для решения поставленных задач, могут быть катализаторы на основе гидридов интерметаллидов [1, 2].
Интерметаллические гидриды – это типичные металлические вещества, в состав которых входят элементы, широко используемые в катализе. Водород в них следует рассматривать как металлический элемент внедрения, являющийся донором электронов. Принципиальным отличием гидридов интерметаллидов от известных катализаторов является большой запас водорода в кристаллической решетке. При выделении водорода из объема интерметаллида на поверхности последнего создается некоторая стационарная концентрация активированного водорода. Уникальная способность интерметаллидов поглощать значительное количество водорода, а при повышении температуры выделять его из кристаллической решетки создает потенциальную возможность для использования этих соединений в качестве катализаторов в реакциях, протекающих с участием водорода, в частности, в гидрогенизационных процессах нефтепереработки, а также в синтезе Фишера–Тропша.
Поглощение и выделение водорода из гидридов сопровождается фазовыми переходами и изменениями объемной структуры интерметаллидов, а, следовательно, и структуры поверхности.
СВОЙСТВА КАТАЛИЗАТОРОВ НА ОСНОВЕ ГИДРИДОВ ИНТЕРМЕТАЛЛИДОВ
Гидриды интерметаллидов представляют собой соединения, в которых в качестве гидридообразующего компонента используются переходные металлы IV, V групп (Ti, Zr, Hf, V, Nb), а в качестве второго компонента металлы VIII группы (Ni, Co, Fe), входящие в состав многих промышленных катализаторов. Эти системы способны поглощать большое количество водорода. В отличие от бинарных гидридов (Z9rH2, TiH2), термостабильность гидридов интерметаллидов можно регулировать в широких пределах путем изменения соотношения и природы образующих сплав компонентов.
Каталитические процессы на гидридах интерметаллидов обладают рядом своеобразных особенностей, обусловленных наличием водородной подсистемы, которая может претерпевать фазовые превращения при изменении концентрации водорода в газовой фазе [3]. Изменение концентрации водорода в газовой фазе является причиной сложного динамического поведения гидридной подсистемы.
Поверхностные процессы диссоциативной адсорбции и рекомбинации водорода при абсорбции и десорбции также влияют на общую скорость процесса. Вопрос о стадии, лимитирующей скорость реакции, является принципиальным, поскольку позволяет оценить влияние водорода из гидрида, как на его каталитические свойства, так и на формирование активной поверхности. Удаление водорода из решетки интерметаллида в газовую фазу происходит, по крайней мере, в две стадии: переход атомов водорода из пустот решетки на поверхность
и десорбция молекул водорода, диссоциативно хемосорбированных на поверхности Присутствие какого-либо адсорбата на поверхности гидрида может повлиять на кинетику выделения водорода только в том случае, если адсорбированное вещество способно изменить скорость процесса, описываемого стадией (II). Результаты исследования кинетики выделения водорода из гидридов интерметаллидов ZrNi и ZrCo в атмосфере аргона, этилена и этана представлены на рис. 1.Рис. 1.
Влияние природы газов на скорость выделения водорода из гидрида ZrNiH": 1 – 463 К, этилен; 2 – 483 К, кислород; 3 – 463 К, аргон.
Как видно из приведенных данных, природа газа, в атмосфере которого протекает термическое разложение гидридов, оказывает существенное влияние на скорость процесса. Газы адсорбирующиеся на поверхности ГИ оказывают тормозящее действие на десорбцию водорода, в то время как процесс выделения водорода в присутствии аргона является процессом второго порядка по водороду. Следовательно, при выделении водорода из гидридов лимитирующей стадией является рекомбинация атомов водорода на поверхности (стадия II). Таким образом, скорость выделения водорода из объема гидридов зависит от состояния поверхности и в свою очередь оказывает существенное влияние на ее формирование и каталитические свойства.
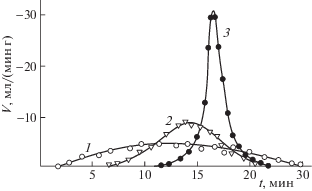
На рис. 2 приведены зависимости скорости выделения водорода из гидрида ZrNiН2.88 от времени при температуре 200 и 210°С в токе аргона.
Рис. 2.
Зависимости скорости выделения водорода из ZrNiН2.88 от времени при 200 (1) и 210°С (2) в атмосфере Аr.
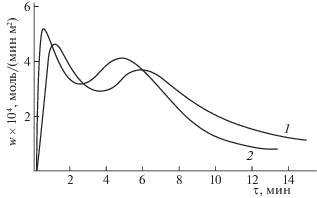
Наличие второго максимума на кинетических кривых обусловлено фазовыми превращениями, происходящим в гидриде в процессе выделения водорода.
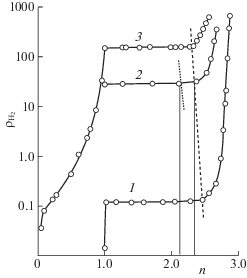
Из изотермы давление–состав (рис. 3) следует, что при 200°С, когда n = 2.4–2.3 (где n – стехиометрия по водороду) происходит фазовый переход из β‑фазы, соответствующей гидриду, в α + β-фазу, соответствующую области сосуществования гидрида и α-раствора.
При некотором содержании водорода, которое соответствует спинодальному распаду, лимитирующей стадией в процессе десорбции водорода может быть диффузия последнего в гидриде. Из зависимости коэффициента диффузии от содержания водорода следует, что диффузия не обязательно должна быть лимитирующей стадией во всем диапазоне изменения n, т.е. не исключено, что при некоторых концентрациях водорода диффузия будет достаточно быстрым процессом. Из представленных результатов следует, что механизм каталитической реакции на гидридах интерметаллидов может зависеть от стехиометрии гидрида по водороду и в области концентраций, приводящих к спинодальному распаду, может претерпевать изменение.
Таким образом, гидрирование непредельных углеводородов в присутствии катализаторов на основе гидридов интерметаллидов сопровождается гетерофазным обменом водорода кристаллической решетки с водородом газовой фазы [4]. Водород, растворенный в кристаллической решетке интерметаллида, принимает непосредственное участие в каталитических реакциях [5]. Выделяющийся из кристаллической решетки гидрида водород находится на поверхности первоначально в атомарном состоянии, что обуславливает высокую активность гидридных катализаторов. Скорость выделения водорода из объема гидридов зависит от наличия на поверхности адсорбированных молекул, а также от состояния поверхности гидрида и определяется не диффузией в кристаллической решетке, а количеством “свободных” центров на поверхности [1, 5–7]. Пополнение запаса водорода в кристаллической решетке катализатора происходит за счет взаимодействия с водородом газовой фазы. Процесс этот протекает, по крайней мере, в две стадии: диссоциация хемосорбированных на поверхности молекул водорода и переход образующихся атомов водорода с адсорбционных центров в объем катализатора. Перечисленные свойства катализаторов на основе гидридов интерметаллидов делают их принципиально отличными от традиционных катализаторов гидрогенизации.
ФОРМИРОВАНИЕ АКТИВНОЙ ПОВЕРХНОСТИ КАТАЛИЗАТОРОВ НА ОСНОВЕ ГИДРИДОВ ИНТЕРМЕТАЛЛИДОВ
При контакте с воздухом на поверхности гидридов интерметаллидов образуется тонкий поверхностный слой оксида, препятствующий дальнейшему окислению. Вместе с тем, именно состав и структура поверхностного слоя, его диффузионная проницаемость для водорода определяет каталитические свойства гидридов.
Известно, что при контакте металлического сплава с каким-либо адсорбатом поверхность сплава обогащается тем компонентом сплава, который обладает большей энергией связи с данным адсорбатом. Отсюда, в частности, следует, что при контакте с кислородом в первую очередь окисляется компонент сплава, обладающий большим сродством к кислороду. Стандартные энергии Гиббса образования оксидов никеля и циркония составляют соответственно = = ‒211.58 кДж/моль и = –1039.7 кДж/моль, т.е. /δ(ΔG)/ = 828.12 кДж/моль. Следовательно, в интерметаллиде ZrNi должно наблюдаться селективное окисление циркония. Окисление сопровождается диффузией катионов циркония из подокалинного слоя к поверхности. Это, в свою очередь, приводит к обеднению подокалинного слоя цирконием и, следовательно, обогащению его никелем. Аналогичная картина наблюдается при окислении сплавов циркония с железом, циркония с кобальтом, гафния с никелем и т.д. Во всех перечисленных интерметаллидах селективно окисляющимися компонентами являются металлы IV, V групп.
Известно, что ни одно из интерметаллических соединений металлов IV, V групп с металлами подгруппы железа не обладает ферромагнитными свойствами из-за отсутствия в этих соединениях обменного взаимодействия, отвечающего за ферромагнетизм. Однако в процессе окисления интерметаллидов наблюдается появление ферромагнетизма [8]. Это указывает на образование в процессе окисления фазы ферромагнитного металла. Исследование поверхности интерметаллидов методами рентгенофотоэлектронной спектроскопии (РФС) и магнитооптическим методом показали, что в процессе окисления происходит сегрегация более благородного компонента сплава на поверхности с выделением фазы металла подгруппы железа [9, 10]. В частности, для системы ZrNi методом РФС показано, что поверхность исходного сплава покрыта нестехиометрическим оксидом циркония ZrO2 – x. Относительное содержание элементов в приповерхностном слое Ni/Zr = 0.2–0.3. Тем не менее, исходный интерметаллид не обладает ферромагнитными свойствами, однако экспозиция сплава ZrNi при температуре более 200°С в присутствии даже незначительного количества кислорода (10–1 Торр) приводит к появлению ферромагнитных свойств. Об этом свидетельствуют результаты измерения магнитной восприимчивости и исследования ферромагнитного резонанса (ФР). Исходные образцы ZrNi и его гидрида не давали сигнала ФР. После нагревания образцов при 300оС в течение 30 мин на воздухе появлялся интенсивный асимметричный сигнал (ΔН = 1300 Э), характерный для кристаллического никеля. Дальнейшее нагревание сопровождалось увеличением интенсивности и уширением линии ФР ((ΔН = 2400 Э), что указывает на рост концентрации никеля и укрупнение его кристаллов.
Одновременно с появлением сигналов ФР происходит резкое увеличение магнитной восприимчивости исследуемых образцов. Характер зависимости намагниченности от напряженности магнитного поля (отсутствие остаточной намагниченности и коэрцитивной силы) на ранних стадиях окисления указывает на суперпарамагнитные свойства образующихся в результате окислительной сегрегации частиц никеля.
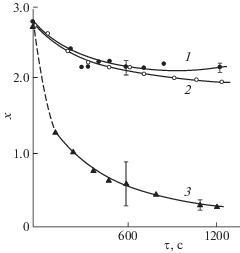
Рентгенофазовый анализ образцов ZrNiHx (1.4 < x < 2.8), окисленных в тех же условиях, показал, что их кристаллическая структура соответствует структуре гидрида. На дифрактограммах наблюдались лишь слабые широкие пики, соответствующие никелю. Это позволило предположить, что процесс разрушения гидридной фазы и выделения фазы никеля протекает только в приповерхностном слое.
Для исследования структуры поверхностного слоя интерметаллидов и их гидридов был применен магнитооптический метод [7, 8]. Метод основан на использовании экваториального эффекта Керра, заключающегося в изменении интенсивности отраженного от поверхности исследуемого образца света при изменении магнитного поля. Величину относительного изменения интенсивности отраженного света при экваториальном намагничивании определяли по формуле δэ = = (R ‒ R0)/R, где R и R0 – интенсивность отраженного света на Р-компоненте в ненамагниченном и намагниченном состоянии соответственно. Метод позволяет оценить относительную концентрацию ферромагнитной фазы в слое толщиной до 30 нм. На рис. 4 представлена зависимость величины экваториального эффекта Керра от энергии квантов падающего света для поликристаллического никеля, интерметаллида ZrNi, прогретого на воздухе при 200°С 6 ч, и для гидрида ZrNiHx, прогретого на воздухе в тех же условиях. Как видно из рис. 4, в видимой и ИК‑областях спектра кривые для Ni и исследуемых образцов, прогретых в течение 6 ч, сходны. Эти результаты свидетельствуют о появлении в процессе окисления интерметаллида ZrNi и соответствующего гидрида ферромагнитного слоя никеля. Существенно, что после незначительной полировки окисленных образцов ферромагнитный эффект исчезает. Этот факт указывает на то, что структурные изменения, вызванные окислением, происходят только в приповерхностном слое катализаторов.
Рис. 4.
Экваториальный эффект Керра: 1 – поликристаллический никель, 2 – интерметаллид ZrNi после экспозиции на воздухе при 200°С в течение 6 ч, 3 – гидрид ZrNiH2.8 после экспозиции на воздухе при 200°С в течение 6 ч, 4 – интерметаллид ZrNi после экспозиции на воздухе при 200°С в течение 3 ч.
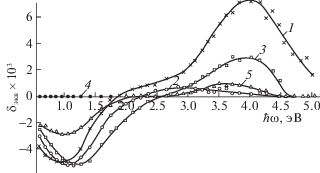
Уменьшение эффекта по отношению к чистому никелю в коротковолновой области магнитооптического спектра свидетельствует о наличии над ферромагнитным слоем никеля неферромагнитного слоя оксида, прозрачного в ИК- и видимой областях спектра. Из сравнения кривых 2 и 3 на рис. 4 видно, что на гидриде оксидный слой заметно тоньше, чем на интерметаллиде.
Исследование поверхностного слоя интерметаллидов и гидридов методом РФС подтвердило результаты магнитооптического исследования и позволило получить дополнительную информацию о механизме процесса окислительной сегрегации. По данным РФС как в исходных образцах интерметаллида и его гидрида, так и в образцах после окислительной обработки цирконий в приповерхностном слое находится только в окисленной форме. Относительное распределение никеля и циркония в приповерхностном слое интерметаллида ZrNi после окислительной обработки показано на рис. 5.
Рис. 5.
Зависимости отношения СNi/CZr от времени ионного травления поверхности интерметаллида ZrNi: 1 – исходный образец, 2 – образец, окисленный в течение 80 мин, 3 – образец, окисленный в течение 160 мин, 4 – образец, окисленный в течение 320 мин.
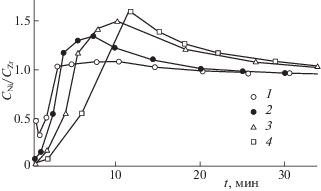
Эти данные получены методом ионного травления, причем одна минута травления ионами Ar соответствует удалению с поверхности слоя толщиной 2 нм. Как видно из рис. 5, в интерметаллиде поверхностный слой на глубину 1–4 нм обогащен оксидом , далее следует слой, обогащенный никелем, и только на глубине 40 нм достигается стехиометрический состав. Такой порядок распределения элементов по глубине поверхностного слоя характерен как для интерметаллида, так и для его гидрида (рис. 6).
Рис. 6.
Зависимости отношения СNi/CZr от времени ионного травления поверхности гидрида ZrNiНх: 1 – исходный гидрид, 2 – гидрид, окисленный 50 мин, 3 – окисленный 100 мин.
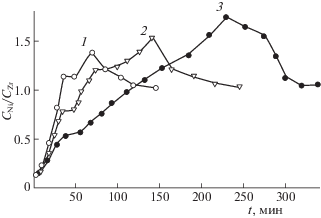
Аналогичные изменения состава поверхностного слоя наблюдались после окислительной обработки интерметаллидов HfNi, ZrCo, HfCo, ZrNiCu и их гидридов [11, 12].
Сопоставление данных РФС и магнитооптики позволяет сделать определенные выводы относительно состояния никеля в подокалинном слое. Магнитооптическое исследование показывает, что, начиная с некоторого момента окисления, интерметаллид обнаруживает поверхностный ферромагнетизм. Следовательно, в подокалинной области содержится чистый никель, поскольку известно, что уже 8 ат. % примесей в никеле неферромагнитного металла понижают температуру Кюри никеля до комнатной.
С другой стороны, данные РФС показывают, что максимальное обогащение подокалинного слоя никелем не превышает 60–70%. Это противоречие можно объяснить, если предположить, что в процессе окисления никель в подокалинном слое образует фазу в виде кристаллитов, вкрапленных в матрицу или исходного интерметаллида. При этом кристаллиты никеля на ранних стадиях окислительной обработки обладают суперпарамагнитными свойствами, а с увеличением времени окисления наблюдается агрегация частиц никеля. На агрегацию частиц никеля указывают магнитные гранулометрические исследования, показавшие, что окисление при 250°С в течение 30 мин приводит к образованию частиц никеля размером 4 нм, а через 1 ч окисления размер увеличивается до 9.5–10 нм. Исследование временной зависимости остаточной намагниченности показало, что после 4 ч окисления система проявляет значительную магнитную вязкость, которая отсутствует на начальных стадиях окисления. Это указывает на агрегацию частиц никеля и появление многодоменных частиц. Зависимость размера частиц никеля от времени и температуры предварительного окисления открывает широкие возможности регулирования среднего размера частиц каталитически активного металла.
Для проведения окислительной сегрегации в интерметаллидах и их гидридах требуются достаточно жесткие условия. На рис. 7 показано изменение состава поверхностного слоя во времени при окислительной обработке интерметаллида ZrNi и его гидрида. Данные получены магнитооптическим методом.
Рис. 7.
Зависимости экваториального эффекта Керра от времени окисления интерметаллида ZrNi и гидрида ZrNiH2.8 (hω = 1.14 эВ): ZrNi 1 – 100°С; 2 – 200°С; ZrNiH2.8; 3 – 100°С; 4 – 200°С.
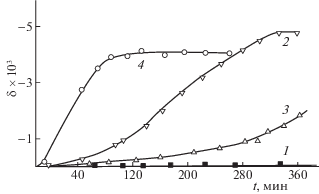
Как видно из рис. 7, скорость формирования поверхностного ферромагнитного слоя никеля в случае гидрида (кривые 3, 4) значительно выше, чем в интерметаллиде (кривые 1 и 2). Данные РФС подтверждают этот вывод.
Явление ускорения процесса поверхностной окислительной сегрегации под влиянием водорода, обнаружено впервые и положено в основу нового способа приготовления тонких ферромагнитных пленок на поверхности неферромагнитных материалов [13, 14].
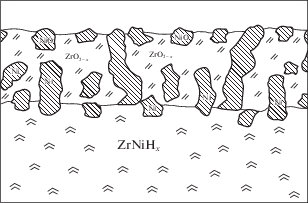
На основании приведенных результатов можно предложить следующую структуру катализатора, образующегося в результате окислительной сегрегации гидрида интерметаллида (рис. 8). Такой катализатор представляет собой гидридную фазу, поверхностный слой которой состоит преимущественно из нестехиометрического оксида циркония и никеля, причем никель, находящийся на поверхности, пребывает в окисленном состоянии. Естественно, что при восстановлении в водороде оксидная пленка никеля также восстанавливается. Если не принимать во внимание гидридную подсистему, то такой катализатор внешне напоминает обычный металл-нанесенный катализатор.
Свойства системы, образующейся в результате окислительной сегрегации, принципиально отличаются как от свойств традиционных нанесенных катализаторов, так и от исходных интерметаллидов или гидридов. Оказалось, что интерметаллид ZrNi, подвергнутый окислительной сегрегации, обладает уникальными свойствами, а именно, способностью поглощать водород в мягких условиях (при 200°С и атмосферном давлении), образуя гидрид состава ZrNiH2.7–2.8. Следует отметить, что стандартный способ получения гидридов интерметаллидов предполагает предварительное нагревание исходного интерметаллида в вакууме до температуры около 900оС в атмосфере высокочистого водорода с целью растворения в объеме поверхностной оксидной пленки, препятствующей контакту металла с водородом.
На рис. 9 представлены зависимости скорости поглощения водорода интерметаллидом ZrNi при 200°С от времени для образцов с различной степенью окисления. Исходный интерметаллид практически не поглощает водород в этих условиях. Как видно из рисунка скорость поглощения водорода заметно возрастает с увеличением продолжительности предварительного окисления. Количество поглощенного водорода во всех случаях примерно одинаково и соответствует гидридной фазе состава ZrNiH 2.7–2.8.
Рис. 9.
Скорость поглощения водорода интерметаллидом ZrNi как функция времени предварительного окисления при 200°С: 1 – время окисления 2 ч; 2 – 3 ч; 3 – 5 ч.
Таким образом, процесс окислительной сегрегации приводит к увеличению диффузионной проницаемости оксидного слоя для водорода. Прежде чем попасть в решетку интерметаллида водород должен претерпеть диссоциативную хемосорбцию на поверхности. Диссоциативная хемосорбция водорода протекает на никеле, который в заметном количестве присутствует на поверхности гидрида. Очевидно, что в начальный момент взаимодействия водорода с гидридом происходит восстановление оксида никеля. Далее водород, хемосорбированный на никеле, диффундирует через никель в интерметаллид. Увеличение скорости поглощения водорода с ростом продолжительности предварительного окисления обусловлено увеличением концентрации никеля на поверхности по мере окисления.
Следует отметить, что окислительно-восстановительная обработка гидрида интерметаллида, приводящая к формированию поверхностного слоя, изображенного на рис. 8, не влияет на стехиометрию гидрида по водороду, которая после восстановления остается прежней [15]. Это свидетельствует о том, что формирование оксидного слоя не влияет на состояние гидридной подсистемы.
Присутствие гидридной фазы в объеме катализаторов существенно влияет на специфику их каталитического действия. Это следует из сравнения каталитических свойств катализаторов на основе гидридов и нанесенных катализаторов. Гидридные катализаторы в меньшей степени подвержены закоксовыванию чем аналогичные металл-нанесенные системы, например Ni/ZrO2.
Наличие гидридной подсистемы обеспечивает стабильность работы катализатора. Это достигается за счет интенсивного гетерофазного обмена, в результате которого поверхностный слой непрерывно обрабатывается потоком водорода, поступающим как из газовой фазы, так и из объема гидрида.
Установленные закономерности позволяют предложить новый метод приготовления гетерогенных катализаторов, в основе которого лежит явление поверхностной окислительной сегрегации. На основе гидридов интерметаллидов получены стабильные и активные катализаторы превращений углеводородов, работающие при относительно низких температурах, атмосферном давлении водорода и длительное время не требующие регенерации.
ПРЕВРАЩЕНИЯ УГЛЕВОДОРОДОВ В ПРИСУТСТВИИ КАТАЛИЗАТОРОВ НА ОСНОВЕ ГИДРИДОВ ИНТЕРМЕТАЛЛИДОВ
Гидриды интерметаллидов ZrNiH2.8, ZrCoH2.8, ZrFeH0.7, ZrNi0.7Cu0.3H1.8, HfNiH2.8, Ti2CuH5.79, TiNiH1.53, Nb3NiH2.4 показали высокую активность в реакциях гидро-дегидрогенизации, гидродеалкилирования, гидрогенолиза, изомеризации углеводородов [16].
В присутствии катализатора на основе ZrNiH2.8 протекают реакции гидрирования, деметилирования и гидрогенолиза 1-метилнафталина. Выход нафталина в реакции гидродеалкилирования составляет 25 мас. %. Продукты гидрирования представлены, в основном, метилтетралинами, продукты гидрогенолиза – алкилбензолами, а при более высокой температуре (350°С) углеводородами С1–С3. При температуре до 300°С наиболее селективно протекают реакции гидрирования, а выше 300°С гидрогенолиза.
В интервале температур 180–300°С, в присутствии ZrNiH2.8 и HfNiH2.8 нафталин претерпевает гидрирование с образованием тетралина и декалинов, причем при атмосферном давлении и с высокими степенями превращения. При температурах 210–240°С селективность гидрирования нафталина в тетралин составляет 92–98%. Катализаторы на основе гидридов ZrNi и HfNi активны в превращении и других полициклических ароматических углеводородов таких как индан, тетралин, октагидроантрацен, октагидрофенантрен и др.
ПРЕВРАЩЕНИЯ АЗОТСОДЕРЖАЩИХ СОЕДИНЕНИЙ
Катализаторы на основе гидридов ZrFe и ScFe проявляют высокую активность в каталитических превращениях азотсодержащих углеводородов, таких как пиридин, пиперидин, 2-,3-,4-пиколины, хинолин и диметилгидразины. Максимум активности достигается при температурах, соответствующих интенсивному выделению водорода из гидридной фазы [17].
В результате превращений диметилгидразинов образуется метан, аммиак, азот и метиламины. Относительное содержание продуктов зависит от температуры реакции. Полная конверсия на ScFe2Hx достигается при 270°С. На основе этих результатов предложен способ полной каталитической утилизации несимметричного диметилгидразина, что имеет большое экологическое значение [18].
ГИДРИРОВАНИЕ ОКСИДОВ УГЛЕРОДА В ПРИСУТСТВИИ КАТАЛИЗАТОРОВ НА ОСНОВЕ ГИДРИДОВ ИНТЕРМЕТАЛЛИДОВ
Гидриды интерметаллидов оказались весьма перспективными катализаторами гидрирования оксидов углерода. Так, гидрид интерметаллида ZrCuxHy оказался весьма эффективным катализатором синтеза метанола. Катализаторы на основе интерметаллидов ZrCux по своей производительности в синтезе метанола сравнимы с промышленным катализатором СНМ-1 и превосходят его по термостабильности и устойчивости к дезактивации водой.
Катализаторы на основе гидридов ZrNiHx и HfNiHx весьма эффективны в процессах высокотемпературного гидрирования СО и превосходят по активности и термостабильности традиционные металл-содержащие катализаторы [19, 20].
Катализаторы на основе гидиридов ZrFexHy показали превосходную активность в синтезе Фишера–Тропша. Катализатор на основе ZrFe2Hx в несколько раз превосходит по активности в синтезе высших углеводородов и спиртов традиционные плавленые катализаторы синтеза Фишера–Тропша.
ГИДРИДНЫЕ КАТАЛИЗАТОРЫ В ПРОЦЕССАХ ОБЛАГОРАЖИВАНИЯ НЕФТЯНЫХ ОСТАТКОВ
В настоящее время в мировой практике отсутствуют катализаторы устойчивые к отравлению азот и серосодержащими веществами, которые содержатся в значительных концентрациях в нефтяных остатках и тяжелых нефтях. Катализаторы на основе ZrCoHx оказались весьма перспективными в процессах осветления тяжелых нефтей. Кроме того, оказалось, что эти катализаторы проявляют высокую активность и стабильность в процессах деметаллизации нефтяного сырья.
Список литературы
Лунин В.В. // Изв. АН СССР. Неорган. материалы. 1978. Т. 14. С. 19.
Лунин В.В. // Наука в СССР. 1985. № 5. С. 78.
Чернавский П.А., Лунин В.В. // Кинетика и катализ. 1985. Т. 26. С. 232.
Лунин В.В., Бондарев Ю.М., Падурец Л.И. и др. // ДАН. 1975. Т. 230. С. 383.
Лунин В.В., Чернавский П.А., Чулков Н.Г. // II Всесоюзн. конф. по механизму каталитических реакций. Тез. докл. М. 1978. Т. 1. С. 210.
Лунин В.В., Соловецкий Ю.И., Чернавский П.А. // ДАН. 1982. Т. 266. С. 1417.
Лунин В.В., Чернавский П.А., Соловецкий Ю.И. // II Всесоюзн. конф. “Нестационарные процессы в катализе”. Тез. докл. Новосибирск. 1983. Ч. I. С. 140.
Лунин В.В., Чернавский П.А., Рахамимов Б.Ю., Чулков Н.Г. // Изв. АН СССР, Неорган. материалы. 1978. Т. 14. С. 1593.
Кринчик Г.С., Никитин Л.В., Лунин В.В., Чернавский П.А. // ФТТ. 1979. № 2. С. 599.
Кринчик Г.С., Лунин В.В., Никитин Л.В., Чернавский П.А. // Материалы V Советско-японского семинара по катализу. Ташкент. 1979. С. 144.
Лунин В.В., Нефедов В.И., Жумадилов Э.К. и др. // ДАН. 1978. Т. 240. С. 114.
Лунин В.В., Нефедов В.И., Рахамимов Б.Ю., Эриванская Л.А. // Журн. физ. химии. 1980. Т. 54. С. 881.
Кринчик Г.С., Лунин В.В., Никитин Л.В., Чернавский П.А. Способ получения тонкой ферромагнитной пленки (публикация в открытой печати запрещена): А. с. № 738462 СССР // 1980.
Лунин В.В., Кринчик Г.С., Никитин Л.В., Чернавский П.А. // Способ получения тонких ферромагнитных пленок: А. с. № 802250 СССР // Бюлл. изобр. № 50. 1981.
Чернавский П.А., Киселев В.В., Лунин В.В. // Кинетика и катализ. 1989. Т. 30. С. 497.
Лунин В.В., Чернавский П.А., Чулков Н.Г., Четина О.В. и др. Природа действия катализаторов на основе гидридов интерметаллидов. В кн.: Гетерогенный катализ. Новосибирск: Наука, 1982. С. 129.
Лунин В.В., Галафеев В.А., Спиридонова А.Б., Платэ А.Ф. // Нефтехимия. 1980. Т. 20. С. 881.
Лунин В.В., Галафеев В.А., Крюков О.В. Катализатор для разложения несимметричного диметилгидразина (не подлежит опубликованию в открытой печати): А. с. № 686183 СССР // 1978.
Лунин В.В., Лапидус А.Л., Брук И.А. и др. Способ получения метана: А. с. № 802250 СССР // Бюлл. изобр. № 50. 1981.
Lapidus A.L., Bruk I.A., Lunin V.V., Kryukov O.V. // Mol. Chem. 1985. V. 2. P. 89.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии