Журнал физической химии, 2021, T. 95, № 3, стр. 426-433
Структура поверхности Pt–Ni–Cr/С-катализаторов
Т. В. Богдан a, b, *, А. Н. Каленчук a, b, С. В. Максимов a, В. И. Богдан b, a
a Московский государственный университет имени М.В. Ломоносова,
Химический факультет
119991 Москва, Россия
b Российская академия наук, Институт органической химии им. Н.Д. Зелинского
119991 Москва, Россия
* E-mail: chemist2014@yandex.ru
Поступила в редакцию 02.09.2020
После доработки 02.09.2020
Принята к публикации 14.09.2020
Аннотация
Методом ПЭМ исследованы состав и структура поверхностных фаз катализаторов на основе Pt, Ni и Cr (платиновых, би- и триметаллических), нанесенных на носитель Сибунит. Проведено сопоставление структуры катализаторов до и после восстановительного гидрирования. Получено, что в системе Pt/C металл находится в высокодисперсном состоянии, преимущественно в окисленной форме. В двойных и тройных катализаторах поверхность содержит металлическую и оксидную составляющие, на поверхности Pt–Ni-катализатора металлическая фаза более выражена по сравнению с Ni–Cr и Pt–Ni–Cr. Катализаторы на основе никеля содержат крупные металлические частицы (до 30 нм). После восстановительного гидрирования наблюдается увеличение дисперсности и уменьшение кристалличности металлических частиц во всех исследуемых системах.
Разработка новых эффективных катализаторов для процессов гидрирования ненасыщенных органических соединений имеет большой практический и научный интерес. Гетерогенно-каталитические реакции гидрирования-дегидрирования, гидрогенолиза С–С- и С–О-связей, риформинга природного газа обычно проводят на катализаторах на основе благородных и переходных металлов (Rh, Ru, Pt, Pd, Ni, и др.) [1–3]. В работах [4–13] рассматриваются электронные особенности нанесенных Pt-содержащих каталитических систем в контексте их влияния на каталитическую активность. Дегидрирование циклоалканов наиболее эффективно происходит на Pt-катализаторах, однако необходимость снижения содержания благородного металла стимулирует поиск альтернативных каталитических систем [5, 6], в частности, путем комбинирования Pt с переходными d-металлами [7, 8]. Взаимодействие электронных оболочек Pt и переходных металлов ведет к снижению электронной плотности на 5d-орбиталях Pt, что способствует увеличению адсорбции реагирующих молекул на поверхности катализатора [9]. Влияние никеля на увеличение каталитической активности Pt-нанесенных на углерод катализаторов дегидрирования циклогексана показано в работе [10]. В реакции риформинга метана установлено промотирующее действие Cr(III) на Ni в бинарных Ni–Cr системах [11]. Авторы [12] связали эффект влияния Cr(III) с образованием в исследуемых NiCr-системах кристаллитов со структурой шпинели NiCr2O4. Увеличение активности трёхкомпонентных Pt–Ni–Cr катализаторов гидрирования дегидрирования ароматических соединений авторы [13] связывают с частичным сплавлением никеля и хрома. Отмечается наличие сложных многофазных сплавов с кристаллитами никеля, однако на рентгенограммах отсутствуют сверхструктурные пики под малыми углами, характерные для образования упорядоченных интерметаллидов. При этом обнаружены слабые отражения, характерные для оксида хрома.
Таким образом, для обнаружения активных фаз актуальным становится детальное изучение структуры поверхности катализаторов. В настоящей работе проведено исследование методами просвечивающей электронной микроскопии (ПЭМ) и энергодисперсионной рентгеновской спектроскопии (ЭДС) состава и структуры поверхностных фаз Pt–Ni–Cr-нанесенных на углеродный носитель катализаторов с пониженным содержанием благородного металла и отличающихся концентрацией металлов, разным порядком их нанесения, свежеприготовленных и после восстановительной активации водородом.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Приготовление катализаторов
Для получения металл-нанесенных катализаторов использовали окисленный углеродный носитель сибунит (ЦНХТ ИК СО РАН, Омск) [13] со средним диаметром гранул 1.5–1.8 мм, удельной поверхностью 243 см2/г, средним размером пор 4.2 нм и объемом пор 0.45 см3/г. Монометаллические катализаторы Pt/С с содержанием Pt 0.1% и 3% (по массе) готовили пропиткой носителя по влагоемкости рассчитанным количеством водного раствора платинохлористоводородной кислоты [H2PtCl6 ⋅ 6H2O]. Биметаллические системы с платиной получали соответствующей пропиткой монометаллических Ni/С и Cr/С систем, которые, в свою очередь, были получены пропиткой носителя рассчитанным количеством водного раствора нитратов соответствующих металлов [Ni(NO2)3 ⋅ 6H2O] и [Cr(NO3)3 ⋅ 9H2O]. Трехкомпонентные катализаторы получали нанесением водного раствора [H2PtCl6 ⋅ 6H2O] на соответствующие термически обработанные никель-хромовые катализаторы. Никель-хромовые нанесенные на сибунит системы приготовлены двумя способами: 1) 3Ni/1.5Cr/С и 1.5Cr/3Ni/С катализаторы получали пропиткой образцов Cr/С и Ni/С, соответственно, 2) системы (3Ni–1.5Cr)/С приготовлены совместной пропиткой носителя смесью рассчитанных количеств водных растворов нитратов солей никеля и хрома. Детали приготовления катализаторов и проведение восстановительного гидрирования подробно описаны в работе [13]. Структура поверхности исходных систем: 0.1Pt/С, 3Pt/С, 0.1Pt/3Ni/C, (3Ni–1.5Cr)/C и 0.1Pt/1.5Cr/3Ni/C исследована после приготовления, а систем – 0.1Pt/3Ni/C, 0.1Pt/1.5Cr/C и 0.1Pt/(3Ni–1.5Cr)/C и 0.1Pt/1.5Cr/3Ni/C, – после восстановительной активации водородом исходных образцов.
Исследование структуры поверхностных фаз катализаторов
Состав и структуру поверхности катализаторов изучали методом просвечивающей электронной микроскопии (ПЭМ) на электронном микроскопе JEOL-2100F (Japan) в режимах светлого и темного поля при ускоряющем напряжении 200 кВ. Также методом энергодисперсионной рентгеновская спектроскопии (ЭДС) был проведен элементный анализ отдельных фрагментов. Для кристаллитов были получены дифракционные картины, фазовый состав кристаллитов определяли путем сопоставления данных ЭДС и определенных по дифракционной картине межплоскостных расстояний со справочными значениями для чистых металлов, их сплавов, оксидов и карбидов из открытой базы данных [14]. Некоторые из межплоскостных расстояний, на основании которых производилась идентификация поверхностных фаз, приведены в табл. 1. Оценка размера частиц производилась визуально по микрофотографиям ПЭМ.
Таблица 1.
Межплоскостные расстояния, на основании которых производилась идентификация поверхностных фаз
| Катализатор, мас. % |
Поверхностная фаза | Пространствен-ная группа | d, нм | d1, нм | hkl | N [14] |
|---|---|---|---|---|---|---|
| 3 Pt/C, мас. % | Pt | Fm-3m | 0.393 | 0.392 | 100 | 4 334 349 |
| Pt3O4 | Fm-3n | 0.393 | 0.395 | 011 | 1 008 965 | |
| 0.1Pt/3Ni, мас. % | Ni0.92 Pt0.08 | Fm-3m | 0.216 | 0.216 | 111 | 1 523 344 |
| NiPt | Fm-3m | 0.219 0.206 |
0.219 0.206 |
111 | 1 538 610 | |
| NiO | C2/m | 0.241 | 0.240 | –111 | 1 522 025 | |
| R-3m | 0.209 | 0.209 | 012 | 15 26 380 | ||
| Ni | Fm-3m | 0.204 | 0.204 | 111 | 4 320 489 | |
| PtO2 | Pnnm | 0.260 | 0.258 | 110 | 1 530 633 | |
| Pt3O4 | Fm-3n | 0.250 | 0.250 | 011 | 1 008 965 | |
| 0.1Pt/1.5Cr, мас. % | Cr | Fm-3m | 0.365 | 0.368 | 100 | 1 535 885 |
| Cr3C2 | Pnma | 0.211 | 0.211 | 113 | 7 222 489 | |
| 0.212 | 105 | |||||
| Pt3.4O4 | Fm-3n | 0.404 | 0.397 | 011 | 2 002 332 | |
| 3Ni–1.5Cr , мас. % | Cr | Fm-3m | 0.208 | 0.208 | 111 | 1 535 885 |
| CrNi3 | Fm-3 | 0.205 | 0.205 | 111 | 1 525 114 | |
| Cr0.4Ni0.6 | Fm-3m | 0.207 | 0.207 | 111 | 1 523 948 | |
| Cr3C2 | Pnma | 0.210 | 0.211 | 113 | 7 222 489 | |
| 0.212 | 105 | |||||
| 0.224 | 0.224 | 203 | ||||
| Cr2O3 | R-3c | 0.264 | 0.266 | –114 | 9 0163 27 | |
| 0.216 | 0.217 | –123 | ||||
| NiCrO4 | Cmcm | 0.204 | 0.204 | 202 | 1 008 105 | |
| 0.206 | 0.206 | 040 | ||||
| NiCr2O4 | I41/amd | 0.213 | 0.213 | 042 | 1 536 758 | |
| 0.204 | 0.204 | 204 | ||||
| Fd-3m | 0.208 | 0.208 | 004 | 2 009 226 | ||
| NiO | R-3m | 0.209 | 0.209 | 012 | 1 526 380 | |
| Cr3O | Pm-3n | 0.186 | 0.186 | 112 | 1 528 029 | |
| 0.1Pt/1.5Cr/3Ni, мас. % | Cr | Fm-3m | 0.214 | 0.213 | 111 | 9 008 467 |
| CrNi3 | Fm-3m | 0.178 | 0.178 | 200 | 1 525 114 | |
| CrNi | Fm-3m | 0.207 | 0.207 | 111 | 1 525 375 | |
| Cr0.4Ni0.6 | Fm-3m | 0.179 | 0.179 | 200 | 1 523 948 | |
| 0.206 | 0.207 | 111 | ||||
| Cr23C6 | Fm-3m | 0.150 | 0.149 | 117 | 2 107 332 | |
| Cr3C2 | Pnma | 0.189 | 0.188 | 044 | 7 222 489 | |
| 0.224 | 0.224 | 203 | ||||
| Pt3O4 | Fm-3n | 0.228 | 0.228 | 112 | 1 008 965 | |
| 0.278 | 0.279 | 002 | ||||
| PtO2 | Pnnm | 0.224 | 0.224 | 200 | 1 530 633 | |
| NiO | R-3m | 0.209 | 0.209 | 012 | 1 526 380 | |
| NiCrO4 | Cmcm | 0.204 | 0.204 | 202 | 1 008 105 | |
| 0.214 | 0.214 | 221 | ||||
| NiCr2O4 | I41/amd | 0.212 | 0.213 | 042 | 1 536 758 | |
| NiCr2O4 | Fd-3m | 0.251 | 0.252 | 113 | 2 009 226 |
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Структура невосстановленных катализаторов
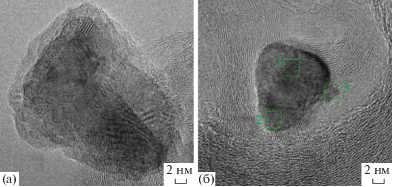
Методом ПЭМ в образцах катализатора 0.1Pt/С можно выделить металлические частицы размером от 1–2 до 10 нм (рис. 1, 2). Вследствие высокой дисперсности нанесенной платины и ее низкой концентрации, дифракционной картины от образцов получить не удалось. Элементный состав областей, содержащих частицы металла, показывает наличие кислорода.
Рис. 1.
Металлические частицы в образце 0.1Pt/C: а) частица с линейным размером 10 нм; б) частицы с линейным размером 1–2 нм и 5 нм.

Рис. 2.
Микрофотография поверхности 3Pt/С: в темнопольном изображении (а); формирование кристаллической фазы (б) и дифракционная картина в выделенной кристаллической области (в).

Данные ЭДС показывают наличие в образцах монометаллического катализатора 3Pt/С атомов углерода, кислорода, хлора и платины. Наличие хлора указывает на неполное удаление исходных солей при прокаливании катализатора. На микрофотографиях образцов 3Pt/С имеются признаки формирования кристаллической фазы на носителе (рис. 3), для которой удалось получить дифракционную картину и оценить характерное межплоскостное расстояние – 0.393 нм. Это значение близко к 0.392 нм для плоскости (100) металлической платины (пространственная группа Fm-3m, Z = 4) и 0.395 нм для плоскости (011) смешанного оксида платины Pt3O4 (пространственная группа Pm-3n, Z = 2). Сопоставляя полученные данные, можно сделать вывод о наличии на поверхности носителя атомов платины в окисленном состоянии.
Рис. 3.
Катализатор 0.1Pt/3Ni/C: а–в) Микрофотографии металлических частиц, частично или полностью покрытых оксидной оболочкой; распределение атомов никеля (г) на поверхности носителя.

В системе 0.1Pt/3Ni/C характерный размер металлических частиц составляет порядка 10–20 нм. Методом ЭДС показано, что атомы никеля преимущественно агломерируются в частицы, тогда как атомы платины равномерно распределены по образцу. Частицы представляют собой металлическое ядро, частично или полностью покрытое оксидной оболочкой (рис. 3). Данные ЭДС и определенные по дифракционной картине межплоскостные расстояния указывают на присутствие металлического никеля и твердых растворов ${\text{P}}{{{\text{t}}}_{х}}{\text{N}}{{{\text{i}}}_{{1--х}}}$. Оболочку частиц образуют оксиды NiO, Pt3O4, PtO2. Таким образом, по сравнению с монометаллическим платиновым катализатором, в системе 0.1Pt/3Ni/C наблюдается появление неокисленной металлической фазы на поверхности носителя.
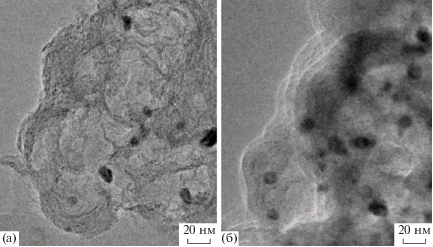
В системе (3Ni–1.5Cr)/C образуются металлические частицы размером до 50 нм (рис. 4). Согласно данным ЭДС, металлические частицы содержат атомы металлов Ni и Cr и их твердые растворы ${\text{C}}{{{\text{r}}}_{х}}{\text{N}}{{{\text{i}}}_{{1--х}}}$ в разном соотношении. Металлические частицы покрыты оксидной оболочкой, по межплоскостным расстояниям можно идентифицировать оксиды: NiO, Cr2O3, NiCr2O4 со структурой шпинели и NiCrO4 со структурой рутила. Также обнаружено образование поверхностных карбидов хрома. По сравнению с катализатором 0.1Pt/3Ni/C в составе поверхностной фазы количество металлического (неокисленного) никеля уменьшается, преобладают оксидные фазы.
Рис. 4.
Катализатор (3Ni–1.5Cr)/C: микрофотография в темном поле (а), поверхностные фазы: б) металлическая фаза, в) карбидная фаза, г) металлическая/карбидная фаза в оксидной оболочке.

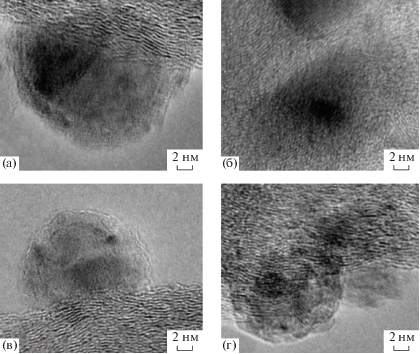
В тройной системе 0.1Pt/1.5Cr/3Ni/C образуются крупные частицы катализатора неоднородной структуры и состава (до 30 нм, рис. 5а). Фазовый состав катализатора близок к двойным системам (3Ni–1.5Cr)/C и 0.1Pt/3Ni/C: частицы катализатора находятся как в виде металлов, в частности, в виде твердых растворов замещения ${\text{C}}{{{\text{r}}}_{х}}{\text{N}}{{{\text{i}}}_{{1--х}}}$, ${\text{P}}{{{\text{t}}}_{х}}{\text{N}}{{{\text{i}}}_{{1--х}}}$, так и в виде оксидов (Pt3O4, PtO2, NiO, Cr2O3, NiCr2O4, Cr3O). Также обнаружены карбиды хрома (Cr23C6, Cr3C2). На рис. 5б приведена фотография микроструктуры металлической частицы с линейными размерами порядка 15–20 нм. Для отдельных участков частицы получены дифракционные картины и определены характерные межплоскостные расстояния. Участки 1 и 2 относятся к металлическим фазам: ${\text{C}}{{{\text{r}}}_{х}}{\text{N}}{{{\text{i}}}_{{1--х}}}$, участок 3 – на поверхности металлической частицы – содержит оксидную фазу.
Структура восстановленных катализаторов
На рис. 6 приведены микрофотографии катализатора 0.1Pt/3Ni/С до и после восстановления водородом. При одинаковом распределении металлических частиц по размерам образец после восстановительного гидрирования обладает большей дисперсностью. Элементный анализ показывает, что в состав металлических частиц входят оба металла.
Катализатор 0.1Pt/1.5Cr/C после восстановления содержит мелкодисперсные металлические частицы размером до 5 нм, дифракционная картина указывает на аморфность образца (рис. 7). Поверхностная структура катализатора 0.1Pt/1.5Cr/C напоминает структуру платинового катализатора (см. рис. 2).
В тройной системе 0.1Pt/(3Ni–1.5Cr)/C, согласно данным ЭДС, частицы металла преимущественно состоят из атомов никеля, однако отдельные образцы представляют собой твердый раствор CrхPt1–х. В тройной системе 0.1Pt/1.5Cr/3Ni/C, отличающейся от вышеприведенной порядком нанесения атомов Cr и Ni (поверх монометаллического никелевого катализатора сначала наносится хром, а затем платина), металлические частицы в целом более крупные и преимущественно также содержат атомы никеля (рис. 8). Фазовый состав катализаторов 0.1Pt/1.5Cr/3Ni/C до и после восстановления одинаковый, но частицы восстановленного катализатора более однородны по размеру и по форме. Дифракционная картина указывает на аморфность образцов. Следует отметить, что после восстановления катализатор 0.1Pt/(3Ni–1.5Cr)/C, полученный совместным нанесением солей никеля и хрома на носитель, в поверхностной фазе более представлен хромом, оксидами металлов и карбидами хрома, тогда как поверхность металлической фазы катализатора 0.1Pt/1.5Cr/3Ni/C после восстановления содержит неокисленные формы никеля и платины.
Таким образом, проведено исследование методом ПЭМ-состава и структуры поверхностных фаз моно-, би- и триметаллических катализаторов на основе Pt, Ni и Cr с пониженным содержанием благородного металла, нанесенных на носитель Сибунит и отличающихся концентрацией металлов и разным порядком их нанесения – до и после восстановления водородом. В системе Pt/C металл находится в высокодисперсном состоянии, преимущественно в окисленной форме. В би- и триметаллических катализаторах поверхность содержит металлическую и оксидную составляющие. Катализаторы на основе никеля характеризуются образованием крупных металлических частиц (до 30 нм). Поверхность Pt–Ni-систем характеризуется увеличением содержания металлической платины и окисленными формами никеля. Поверхность системы Pt–Cr отличается высокой дисперсностью и увеличением количества окисленной платины. В системах, содержащих Ni и Сr, наряду с образованием смешанных оксидов никеля и хрома, происходит восстановление хрома и образование карбидов. На поверхности Pt–Ni-катализатора металлическая фаза более выражена по сравнению с Ni–Cr и Pt–Ni–Cr. В тройных системах происходит взаимное влияние компонентов друг на друга: в присутствии никеля увеличивается доля металлической платины, в присутствии хрома металлическая платина переходит в активную окисленную форму. Проведено сопоставление структуры катализаторов до и после гидрирования. После восстановительного гидрирования наблюдается увеличение дисперсности и уменьшение кристалличности металлических частиц во всех исследуемых системах.
Данная работа является развитием идей в области физической химии и гетерогенного катализа академика РАН Лунина Валерия Васильевича. Авторы благодарны В.В. Лунину – Человеку, Ученому и Педагогу.
Список литературы
Кустов Л.М., Каленчук А.Н., Богдан В.И. // Успехи химии. 2020. V. 89. P. 897 [Kustov L.M., Kalenchuk A.N., Bogdan V.I. // Rus. Chem. Rev. 2020. V. 89. P. 897].
Kalenchuk A N., Bogdan V.I., Dunaev S.F., Kustov L.M. // Fuel. 2020. V. 280. P. 118625.
Bogdan V.I., Koklin A.E., Kalenchuk A.N., Kustov L.M. // Mend. Comm. 2020. V. 300. P. 462.
Stanislaus A., Cooper B.H. // Catal. Rev.-Sci. Eng. 1994. V. 36 P. 75.
Kalenchuk A.N., Bogdan V.I., Dunaev S.F., Kustov L.M. // Fuel Processing Technology. 2018. V. 169. P. 94.
Kariya N., Fukuoka A., Ichikawa M. // Appl. Catal. A. 2002. V. 233. P. 91.
Scott K., Cheng H. // J. Power Sources. 2006. V. 163. P. 323.2007. V. 53. P. 1360.
Colon-Mercado H.R., Popov B.N. // J. Power Sources. 2006. V. 155. P. 253.
Shukla A.A., Gosavi P.V., Pande J.V. et al. // Int. J. Hydrogen Energy. 2010. V. 35 P. 4020.
Tarasov A.L., Tkachenko O.P., Kustov L.M. // Catalysis Letters. 2018. V. 148. P. 1472.
Rouibah K., Barama A., Benrabaa R. et al. // Int. J. Hydrogen Energy. 2017. V. 30. P. 1.
Mani P., Srivastava R., Strasser P. // J. Power Sources. 2011. V. 196. P. 666.
Kalenchuk A.N., Bogdan V.I., Dunaev S.F., Kustov L.M. // Int. J. Hydrogen Energy. 2018. V. 43. P. 6191.
Open crystallographic database. http://crystallography.net/cod/
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии