Журнал физической химии, 2021, T. 95, № 3, стр. 472-480
Физико-химические закономерности делигнификации лиственной и хвойной древесины при озонировании
Н. А. Мамлеева a, *, Е. М. Бенько a, А. Н. Харланов a, А. В. Шумянцев a, Д. Г. Чухчин b
a Московский государственный университет имени М.В. Ломоносова,
Химический факультет
119992 Москва, Россия
b Северный (Арктический) федеральный университет
163002 Архангельск, Россия
* E-mail: mamleevana@bk.ru
Поступила в редакцию 01.08.2020
После доработки 01.08.2020
Принята к публикации 03.08.2020
Аннотация
Представлены результаты сравнительного изучения эффективности использования озона для делигнификации лиственной (осина) и хвойной (сосна) древесины. Физико-химические свойства лигноцеллюлозных материалов (ЛЦМ), полученных при озонировании древесины, исследованы с помощью методов ИК-спектроскопии и термического анализа. Определено содержание лигнина в ЛЦМ. Показано, что делигнификация древесины сопровождается разрушением гемицеллюлоз. С использованием ВЭЖХ определен состав продуктов озонирования. Установлено, что деструкция лигнина осуществляется как за счет реакций с участием молекулярного озона (озонолиза), так и свободно-радикальных процессов. Оптимальный расход озона в процессах делигнификации древесины соответствует ~2 моль О3/моль фенилпропановой единицы (ФПЕ) лигнина. Установлено, что по сравнению с осиной эффективность делигнификации сосны ниже, что может быть связано с различием пористой структуры лиственной и хвойной древесны. Показано, что предварительная обработка озоном приводит к значительному возрастанию выхода восстанавливающих сахаров в реакциях ферментативного гидролиза древесных субстратов. Сделан вывод о том, что при использовании метода делигнификации озоном в процессах получения сахаров при ферментативном гидролизе лиственная древесина как сырье более перспективна, чем хвойная.
Разработка способов делигнификации лигноцеллюлозных материалов (ЛЦМ) представляет интерес для развития технологий конверсии возобновляемого сырья [1–6]. Древесина – один из перспективных материалов биологического происхождения, основными компонентами которого являются целлюлоза (ЦЛ), гемицеллюлозы (ГЦ) и лигнин (ЛГ), а также небольшие количества экстрактивных веществ. Целлюлоза – самый ценный биоматериал, однако его утилизации мешает присутствие лигнина [7].
Удаление лигнина из структуры растительного полимера позволяет увеличить доступность целлюлозы, что важно для получения целлюлозы и ее переработки в сахара и спирты [3–6]. Использование озона для делигнификации биомассы основывается на его способности активно взаимодействовать с ароматическими структурами, тогда как целлюлоза и гемицеллюлозы относительно устойчивы к воздействию озона. Озон рассматривают как экологически чистый реагент, не оставляющий после себя токсичных соединений, реакции идут при комнатной температуре, продукты реакций озона экологически безопасны [6].
Прогресс в области синтеза озона, достигнутый в последние годы, привел к существенному снижению стоимости озона [8] и, закономерно, к возрастанию интереса к методу озонной обработки биомассы. К настоящему времени в мире накоплен большой экспериментальный материал по взаимодействию растительной биомассы с озоном. Показана перспективность озонирования для делигнификации растительного сырья и экономическая целесообразность этого метода для последующего получения сахаров и биоэтанола [5, 6]. Однако, теоретические основы метода делигнификации озоном до сих пор не разработаны.
В течение последних 15 лет на химическом факультете МГУ имени Ломоносова, под руководством академика РАН проф. В.В. Лунина проводились исследования, направленные на поиск оптимальных условий озонирования, позволяющих снизить расход озона и увеличить выход целевых продуктов биоконверсии растительного сырья. В основе этого подхода лежит поиск закономерностей превращения разных видов растительной биомассы при обработке озоном; особое внимание обращено на установление взаимосвязи между основными характеристиками поглощения озона и эффективностью делигнификации биомассы.
Материалы, полученные при обработке биомассы озоном, исследованы с помощью различных физико-химических методов (УФ-, ИК-, КР-спектроскопия, рентгеновская дифракция [9–13], термический анализ [14, 15] электронная микроскопия [10, 16]. Определено содержание лигнина (ЛГ) в озонированных образцах [9–11, 17], а также степень полимеризации (СП) и молекулярно-массовое распределение целлюлозы, полученной из озонированной древесины [9, 11]. С использованием метода ВЭЖХ исследованы водорастворимые продукты озонирования биомассы [17–19]. В работах [20, 21] проведено тестирование озонированных ЛЦМ в реакциях ферментативного гидролиза в сахара и установлено, что предварительная обработка озоном многократно увеличивает степень конверсии биомассы в сахара. Показана возможность проведения глубокой делигнификации растительной биомассы обработкой озоном [9, 11]. На основании многочисленных экспериментальных данных установлены оптимальные условия озонирования [12, 13, 20, 21].
В данной работе представлены результаты сравнительного изучения физико-химических свойств ЛЦМ, полученных из озонированной лиственной и хвойной древесины – двух видов биомассы, отличающихся друг от друга разным составом и строением структурных компонентов. Авторы работы ставили своей задачей установить основные свойства биоматериала, определяющие эффективность делигнификации, что необходимо при разработке современной технологии конверсии растительного сырья с применением озона.
Проведено сопоставление результатов изучения свойств ЛЦМ, полученных из образцов озонированной древесины осины и сосны, что позволило установить особенности и общие закономерности процесса делигнификации древесины разного строения. Приведены зависимости поглощения озона от времени обработки, содержание ЛГ в озонированных материалах, состав водорастворимых продуктов озонирования; представлены ИК-спектры и результаты термического анализа озонированных образцов, а также данные по ферментации древесины в сахара до и после обработки озоном.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Исследовали опилки древесины осины (Populus tremula) и сосны (Pinus silvestris) с размером частиц от 0.315 до 0.63 мм с содержанием воды 53–55% (осина), 60–63% (сосна) относительно массы абсолютно сухой древесины (а.с.д.). Озонирование образцов проводили в проточной системе в реакторе с неподвижным слоем при 25°С. Подробно методика озонирования и способ расчета количества поглощенного озона на 1 г а.с.д. (Qr , ммоль/г) приведены в [11, 18]. Озонированные образцы древесины промывали водой, раствор анализировали методом ВЭЖХ; полученный ЛЦМ высушивали на воздухе и изучали методами ИК-спектроскопии, термического анализа и исследовали в реакции ферментативного гидролиза.
Количество кислотонерастворимого лигнина (KНРЛ) и кислоторастворимого лигнина (КРЛ) в древесине и ЛЦМ определяли по методике [22]. Общее количество лигнина в исходном образце (ЛГо) и количество остаточного ЛГ в ЛЦМ (ЛГоз) в образце определяли в %/ на 1 г а.с.д. как сумму КНРЛ и КРЛ. Степень делигнификации (СД) при озонировании рассчитывали из соотношения: СД, % = (ЛГо – ЛГоз) × 100/ЛГо.
Стехиометрический коэффициент A (моль О3/моль ФПЕ), соответствующий количеству молей озона, израсходованных на окисление фенилпропановой единицы (ФПЕ) ЛГ, рассчитан из соотношения: A = Qr/(ЛГо – ЛГоз)/MФПЕ, где МФПЕ – молярная масса гваяцильной субъединицы лигнина сосны (190 г/моль) или сиренгильной субъединицы лигнина осины (210 г/моль) [7].
Термический анализ образцов проводили на синхронном термоанализаторе Netzsch 449 C Jupiter, совмещенном с масс-спектрометром NETZSCH 409 AOELOS [14, 15].
Спектры ИК-ДО образцов ЛЦМ регистрировали на ИК-фурье-спектрометре EQUINOX 55/S (Bruker) с приставкой диффузного отражения. Полученные спектры отражения преобразовывали в единицы Кубелки–Мунка (F(R)) [11, 12].
Анализ водорастворимых продуктов озонирования выполняли на жидкостном хроматографе Agilent 1100 c УФ-детектором (195 нм) и колонкой Rezex ROA [18].
Ферментативный гидролиз осуществляли с помощью коммерческого препарата целлюлазного комплекса Trichoderma Viride по методике [20].
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
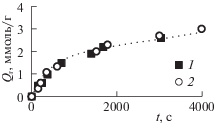
На рис. 1 представлены данные по поглощению озона образцами древесины осины и сосны. Видно, что количество поглощенного озона (Qr) в зависимости от продолжительности озонирования древесины осины и сосны описывается одной кривой, постепенно выходящей на насыщение.
Содержание лигнина
На рис. 2а представлены результаты определения содержания лигнина в исходных образцах древесины сосны и осины и в озонированных образцах. Установлено, что в исходном образце древесины сосны содержится 28.5% КНРЛ и 0.9% КРЛ, а общее содержание лигнина (ЛГо) составило 29.4%. Для древесины осины получены соответственно 25.3% КНРЛ и 0.6% КРЛ, 25.9% ЛГо. Эти значения согласуются с данными по содержанию лигнина в хвойной и лиственной древесине [23]. Из зависимости общего содержания ЛГ от удельного поглощения озона для древесины осины и сосны видно, что в обоих случаях зависимости имеют линейный участок. Полученные данные показывают, что на этом этапе озонирования (Qr < 1.3 –1.4 ммоль/г для древесины сосны и осины) озон расходуется в основном на деструкцию ЛГ. Этот интервал значений Qr соответствует подъему на кривой поглощения озона (рис. 1).
Рис. 2.
Содержание ЛГ в озонированных ЛЦМ и доля КРЛ от общего содержания ЛГ (а), стехиометрический коэффициент А и степень делигнификации (СД) (б) в зависимости от удельного поглощения озона (Qr) при озонировании древесины осины (1) и сосны (2).
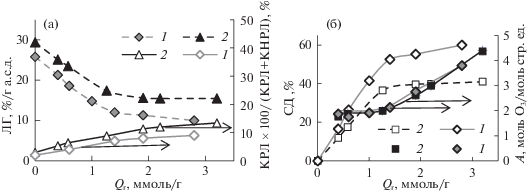
На рис. 2а также представлена доля КРЛ для разных значений Qr. Если для исходного образца доля КРЛ от общего количества составила 2–3%, то для озонированных образцов она достигает 9–13%, причем в случае древесины сосны значения выше. Этот результат указывает на существование разных направлений деструкции ЛГ в биомассе при озонировании. Очевидно, что по мере увеличения продолжительности озонирования идет процесс модифицирования части ароматических структур кислородсодержащими группами с образованием ароматических соединений, растворимых в кислоте.
Как видно из рис. 2б, степень делигнификации (СД) для ЛЦМ из озонированной древесины сосны достигает 40%, а для древесины осины – 60%. На линейном участке СД составляет 37 и 53% соответственно. На рис. 2 также представлены данные по расходу озона на структурную единицу ЛГ, прореагировавшего с озоном. На начальном участке в обоих случаях значение стехиометрического коэффициента А составило ~2 моль О3/моль ФПЕ. При более высоких значениях Qr расчетный коэффициент А возрастает до 4–5 моль О3/моль ФПЕ. Вероятно, в этих условиях озон расходуется не только на деструкцию ароматики, но и на процессы окисления других функциональных групп окисленного озоном ЛЦМ.
ИК-спектры
На рис. 3 приведены ИК-ДО-спектры исходной биомассы и образцов ЛЦМ озонированной древесины. Основные изменения значений F(R) в спектрах озонированных образцов наблюдаются в области скелетных колебаний ароматического кольца, карбонильных и карбоксильных групп. Для древесины осины (рис. 3а) интенсивность полос при 1508 и 1595 см-1, относящихся к скелетным колебаниям ароматики [24], в спектрах озонированных образцов уменьшаются. Полосу 1650 см–1 относят к валентным колебаниям С=О-групп, конъюгированных с ароматическим кольцом [24]. По мере увеличения Qr интенсивность полосы немного уменьшается.
Рис. 3.
ИК-ДО-спектры (сверху) и зависимости интенсивности полос в ИК-ДО-спектрах ЛЦМ из озонированной древесины осины (а) и сосны (б) от Qr.
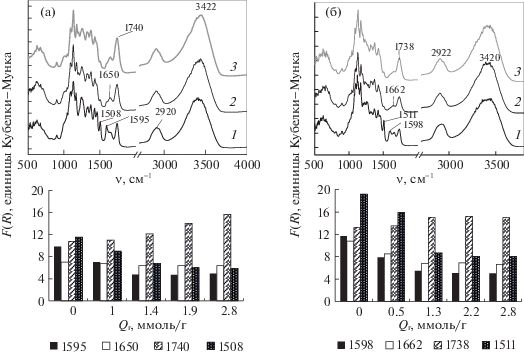
Данные ИК-спектров показывают, что разрушение ароматики наблюдается при всех значениях Qr, но преобладает при Qr ≤ 1.4 ммоль/г; по мере увеличения Qr заметно возрастает интенсивность полос при 1740 см–1 С=О- и карбоксильных групп с алифатическими заместителями [24], изменяется контур спектра в области валентных С‒Н-колебаний (2850–3000 см–1) (спектры 2, 3). 3420 см–1 – валентные колебания ОH- групп, связанных водородной связью [24]. С увеличением Qr положение полосы сохраняется.
Аналогичные изменения ИК-спектра наблюдаются и для древесины сосны: уменьшается интенсивность колебаний ароматики (1511 и 1598 см–1) и полосы 1662 см–1 (валентные колебания С=О, конъюгированных с ароматическим кольцом), возрастает интенсивность полосы 1738 см–1 (рис. 3б). По данным ИК-спектров, основное отличие превращений древесины сосны от древесины осины при обработке озоном состоит в относительно небольшом возрастании F(R)1738 (C=О-колебания в карбоксильных и карбонильных группах с алифатическими заместителями) при высоких значениях Qr. На спектрах 2 и 3 (рис. 3б) видно, что по сравнению с рис. 3а контур этой полосы расширен. С помощью деконволюции ИК-спектра на компоненты Лоренца показано [12], что при Qr ≥ 2 ммоль/г присутствуют компоненты с максимумами 1750–1765 см–1, относящиеся к группам С=О с кислородсодержащими алифатическими заместителями. По мере увеличения Qr были отмечены [12] полосы при 1690–1700 см–1 (νС=О) альдегидов и карбоксильных групп с ароматическим заместителем [24].
Таким образом, данные ИК-спектроскопии подтвердили, что деструкция ароматических структур древесины происходит, в основном, на начальных этапах озонирования. При высоких расходах озона на поверхности ЛЦМ присутствуют кислородсодержащие алифатические структуры, которые в случае древесины сосны представляют собой продукты более глубокого окисления по сравнению с осиной.
Термический анализ
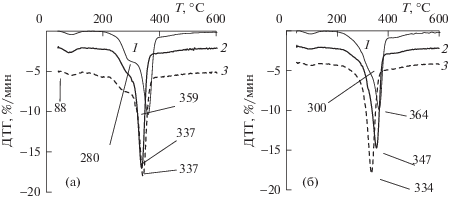
На рис. 4 приведены кривые ДТГ образцов ЛЦМ из озонированной древесины осины и сосны. На кривых ДТГ видны максимумы при 88–90°С, соответствующие потере физически сорбированной воды. Второй максимум кривой ДТГ соответствует термодеструкции основных структурных компонентов древесины. Термическое разложение ГЦ, ЦЛ и ЛГ происходит в интервалах 225–325, 305–375 и 150–500°С соответственно [5, 25, 26]. Плечо в области 280°С на кривой ДТГ рис. 4а относят к термодеструкции гемицеллюлоз, состоящих в древесине осины, в основном, из ксилана [25], а его заметное уменьшение при Qr = 1.4 ммоль/г свидетельствует о разрушении ГЦ. При Qr = 2.8 ммоль/г на кривой ДТГ видны области (при 180 и 260°С) термической деструкции продуктов окисления древесины осины озоном.
Понижение температуры термодеструкции ЛЦМ при уменьшении содержания ЛГ (наиболее термически устойчивого компонента ЛЦМ), а также разрушение ГЦ наблюдается и для древесины сосны (рис. 4б). Так, плечо при 300°С термодеструкции ГЦ, состоящих в древесине сосны, главным образом, из глюкоманнана [25], уже при поглощении первых порций озона у озонированных образцов отсутствует.
Рисунок 5 демонстрирует понижение температуры максимума на кривой ДТГ (Тmax) по мере ее делигнификации озоном. Для осины при увеличении Qr до 2.8 ммоль/г идет постепенная деструкция ЛГ, разрушение аморфной части полисахаридов и уменьшение их содержания с образованием термически неустойчивых продуктов окисления древесины осины озоном.
Рис. 5.
Температура максимума на кривой ДТГ при различном содержании ЛГ в образцах осины (1) и сосны (2).
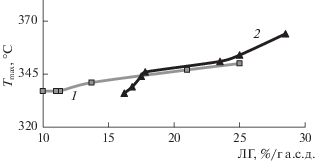
В случае древесины сосны при Qr > 1.4 ммоль/г деструкция ЛГ практически прекращается (содержание ЛГ 17–18%) (рис. 2а). Так как аморфизация целлюлозы понижает термическую устойчивость ЛЦМ [26], а повышение степени кристалличности, наоборот, приводит к повышению термической устойчивости биомассы [5], то наблюдающееся на рис. 5 резкое снижение Тmax можно объяснить аморфизацией целлюлозы при озонировании биомассы. Показано [11], что делигнификация древесины сосны при обработке озоном сопровождается уменьшением степени полимеризации (СП) целлюлозы. Так, по мере повышения Qr до 3.0 ммоль/г значение средней степени полимеризации целлюлозы понизилось до 500 по сравнению с СП целлюлозы исходного образца (СП 760). Уменьшение СП целлюлозы в ходе озонирования биомассы происходит в результате модифицирования ЦЛ и не может не сопровождаться возрастанием размеров аморфных областей целлюлозного волокна.
Наблюдаемое различие термодеструкции озонированных образцов, полученных из древесины осины и сосны, связано с особенностями строения древесины. По данным [27], в лиственной древесине лигнин, в основном, связан с гемицеллюлозами и менее 17% ЛГ ковалентно связано с ЦЛ. В хвойной древесине до 50% целлюлозы ковалентно связано с ЛГ. Последнее обстоятельство осложняет удаление малодоступного ЛГ в хвойной древесине; при длительном озонировании происходит модифицирование доступной озону целлюлозы, которое приводит к нарушению ее надмолекулярной структуры и понижению термической устойчивости.
В работах [14, 15] представлены результаты анализа масс-спектров неконденсируемых продуктов пиролиза озонированных ЛЦМ. Отмечено образование ряда соединений (Н2О, СН4, СО2 СО, формальдегид), характерных для пиролиза биомассы. На основании данных по выходу продуктов пиролитической деструкции сделан вывод, что эффективность делигнификации древесины осины выше, а количество продуктов окисления в озонированных образцах из лиственной древесины ниже, чем для ЛЦМ, полученных озонированием хвойной древесины. Результаты анализа масс-спектров согласуются с данными ИК-спектроскопии и термогравиметрии [14, 15].
ВЭЖХ-анализ продуктов озонирования
Отмечено [11, 18], что в продуктах озонирования древесины присутствуют муравьиная, щавелевая и глиоксалевая кислоты, которые относят к продуктам деструкции ароматических систем ЛГ по механизму озонолиза [28]. В результате озонирования значение рН контактных растворов падает до 2.5–2.6 по мере увеличения Qr (рис. 6), в то время как рН контактного раствора исходной древесины составляет 5.6–5.7. На рис. 6 данные по составу кислот при различных значениях удельного поглощения озона приведены в процентах на 1 г а.с.д. древесины. Зависимости количества муравьиной и глиоксалевой кислот характеризуются выраженным максимумом. Содержание щавелевой кислоты практически выходит на насыщение. Наблюдаемые зависимости объясняются сочетанием двух процессов – образования кислот и их окисления озоном. В интервале Qr от 0.4 до 3.0 ммоль/г в случае сосны молярное отношение муравьиная/щавелевая уменьшается от 6.0 до 3.3 (кривая 1 рис. 6б), для осины – от 4.3 до 2.3 (кривая 1, рис. 6а). Соотношение глиоксалевая/ щавелевая кислота также уменьшается (кривая 2 рис. 6а, 6б), проходя через небольшой максимум. Наблюдаемые зависимости объясняются постепенным окислением кислот озоном. Глиоксалевая кислота окисляется в щавелевую кислоту, а муравьиная и щавелевая кислоты окисляются до СО2 и Н2О [29]. Константы скоростей окисления кислот озоном уменьшаются в ряду: муравьиная (k = 30 л/(моль с)), глиоксалевая (k = 0.2 л/(моль с)), щавелевая (k = 10–2 л/(моль с)) [29, 30].
Рис. 6.
Профиль содержания кислот в водорастворимых продуктах озонирования, и рН контактных растворов при озонировании древесины осины (а) и сосны (б). Молярное отношение муравьиная/щавелевая (1) и глиоксалевая/щавелевая кислота (2) в зависимости от удельного поглощения озона.
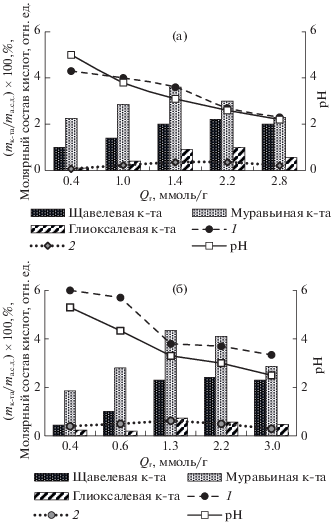
Следует отметить более высокое содержание продуктов озонолиза в случае сосны, так как степень делигнификации, как показано на рис. 2, ниже, чем СД древесины осины. При Qr > 1.3 ммоль/г, когда степень делигнификации древесины осины уменьшается на 8%, а древесины сосны на 3%, соотношение количества муравьиной и щавелевой кислот в случае осины уменьшается, а в случае древесины сосны практически постоянно. По-видимому, этот результат свидетельствует о наличии проблем диффузионного характера в процессе окисления озоном продуктов озонолиза ЛГ в хвойной древесине.
Ферментативный гидролиз
На рис. 7 представлен выход восстанавливающих сахаров (ВС) – продуктов ферментативного гидролиза образцов древесины, – в зависимости от продолжительности озонирования. Предобработка озоном позволяет значительно повысить реакционную способность растительных субстратов. Отмечено многократное по сравнению с исходным образцом, увеличение начальной скорости реакции и предельного выхода сахаров за 48 ч гидролиза (ВС48) [21]. Так, необработанные озоном опилки осины и сосны при гидролизе дают ~40 мг/г ВС, а озонированные ~300 мг/г.
Рис. 7.
Зависимость выхода сахаров (ВС) в реакциях ферментативного гидролиза древесины сосны (1) и осины (2) от продолжительности озонирования. Кинетические кривые поглощения (3) озона образцами древесины сосны ($\bigcirc $) и осины ($ \bullet $).
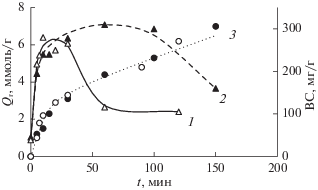
Как видно из сопоставления кривых 1 и 2 с кривой поглощения озона (кривая 3 рис. 7), область роста реакционной способности озонированных образцов соответствует удалению лигнина из древесины. Удаление лигнина и связанных с ним гемицеллюлоз повышает доступность целлюлозы, и ферментативные реакции протекают быстрее и более глубоко. Этот результат согласуется с данными, полученными другими методами. Как отмечалось ранее, уменьшение реакционной способности ЛЦМ при длительной обработке озоном может быть связано и с рядом других причин, например, ингибирующим действием продуктов окисления ЛГ и ГЦ [31], структурными изменениями в клеточной стенке [16]. В любом случае, с точки зрения повышения эффективности ферментативного гидролиза, кратковременная обработка озоном более предпочтительна.
Взаимодействие озона с древесиной
Многочисленные экспериментальные данные показали [3–6, 9–11, 17–21], что наиболее значимыми параметрами озонирования являются содержание воды в образце и количество поглощенного озона. Содержание воды в образце влияет на скорость реакции биомассы с озоном, а количество поглощенного озона определяет степень делигнификации и, в конечном счете, выход сахаров в ферментативной реакции. Наблюдаемые закономерности обусловлены двумя процессами – набухания лигноцеллюлозного материала в воде, приводящего к увеличению внутренней поверхности и повышению доступности поверхностных реакционных центров субстрата, и диффузии озона к поверхностным реакционным группам в порах субстрата. Значения точки насыщения волокна (ТНВ) для обоих видов древесины равны (30% [4]), а содержание воды, при котором скорость поглощения озона максимальна, для древесины составляет от 50 до 60% [17–19].
При содержании воды выше ТНВ рассматриваемая система характеризуется наличием двух границ раздела: первая находится на границе газ – “свободная” вода. Здесь происходит переход О3 из газовой фазы в воду. Концентрация озона в воде в начальный момент времени определяется константой Генри. Озон диффундирует ко второй межфазной границе (вода–полимер), находящейся в “связанной” воде, где и осуществляются превращения субстрата.
Таким образом, в реакциях с древесиной принимает участие, главным образом, озон, растворенный в воде, присутствующей в клеточной структуре древесины [3–6]. Молекулярный озон вступает в реакции электрофильного циклоприсоединения с последующим раскрытием ароматического кольца [28, 30, 32, 33]. Этот механизм (озонолиз) считают основным при окислении озоном модельных соединений лигнина [34]. Он характеризуется образованием продуктов озонолиза – С1- и С2-кислот и, по-видимому, реализуется и при взаимодействии озона с лигнином в древесине. Реакции электрофильного присоединения полагают основным механизмом деструкции β-O-4 связей лигнина [34]. Протекают и другие реакции, такие как гидроксилирование конифериловых и паракумаровых структур или окислительная деструкция метоксильных групп лигнина [28]. Возможен и другой механизм, предполагающий основным направлением реакции образование феноксильных радикалов с последующим раскрытием ароматического кольца и образованием непредельных кислот, альдегидов, пероксидных соединений [30]. Известно [2, 32], что лигнин деструктурирует и под действием ${\text{O}}{{{\text{H}}}^{ \bullet }}$-радикалов.
Взаимодействие О3 с молекулами воды приводит к генерации ${\text{O}}{{{\text{H}}}^{ \bullet }}$-радикалов; соотношение концентраций молекулярного озона и радикалов зависит от рН среды [32, 34, 35], причем выход радикалов заметно возрастает при рН > 3 [34]. С учетом того, что на начальных стадиях озонирования рН контактного раствора составляет 5.6, участие радикалов в процессе окисления субстрата вполне возможно. В ходе озонирования рН понижается вследствие накопления в порах биомассы продуктов озонолиза, поэтому вклад радикальных процессов снижается, и реакции с участием молекулярного озона становятся доминирующими. По-видимому, в реакции с биомассой вступают также продукты реакций О3 с ароматическими структурами (Н2О2, ${\text{HO}}_{2}^{ \bullet }$-радикалы [28, 30]).
В области наиболее эффективной делигнификации древесины стехиометрический коэффициент составляет 2 моль О3/моль ФПЕ. Согласно схеме озонолиза [28], на окисление одного моля фенольного соединения, моделирующего лигнин, требуется 3 моля О3. В рассмотренном случае стехиометрический коэффициент понижен, так как деструкция ароматического кольца происходит вследствие комбинации реакций молекулярного озона с радикальными процессами.
Взаимодействие озона с древесиной протекает в аморфных областях лигноуглеводного комплекса, состоящего из полисахаридов и лигнина. Будучи наиболее реакционноспособной частью структурной организации, доступные реагенту ароматические структуры разрушаются в первую очередь.
Лигнин лиственной древесины содержит гваяцильные и сиренгильные структурные субъединицы, лигнин хвойной древесины на ~90% состоит из гваяцильных структур [7]. Известно, что в ряду соединений гваякол – 2,6-диметоксифенол, моделирующих соответственно гваяцильные и сиренгильные остатки, константы скорости реакции с озоном различаются на несколько порядков: 105 и >107 л/(моль с) – для гваякола и сиренгола соответственно [36]. Однако кинетические кривые поглощения озона для древесины сосны и осины практически совпадают (рис. 1). Наблюдаемая зависимость объясняется тем, что окислительная деструкция лигнина сопровождается реакциями озона с продуктами окисления, идентичными в обоих случаях, а также реакциями с полисахаридами.
Показано, что при обработке древесины озоном идет заметная деструкция гемицеллюлоз. Целлюлоза также может частично подвергаться деструкции, что подтверждается снижением степени полимеризации ЦЛ, выделенной из озонированной древесины [10, 11]. Действие О3 и ${\text{OH}}_{{}}^{ \bullet }$-радикалов на ЦЛ состоит в разрыве гликозидных связей и окислении спиртовых групп, что приводит к уменьшению степени полимеризации и образованию карбонильных и карбоксильных соединений [32, 33]. В работах [3, 37] отмечено, что за превращения полисахаридов при озонировании целлюлозосодержащих материалов ответственны ${\text{O}}_{2}^{{ \bullet {\kern 1pt} - }}$ радикалы.
ЗАКЛЮЧЕНИЕ
Приведенные данные показывают, что обработка древесины осины и сосны озоном позволяет провести делигнификацию, причем, несмотря на относительную селективность озона по отношению к ароматическим группам, под действием озона происходит и деструкция полисахаридов. Наиболее эффективным с точки зрения глубины делигнификации и выхода сахаров при последующем ферментативном гидролизе является кратковременное озонирование. Более подробно вопрос о выборе оптимальной дозы озона в процессах предобработки биомассы рассмотрен в [12, 15, 20, 21].
Сопоставление результатов, полученных для древесины осины и сосны, показывает, что делигнификация озоном хвойной древесины менее эффективна. С помощью метода УФ-спектрофотометрии установлено [9, 12], что, помимо деструкции ароматического кольца до низкомолекулярных соединений, в случае древесины сосны часть озона расходуется на реакции с боковыми заместителями с образованием ароматических окисленных структур. Образование карбонильных и карбоксильных производных в реакциях О3 с соединениями гваяцильного ряда (конифериловый спирт) и вератрильного ряда (вератрол) отмечено в работах [38, 39], так что при обработке озоном древесины проявляются специфические особенности реакций хвойного ЛГ с озоном. Для сиренгильного (лиственного ) ЛГ эти реакции нехарактерны.
При озонировании образцов сосны образуются кислородсодержащие алифатические продукты окисления озоном, характеризующиеся многообразием строения. Образование некоторых из них обусловлено особенностями строения древесинной матрицы, связями ЛГ с гемицеллюлозами, наличием связей между ЛГ и ЦЛ, что более характерно для хвойной древесины.
Необходимо отметить также различное пористое строение лиственной и хвойной древесины [40]. Пористость древесины сосны обусловлена наличием в ее структуре полостей клеток, межклетников и участков клеточных стенок, содержащих микропустоты и каналы молекулярных размеров. Структура лиственной древесины имеет более сложное строение и характеризуется клетками веретенообразной формы с узкими полостями кроме того присутствуют полости, достигающие в диаметре сотен микрон [41].
Широкопористая структура лиственной древесины обеспечивает доступность внутренней поверхности пор для реагента, где идет окислительная деструкция ЛГ с последующими реакциями озона с некоторыми продуктами озонолиза ЛГ. Тонкопористая структура древесины сосны становится причиной блокировки части поверхности из-за накопления в узких порах продуктов озонирования. Это могут быть, например, продукты окисления и конденсации фрагментов макромолекул лигнина [19, 42], а также не растворимые в воде оксалаты кальция, образующиеся при взаимодействии щавелевой кислоты (продукта озонолиза лигнина) и примесных солей кальция, присутствующих в растительном сырье [10, 37]. Диффузионные ограничения, возникающие вследствие блокировки пор, влияют не только на эффективность делигнификации, но и на последующие превращения продуктов озонолиза.
Таким образом, при обработке озоном делигнификация древесины осины протекает более эффективно, что, в первую очередь, объясняется различием пористой структуры исследованных растительных субстратов. Представленный материал свидетельствует о том, что как основа для получения сахаров при ферментативном гидролизе лиственная древесина более перспективна для предобработки озоном, чем хвойная.
Работа выполнена на оборудовании Центра коллективного пользования Химического факультета МГУ имени М.В. Ломоносова.
Список литературы
Боголицын К.Г., Пряхин А.Н., Лунин В.В. Физическая химия лигнина / Под ред. К.Г. Боголицына, В.В. Лунина. Архангельск: Изд-во Архангельск. гос. ун-та, 2009. 432 с.
Демин В.А., Шерешовец В.В., Монаков Ю.Б. // Успехи химии. 1999. Т. 68. С. 1029.
Li C., Wang L., Chen Z. et al. // Bioresour. Technol. 2015. V. 183. P. 240.
Travaini R., Martín-Juárez J., Lorenzo-Hernando A., Bolado-Rodriges S. // Ibid. 2016. V. 199. № 1. P. 2.
Perrone O.M., Colombari F., Rossi J. et al. // Ibid. 2016. V. 218. P. 69.
García-Cubero M.T., Palacín L.G., González-Benito G., et al. // Ibid. 2012. V. 107. P. 229.
Фенгель Д., Вегенер Г. Древесина: химия, ультраструктура, реакции. М.: Лесная промышленность, 1988. 512 с.
Самойлович В.Г., Ткаченко С.Н., Ткаченко И.С., Лунин В.В. / Теория и практика получения и применения озона / Под ред. В.В. Лунинa. M.: Изд-во Московского ун-та, 2016. 432 с.
Mamleev N.A., Autlov S.A., Bazarnova N.G., Lunin V.V. // Pure Appl. Chem. 2009. V. 81. № 11. P. 2081.
Mamleeva N.A., Autlov S.A., Bazarnova N.G., Lunin V.V. // Russ. J. Bioorg. Chem. 2016. V. 42. № 7. P. 694.
Мамлеева Н.А., Харланов А.Н., Чухчин Д.Г. и др. // Химия растительного сырья. 2019. № 1. С. 85.
Мамлеева Н.А., Харланов А.Н., Лунин В.В. // Журн. физ. химии. 2019. Т. 93. № 12. С. 1901.
Бенько Е.М., Чухчин Д.Г., Малков А.В. и др. // Там же. 2020. Т. 94. № 6. С. 862.
Мамлеева Н.А., Шумянцев А.В., Лунин В.В. // Там же. 2020. Т. 94. № 3. С. 526
Мамлеева Н.А., Харланов А.Н., Шумянцев А.В. // Там же. Принято в печать.
Benko E.V., Chukhchin D.G., Lunin V.V. // Holzforschung. https://doi.org/10.1515/hf-2019-0168 | Published online: 22 July 2020
Мамлеева Н.А., Кустов А.Л., Лунин В.В. // Журн. физ. химии. 2018. Т. 91. № 9. С. 1402.
Бенько Е.М., Мамлеева Н.А., Чухчин Д.Г. и др. // Там же. 2020. Т. 94. № 8. С. 1153.
Мамлеева Н.А., Бабаева Н.А., Харланов А.Н., Лунин В.В. // Там же. 2019. Т. 93. № 1. С. 28.
Бенько Е.М., Лунин В.В. // Химия растительного сырья. 2019. № 4. С. 305.
Бенько Е.М., Лунин В.В. // Журн. физ. химии. 2020. Т. 94. № 9. С. 1411.
Aldaeus Fr., Sjöholm E. // (2011). COST Action FP0901. Version 3 (2010-12-14). Innventia Report No.: IR 108.
Kushnir E.Y., Autlov. S.A., Bazarnova N.G. // Russ. J. Bioorg. Chem. 2015. V. 41. № 7. P. 713.
Schwanninger M., Rodrigues J.C., Pereira H., Hinterstoisser B. // Vibr. Spectr. 2004. V. 36. № 1. P. 23.
Лоскутов С.Р., Шапченкова О.А., Анискина А.А. // Сибирский лесной журн. 2015. № 6. С. 17.
Zhang J., Feng L., Wang D. et al. // Biores. Technol. 2014. V. 153. P. 379.
Jin Z., Katsumata K.S., Lam T.B.T., Iiyama K. // Biopolymers. 2006. V. 83. P. 103.
Bailey P.S. / Ozonation in Organic Chemistry. V. 2. Nonolefinic Compounds. N.Y.: Acad. Press, 1982. P. 31.
Schöne L., Herrmann H. // Atmos. Chem. Phys. 2014. V. 14. P. 4503.
Разумовский С.Д., Заиков Г.Е. Озон и его реакции с органическими соединениями (кинетика и механизм). М.: Наука, 1974. 322 с.
Бенько Е.М., Манисова О.Р., Лунин В.В // Журн. физ. химии. 2017. Т. 87. № 7. С. 1131.
Olkkonen C., Tylli Y., Forsskåhl I. et al. // Holzforschung. 2000. V. 54. P. 397.
Ragnar M., Eriksson T., Reitberger T. // Ibid. 1999. V. 53. P. 292.
Bertaud F., Croué J.P., Legube B. // Ozone: Science & Engineering. 2001. V. 23. P. 139.
Staehelin J., Hoigné // Environ. Science Technol. 1982. V. 16. P. 666.
Kaneko H., Hosoya S., Iiyama K., Nakano J. // J. Wood Chem. Technol. 1983. V. 3. P. 687.https://doi.org/10.1080/01919512.1995/10555779
Roncero M.B., Colom J.F., Vidal T. // Carbohydrate Polymers. 2003. V. 51. № 4. p. 411.
Ferron B., Croué J.P., Dore M. //Ozone: Science & Engineering. 1995. V. 17. p. 687. https://doi.org/10.1080/01919512.1995/10555779
Худошин А.Г., Митрофанова А.Н., Лунин В.В. // Изв. АН. Сер. хим. 2008. № 2. С. 276.
Hoadley R.B. / Understanding Wood: A Craftsman’s Guide to Wood Technology Hardcover, The Taunton Press.USA, 2000.
Азаров В.И. / Химия древесины и синтетических полимеров. 1999. СПб., 629 с.
Kobayashi M., Asano T., Kajiyama M., Tomita B. // J. Wood Sci. 2005. V. 51. № 4. P. 348.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии