Журнал физической химии, 2021, T. 95, № 4, стр. 646-654
Инактивация планктонных микроорганизмов ударными акустическими волнами
С. Н. Летута a, С. Н. Пашкевич a, А. Т. Ишемгулов a, *, А. Н. Никиян a
a Оренбургский государственный университет
460018 Оренбург, Россия
* E-mail: azamat.ischemgulov@yandex.ru
Поступила в редакцию 13.05.2020
После доработки 13.05.2020
Принята к публикации 19.05.2020
Аннотация
Исследована инактивация планктонных бактерий Escherichia coli и Bacillus subtilis ударными акустическими волнами, которые генерировались наносекундным лазерным импульсом, вызывающим быстрый локальный нагрев, рост и схлопывание пузырьков пара в физиологическом растворе с бактериями, содержащем органические красители в качестве термосенсибилизаторов. Показана роль высоких электронно-возбужденных состояний красителей в локальном нагреве среды. Исследована зависимость эффективности инактивации микроорганизмов от типа и концентрации красителей, плотности мощности возбуждающего излучения и расстояния от источника генерации ударных волн.
Поиск новых способов инактивации патогенных микроорганизмов с каждым годом становится все более актуальным, поскольку увеличивается резистентность штаммов к традиционным антимикробным препаратам [1, 2]. Ситуация осложняется тем, что многие микроорганизмы образуют биопленки. В них повышается не только вирулентность микроорганизмов, но и их устойчивость к химическим и физическим воздействиям [3–5]. Требуются неинвазивные и нетоксичные противомикробные стратегии, которые действуют эффективно и быстро, и к которым патогены не смогут легко вырабатывать иммунитет [6].
Эффективный способ воздействия на живые микроорганизмы – фотодинамическая обработка [7–15]. Привлекательность такого способа поражения бактерий в том, что против него невозможно выработать иммунитет. Однако фотодинамическое действие применимо только для аэрированных периферийных слоев подложки, где находятся микроорганизмы, поскольку в глубокие слои сенсибилизаторы и возбуждающий свет практически не проникают.
Эти трудности можно преодолеть, если воздействовать на микроорганизмы механически, например, ультразвуковыми или ударными волнами. Очевидно, что такое воздействие будет эффективным, если волна создает достаточный для разрушения перепад давления в масштабе, сравнимом с размерами микроорганизма. Например, если диаметр бактерии принять ~1 мкм, то при скорости звука в растворе ~1500 м/с, частота ультразвука должна быть не меньше, чем ~1500 МГц. Технически использовать такую волну довольно трудно из-за отсутствия эффективных высокочастотных излучателей и проблем при доставке колебаний в среду с микроорганизмами.
Значительно проще воспользоваться другим известным приемом – возбудить ударную волну путем быстрого (~1 нс) локального нагрева среды. Протяженность фронта такой волны составит ~1.5 мкм, что при достаточной амплитуде окажется губительным для микроорганизмов.
Локальный нагрев удобно производить короткими импульсами лазерного излучения, которые возбуждают молекулы-термосенсибилизаторы. Термосенсибилизатор (ТС) должен иметь высокий коэффициент экстинкции, хорошо растворяться в среде с микроорганизмами, не обладать токсичностью.
Молекулы органических красителей удовлетворяют этим требованиям, в том числе и основному: они способны очень быстро преобразовать поглощенную лучистую энергию в тепловую. При возбуждении мощными импульсами молекулы красителей могут поглощать два (или более) кванта падающего излучения и ступенчато через реальные нижние электронно-возбужденные состояния переходить в высокие электронно-возбужденные состояния (ВЭВС) [16–19]. Время жизни таких состояний, как правило, составляет единицы пикосекунд, а основной канал релаксации – безызлучательная внутренняя конверсия, приводящая к очень быстрой передаче тепла окружению [20–22]. Таким образом, при мощном импульсном возбуждении молекулы красителей становятся эффективными фототермическими сенсибилизаторами.
Кроме того, многие красители обладают высоким квантовым выходом в триплетное состояние и поэтому могут служить не только ТС для генерирования ударных волн, но и фотосенсибилизаторами (ФС) синглетного кислорода (СК).
При быстром локальном нагреве среды возможна гибель бактерий в результате:
– прямой гипертермии;
– повреждения бактерий акустическими ударными волнами.
В настоящей работе представлены результаты исследований повреждения бактерий именно ударными волнами. Условия экспериментов выбирались так, чтобы минимизировать гипертермию микроорганизмов, безызлучательный перенос энергии с ВЭВС на молекулы окружения и участие в реакциях активных форм кислорода или других фотохимических продуктов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы
Для исследований использовались суточные агаровые (LB-агар, Sigma Aldrich, США) культуры клеток Escherichia coli (штамм K12TG1) и Bacillus subtilis (штамм 534). Перед облучением бактерии переносились в физиологический раствор (0.85% водный раствор NaCl). Плотность полученной суспензии стандартизировали фотометрически с помощью спектрофлуориметра CM2203 (SOLAR, Беларусь) на длине волны 620 нм. Для оценки выживаемости бактерий после облучения видимым светом в присутствии ФС применялся метод подсчета колониеобразующих единиц (КОЕ). Количество КОЕ определялось через 16 ч роста на LB-агаре при температуре 37°С. КОЕ до облучения и добавления красителя составляло (45.0 ± 4.4) × 108/мл для E. coli и (31.0 ± ± 2.3) × 108/мл для B. subtilis.
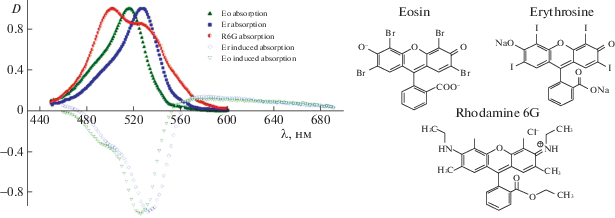
Термосенсибилизаторами служили анионные ксантеновые красители эритрозин и эозин, а также катионный краситель родамин 6Ж (рис. 1). Эритрозин и эозин имеют квантовый выход в триплетное состояние ~(0.7–1.0) [23] и обладают фотодинамической активностью, в отличие от родамина 6Ж, который имеет квантовый выход в триплетное состояние ~0.01 [24]. Из-за противоположных зарядов красители по-разному взаимодействуют с клеточными стенками грамположительных и грамотрицательных бактерий. Концентрация красителей в растворах составляла 0.01–0.5 мМ. Авторы сознательно выбрали красители с различными свойствами, чтобы наглядно продемонстрировать генерацию ударных волн через ВЭВС молекул и инактивацию микроорганизмов такими волнами. Вместо перечисленных красителей можно использовать любые другие соединения, которые эффективно поглощают возбуждающее излучение требуемой длины волны, обеспечивают очень быстрый локальный нагрев среды вплоть до температуры кипения, отвечают требованиям нетоксичности, легко выводятся из организма.
Методика возбуждения и регистрации ударных волн
Для фотоинактивации микроорганизмов и изучения ударных волн в растворах красителей использовалась экспериментальная установка, показанная на рис. 2. Растворы помещались в прямоугольную кварцевую кювету 1 сечением 5 × × 10 мм и облучались через ее торцевую стенку. Источником возбуждения служил импульсный YAG : Nd лазер 4 (вторая гармоника λ = 532 нм, длительность импульса 15 нс, SolarLS, Беларусь). Энергия возбуждающих импульсов измерялась дозиметром Field Master (Coherent, USA).
Рис. 2.
Экспериментальная установка; 1 – кювета с раствором, 2 – область возбуждения, 3 – зондирующий луч, 4 – Nd-YAG-лазер, 5 – He–Ne-лазер, 6 – цилиндрическая линза, 7 – подвижная платформа, 8 – фокусирующая линза, 9 – непрозрачный экран, 10 – монохроматор, 11 – фотоприемник. На вставке – сечение кюветы поперек зондирующего пучка.
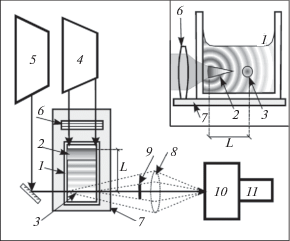
С помощью цилиндрической собирающей линзы 6 создавалась протяженная зона возбуждения 2 с апертурой 3.2 × 0.35 мм2. Плотность мощности возбуждения максимальна в перетяжке и регулировалась в пределах 0.1–50 МВт/см2. Наибольшее поглощение возбуждающего света красителями происходит в зоне перетяжки. Часть света после перетяжки проникала в раствор (на вставке рис. 2 обозначено цифрой 2). Если перетяжка формировалась у границы стекло–раствор, то в зависимости от концентрации красителей и интенсивности накачки, возбуждающее излучение проникало вглубь раствора на расстояние не более 5 мм. В зоне возбуждения происходил локальный нагрев, и возникали пузырьки пара. Именно эта область раствора служила протяженным источником ударных волн аксиальной симметрии.
Вдоль перетяжки линзы (или параллельно ей на регулируемом расстоянии L) пропускался зондирующий луч 3 сечением менее 1 мм от маломощного (менее 1 мВт) He–Ne-лазера 5. Использованные в работе красители в невозбужденном состоянии практически не поглощают свет He–Ne-лазера длиной волны 632 нм (рис. 1), поэтому рассеяние зондирующего луча возможно только на неоднородностях в растворе, а поглощение – только молекулами красителей в возбужденных состояниях (особенно триплет-триплетное поглощение).
С помощью линзы 8 на щели монохроматора 10 (МДР-41) собирается рассеянный пузырьками свет зондирующего луча. Измеряя интенсивность рассеянного света, можно судить о наличии рассеивающих центров на пути луча. Нерассеянная часть луча задерживается непрозрачным экраном 9, диаметр которого соответствует сечению луча.
Измеряя интенсивность нерассеянной части зондирующего луча (для этого линза 8 и экран 9 убираются), можно судить о наведенном триплет-триплетном поглощении в зоне возбуждения или о наличии рассеивающих пузырьков пара. Линза 6 и кювета 1 с раствором расположены на одной платформе 7, которая может перемещаться перпендикулярно зондирующему лучу 3. Перемещая платформу, можно, не изменяя геометрии возбуждения, зондировать раствор в кювете на контролируемом расстоянии L от перетяжки.
Возникающая при локальном нагреве ударная акустическая волна, распространяясь в среде, изменяет показатель преломления растворителя. Когда волна пересекает зондирующий луч, происходит рефракция, и количество света, попадающее на фотоприемник 11 (ФЭУ-84), изменяется. При L = 0 и выключенном He–Ne-лазере можно наблюдать флуоресценцию или фосфоресценцию красителей. Свечение возбужденных молекул собирается на щели монохроматора 10 с помощью линзы 8.
В контрольных экспериментах исследуемые растворы бактерий с красителями облучались импульсами с Р < 0.1 МВт/см2. При такой плотности мощности ударные волны в растворе не возникают. Энергетическая эквивалентность дозы облучения обеспечивалась соответствующим увеличением количества возбуждающих импульсов.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Генерация ударных акустических волн
Акустические волны возникают в результате теплового расширения среды после быстрого локального повышения температуры при безызлучательной релаксации возбужденных состояний ТС. Если температура среды превышает порог кипения, то происходит испарение жидкости, и ударные волны генерируются возникающими пузырьками пара. Поскольку и нагрев, и испарение происходят в результате превращения сенсибилизатором световой энергии в тепло, ударные волны образуются одновременно в процессах локального теплового расширения среды и формирования пузырьков пара. В работе [25] показано, что наиболее значительные повреждения в биологических системах происходят при облучении импульсами относительно высокой плотности энергии, когда становятся заметными процессы испарения жидкости.
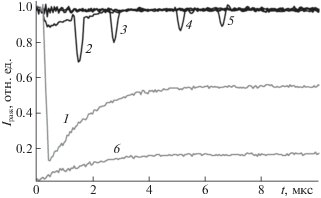
На рис. 3 представлены кинетические кривые пропускания зондирующего луча (экран 9 на рис. 2 убран) при импульсном возбуждении эритрозина концентрации 0.25 мМ в физрастворе на разных расстояниях от перетяжки возбуждающего пучка: кривая 1 – непосредственно в перетяжке; кривые 2 и 3 – в зоне возбуждения на расстояниях 1.4 и 3.3 мм от перетяжки, соответственно; 4 и 5 – вне зоны возбуждения. Как видно, интенсивность нерассеянной части зондирующего луча после возбуждения уменьшается.
Рис. 3.
Кинетические кривые пропускания и рассеяния зондирующего пучка после импульсного возбуждения на разных расстояниях L от перетяжки возбуждающего пучка: 1 – 0, 2 – 1.4, 3 – 3.3, 4 – 6.9, 5 – 9.1 мм; 6 – кинетическая кривая рассеяния зондирующего пучка при L = 0.
На интенсивность нерассеяной части зондирующего луча оказывают влияние четыре явления – рефракция света на тепловой линзе в растворителе, рассеяние света на долгоживущих пузырьках, наведенное триплет-триплетное поглощение возбужденных молекул красителя и пересечение луча ударной волной.
Рефракция на тепловой линзе и рассеяние на пузырьках проявляются только для луча, зондирующего непосредственно перетяжку. В этой позиции (кривая 1, L = 0) ступенчатое уменьшение интенсивности нерассеянной части сохраняется вплоть до нескольких миллисекунд (не показано на рисунке). Аналогична и динамика интенсивности рассеянной части (экран 9 на рис. 2 установлен) зондирующего пучка (кривая 6 на рис. 3), которая в момент возбуждения, наоборот, скачкообразно увеличивается.
Вместе с долгоживущими рефракцией и рассеянием в точке L = 0 имеет место короткоживущее наведенное триплет-триплетное поглощение света возбужденными молекулами красителя, которое хорошо видно на кривых 1, 2 и 6 (L = 0; 1.4 мм) и в значительно меньшей степени на кривой 3 (L = 3.3 мм). Отметим, что наличие триплетных состояний красителя в присутствии молекулярного кислорода в этих областях может повлечь генерацию активных форм кислорода. Кривая 3 соответствует дальнему краю зоны возбуждения. На расстояниях L ≥ 5 мм триплет-триплетное поглощение уже не проявляется, что видно из кривых 4 и 5 (L = 6.9 и 9.1 мм соответственно).
На всех кривых присутствуют острые провалы, которые соответствуют моментам пересечения зондирующего луча фронтом ударной акустической волны. Косвенным доказательством этого служит совпадение измеренной экспериментально скорости распространения волны со скоростью звука в воде. Скорость распространения обнаруженных волн зависит от температуры раствора – при повышении температуры до 80°С скорость возрастала до 1555 м/с, а при охлаждении раствора до 0°С уменьшалась до 1410 м/с.
Ударные волны генерируются в зоне перетяжки возбуждающего пучка. В этой области имеет место скачкообразное увеличение давления за счет быстрого разогрева среды. Кроме того, в этой области возможна генерация ударных волн при быстром испарении воды в микропузырьки воздуха (бабстоны), всегда имеющиеся в воде при нормальных условиях.
Таким образом, для использованных концентраций красителей и плотности мощности возбуждающего излучения в кювете можно выделить три области, в которых возможны различные воздействия на микроорганизмы. В области перетяжки (L = 0) возможны гипертермия бактерий, воздействие на них ударной волной, повреждение активными формами кислорода (АФК) и перенос энергии с ВЭВС связанных молекул красителей на мембраны или внутриклеточные структуры. В промежуточной области зоны возбуждения (L ≤ 5 мм), где присутствуют молекулы сенсибилизаторов в триплетном состоянии, гипертермия и перенос энергии маловероятны, но возможно химическое повреждение бактерий АФК и действие ударной волны. Наконец, вне зоны возбуждения (L ≥ 5 мм) единственным потенциально опасным фактором повреждения микроорганизмов выступает ударная волна.
Роль ВЭВС в генерации волн
Пузырьки пара возникают вследствие локального разогрева среды при безызлучательной релаксации возбужденных состояний молекул красителей. Следует подчеркнуть, что при использованных нами плотностях мощности возбуждения существенный (а в случае родамина 6Ж основной) вклад в разогрев растворителя вносит релаксация именно ВЭВС. Заселение ВЭВС молекул в наших экспериментах подтверждается зависимостью интенсивности фосфоресценции от плотности мощности накачки, измеренные в растворах эозина и эритрозина (рис. 4).
Рис. 4.
Зависимости интенсивности фосфоресценции эозина и эритрозина в физрастворе от плотности мощности накачки.
Интенсивность фосфоресценции красителей очень быстро нарастает, достигая насыщения при плотности мощности возбуждающего излучения ~5 МВт/см2. Это связано с выходом на насыщение заселенности S1-состояний молекул и, как следствие, заселенности нижних триплетных T1 уровней красителей, образующихся в результате интеркомбинационной конверсии (ИКК) S1 → T1. При дальнейшем увеличении плотности мощности накачки интенсивность фосфоресценции эритрозина плавно выходит на насыщение, а интенсивность свечения эозина вновь начинает заметно расти. Это объясняется тем, что при мощном возбуждении молекулы красителей, находящиеся в S1-состоянии поглощают второй квант и по схеме ${{S}_{0}}\;\mathop \to \limits^{h\nu } \;{{S}_{1}}\;\mathop \to \limits^{h\nu } \;{{S}_{n}}$ переходят на более высокие Sn-уровни, эффективность ИКК из которых в триплетное состояние выше, чем с S1-уровня [24, 26].
Интенсивность фосфоресценции пропорциональна концентрации молекул в триплетном состоянии:
где ${{K}_{{{{T}_{1}}{{S}_{0}}}}}$ – константа скорости переходов Т1 → S0, а концентрация триплетных состояний молекул сразу после окончания возбуждающего лазерного импульса [27]:(2)
${{n}_{T}}(0) = {{K}_{{{{S}_{1}}{{T}_{1}}}}}\int\limits_0^{{{\tau }_{p}}} {{{n}_{1}}(t)dt} + {{\varphi }_{{{{S}_{n}}{{T}_{m}}}}}(1 - {{\varphi }_{{{{T}_{m}}{{S}_{1}}}}}){{K}_{{{{S}_{1}}{{S}_{n}}}}}\int\limits_0^{{{\tau }_{p}}} {{{n}_{1}}(t)dt} ,$Первое слагаемое в этом уравнении определяет концентрацию триплетных состояний молекул, образовавшихся в результате интерконверсии S1 → Т1. Второе слагаемое в (2) дает увеличение заселенности нижнего Т1 триплетного уровня за счет ИКК из высоких Sn синглетных состояний.
Учитывая, что квантовый выход ИКК из Sn-состояний молекул эозина выше, чем с нижнего синглетного S1-уровня [26], населенность триплетного T1-уровня растет в результате последовательных переходов S1 → Sn → Тm → T1. Увеличение концентрации молекул в T1-состоянии приводит к увеличению интенсивности фосфоресценции. У эритрозина квантовые выходы процессов S1 → T1 и Tm → → S1 близки к единице, поэтому второе слагаемое в уравнении (2) фактически равно нулю, а концентрация ${{n}_{T}}(t)$ триплетных состояний (т.е. интенсивность фосфоресценции) определяется процессом ИКК с нижнего синглетного S1-уровня.
При плотности мощности возбуждающего излучения Р < 0.5 МВт/см2, ударные волны в растворах с ксантеновыми красителями имеют очень низкую интенсивность, и их экспериментальная регистрация затруднена. В растворах с родамином 6Ж при таких условиях акустические волны вообще не обнаружены. Если Р > 5 МВт/см2, акустические волны уверенно регистрировались как в растворах с ксантеновыми красителями, так и в растворах с родамином 6Ж. В отсутствие ТС в растворе, даже при плотности мощности возбуждающего света 30 МВт/см2 ударные волны не обнаружены.
Поскольку количество квантов возбуждающего излучения при Р > 10 МВт/см2 на несколько порядков больше, чем количество молекул красителей в единице облучаемого объема, то можно считать, что возбуждались все молекулы ТС. Более того, каждая молекула ТС за время длительности возбуждающего импульса (τ = 15 нс) может неоднократно повторно поглотить возбуждающий квант, совершая переходы S1 ↔ Sn (а также S1 → Sn → Tm → S1, или T1 ↔ Tm, или T1 → Tm → → S1 → T1), каждый из которых сопровождается выделением тепла. Поскольку в исследованных нами красителях сильно перекрываются полосы поглощения S0 → S1, S1 → Sn и T1 → Tm, то при воздействии на вещество интенсивным излучением одновременно возбуждаются все перечисленные переходы.
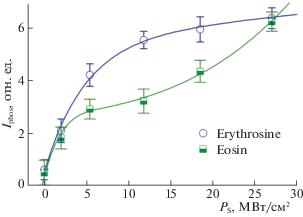
На рис. 5 представлены графики рассеяния света пузырьками пара в зависимости от плотности мощности возбуждения молекул различных красителей в физрастворах. Как видно, ксантеновые красители порождают рассеяние/рефракцию луча даже при Р < 0.5 МВт/см2, тогда как родамин 6Ж только при Р > 5 МВт/см2. Это объясняется тем, что эритрозин в физрастворе имеет квантовый выход в триплетное состояние φТ ~ 0.99 и константу ${{K}_{{{{S}_{1}}{{T}_{1}}}}}\sim {{10}^{9}}$ c–1 [23], поэтому практически каждая молекула после возбуждения в основной полосе S0 → S1 за время ~1 нс переходит в триплетное T1-состояние и становится источником тепловыделения за счет безызлучательных переходов T1 ↔ Tm, или T1 → Tm → S1 → T1.
Рис. 5.
Интенсивность рассеяния/рефракции света растворами красителей в зависимости от плотности мощности возбуждающего излучения в растворах эритрозина и родамина 6Ж.
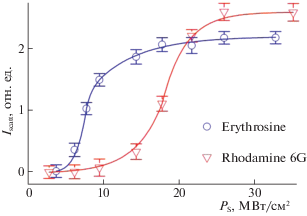
У родамина 6Ж квантовый выход φТ ИКК S1 → → T1 в триплетное состояние φТ ~ 0.01, а квантовый выход S1 → S0-флуоресценции φфл ~ 0.99 [24], поэтому при релаксации S1-состояний молекул раствор не нагревается. Когда Р достигает ~5 МВт/см2, процесс поглощения становится двухквантовым ${{S}_{0}}\;\mathop \to \limits^{h\nu } \;{{S}_{1}}\;\mathop \to \limits^{h\nu } \;{{S}_{n}}$ и эффективно заселяются высокие Sn-состояния молекул. При релаксации ВЭВС родамина 6Ж возникает локальный нагрев, образуются пузырьки пара, и появляется рассеяние света.
Возможны следующие каналы релаксации Sn-состояний молекул:
– безызлучательная внутренняя Sn → S1-конверсия, при которой вся запасенная энергия выделяется в виде тепла;
– перенос энергии на молекулы растворителя;
– Sn → S0-флуоресценция;
– ИКК Sn → Tm с последующей релаксацией Tm-состояний.
Эффективность синглет-синглетного переноса энергии и Sn → S0-флуоресценции родамина 6Ж в воде не превышают 10-6–10-5 [20]. Квантовый выход Sn → Tm-интерконверсии выше, чем S1 → T1 [24], но переходы Sn → Tm → T1 безызлучательные, и энергия ВЭВС выделяется в среде в виде тепла. Поэтому при заселении высоких Sn-состояний молекулы родамина 6Ж становятся очень эффективными ТС.
Повреждение бактерий ударными волнами
Возможны следующие виды фотоинактивации планктонных микроорганизмов в присутствии красителей:
– фотодинамическое воздействие на бактерии активных форм кислорода;
– гипертермия клеток при безызлучательной релаксации возбужденных состояний красителей, связанных со стенками бактерий или находящихся внутри клеток;
– повреждение мембран или внутриклеточных элементов при безызлучательном переносе энергии с ВЭВС красителей (при поглощении двух квантов λ = 532 нм энергия ВЭВС молекул составляет ~5 эВ, что больше энергии любой химической связи);
– повреждение стенок бактерий или внутриклеточных элементов ударными волнами, возникающими при быстром образовании и схлопывании пузырьков пара при локальном нагреве раствора до температуры кипения.
Инактивация бактерий проводилась в кювете 1 установки, представленной на рис. 2. Отбор бактерий для определения выживаемости по КОЕ до и после возбуждения производили микродозатором непосредственно в зоне облучения (здесь возможны все из перечисленных выше процессов повреждения микроорганизмов), а также на расстояниях 6 и 10 мм от перетяжки. На таких расстояниях от зоны возбуждения не проявляются тепловые эффекты, нет фотодинамического действия и переноса энергии. Если имеет место повреждение бактерий, то оно происходит исключительно под действием ударных волн.
На рис. 6а, 6б показаны графики изменения КОЕ клеток E. coli и B. subtilis в физрастворах с ксантеновыми красителями (0.25 мМ) до и после облучения импульсами (λ = 532 нм) различной плотности мощности Р в зависимости от расстояния до зоны возбуждения. Видно, что непосредственно в зоне облучения повреждение бактерий E. coli происходит даже при относительно малых плотностях мощности возбуждающего излучения. По-видимому, это обусловлено фотодинамическим действием. Для гипертермии клеток и безызлучательного переноса энергии необходимо взаимодействие красителей со стенками бактерий или их проникновение внутрь клеток. Ксантеновые красители-анионы не взаимодействует с клетками E. coli, стенки которых имеют отрицательный заряд [10]. На растояниях 6 и 10 мм от зоны возбуждения повреждения клеток E. coli становятся заметными только при Р > 10 МВт/см2, когда за счет двухквантового поглощения возрастает эффективность генерации ударных волн.
Рис. 6.
Изменения КОЕ клеток в физрастворах до и после облучения импульсами различной плотности мощности: a – E. coli (0.25 мМ раствор эритрозина); б – B. subtilis (0.25 мМ раствор эозина); в – B. subtilis (растворы родамина 6Ж на расстоянии 10 мм).

Клетки B. subtilis оказались более чувствительными к воздействию ударных волн. Их чувствительность даже к малым дозам облучения, по-видимому, обусловлена взаимодействием эозина с бактериями.
Зависимость выживаемости бактерий от плотности мощности накачки при разной концентрации родамина 6Ж в растворе, на расстоянии 10 мм от зоны возбуждения, представлена на рис. 6в. Видно, что с ростом концентрации ТС эффективность повреждения микроорганизмов возрастает. Особенно заметными повреждения становятся при Р > 20 МВт/см2.
С ростом концентрации красителя в растворе увеличивается плотность тепловых источников. Это повышает эффективность генерации ударных волн и, соответственно, увеличивает вероятность повреждения бактерий. Кроме того, при большой концентрации красителей образуются ассоциаты, квантовый выход флуоресценции у которых ниже, чем у мономеров [19]. Ассоциаты красителей могут быть дополнительными источниками тепловыделения в растворах.
Повреждения бактерий ударными волнами можно обнаружить на АСМ-изображениях, представленных на рис. 7. В исследованных образцах, содержащих бактериальные клетки E.coli до облучения, на поверхности подложки обнаружены продолговатые объекты высотой более 600 нм и объекты разнообразной формы, высотой менее 100 нм (рис. 7а). Первые объекты идентифицированы как бактериальные клетки со средними размерами 1.8 мкм в длину, 0.9 мкм в ширину и 0.7 мкм в высоту. Более мелкие структуры, очевидно, являются остатками питательной среды и физраствора, использующегося в качестве буфера.
Рис. 7.
АСМ-изображения бактериальных клеток E.coli до (а) и после (б) облучения (λвозб = 532 нм, Р = 30 МВт/см2) в растворе с эритрозином (0.25 мМ).

Результаты визуализации клеток E.coli после облучения (Р = 30 МВт/см2) в растворе с эритрозином (0.5 мМ), отобранных на расстоянии 5 мм от зоны возбуждения, показаны на рис. 7б. Отличительная особенность представленных изображений – наличие на подложке клеток с поврежденной клеточной стенкой. При этом высота клеток уменьшилась и составила в среднем 0.5 мкм. Для количественного описания изменений клеточной стенки оценена ее шероховатость до и после воздействия. Среднеквадратичная шероховатость увеличилась в среднем на 40%, составляя до и после облучения в среднем 23 и 32 нм.
Аналогичные изменения наблюдаются в клетках B.subtilis: в контрольных образцах, помимо интактных, обнаруживаются также деформированные клетки с разной степенью поражения вплоть до полностью дефрагментированных микроорганизмов.
ЗАКЛЮЧЕНИЕ
Для повреждения патогенных бактерий можно с успехом использовать ударные волны, возникающие при быстром локальном нагреве среды. Такой способ инактивации бактерий по сравнению с другими обладает рядом преимуществ. Он эффективен и универсален, поскольку пригоден для любых микроорганизмов. Бактерии не могут легко выработать против такого способа иммунитет.
Для генерации ударных волн можно использовать разнообразные сенсибилизаторы. Важно лишь, чтобы сенсибилизаторы быстро и эффективно преобразовывали энергию света в тепло. Если это не удается сделать при релаксации нижних возбужденных состояний молекул, то можно “включить” высоковозбужденные электронные состояния. Особенно удобен такой подход для сенсибилизаторов с высоким выходом в триплетное состояние – в зависимости от ситуации их можно использовать либо для генерации активных форм кислорода, либо ударных волн.
Инактивация микроорганизмов ударными волнами целесообразна в средах, где традиционные способы – антибиотикотерапия или фотодинамическое воздействие на патогены – малоэффективны из-за ограниченного проникновения в среду препаратов и света.
Исследование поддержано Минобрнауки России, проект № FSGU-2020-0003.
Список литературы
Simonsen G.S., Tapsall J.W., Allegranzi B. et al. // Bull. World Health Organ. 2004. V. 82(12). P. 928.
Arias C.A., Murray B.E. // N. Engl. J. Med. 2009. V. 360. P. 439. https://doi.org/10.1056/NEJMp0804651
Wilson M. // J. Photochem. Photobiol. 2004. V. 3. P. 412. https://doi.org/10.1039/b211266c
Donlan M. // Emerg. Infect. Dis. 2002. V. 8. P. 881. https://doi.org/10.3201/eid0809.020063
Fux C.A., Costerton J.W., Stewart P.S. et al. // 2005. V. 13. P. 34. https://doi.org/10.1016/j.tim.2004.11.010
Taylor P.W., Stapleton P.D., Luzio J. // Drug Discov. Today. 2002. V. 7. P. 1086. https://doi.org/10.1016/s1359-6446(02)02498-4
Hamblin M.R. // Curr. Opin. Microbiol. 2016. V. 33. P. 67. https://doi.org/10.1016/j.mib.2016.06.008
Huang L., Dai T., Hamblin M.R. // Methods Mol. Biol. 2010. V. 635. P. 155. https://doi.org/10.1007/978-1-60761-697-9_12
Kashef N., Huang Y., Hamblin M.R. // Nanophotonics. 2017. V. 6(5). P. 853. https://doi.org/10.1515/nanoph-2016-0189
Hamblin M.R., Hasan T. // Photochem. Photobiol. Sci. 2004. V. 3. P. 436. https://doi.org/10.1039/b311900a
Taraszkiewicz G., Fila G., Grinholc M. et al. // Int. J. Biomed. Res. 2013. V. 5. P. 150653. https://doi.org/10.1155/2013/150653
Vatansever F., de Melo W., Avci P. et al. // FEMS Microbiol. Rev. 2013. V. 37. P. 955. https://doi.org/10.1111/1574-6976.12026
Летута С.Н., Летута У.Г., Пашкевич С.Н. // Биофизика. 2019. Т. 64. № 4. С. 726. S.N. Letuta, U.G. Letuta and S.N. Pashkevich // Biophysics. 2019. V. 64. No. 4. P. 576. https://doi.org/10.1134/S0006350919040092
Ишемгулов А.Т., Летута С.Н., Пашкевич С.Н. и др. // Оптика и спектроскопия. 2017. Т. 123. № 5. С. 818. A.T. Ishemgulov, S.N. Letuta, S.N. Pashkevich, et al. // Optics and Spectroscopy. 2017. V. 123 (5). P. 828. https://doi.org/10.1134/S0030400X1711008X
Letuta S.N., Pashkevich S.N., Ishemgulov A.T. et al. // J. Photochem. Photobiol. B. 2016. V. 163. P. 232. https://doi.org/10.1016/j.jphotobiol.2016.08.036
Летохов В.С. Нелинейные селективные фотопроцессы в атомах и молекулах. М.: Наука, 1983.
Nickel B., Roden G. // Ber. Bunsenges. Phys. Chem. 1977. V. 81. № 3. P. 281. https://doi.org/10.1002/bbpc.19770810308
Tobita S., Kaisu Y., Kobayashi H. et al. // J. Chem. Phys. 1984. V. 81. № 7. P. 2962https://doi.org/https://doi.org/10.1063/1.448046
Orner G.C., Topp M.R. // Chem. Phys. Lett. 1975. V. 36. № 5. P. 295. https://doi.org/10.1016/0009-2614(75)80240-5
Lin H.B., Topp M.R. // Chem. Phys. Lett. 1977. V. 48. № 2. P. 251. https://doi.org/10.1016/0009-2614(77)80309-6
Ермолаев В.Л., Любимцев В.А. // Опт. и спектр. 1984. Т. 56, вып. 6. С. 1026.
Nagaoka C., Fujita M., Takemura T. et al. // Chem. Phys. Lett. 1986. V. 123. № 6. P. 489. https://doi.org/10.1016/0009-2614(86)80048-3
Rohatgi-Mukherjee K.K., Mukhopadhyay A.K. // Indian J. of Pure and Applied Phys. 1976. V. 14. № 6. P. 481.
Рыльков В.В., Чешев Е.А. // Докл. АН СССР. 1985. Т. 281. № 3. С. 648.
Laser Applications in Medicine and Biology / Wolbarsht M.L. (ed.). New York, Plenum Press, 1977. P. 175-219. https://doi.org/10.1007/978-1-4615-7326-5
Рыльков В.В., Чешев Е.А. // Опт. и спектр. 1987. Т. 63, вып. 4. С. 778.
Летута С.Н. // Вестник ОГУ. 2002. № 5. С. 88.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии