Журнал физической химии, 2021, T. 95, № 4, стр. 641-645
Влияние направленного светового потока на пространственную ориентацию мицелл тритона Х-100
О. А. Федяева a, *, Е. Г. Пошелюжная a
a Омский государственный технический университет
Омск, Россия
* E-mail: kosatine@mail.ru
Поступила в редакцию 29.04.2020
После доработки 17.07.2020
Принята к публикации 20.07.2020
Аннотация
Методами турбидиметрии, оптической микроскопии, рефрактометрии и поляриметрии изучены оптические свойства коллоидных растворов неионогенного поверхностно-активного вещества Тритон X-100. Показано, что его мицеллы имеют вид вытянутых эллипсоидов вращения, оптически активны, сохраняют ориентационный порядок и перемещаются под действием направленного светового потока в зависимости от концентрации раствора.
В работе представлены результаты исследования неизвестного ранее явления изменения пространственной ориентации мицелл неионогенного поверхностно активного вещества (НПАВ) Тритона X-100 под действием направленного светового потока.
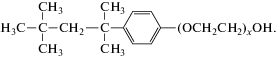
Тритон X-100 представляет собой растворимый в воде полидисперсный препарат моно-н-(1,1,3,3-тетраметилбутил)фениловый эфир полиэтиленгликоля, содержащий 9–10 оксиэтильных групп в молекуле:
Он используется в биохимии для солюбилизации белков, липосахаридов и других гидрофобных молекул [1], стабилизации прямых эмульсий, а также как моющее средство в лабораториях.Мицеллы Тритона X-100 в водных растворах изучаются давно [1–15]. Для описания их структуры были предложены две модели частиц – сферические [2–7] и эллипсоидальные [8–15]. Наиболее распространенной является гипотеза о том, что мицеллы данного вещества имеют форму сплющенных эллипсоидов. Авторы работы [16] при исследовании Тритона X-100 в агрегированном состоянии установили, что при низких концентрациях его мицеллы являются почти сферическими, а при более высоких концентрациях – эллипсоидальными. Наши исследования мицелл Тритона X-100, опубликованные в виде краткого сообщения [17], показали, что они имеют форму вытянутых эллипсоидов вращения, которые могут изменять свою ориентацию по отношению к падающему свету в зависимости от концентрации раствора. В данной статье мы представляем более полную информацию об этом явлении.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Водные растворы НПАВ в области концентраций (0.1–51.2) × 10–3 моль/л готовили из коммерческого препарата Triton X-100 фирмы SIGMA-ALDRICH и деионизованной воды, полученной на приборе “Водолей”. Критические концентрации мицеллообразования (ККМ1 и ККМ2) определяли кондуктометрическим методом на приборе Мультитест КСЛ. При 22°C они составили соответственно 1.72 × 10–4 и 3.2 × 10–3 моль/л [18]. Показатели преломления исходного препарата Triton X-100 и его водных растворов определяли на рефрактометре ИРФ-454 Б2М. Количество оксиэтильных групп (x) в молекуле Тритона X-100 определяли сравнением значений молекулярной рефракции, определяемой на основании измерения коэффициента преломления с ее теоретической величиной, рассчитанной по правилу аддитивности из составляющих инкрементов рефракции [19]. Экспериментальное $R_{M}^{Э}$ и теоретическое $R_{M}^{T}$ значения молекулярной рефракции рассчитывали по формулам:
где n – показатель преломления (n = 1.4886); М – молекулярная масса; $\rho $ – плотность вещества где m – число атомов или связей данного вида в молекуле; R – инкременты молекулярной рефракции.Экспериментальное значение молекулярной рефракции Тритона X-100 составило 168.465 см3/моль, а теоретическое значение для молекулы НПАВ, имеющей в своем составе 10 оксиэтильных групп (x = 10), оказалось равным 168.367 см3/моль.
Форму и ориентацию мицелл Тритона X-100 по отношению к падающему свету определяли методами турбидиметрии на приборе Specol 1500 и оптической микроскопии на монокулярном микроскопе Биомед 2. Фотосъемку изображений с окуляра выполняли с помощью фотокамеры с разрешением 3248 × 2448 пикселей. Измерения водородного показателя осуществляли с помощью комбинированного измерителя Seven Easy pH в комплекте с комбинированным электродом InLab 413.
Оптическую активность водных растворов НПАВ изучали измерением угла вращения плоскости поляризации с помощью кругового поляриметра СМ-3 при длине волны света λ = 589 нм и толщине слоя раствора, равной 1 дм. Чувствительность поляриметра –0.04°, погрешность в диапазоне от 0 до ± 35° не более ±0.04°.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Спектры пропускания водных растворов Тритона X-100, представленные на рис. 1, имеют характерные для феноксильных групп полосы поглощения в области 247–290 нм [20], интенсивность которых изменяется в зависимости от концентрации раствора. При длине волны падающего света, равной 246 нм, поглощение феноксильными группами отсутствует, а ослабление интенсивности падающего света, вероятнее всего, происходит за счет светорассеяния на мицеллах.
Рис. 1.
Спектры пропускания водных растворов Тритона X-100 при различной концентрации (моль/л): 1 – 1 × 10–4, 2 – 2 × 10–4, 3 – 4 × 10–4, 4 – 8 × 10–4, 5 – 1.6 × 10–3; 6 – 3.2 × 10–3, 7 – 6.4 × 10–3, 8 – 1.28 × 10–2, 9 – 2.56 × 10–2, 10 – 5.12 × 10–2.
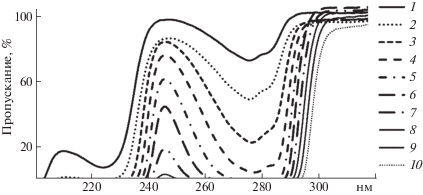
Для проверки данного предположения из спектров пропускания нами были выполнены расчеты мутности растворов и найдены эквивалентные радиусы мицелл по следующим формулам:
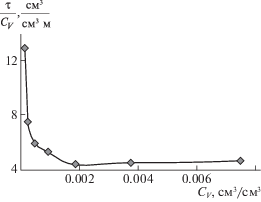
Из графика, представленного на рис. 2, видно, что в зависимости от объемной доли Тритона Х-100 (${{C}_{V}}$) растворы отличаются между собой оптическими свойствами. Можно выделить растворы, для которых значение функции $\frac{\tau }{{{{C}_{V}}}} = f({{C}_{V}})$ резко уменьшается с ростом объемной доли дисперсной фазы, и растворы, для которых эти значения плавно увеличиваются. Для растворов с объемной долей дисперсной фазы, равной (1.16–9.34) × × 10–4 см3/см3, эквивалентный радиус мицелл составил 11.4 Å, а для растворов с содержанием дисперсной фазы (1.87–7.47) × 10–3 см3/см3 он оказался равным 6.4 Å.
Поскольку размеры мицелл и их форма не могут значительно изменяться с разбавлением растворов, полученные результаты можно объяснить эллипсоидальной формой частиц и их различной ориентацией по отношению к падающему свету. Полученный нами размер полуоси b (11.4 Å) эллипсоидальных мицелл Тритона Х-100 согласуются с литературными данными [9, 15]. Эти авторы, предположили, что мицеллы тритона Х-100 имеют форму сплюснутого эллипсоида. Несмотря на то, что рассчитанные ими размеры полуоси b совпали и составляют 10.4 Å, размеры полуоси a у них значительно различаются: 20 [15] и 34 Å [9]. Если бы мицеллы имели форму сплюснутых эллипсоидов, вращающихся вокруг малой оси, то они имели бы одинаковый эквивалентный радиус независимо от их ориентации в растворе по отношению к падающему свету. Мицеллы, имеющие форму вытянутых эллипсоидов, при изменении их положения в растворе могут казаться как частицы с различными радиусами.
Согласно микроскопическими исследованиями микрокапли дисперсной фазы в системе Тритон X-100/н-гексан/вода имеют форму вытянутых эллипсоидов вращения, большие оси которых направлены вдоль одного преимущественного направления. При концентрациях растворов НПАВ (0.17–0.8) × 10–3 моль/л эллипсоиды располагаются перпендикулярно световому потоку (рис. 3), а в более концентрированных растворах (1.6–51.2) × × 10–3 моль/л они имеют одинаковое с ним направление (рис. 4).
Рис. 3.
Мицеллы эмульсии Тритона Х-100 в н-гексане при концентрации 1 × 10–4 моль/л, ориентированные перпендикулярно световому потоку. Увеличение микроскопа 1600 крат.
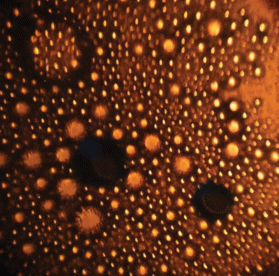
Рис. 4.
Мицеллы эмульсии Тритона Х-100 в воде при концентрации 3.2 × 10–3 моль/л, ориентированные по направлению светового потока. Увеличение микроскопа 1600 крат.

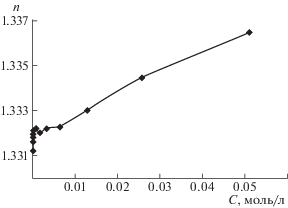
Изменение оптических свойств водных растворов Тритона Х-100, обусловленных переориентацией его мицелл, можно наблюдать на кривой зависимости показателя преломления от концентрации НПАВ (рис. 5). Также как на кривой изменения мутности (рис. 2), на данном графике можно выделить участки, соответствующие двум видам растворов. У первого вида растворов показатель преломления резко возрастает с ростом концентрации НПАВ. При достижении граничной концентрации, равной 0.8 × 10–3 моль/л, раствор меняет свои свойства и на кривой появляется небольшой максимум. Согласно микроскопическим исследованиям, в данных условиях происходит изменение ориентации мицелл по отношению к падающему свету. У растворов второго вида показатель преломления плавно увеличивается с ростом концентрации НПАВ.
Рис. 5.
Изменение показателя преломления водных растворов Тритона X-100 в зависимости от его концентрации.
Следует отметить, что водные растворы Тритона Х-100 имеют ряд специфических свойств, характерных для нематических жидких кристаллов. К этим свойствам относятся эллипсоидальное строение мицелл, способных к вращению вокруг большой оси и перемещению в любых направлениях, сохранение ориентационного порядка, коллективное изменение оптических свойств мицелл при внешних воздействиях. Учитывая, что жидкие кристаллы поворачивают плоскость поляризации света, то коллоидные растворы Тритона Х-100 также могут быть оптически активны.
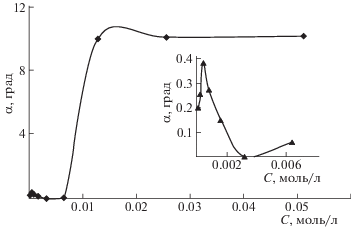
На рис. 6 представлена зависимость оптического вращения растворов от концентрации Тритона X-100. Из рисунка видно, что оптическая активность растворов в области ККМ1 изменяется экстремально. Максимум оптического вращения соответствует концентрации НПАВ, равной 4 × 10–4 моль/л. При концентрации НПАВ 3.2 × 10–3 моль/л, соответствующей ККМ2, раствор становится ахиральным. Дальнейшее увеличение концентрации НПАВ приводит к появлению незначительной оптической активности растворов и затем резкому ее росту. При концентрациях (1.28–5.12) × 10–2 моль/л оптическая активность плавно изменяется с увеличением концентрации НПАВ.
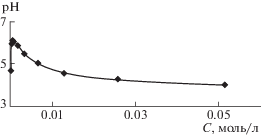
Полезную информацию о свойствах растворов Тритона X-100 можно получить из данных измерения водородного показателя (рис. 7). Оказалось, что все растворы имеют кислотный характер. Их pH изменяется через максимум, совпадающий с максимумом оптического вращения.
Анализируя полученные результаты, можно заключить, что рост оптической активности растворов тритона X-100 в области ККМ1 обусловлен возникновением хиральных домицеллярных комплексов [21, 22], концентрация которых по мере образования мицелл уменьшается. Кислотный характер дисперсионной среды указывает на то, что на мицеллах протекает протолитическая реакция между адсорбированными молекулами воды с преимущественным переходом ионов гидроксония в раствор [18]. При концентрациях НПАВ незначительно превышающих ККМ1, образуются нематические коллоидные системы, состоящие из эллипсоидальных мицелл [18], внутренняя часть которых состоит из переплетающихся углеводородных радикалов, а внешняя часть образована гидратированными полярными группами. При второй критической концентрации ККМ2 формирование полных мицелл заканчивается и начинает образовываться, вероятнее всего, лиотропная гексагональная жидкокристаллическая мезофаза [23]. В этот момент раствор оптически неактивен. Дальнейший рост концентрации хиральных жидкокристаллических ассоциатов сопровождается незначительным увеличением оптического вращения. И, наконец, резкое увеличение оптической активности можно отнести к формированию сплошной лиотропной гексагональной фазы.
В результате выполненных исследований установлено, что мицеллы Тритона Х-100 имеют форму вытянутых эллипсоидов вращения с размерами полуосей a = b = 11.4 Å и с = 25.5 Å. Эллипсоиды меняют свою ориентацию по отношению к падающему свету: при концентрациях растворов НПАВ (0.17–0.8) × 10–3 моль/л они располагаются перпендикулярно световому потоку, а в более концентрированных растворах они имеют одинаковое с ним направление. Изменение оптических свойств растворов, обусловленных переориентацией мицелл, проявляется в виде небольшого максимума на концентрационной кривой показателя преломления.
Мицеллы Тритона Х-100 обладают свойствами нематических жидких кристаллов. Они не только сохраняют ориентацию в растворе, управляемую светом, но и могут вращать плоскость поляризации плоскополяризованного света в правую сторону. Оптическая активность растворов данного НПАВ обусловлена появлением хиральных домицеллярных комплексов, жидкокристаллических ассоциатов и лиотропной гексагональной мезафазы. Оптическое вращение возникает выше точки Крафта и на концентрационном графике характеризуется выраженным максимумом в районе ККМ1.
Список литературы
Kushner L.M., Hubbard W.D. // J. of Physical Chemisrty. 1954. V. 58. № 12. P. 1163.
Biaselle C.J., Millar D.B. // Biophysical chemistry. 1975. V. 3. № 4. P. 355.
Corti M., Degiorgio V. // Optics communications. 1975. V. 14. № 3. P. 358.
Dennis E.A., Ribeiro A.A. // ACS symposium series. 1976. № 34. P. 453.
Ribeiro A.A., Dennis E.A. // Biochemistry. 1975. V. 14. № 17. P. 3746.
Ribeiro A.A., Dennis E.A. // J. of Physical Chemisrty. 1976. V. 80. № 16. P. 1746.
Wright A.K. // J. of Colloid and Interface Science. 1976. V. 55. № 1. P. 109.
Brown W., Rymden R., Van Stam J. et al. // J. of Physical Chemisrty. 1989. V. 93. № 6. P. 2512.
Robson R.J., Dennis E.A. // Ibid. 1977. V. 81. № 11. P. 1075.
Paradies H.H. // Ibid. 1980. V. 84. № 6. P. 599.
Rao K.S., Goyal P.S., Dasannacharya B.A. et al. //Pramana. 1991. V. 37. P. 311.
Charlton I.D., Doherty A.P. // J. of Physical Chemisrty B. 2000. V. 104. № 34. P. 8327.
Goyal P.S., Menon S.V.G., Dasannacharya B.A., Thiyagarajan P. // Physical Review E. 1995. V. 51. № 3. P. 2308.
Tanford C., Nozaki Y., Ronde M.F. // J. of Physical Chemisrty. 1977. V. 81. № 16. P. 1555.
Baglione M., Poggi G., Ciolli G. et al. // Materials. 2018. V. 11. № 7 (1144).
Dencova P.S., Van Lokeren L., Verbruggen I., Willem R. // J. of Physical Chemisrty B. 2008. V. 112. № 35. P. 10935.
Fedyaeva O. A., Poshelyuzhnaya E.G. // Rus. J. of Physical Chemistry A. 2019. V. 93. № 12. P. 2559.
Fedyaeva O.A., Poshelyuzhnaya E.G. // Ibid. 2020. V. 94. № 2. P. 327.
Краткий справочник физико-химических величин / Под ред. А.А. Равделя и А.М. Пономаревой. Л., 1983.
Мицеллообразование и солюбилизация микроэмульсии / Пер. с англ. М.Г. Гольдфельда. Под ред. В.Н. Измайловой. М.: Мир, 1991. 763 с.
Nekrasov A.G., Rusanov A.I. // Colloid Journal. 2011. V. 73. № 4. P. 506.
Rusanov A.I., Nekrasov A.G. // Doklady Physical Chemistry. 2010. V. 434. Part 2. P. 166.
Ghos H.N., Sapre A.V., RamaRao K.V.S. // Chemical physics letters. 1996. V. 255. P. 49.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии