Журнал физической химии, 2021, T. 95, № 5, стр. 670-677
Растворимость, диффузия компонентов и равновесие в системах СО2–этан–тяжелая нефть и СО2–пропан–тяжелая нефть
М. М. Асадов a, b, *, Э. Э. Рамазанова a, Э. Н. Алиев a
a НИИ “Геотехнологические проблемы нефти, газа и химии”
Баку, Азербайджан
b Hациональная академия наук Азербайджана, Институт катализа и неорганической химии
Баку, Азербайджан
* E-mail: mirasadov@gmail.com
Поступила в редакцию 01.07.2020
После доработки 21.10.2020
Принята к публикации 21.10.2020
Аннотация
Приведены результаты исследования (T = 320–355 K и P = 2–15 MПa) растворимости, диффузии компонентов смесей и фазового поведения в системах СО2–этан–тяжелая нефть (I) и СО2–пропан–асфальтен (II). В качестве тяжелой нефти использованы высокомолекулярные углеводороды (0.9952 мас. доли атомов углерода С7+, содержащиеся в тяжелой Бакинской (Апшеронское месторождение, Азербайджан) нефти (${{\rho }_{{{\text{oil\;}}}}}$ = 952.15 кг/м3 и ${{\mu }_{{{\text{oil\;}}}}}$ = 724.15 MПa с при атмосферном давлении и температуре пласта 300 K). Изучена растворимость смесей CO2–этана и CO2–пропана в тяжелой нефти при 288–303 К и 100–600 кПа. Показано, что растворимость смесей CO2–этан и CO2–пропан в тяжелой нефти увеличивалась с ростом давления при постоянной температуре и уменьшается с ростом температуры. Установлено, что коэффициент диффузии CO2–этан и CO2–пропан в системах I и II при 287–303 К и давлении 2 MПa соответственно увеличивается с давлением и уменьшается по мере увеличения плотности нефти. Построены P–T-проекции фазовых диаграмм P–T–x для систем сверхкритических флюидов (СКФ) CO2–этан–тяжелая нефть и СКФ CO2–пропан–тяжелая нефть.
Технологическая обработка нефтегазоконденсатных смесей с применением сверхкритических флюидов (СКФ), например, диоксида углерода (СО2), требует знаний о диффузии и растворимости компонентов [1–4]. Однако диффузия компонентов СКФ СО2 и их фазовые взаимодействия в системах с участием тяжелых фракций нефти слабо изучены [5, 6], особенно растворимость [7–10] и диффузия [11–14] компонентов во флюидных смесях с участием тяжелых фракций нефти (асфальтенов) [9–12]. Мало работ по коэффициентам диффузии углеводородов в областях, близких к критической точке сверхкритического флюида СО2 (>305 K, >10 МПа). Кроме того, такие растворители, как этан [15–17] и пропан [17–19] также используются в качестве СКФ, в которых бинарные коэффициенты диффузии были измерены для различных органических соединений [20] с маленькой молекулярной массой.
Для расчета коэффициента бинарной диффузии флюидов при высоких давлениях предложены различные модели, которые используются для получения корреляций между важными факторами. Типичная погрешность в этих корреляциях оценивается в пределах 10–30% [16, 21–27]. Для определения коэффициентов молекулярной диффузии, например, в бесконечно разбавленных сверхкритических жидкостях в [16] предложено уравнение:
(1)
$\begin{gathered} \alpha = f\left( {\frac{{{{\sigma }_{2}}}}{{{{\sigma }_{1}}}}} \right) = \frac{{{{\sigma }_{2}}}}{{{{\sigma }_{1}}}} - \frac{1}{3}, \\ {{b}_{2}} = \frac{b}{a} = \left[ { - 0.2440{{{\left( {\frac{{{{\sigma }_{2}}}}{{{{\sigma }_{1}}}}} \right)}}^{2}}} \right. + \\ \end{gathered} $Для получения уравнения (1) использована модель грубой сферы, предложенная в работе [17]. Эмпирические константы σ и γ уравнения (1) подобраны из многочисленных экспериментальных данных по диффузии ограниченных смесей в широком диапазоне температур и давлений. Проведены сравнения модели с литературными данными для систем углеводород–СКФ СО2 с известными критическими константами (Tc и Vc). Анализ критических констант 101 органических систем, доступных из литературы, показывает, что вычисленная средняя погрешность бинарной диффузии по уравнению (1) составляет ~15%.
Известны современные методы измерения диффузии растворителя в тяжелой нефти в практических условиях нефтяного пласта [28–31]. В этих работах изучены диффузия растворителя в динамической висячей капле [28], диффузия газообразных растворителей в тяжелой нефти с использованием магнитно-резонансной томографии [29], диффузия пропана (C3H8) в тяжелой нефти при 80–130°С и ≤1900 кПа [30] и диффузия в системе нефть–CO2 в пластовых условиях с использованием акустически контролируемого сепаратора [31]. В частности, в [28] исследована диффузия растворителя в динамической висячей капле нефти. Диффузия растворителя (диоксид углерода) при этом вызывает физическое изменение формы и объема капли нефти до достижения равновесного состояния. Этот экспериментальный метод проверен для измерения диффузии СО2 в образце тяжелой нефти (общее количество растворенного твердого вещества составляло 4310 мг/л). Показано, что способ позволяет измерять коэффициент диффузии растворителя в пробе нефти при постоянном заданном давлении 0.1–7.2 MПa и температуре. Одно измерение коэффициента диффузии может быть выполнено в течение 1 ч, при этом требуется только небольшое количество пробы нефти.
Изучена также зависимость коэффициента диффузии СКФ СО2 от состава и свойств нефти в условиях плотного нефтяного пласта [32]. С использованием математической модели, объединяющей уравнение диффузии Фика и уравнение состояния Пенга–Робинсона [21], описаны процесс массопереноса и изменение экспериментальных данных о коэффициенте диффузии СКФ СО2.
Однако процесс диффузии сверхкритических бинарных систем в тяжелой нефти мало изучен. Изучение закономерностей поведения углеводородной системы под высоким давлением имеет научное и практическое значение. Это связано, в частности, с тем, что она позволяет предсказать фазовые превращения флюидов в суперктритических условиях [33]. Бинарные и многокомпонентные нефтяные флюидные системы имеют свои особенности в области, лежащей вблизи критических давлений и температур [34]. Критическое давление смеси обычно выше, чем критическое давление чистых компонентов. Величина критической температуры различных смесей находится между критическими температурами компонентов [35].
Природные углеводородные смеси отличаются большим разнообразием состава. Поэтому фазовые диаграммы нефтегазовых смесей зависят также от состава нефти и газа [36]. Размеры двухфазных областей обычно возрастают по мере того, как в составе углеводородной смеси распределение между компонентами становится равномерным.
Анализ литературы показывает, что низкие коэффициенты диффузии СО2 в нефтяных системах можно объяснить составом и свойствами нефти [37, 38]. В частности, увеличение вязкости, т.е. доли тяжелых компонентов нефти, замедляет скорость процесса массопереноса [39], т.е. при этом увеличивается сопротивление к массопереносу СО2.
Результаты расчетов фазовых P–T–x-диаграмм для некоторых углеводородсодержащих систем приведены в работах [40, 41].
Цель данной работы – изучение растворимости, бинарной диффузии и фазового равновесия в системах CO2–этан–тяжелая нефть и СКФ CO2–пропан–тяжелая нефть.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Дистиляционный и абсорбционно-хроматографический анализ состава сырой тяжелой нефти месторождения Апшерона (2014 год, Баку, Азербайджан) показал, что в ее составе мольная доля углеводородов с числом атомов углерода ≥7 составляет 0.9877 [6, 12]. Абсорбционно-хроматографическим методом (ASTM D 2007) разделили тяжелую нефть на следующие фракции: насыщенные и ароматические углеводороды, смолы и асфальтены (табл. 1). Относительная молекулярная масса и плотность углеводородов составляет 391 г/моль и 957 кг/м3. Чистота CO2, C2H6, C3H8, использованных для этого исследования, составляла 99.995, 99.99 и 99.99% соответственно.
Таблица 1.
Анализ тяжелой нефти и молярной массы каждой фракции (М – молярная масса)
| Образeц | С, мас. % | М, г/моль |
|---|---|---|
| Сырая нефть всего | 100 | 391 |
| Насыщенные углеводороды | 25 | 362 |
| Ароматические углеводороды | 24 | 389 |
| Смолы | 23 | 952 |
| Асфальтены | 11 | 1897 |
| Летучие органические соединения (<313 К) | 17 |
Для измерения растворимости в системах СКФ CO2–этан–тяжелая нефть (I) и СКФ CO2–пропан–тяжелая нефть (II) использовали гравиметрический способ с динамическим газосорбционным анализатором (IGA 003, Hiden Isochema Ltd., Warrington, UK). Смесь растворителей готовили до требуемого состава из газов CO2–этан (пропан) с использованием объемного метода в стальных баллонах высокого давления. Мольные соотношения [растворитель] : [растворенное вещество] брали таким образом, чтобы CO2 был в избытке по отношению к углеводородному компоненту. Смеси CO2–этан (пропан) переносили из баллонов в водяную баню, поддерживаемую при 273 K. Газы проходили через теплообменники, которые доводили их до температуры водяной бани. Сжиженные смеси CO2–этан (пропан) хранили в стальных гидроцилиндрах. Здесь сжиженная смесь находилась под давлением с помощью гидравлического поршня, работу которого контролировали с помощью насоса. В качестве гидравлической жидкости использовали толуол. Для создания СКФ смеси CO2–этан (пропан) пропускали через теплообменник в масляную баню, температуру которой контролировали с точностью до ±1 K.
Измерения коэффициента диффузии проводили на лабораторной установке, собранной по методике, описанной в работах [42–45]. В указанных работах приведены также схема измерительной установки, методика проведения экспериментов и процедура определения коэффициента диффузии в сверхкритических флюидах СО2. Оборудование включает в себя жидкостной хроматограф (SUPREX 200A) с клапаном, двумя пустыми колонками из нержавеющей стали, детектор на выходе из колонок и предохранитель, расположенный между колонкой и детектором. После того, как температура и давление в изучаемой системе достигли желаемых значений, системе давали возможность уравновеситься в течение 1–2 ч. После установления теплового и гидродинамического равновесия начали измерения. Диоксид углерода подавали шприцевым насосом при скорости потока 0.15 мл/мин. Линейную скорость CO2 определяли с помощью расходомера. Раствор вводили в поток диоксида углерода с помощью инжекционного клапана.
Эксперименты проводили при 288–303 К и давлении 2 МПа. Тестирование экспериментальной установки проводили, измеряя бинарные коэффициенты диффузии (D12) ацетона и толуола в СКФ–CO2. Погрешность измерения D12 составляла ≤2%. Полученные значения D12 хорошо совпадали с данными [42–45]. Критические состояния и фазовое поведение компонентов систем I и II изучали (T = 287–355 K and P = 2–15 MPa) на углеводородно-конденсатной установке марки УГК-4, включающей двойной реактор типа OL-105/02.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Растворимость. Растворимости смесей CO2–этан и CO2–пропан в тяжелой нефти и фракций нефти были измерены при 288–303 К и 100–600 кПа. Объемная мольная доля газообразной фазы CO2, смешанного с этаном (пропаном), до растворения в нефти в системах I и II составляла 0.85–0.87. В качестве примера на рис. 1 приведены термобарические зависимости растворимости CO2–пропан (0.15 мол. доли С3Н8) в тяжелой нефти при температурах 288, 297 и 303 K и 2 МПа. Из рис. 1 видно, что растворимость смеси CO2–пропан в тяжелой нефти увеличивалась с ростом давления при постоянной температуре и уменьшалась с ростом температуры. Установлено, что наиболее высокую растворимость смесей CO2–этан и CO2–пропан в тяжелой нефти имеет фракция насыщенных углеводородов. Далее следуют мальтеновые фракции, ароматические соединения и смолы. Концентрация асфальтена в системе сильно влияет на растворимость смесей CO2–этан и CO2–пропан в тяжелой нефти при том же равновесном давлении.
Рис. 1.
Термобарические зависимости растворимости смеси CO2–пропан в тяжелой нефти; 1 – 288, 2 – 297, 3 – 303 K. Объемная мольная доля газообразной фазы CO2, смешанной с пропаном, до растворения в тяжелой нефти составляла 0.85.

Коэффициент диффузии. Классическая кинетическая теория диффузии в газовых системах применяется при атмосферном и низком давлении. Уравнения этой теории не подходят для определения коэффициентов диффузии (D12) бинарных компонентов и описания сверхкритических жидкостей и плотных газов. Расчет коэффициентов диффузии бинарных систем с высокой точностью требует особый подход [46, 47]. Когда растворенное бинарное вещество 1 диффундирует в растворитель 2 в направлении z, коэффициенты диффузии можно оценить из соотношения для диффузионного потока массы. В этом случае подобно передаче импульса и тепла, диффузионной поток массы $J$ можно задать следующим образом:
где C12 – концентрация растворенного бинарного вещества, D12 – бинарный коэффициент диффузии. Бинарный коэффициент диффузии зависит от состава вещества. Если C2 ≪ C1 то значение D12 не зависит от концентрации C2. Однако, если C2 ≈ ≈ C1, то выражение (2) является неточным для вычисления D12. Погрешность использования уравнения (2) в литературе еще не вполне выяснена. Не вполне ясны также те пределы, в которых уравнением (2) можно пользоваться. Уравнение (2) подходит для оценки ${{D}_{{12}}}$ в очень разбавленных бинарных смесях [47]. В системах I и II условие C2 ≪ C1 не соблюдалось. Кроме того, околокритическое поведение бинарных смесей сильно зависит от производных критических параметров $({{P}_{{\text{c}}}},~{{T}_{{\text{c}}}})$: ${{T}_{{\text{c}}}}{\text{/}}dx$, ${{P}_{{\text{c}}}}{\text{/}}dx$, $(d{{P}_{{\text{с}}}}{\text{/}}dT)_{{{{V}_{{{\text{c\;}}}}}{{T}_{{{\text{c\;}}}}}}}^{C}$, т.е. от знака и величины параметра Кричевского [48, 49]. Здесь $(d{{P}_{{\text{с}}}}{\text{/}}dT)_{{{{V}_{{{\text{c\;}}}}}{{T}_{{{\text{c\;}}}}}}}^{C}$ относится к чистому растворителю. С учетом изложенного выше оценка D12 по уравнению (2) не соответствовала истинному значению в изученных системах I и II.В изученных системах I и II при 287–303 К измеренное давление 2 MПa было ниже, чем критические давления используемых смесей CO2–этан и CO2–пропан (рис. 2). Экспериментальные бинарные коэффициенты диффузии в этих системах увеличиваются с повышением давления >2 MПa. Бинарные коэффициенты диффузии в системах CO2–этан–тяжелая нефть (система I) и CO2–пропан–тяжелая нефть (система II) увеличиваются с ростом давления, а с увеличением плотности исследуемых образцов нефти коэффициенты диффузии смесей уменьшаются. Температурные зависимости коэффициента диффузии CO2 и систем I и II в тяжелой нефти при заданном давлении согласуются между собой. Как видно из рис. 2, с ростом температуры от 287 до 303 К значение D12 увеличивается.
Рис. 2.
Сравнение коэффициентов диффузии CO2 (1), смесей СКФ CO2–этан (2) и СКФ CO2–пропан (3) в тяжелой нефти при 2 МПа. Объемная мольная доля газообразной фазы CO2, смешанной с этаном и пропаном, до растворения в тяжелой нефти составляла 0.85.

P–T-проекции. На рис. 3 и 4 приведены P–T-проекции фазовых P–T–x-диаграмм флюидных систем I и II соответственно. Каждая из этих систем характеризуется тремя критическими точками компонентов CO2, этана (пропана) и тяжелой нефти. На P–T-проекциях систем I и II моновариантные линии начинаются от критических координат $({{P}_{{\text{c}}}},~\,\,{{T}_{{\text{c}}}})$ соответствующих компонентов (С1 – критическая точка СО2; С2 – критическая точка C2H6 (C3H8); С3 – критическая точка тяжелой нефти) и образуют моновариантные критические кривые смесей. В табл. 2 приведены критические характеристики компонентов этих систем. Моновариантные критические кривые на участке С1–С2 (рис. 3 и 4), характеризующие равновесия фаз на основе тяжелой нефти систем I и II, аппроксимировали уравнением состояния Пенга–Робинсона [21]:
(3)
$a = \mathop \sum \limits_i \mathop \sum \limits_j \,{{x}_{i}}{{x}_{j}}{{a}_{{ij}}},\quad b = \mathop \sum \limits_i \,{{x}_{i}}{{b}_{i}},$Рис. 3.
Р–Т-проекции фазовой диаграммы системы СКФ CO2–этан–тяжелая нефть. При соответствующих критических координатах (${{P}_{c}},~{{T}_{c}}$) С1 = (CP CO2), С2 = (CP C2H6), С3 = (CP – тяжелая нефть), составы паровой фазы (V) и жидкой фазы компонентов (L) совпадают. Объемная мольная доля газообразной фазы CO2, смешанной с этаном, до растворения в тяжелой нефти составляла 0.85. Сплошные кривые 1 – участки P–T-диаграммы, построенные по экспериментальным данным. Кривая 2 – аппроксимация критической кривой по уравнению состояния (3). Пунктирные линии – ориентировочный ход участков диаграммы, не определенных экспериментально.
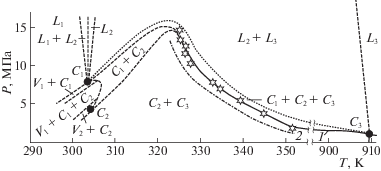
Рис. 4.
P–T-проекции фазовой диаграммы системы СКФ CO2–пропан–тяжелая нефть. При соответствующих критических координатах (Pc, Tc) С1 = (CP CO2), С2 = (CP C2H6), С3 = (CP – тяжелая нефть); составы паровой фазы (V) и жидкой фазы компонентов (L) совпадают. Объемная мольная доля газообразной фазы CO2, смешанной с этаном, до растворения в тяжелой нефти составляла 0.85. Сплошные кривые 1 – участки P–T-диаграммы, построенные по экспериментальным данным. Кривая 2 – аппроксимация критической кривой по уравнению состояния (3). Пунктирные линии – ориентировочный ход участков диаграммы, не определенных экспериментально.

Таблица 2.
Критические свойства компонентов
| Компонент | Рс, МПа | Тс, К |
|---|---|---|
| Диоксид углерода (СО2) | 7.38 | 304.14 |
| Этан (С2Н6) | 4.87 | 305.33 |
| Пропан (С3Н8) | 4.25 | 369.84 |
| Тяжелая нефть | 1.16 | 910.13 |
При температурах, отличных от критической, принимается, что
α – ацентрический коэффициент Питцера, Tr – приведенная температура, ω – ацентрический фактор вещества. Зависимости коэффициента α от температуры и ацентрического фактора веществ определяются по экспериментальным данным для давления насыщенного пара веществ. Безразмерный $Z$-фактор характеризует отклонение уравнения состояния (3) от уравнения состояния идеального газа.Моделирование фазовых P–T-диаграмм с помощью уравнения состояния Пенга–Робинсона требует знания критических параметров (Pc, Tc) и ацентрических коэффициентов Питцера (α) для каждого компонента флюидных систем I и II. Для тяжелой нефти, которая имеет сложный состав, эти требования экспериментально трудно удовлетворить. Поэтому в P–T–x-экспериментах использовали одни и те же образцы тяжелой нефти. Рассчитанные критические кривые (рис. 3 и 4; кривые 2) качественно аппроксимируют экспериментальные данные для систем I и II.
Отклонение оцененных кривых для систем I и II от экспериментальных данных можно объяснить следующим образом. Альфа-функция (α(Tr , ω)) должна соответствовать трем критериям [50]: 1) альфа должна быть конечной и положительной при всех температурах; 2) альфа должна быть равна единице при критической температуре; 3) альфа должна быть конечной величиной, когда температура приближается к бесконечности. Для систем, содержащих тяжелые углеводороды, все три критерия для альфа-функции не соблюдаются. Кроме того, при разработке уравнения состояния (3) были использованы данные и критические параметры (Pc, Tc) легких углеводородов. Требуется дальнейшее модифицирование уравнения состояния (3) с учетом данных для тяжелых углеводородов.
Критические свойства ($Z = [PV{\text{/}}nRT]$ – коэффициент сжимаемости) углеводородных компонентов оценивали корреляцией Ли–Кеслера [51]:
где ${{P}_{{\text{r}}}} = P{\text{/}}{{P}_{{\text{c}}}}$ приведенное давление, $~{{V}_{{\text{r}}}} = {{P}_{{\text{c}}}}{{V}_{{\text{m}}}}{\text{/}}P{{T}_{{\text{c}}}}$; ${{V}_{{\text{m}}}}$ – мольный объем для эталонной жидкости (н‑октан); R – газовая постоянная, ${{T}_{r}} = T{\text{/}}{{T}_{{\text{c}}}}$; Tc – псевдокритическая температура; T – температура. Вириальные коэффициенты В и С являются функциями температуры: B учитывает взаимодействия между парами молекул, C – взаимодействия между тремя молекулами и т.д. Значения этих констант для конкретных углеводородов приведены в справочниках [52, 53].Применение уравнения состояния Ли–Кеслера позволяет оценить коэффициент сжимаемости (Z-фактор) изученных компонентов в газообразном виде при высоком давлении [54]. Таким образом, корреляция Ли–Кеслера позволяет вычислять Z-фактор флюида как функцию Tr и Pr. Значения Tr и Pr используются для нахождения соответствующего значения Z на диаграмме Ли–Кеслера и в таблицах [51].
Найденные критические параметры (табл. 2) и оцененные ацентрические коэффициенты для каждого компонента систем I и II контролировали известными данными [53, 55–58]: для СО2 (Pc = 7.378 МПа, ${{T}_{{\text{c}}}}$ = 304.14 К), для С2Н6 (Pc = = 4.87 МПа, Tc = 305.33 К), для С3Н8 (Pc = = 4.25 МПа, Tc = 369.82 К, $Z$ = 0.152). Справочные значения коэффициента сжимаемости Z углеводородов заметно отличаются друг от друга в зависимости от состава, давления и температуры. Тяжелая нефть, которая является смесью углеводородов, характеризуется значительными межмолекулярными силами. С учетом указанного оценили величину Z = 1.04 (при 373 К) для используемого образца тяжелой нефти.
Таким образом, использование уравнения (3) с учетом корреляции (4) оказалось не очень эффективным для описания P–T-диаграмм систем I и II (кривые 2; рис. 3, 4). Это связано с тем, что для обработки опытных данных и использования уравнений (3) и (4) необходимо определить точные значения нескольких эмпирических коэффициентов, вводимых в расчет. Для сверхкритических трехкомпонентных систем I и II указанное сделать трудно.
ЗАКЛЮЧЕНИЕ
Термобарические зависимости растворимости смесей диоксид углерода–легкий углеводород в системах CO2–этан–тяжелая нефть (I) и CO2–пропан–тяжелая нефть (II) показывают, что массоперенос компонентов в этих системах заметно зависит от доли тяжелых углеводородов нефти. Из барической зависимости растворимости смеси CO2–пропан в тяжелой нефти следует, что с повышением температуры от 288 до 303 K растворимость смеси значительно уменьшается. Данные по растворимости смесей диоксид углерода–легкий углеводород в системах I и II могут быть использованы в физико-химических моделях, описывающих процессы переноса компонентов в аналогичных системах. Они важны также при оценке физического воздействия растворителей на нефтяные системы. Коэффициенты бинарной диффузии D12 компонентов диоксид углерода–легкий углеводород в системах I и II с участием тяжелых нефтей увеличиваются с повышением давления, а с увеличением плотности нефти коэффициенты D12 уменьшаются. Построенные Р‒Т-проекции фазовых Р–Т–x-диаграмм сверхкритических флюидных систем (СКФ) CO2–этан–тяжелая нефть и СКФ CO2–пропан–тяжелая нефть характеризуются двух- и трехфазными критическими кривыми смесей. Р–Т-диаграммы могут быть использованы для управления процессами разбавления и переноса компонентов веществами, снижающими концентрации тяжелых углеводородов в нефтяной среде.
Список литературы
Kiran E., Debenedetti P.G., Peters C.J. Supercritical Fluids: Fundamentals and Applications. Nato Science Series E: (V. 366). Springer Science & Business Media, 2012. 596 p.
Cabral V.F., Santos W.L.F., Muniz E.C. et al. // J. Supercrit. Fluids. 2007. V. 40. P. 163. https://doi.org/10.1016/j.sup?u.2006.05.004
Brazhkin V.V., Lyapin A.G., Ryzhov V.N. et al. // Rus. J. Phys. Chem. B. 2014. V. 8. № 8. P. 1087. https://doi.org/10.1134/s199079311408003x
Chapoy A., Mohammadi A.H., Richon D., Tohidi B. // Fluid Phase Equilibria. 2004. V. 220. № 1. P. 111. https://doi.org/10.1016/j.fluid.2004.02.010
Merdrignac I., Espinat D. // Oil & Gas Science and Technology – Rev. IFP. 2007. V. 62. № 1. P. 7. https://doi.org/10.2516/ogst:2007002
Asadov M.M., Ramazanova E.E., Aliev E.N. // Azerbaijan Oil Indastry. 2019. № 4. P. 63.
Schneider G.M., Kautz C.B., Tuma, D. Physico-Chemical Principles of Supercritical Fluid Science. In Supercritical Fluids, Fundamentals and Applications, Ed. by E. Kiran, P. G. Debenedetti, and J. Peters, NATO Science Series, Ser. E: Applied Sciences, V. 366. Kluwer Academic Publishers, 2000. P. 31–68. https://doi.org/10.1007/978-94-011-3929-8_2
Brunner G.H. Supercritical Fluids as Solvents and Reaction Media. Elsevier, 2004. 650 p. ISBN: 9780080542102
Kavousi A., Torabi F., Chan C.W., Shirif E. // Fluid Phase Equilib. 2014. V. 371. P. 57. https://doi.org/10.1016/j.fluid.2014.03.007
Опарин Р.Д., Воробьев Е.А., Киселев М.Г. // Сверхкритические флюиды: теория и практика. 2015. Т. 10. № 3. С. 4.
Magalhães A.L., Lito P.F., Da Silva F.A., Silva C.M. // J. Supercrit. Fluids. 2013. V. 76. P. 94. https://doi.org/10.1016/j.supflu.2013.02.002
Рамазанова Э.Э., Асадов М.М., Алиев Э.Н. // Технологии добычи и использования углеводородов. 2014. № 3. С. 1.
Liong K.K., Wells P.A., Foster N.R. // J. Supercrit. Fluids. 1991. V. 4. № 2. P. 91. https://doi.org/10.1016/0896-8446(91)90037-7
Funazukuri T., Kong C.Y., Kagei S. // Int. J. Thermophysics. 2000. V. 21. № 3. P. 651. https://doi.org/10.1023/A:1006637401868
Funazukuri T., Kong C.Y. & Kagei S. // Int. J. Thermophysics. 2000. V. 21. № 6. P. 1279. https://doi.org/10.1023/A:1006749309979
Eaton A.P., Akgerman A. // Ind. Eng. Chem. Res. 1997. V. 36. № 3. P. 923. https://doi.org/10.1021/ie9605802
Dymond J.H. // Chem. Soc. Rev. 1985. V. 14. № 3. P. 317. https://doi.org/10.1039/cs9851400317
Sun C.K.J., Chen S.H. // AIChE Journal. 1986. V. 32. № 8. P. 1367. https://doi.org/10.1002/aic.690320814
Sun C.K.J., Chen S.H. // Chem. Eng. Sci. 1985. V. 40. № 12. P. 2217. https://doi.org/10.1016/0009-2509(85)85123-X
Funazukuri T., Kong C.Yi., Murooka N., Kagei S. // Ind. Eng. Chem. Res. 2000. V. 39. P. 4462. https://doi.org/10.1021/ie000201b
Peng D.-Y., Robinson D.B. // Ind. Eng. Chem. Fundam. 1976. V. 15. № 1. P. 59. https://doi.org/10.1021/i160057a011
Cheng H., Anisimov M.A., Sengers J.V. // Fluid Phase Equilibria. 1997. V. 128. № 1–2. P. 67. https://doi.org/10.1016/s0378-3812(96)03169-x
Arai Y., Sako T., Takebayashi Y. (Eds.) Supercritical Fluids. Molecular Interactions, Physical Properties, and New Applications. Springer-Verlag. Berlin. Heidelberg, 2002. 462 p. ISBN: 978-3-642-62515-2
Durand V., Drobek M., Hertz A. // The Journal of Supercritical Fluids. 2013. V. 77. P. 17. https://doi.org/10.1016/j.supflu.2013.02.016
Kong C.Y. // J. Chromatograph Separat Techniq. 2014. V. 5. № 6. 1000e127. https://doi.org/10.4172/2157-7064.1000e127
Khalifi M., Zirrahi M., Hassanzadeh H., Abedi J. // J. Chem. Eng. Data. 2019. https://doi.org/10.1021/acs.jced.9b00763
Guevara-Carrion G., Ancherbak S., Mialdun A. et al. // Scientific Reports. 2019. V. 9. P. 8466. https://doi.org/10.1038/s41598-019-44687-1
Yang C., Gu Y. // SPE Journal. 2006. V. 11. № 1. P. 48. https://doi.org/10.2118/84202-pa
Fayazi A., Kantzas A. // Ind. Eng. Chem. Res. 2019. V. 58. № 23. P. 10031. https://doi.org/10.1021/acs.iecr.9b01510
Athar K., Doranehgard M.H., Eghbali S., Dehghanpour H. // Journal of Thermal Analysis and Calorimetry. 2019. V. 139. № 1–2. https://doi.org/10.1007/s10973-019-08768-7
Janiga D., Czarnota R., Kuk E. et al. // Journal of Petroleum Science and Engineering. 2019. V. 185. P. 106636. https://doi.org/10.1016/j.petrol.2019.106636
Zhang C., Qiao C., Li S., Li Z. // Energies. 2018. V. 11. P. 1495. https://doi.org/10.3390/en11061495
Dixon D.J., Johnston K.P. Supercritical Fluids. Kirk-Othmer Encyclopedia of Chemical Technology. John Wiley & Sons, Inc. 2000. https://doi.org/10.1002/0471238961.1921160504092415
Papon P., Leblond J., Meijer P.H. Phase Transitions in Fluids. In: Papon P., Leblond J., Meijer P.H. (eds) The Physics of Phase Transitions. Springer, Berlin, Heidelberg, 2006. P. 125–164. https://doi.org/10.1007/3-540-33390-8_4
Kiselev S.B., Rainwater J.C., Huber M.L. // Fluid Phase Equilibria. 1998. V. 150–151. P. 469. https://doi.org/10.1016/s0378-3812(98)00294-5
Pedersen K.S., Christensen P.L. Phase Behavior of Petroleum Reservoir Fluids, CRC Press. Taylor & Francis. Boca Raton, 2007. 423 p. ISBN: 9780824706944, 0824706943
Vitu S., Privat R., Jaubert J.-N., Mutelet F. // The Journal of Supercritical Fluids. 2008. V. 45. № 1. P. 1. https://doi.org/10.1016/j.supflu.2007.11.015
Nikolai P., Rabiyat B., Aslan A. et al. // Journal of Thermal Science. 2019. V. 28. P. 394. https://doi.org/10.1007/s11630-019-1118-4
Mullins O.C., Sheu E.Y., Hammami A., Marshall A.G. Asphaltenes, Heavy Oils, and Petroleomics, Springer. New York, NY, 2006. ISBN:978-0-387-31734-2
Schneider G.M. Fluid Phase Equilibria of Mixtures at High Pressure. In: Timmerhaus K.D., Barber M.S. (Eds). High-Pressure Science and Technology. Springer, Boston, MA 1979. P. 506. https://doi.org/10.1007/978-1-4684-7470-1_65
Altgelt K.H., Boduszynski M.M. Composition and Analysis of Heavy Petroleum Fractions. Ed. M. Dekker, New York, 1994. 495 p. ISBN 9780585374215
Sassiat P.R., Mourier P., Caude M.H., Rosset R.H. // Anal.Chem. 1987. V. 59. № 8. P. 1164. https://doi.org/10.1021/ac00135a020
Suárez J.J., Bueno J.L., Medina I. // Chemical Engineering Science. 1993. V. 48. № 13. P. 2419. https://doi.org/10.1016/0009-2509(93)81063-2
Lai C.C., Tan C.S. // Industrial & Engineering Chemistry Research. 1995. V. 34. № 2. P. 674. https://doi.org/10.1021/ie00041a029
Funazukuri T., Kong C.Y., Kagei S. // Intern. J. Thermophys. 2000. V. 21. P. 651. https://doi.org/10.1023/a:1006637401868
Crank J. The Mathematics of Diffusion; Oxford University Press: Oxford, UK, 1979.
Medina I. // J. Chromatogr. A. 2012. V. 1250. P. 124. https://doi.org/10.1016/j.chroma.2012.04.052
Krichevskii I.R. // Russ. J. Phys. Chem. 1967. V. 41. P. 1332.
Levelt Sengers J.M.H. Critical Behavior of Fluids: Concepts and Applications. In: Supercritical Fluids: Fundamentals for Applications. E. Kiran, J.M.H. Levelt Sengers, (Eds.). Springer Netherlands. Springer Science+Business Media Dordrecht. 1994. P. 3–38. ISBN 978-94-015-8295-7. https://doi.org/10.1007/978-94-015-8295-7
Twu C.H., Bluck D., Cunningham J.R., Coon J.E. // Fluid Phase Equilib. 1991. V. 69. P. 33.
Lee B.L., Kesler M.G. // AIChE Journal. 1975. V. 21. P. 510. https://doi.org/10.1002/aic.690210313
API Technical Data Book 11. Americal Petroleum Insititute.11th Edition. Houston: EPCON International and API. http://www.epcon.com/api-data-book
Prausnitz J.M., Lichtenthaler R.N., de Azevedo E.G. Molecular Thermodynamics of Fluid-Phase Equilibria. 3rd Edition. Printice Hall. PTR. Upper Saddle River, New Jersey, 1998. 886 p. ISBN:9780139777455
Li C., Jia W., Wu X. // Energy Procedia. 2012. V. 14. P. 115. https://doi.org/10.1016/j.egypro.2011.12.904
Reid R.C., Prausnitz J.M., Poling B.E. The Properties of Liquids and Gases. 4th ed, McGraw-Hill. New York, 1987. 742 p. ISBN: 0-07-051799-1
Poling B.E., Prausnitz J.M., O’Connell J.P. The Properties of Gases and Liquids, 5th ed., McGraw-Hill. New York, 2001. 768 p. ISBN: 0-07-011682-2
Sadus R.J. High Pressure Phase Behaviour of Mullicomponent Fluid Mixtures. Elsevier, Amsterdam, London, New York, Tokyo, 1992. 392 p. ISBN: 0-444-88627-3
Gupta R.B., Shim J.-J. Solubility in Supercritical Carbon Dioxide. CRC Press. Tayler & Francis Group. NW, 2007. 960 p. ISBN: 13:9781420005998
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии


