Журнал физической химии, 2021, T. 95, № 5, стр. 818-821
Антиоксидантная активность гидрохинона при окислении 1,4-замещенных бутадиена
А. Д. Чепелева a, А. М. Гробов a, А. В. Сирик a, Е. М. Плисс a, *
a Ярославский государственный университет им. П.Г. Демидова
150000 Ярославль, Россия
* E-mail: pliss@uniyar.ac.ru
Поступила в редакцию 29.07.2020
После доработки 29.07.2020
Принята к публикации 27.08.2020
Аннотация
Методом высокочувствительной микроволюмометрии при 323 K с использованием кинетического моделирования измерены константы скорости (k4) и кинетические коэффициенты ингибирования (fкин) окисляющихся 1,4-замещенных бутадиена реакции гидропероксильных радикалов (${\text{HO}}_{2}^{ \bullet }$) с введенными антиоксидантами (InH): 1,4-гидрохиноном и 1,4-бензохиноном. Подтвержден циклический механизм взаимодействия ${\text{HO}}_{2}^{ \bullet }$ с InH, приводящий к многократному обрыву цепей, о чем свидетельствует обнаруженный эффект длительного торможения процесса окисления субстратов гидрохиноном и бензохиноном и полученные значения fкин > 102. Показано, что снижение величины k4 при замене в 1,4-замещенных бутадиена заместителя при двойной связи с “–C6H5” на “‒COOH3” обусловлено влиянием специфической сольватации.
Механизм жидкофазного окисления 1,4-замещенных бутадиена (X1CH=CH–CH=CHX2) приведен на Схеме 1 [1, 2].
Схема 1.
В качестве заместителей при двойной связи этих соединений служат X1, X2 = –H, –R, –COOR, –C6H5, ‒CH=CHX2, где k1, k2 и k3 – константы скорости реакций (1), (2) и (3).
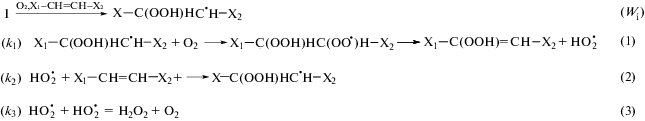
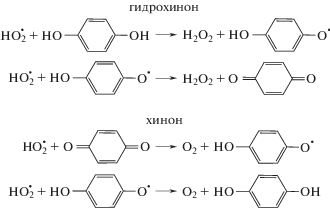
Поскольку цепи окисления ведет гидропероксильный радикал (${\text{HO}}_{2}^{ \bullet }$), для ингибированного окисления этих субстратов характерны циклические механизмы обрыва цепей [1–5]:
(4а)
${\text{HO}}_{2}^{ \bullet }\; + > {\kern 1pt} {\text{InH}} \to {{{\text{Н}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{2}}}} + {\text{I}}{{{\text{n}}}^{ \bullet }},$(4б)
${\text{HO}}_{2}^{ \bullet } + {\text{I}}{{{\text{n}}}^{ \bullet }} \to {\text{InH}} + {{{\text{O}}}_{2}},$Для изученных InH количественные данные отсутствуют только для гидрохинонов. Получение и анализ этой информации и стало целью настоящей работы.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве источника ${\text{HO}}_{2}^{ \bullet }$ использовали транс-фенилбутадиен (ФБ), транс,транс-дифенилбутадиен (ДФБ) и метиловый эфир транс-фенилпентадиеновой кислоты (МФПК), растворителями служил хлорбензол (Хб). Все реактивы приобретены в Aldrich, USA.
Кинетическую чистоту субстратов окисления и растворителя контролировали с помощью высокоэффективного жидкостного хроматографа Flexar и газового хромато-масс-спектрометра Clarus 680T MS (фирма PerkinElmer, USA). Концентрация основного компонента ≥99.6%. Во всех экспериментах концентрация субстратов составляла 50% об. в хлорбензоле.
Ингибиторы: 1,4-гидрохинон, 1,4-бензохинон и С-1 приобретены в Aldrich, USA.
Инициатор АИБН (ОАО “Реактив”, Россия) трижды перекристаллизовывали из этанола и сушили в вакууме.
Кинетику поглощения кислорода изучали с помощью автоматизированного высокочувствительного капиллярного микроволюмометра, конструкция ячейки которого позволяла вводить и отбирать пробы по ходу опыта (аналогично [6]). Кинетику окисления исследовали при температуре 323 К и постоянной величине Wi = = 1.4 × 10–7 моль/(л с).
Скорость инициирования (Wi) определяли методом ингибиторов по формуле: Wi = 2[InH]0/τind [4], где τind – длительность индукционного периода, InH – фенольный ингибитор С-1.
Обработку кинетических данных проводили по оптимизационной программе Кинетика 2012 [7].
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
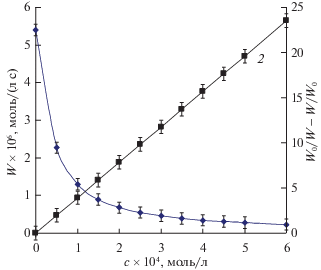
Начальная скорость ингибированного окисления (W) постоянна во времени, не зависит от парциального давления кислорода в диапазоне 20–100 кПa и при увеличении [InH]0 уменьшается (типичный пример приведен на рис. 1, кривая 1). Приведенные факты свидетельствуют, что ингибированное окисление 1,4-замещенных бутадиена протекает по реакциям (i) – (4б) в соответствии с уравнением [6]:
(5)
${{W}_{0}}{\text{/}}W--W{\text{/}}{{W}_{0}} = {{f}_{{{\text{кин}}}}}{{k}_{4}}{{[{\text{InH}}]}_{0}}{\text{/}}{{({{W}_{{\text{i}}}} \times 2{{k}_{3}})}^{0}}^{{.5}},$Рис. 1.
Зависимости W (1) и W0/W–W/W0 (2) от концентрации гидрохинона (с); ДФБ, 323 K, Wi = 1.4 × × 10–7моль/(л с).
В соответствии с уравнением (5), рассчитан параметр k4/(2k3)0.5. Для получения значения k4 использована известная для исследуемых субстратов величина 2k3 = (1.0 ± 0.2) × 108 л/(моль с) [2, 3]. Полученные данные приведены в табл. 1.
Таблица 1.
Значения fкин и k4 (л/(моль с)) в 1,4-замещенных бутадиена при 323 К
| Ингибитор | ДФБ | ФБ | МЭФПК | |||
|---|---|---|---|---|---|---|
| fкин | k4 × 10–5 | fкин | k4 × 10–5 | fкин | k4 × 10–5 | |
| Гидрохинон | >102 | 2.1 ± 0.2 | >102 | 1.3 ± 0.2 | >102 | 0.7 ± 0.1 |
| Бензохинон | >102 | 2.9 ± 0.3 | >102 | 2.1 ± 0.2 | >102 | 1.2 ± 0.2 |
Представленные значения fкин являются нижней границей указанной величины, поскольку отражают лишь длительность проведения опыта. Скорость ингибированного окисления в режиме линейного обрыва цепей длительно сохраняет постоянное значение, практически на порядок ниже W0 (см. рис. 1 при [InH] ≥ 104 моль/л). Этот результат свидетельствует о том, что гидрохинон и бензохинон многократно обрывают цепи окисления 1,4-замещенных бутадиена, как и для других антиоксидантов [1–3].
Отметим, что в одном и том же же субстрате значения k4 для гидрохинона и бензохинона близки (см. табл. 1). Это неудивительно, поскольку отражают единый цикл превращений [4]:
Отметим, что при переходе от ДФБ к МФПК, т.е. при замене фрагмента “–C6H5” на “–COOCH3”, значения k4 падают в ~3 раза (табл. 1). Этому эффекту можно дать следующее объяснение. Экспериментально измеряемая константа скорости реакций ${\text{HO}}_{2}^{ \bullet }$ отражает суперпозицию эффектов специфической и неспецифической сольватации и является по существу эффективной величиной [2, 8, 9]. Влияние неспецифической сольватации сведено к минимуму самой постановкой эксперимента: во всех опытах концентрация субстратов составляла 50 об. % в Хб, т.е. значения диэлектрической проницаемости среды были практически одинаковыми. При этом весьма вероятным оставалось образование водородных связей между сложноэфирным фрагментом МФПК и используемыми антиоксидантами. Не следует исключать и сольватации гидропероксильного радикала в этой среде. Таким образом, можно полагать, что снижение величины k4 и обусловлено влиянием специфической сольватации.Интересно сравнить полученные данные с известными для 1,2-замещенных этилена. При ингибированом гидрохиноном окислении дифенилэтилена величина k4 = 1.4 × 105 (323 K, [4]), что близко к полученному в настоящей работе значению 2.1 × 105 л/(моль с) для ДФБ (табл. 1).
Таким образом, получен еще один аргумент в пользу предложенного в [1, 2] механизма окисления 1,2-замещенных этилена и 1,4-замещенных бутадиена, когда радикалом-носителем цепей является ${\text{HO}}_{2}^{ \bullet }$.
Работа выполнена при финансовой поддержке РНФ (грант № 20-13-00148).
Список литературы
Pliss E.M., Machtin V.A., Grobov A.M. et al. // Int. J. Chem. Kinet .2017. V. 49. № 3. P. 173. http://onlinelibrary.wiley.com/doi/10.1002/kin.21065/abstract.
Pliss E.M., Machtin V.A., Soloviev M.E. et al. // Ibid. 2018. V. 50. № 3. P. 397. https://onlinelibrary.wiley.com/doi/abs/10.1002/kin.21169.
Гробов А.М., Мачтин В.А., Плисс Р.Е. и др. // Вестн. Технологич. ун-та. 2016. Т. 19. №. 21. С. 10.
Denisov E.T., Afanas’ev I.B. Oxidation and Antioxidants in Organic Chemistry and Biology, CRC Press, 2005. 992 p. https://onlinelibrary.wiley.com/ https://doi.org/10.1201/9781420030853
Pliss E.M., Tikhonov I.V., Rusakov A.I. In: Nitroxides – Theory, Experiment and Applications / Ed. By A.I. Kokorin. Intech: Rijeka, 2012. Ch. 9. P. 263. http://onlinelibrary.wiley.com/doi 10.1002/chin.201348273
Loshadkin D.V., Roginsky V.A., Pliss E.M. // Int. J. Chem. Kinet. 2002. V. 34. P. 162 . https://onlinelibrary.wiley.com/doi/10.1002/kin.10041
Соколов А.В., Лошадкин Д.В., Попов С.В. и др. Кинетика 2012 – Программа для расчета кинетических параметров химических и биологических процессов. Официальный бюллетень федеральной службы по интеллектуальной собственности “программы для ЭВМ. Базы данных. Топологии интегральных микросхем”, № 3, опубл. 20.03.2013. https://www1.fips.ru/fips_servl/fips_servlet?db=evm&rn=3028&docnumber=2013612187&typefile=html
Emanuel N.M., Zaikov G.E., Maizus Z.K. Oxidation of Organic Compounds: Medium Effects in Radical Reactions. Burlington: Elsevier Science, 2013. 619 p.
Pliss E.M., Machtin V.A., Pliss R . et al. // React. Kin. Mech. Cat. 2018. V. 123. P. 559. https://onlinelibrary.wiley.comdoi:https://doi.org/10.1007/s11144-017-1336-2.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии