Журнал физической химии, 2021, T. 95, № 5, стр. 692-699
Комплексообразование β-циклодекстрина с бензойной кислотой и рутином в водно-этанольных растворителях: термические и термодинамические характеристики
Фам Тхи Лан a, b, *, Ву Сюань Минь a, Ле Хай Кхоа a, Д. Н. Кабиров c, Нгуен Тхи Нгоан d, Т. Р. Усачева c, **
a Институт тропических технологий, ВАНТ
Ханой, Вьетнам
b Высший университет науки и технологии, ВАНТ
Ханой, Вьетнам
c Ивановский государственный химико-технологический университет
Иваново, Россия
d Институт химии, ВАНТ
Ханой, Вьетнам
* E-mail: ptlan@itt.vast.vn
** E-mail: oxt@isuct.ru
Поступила в редакцию 01.07.2020
После доработки 21.10.2020
Принята к публикации 21.10.2020
Аннотация
Комплексы β-циклодекстрина с бензойной кислотой и рутином получены в водно-этанольных растворителях. Установлено, что выходы обоих комплексов при синтезе в бинарных смесях выше, чем в воде, и достигают максимальных значений в диапазоне 0.05–0.10 мольных долей этанола. На основе сольватационно-термодинамического подхода проанализировано влияние водно-этанольного растворителя на термодинамику реакции образования комплекса включения между β-циклодекстрином и бензойной кислотой, выбранной в качестве модельной реакции образования комплексов включения циклодекстринов с производными фенолов.
Фенолы и их производные известны благодаря своей антиоксидантной активности, противовоспалительным, профилактическим и терапевтическим эффектам при лечении онкологических заболеваний и заболеваний сердечнососудистой системы [1]. При синтезе и исследовании новых молекул, представляющих интерес для медицины, почти 70% из молекул-кандидатов к практическому использованию, имеют плохую растворимость в воде [2]. Растворимость фармакологически активного компонента в воде является фундаментальным свойством в его абсорбции после перорального приема. Многие фенольные соединения относятся к группе биоактивных веществ, имеющих низкую растворимость в воде, поэтому чтобы улучшить их биодоступность, обеспечить максимальную эффективность лечения и снизить токсичность, растворимость этих молекул должна быть увеличена.
Бензойная кислота (БК) – простейшая ароматическая карбоновая кислота, которая подавляет рост плесени, дрожжей и некоторых бактерий (рис. 1а). БК и ее соли используются в качестве консервантов при производстве продуктов питания и косметических средств. БК является составной частью некоторых фармацевтических композиций и проявляет терапевтический эффект при лечении кожных заболеваний. Однако было отмечено, что БК в очень высоких дозах может поражать печень и почки и раздражать кожные покровы и слизистую оболочку глаз [3, 4]. Кроме того, БК может вступать в реакцию с аскорбиновой кислотой, что приводит к образованию бензола, который обладает высокой токсичностью по отношению к живым организмам [3].
Рутин (RU) представляет собой рутозид (кверцетин-3-O-рутинозид, софорин), относится к гликозидам и объединяет в структуре своей молекулы флавонол кверцетин и дисахарид рутинозы (α-L-рамнопиранозил-(1 → 6)-β-D-глюкопиранозу) (рис. 1б). Это флавоноид, который находится в самых различных растениях, включая цитрусовые. Рутин является важным биологически активным ингредиентом, имеющим множество потенциальных применений в фармацевтических продуктах, поскольку он имеет ряд биологически активных свойств и обладает высокой антиоксидантной способностью [5].
В настоящее время существует несколько методов улучшения растворимости малорастворимых соединений, которые включают варьирование рН, микронизацию, дисперсию твердого вещества [6], добавление сорастворителя [7], добавление поверхностно-активного вещества [8]. Кроме того, одним из способов повысить растворимость биоактивных молекул является образование их комплексов включения с солюбилизаторами, такими как циклодекстрины (CD).
Циклодекстрины представляют собой циклические олигосахариды [9]. Они представляют собой циклические олигосахариды, состоящие из шести (α-циклодекстрин), семи (β-циклодекстрин), восьми (γ-циклодекстрин) или более единиц глюкопиранозы. Циклодекстрины являются молекулярными хелатирующими агентами. Благодаря своей гидрофильной внешней поверхности и гидрофобной внутренней полости CD часто используются в фармацевтике для повышения растворимости труднорастворимых в воде соединений. CD имеют надмолекулярную структуру, аналогичную криптандам, каликсаренам, циклофанам, сферандам и краун-эфирам [10]. Известно, что комплексы, образованные по принципу “хозяин-гость”, в основном, стабилизированы слабыми нековалентными взаимодействиями, такими как силы Ван-дер-Ваальса, гидрофобными взаимодействиями, водородными связями и ион-дипольными взаимодействиями. Однако в последнее время обсуждается вопрос о том, какое из этих взаимодействий является преобладающим [11, 12]. По сравнению со всеми супрамолекулярными молекулами-“хозяевами”, упомянутыми выше, циклодекстрины способны образовывать комплексы включения, в которых свойства молекул-“гостей” могут быть значительно изменены. Это свойство лежит в основе широкого использования циклодекстринов во многих промышленных технологиях и аналитических методах. Незначительное цитотоксическое действие циклодекстринов является важным атрибутом при разработке фармкомпозиций и пищевых технологий, их использования в ароматизаторах, косметических средствах, в производстве упаковочных и текстильных материалов, в процессах разделения молекул, в разработке экологически безопасных технологий, в процессах ферментации и в катализе.
Способность циклодекстринов селективно образовывать комплексы включения с молекулой–“гостем” является функцией двух ключевых факторов. Первый – стерический фактор, который зависит от соотношения размера полости циклодекстрина размеру молекулы “гостя” или от определенных ключевых функциональных групп “гостя”. Вторым фактором являются термодинамические критерии взаимодействия между различными компонентами системы (циклодекстрин, “гость”, растворитель). Большинство исследований межмолекулярных взаимодействий посвящено изучению процессов селективного распознавания в водных растворах. Молекулярное комплексообразование циклодекстринов с фенольными соединениями в воде обычно характеризуется низкой устойчивостью комплексов и низкой экзотермичностью комплексообразования, что затрудняет получение молекулярных комплексов, их изучение и дальнейшее практическое использование. Напротив, в неводных растворителях взаимодействия “гость-хозяин” может приводить к образованию устойчивых молекулярных комплексов и иметь высокую экзотермичность реакций, однако экспериментальные исследования в неводных средах ограничены очень низкой растворимостью этих соединений [13]. Эта проблема может быть решена путем изменения состава и природы растворителя, играющего роль среды и участника взаимодействий в растворах. Различное влияние воды и неводных растворителей на молекулярное комплексообразование предполагает возможность использования смешанного растворителя для получения молекулярных комплексов с заданной устойчивостью и энтальпией реакций, что, в свою очередь, повлияет на селективную способность макроциклов [14, 15].
В этом исследовании комплексы β-циклодекстрина (βCD) с БК в качестве небольшого гидрофобного “гостя” и RU, как пример более крупной молекулы, были получены в водно-этанольных растворителях, определены их термические характеристики и термодинамические параметры реакций комплексообразования различными взаимодополняющими методами. Проанализированы сольватационно-термодинамические вклады реагентов в изменение термодинамических характеристик комплексообразования.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Подготовка реактивов
БК и RU (Sigma-Aldrich), βCD (Fluka) использовались без дополнительной очистки. Этанол (Xilong Scientific Co.) предварительно очищали перегонкой при атмосферном давлении. Диметилсульфоксид (Xilong Scientific Co.) использовали без дополнительной очистки (табл. 1). Все растворы готовились с использованием дистиллированной воды.
Таблица 1.
Производители и чистота химических реактивов, используемых в данном исследовании; С – содержание основного вещества
| Реактив | Производитель | Метод очистки | С |
|---|---|---|---|
| БК | Sigma-Aldrich | – | ≥0.995 |
| βCD | Fluka | – | ≥0.980 |
| Этанол | Xilong Scientific Co. | Перегонка при атмосферном давлении | 0.955 ± 0.002 |
| Диметилсульфоксид | Xilong Scientific Co. | – | ≥0.950 |
Синтез комплексов включения
Комплексы включения βCD с фенольными молекулами – “гостями” (БК или RU) были получены в молярном соотношении реагентов 1 : 1 путем растворения реагентов, при перемешивании и термостатировании. Раствор βCD добавляли к раствору БК (или RU) порциями по 10 мл и перемешивали магнитной мешалкой в течение 24 ч при 25°C. Реакционную смесь отстаивали в течение 48 ч при 4°С до получения белого осадка. Осадок несколько раз промывали диметилсульфоксидом и сушили в вакуумной печи.
Дифференциальная сканирующая калориметрия
БК или RU, βCD и их комплексы включения в твердом состоянии были изучены с помощью дифференциального сканирующего калориметра DSC204F1 (NETZSCH-Германия). Навеску твердофазных образцов (3–4 мг) помещали в алюминиевые тигли и сканировали в диапазоне температур от 25 до 300°C при постоянной скорости нагрева 10 К/мин в атмосфере воздуха. Температура начала плавления (Tonset) была определена из термограмм по наклону касательной к кривой плавления в точке перегиба и экстраполяции к базовой линии.
Сканирующая электронная микроскопия
Полевой эмиссионный сканирующий электронный микроскоп (FE-SEM, HITACHI S-4800) использовали для исследования морфологии комплекса (RU–βCD). Образцы в твердой фазе были покрыты платиной для увеличения электропроводности. Для сравнения были также исследованы образцы RU.
Изотермическая калориметрия титрования
Термодинамические параметры реакции образования комплекса включения БК и βCD в водно-этанольных растворителях определены при температуре 25°C из термохимических экспериментов, выполненных с использованием системы калориметрического титрования TAM III (TA Instruments, США), снабженной ячейкой титрования объемом 20 см3. Были выполнены электрическая и химическая калибровки калориметрической системы. Химическая калибровка проведена с использованием тестовой реакции комплексообразования между Ba2+ и 18-краун-6 в воде при T = 25°C [16]. Полученные значения ($\lg K$ = 3.24 ± ± 0.40 и ΔrH = – (30.9 ± 0.8) кДж/моль) соответствуют значениям, рекомендованным в [17].
Процедура эксперимента была аналогична описанной ранее [17–20]. Калориметрические измерения проводили в водно-этанольных растворителях, содержащих 0.00, 0.10, 0.20 и 0.30 мольных долей EtOH. Диапазон используемых водно-этанольных смесей лимитирован низкой растворимостью βCD в водном этаноле [16, 21], что ограничивает набор соотношений концентраций БК : βCD, необходимых для одновременного расчета констант устойчивости комплекса БК–βCD и энтальпии реакции его образования из калориметрических данных. Растворы готовили непосредственно перед измерениями в фосфатном буфере при pH 3.6, что соответствует pH растворов БК с концентрациями, используемыми в экспериментах.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Определение выхода комплексов
Комплексы фенольных соединений с βCD были получены в водно-этанольных растворителях переменного состава. Концентрация этанола в смешанном растворителе ограничена низкой растворимостью βCD в средах с высоким содержанием неводного растворителя. Выход комплексов приведен в табл. 2.
Таблица 2.
Выход комплексов βCD с БК и с RU (Y, %) в растворителях вода–этанол переменного состава
| XEtOH, мол. доли | 0 | 0.05 | 0.07 | 0.10 | 0.17 | 0.20 | 0.24 |
|---|---|---|---|---|---|---|---|
| БК–βCD, (Y, % ) | 63 | 72 | – | 88 | – | 80 | 77 |
| RU–βCD, (Y, % ) | 25 | 73 | 56 | 50 | 46 | – | 41 |
Как видно из табл. 2, выход обоих комплексов в бинарных средах выше, чем в воде. Существуют некоторые различия в комплексообразовании между БК и βCD в воде и в водно-этанольном растворителе: часть внутренней части полости βCD, в которой находится молекула БК, может быть более гидрофобной в присутствии EtOH, и это может быть причиной более высокого выхода комплексов в бинарных растворителях. Чтобы уточнить этот феномен, были проанализированы различия в структуре индивидуальных растворителей, а также в термодинамических свойствах их смесей. Наибольшее значение Y в области 0.05–0.10 мол. доли EtOH, вероятно, обусловлено экстремальными изменениями в сольватном состоянии реагентов при начальных добавках EtOH к воде. Экстремальные значения термодинамических параметров сольватации реагентов и реакций комплексообразования при высоких концентрациях воды в растворителях H2O–EtOH наблюдались ранее [22]. Такие эффекты можно объяснить упрочнением трехмерной пространственной структуры водородных связей в растворителе при добавлении органического сорастворителя к воде [23].
Результаты исследований твердофазных образцов
Дифференциальная сканирующая калориметрия (ДСК) является важным методом исследования, обычно используемым в супрамолекулярной химии для определения изменений термических свойств молекул-“гостей” в результате комплексообразования. На термограмме ДСК не наблюдается поглощения энергии при температуре плавления молекул “гостя”, если они образуют комплексы. Взаимодействие молекул “гостя” с βCD создает более высокий энергетический барьер для испарения “гостя” из полости βCD, поэтому наблюдается повышение температуры примерно на 10°C. Методом ДСК также можно оценить количество незакомплексованных “гостей”.
В данной работе были получены термограммы ДСК для молекул-“гостей”, молекулы-“хозяина” и комплексов включения. Температура пика фазового перехода – это температура максимума процесса, связанного с выделением или поглощением теплоты. Эта температура сильно зависит от кристаллической структуры образца, размера кристалла, подготовки образца и скорости нагрева, что делает эту величину ненадежной для сравнения. В свою очередь температура начала процесса остается неизменной. Температура начала плавления, Тonset, определяется экстраполированной в область пика базовой линией и касательной, проведенной через точку перегиба. В случае βCD (рис. 2) на термограмме (в) присутствует широкий пик в области от 84°C до 150°C, который соответствует дегидратации и плавлению (температура плавления составляет 121°C).
На рис. 2 показано, что для БК начальные температуры плавления и кипения составляют 118°С и 242°С соответственно. Термограмма (б) соответствует комплексу БК–βCD. Эндотермический пик (Tonset = 45°C) связан с потерей воды и, что более важно, указывает на присутствие фракции βCD, которая не взаимодействует с молекулой гостя. На термограмме комплекса наблюдается полное исчезновение эндотермического пика, характерного для БК. Это можно считать доказательством взаимодействия между компонентами соответствующих бинарных систем [24] и показателем аморфизации БК при образовании комплекса включения.
На рис. 3 представлен широкий температурный диапазон (109–187°C), соответствующий дегидратации RU, с температурой плавления 174.8°C. Температура плавления βCD в комплексе с RU смещена по сравнению со свободным βCD (111°C), но интенсивность пика значительно снижается. Температура плавления RU в комплексе смещается в область более низких температур и соответствует 139°С, его интенсивность также значительно уменьшается.
На рис. 4, а, б приведены изображения FE-SEM образца RU до (рис. 4а) и после (рис. 4б) комплексообразования с βCD. Результаты FE-SEM подтвердили, что не связанный в комплекс RU имеет размер микрометра. Как показано на рис. 4б, комплекс RU–βCD имеет сферическую форму со средним размером около 50–60 нм.
Термодинамика комплексообразования БК и βCD
Влияние водно-этанольного растворителя на термодинамические параметры реакции образования комплекса БК–βCD рассмотрено с использованием результатов, представленных в [25]. Термодинамика комплексообразования
обсуждена на основе анализа сольватационных вкладов реагентов в термодинамические параметры реакции с использованием сольватационно-термодинамического подхода [22].Согласно сольватационно-термодинамическому подходу, влияние изменения состава растворителя на реакцию (1) (ΔrY(растворитель), ΔrY(вода)) и на термодинамические параметры сольватации каждого реагента и продукта (Y(Z)(растворитель), Y(Z)(вода)) можно количественно описать уравнениями:
(2)
${{\Delta }_{{{\text{tr}}}}}{{Y}_{{\text{r}}}} = {{\Delta }_{{\text{r}}}}{{Y}_{{({\text{растворитель}})}}} - {{\Delta }_{{\text{r}}}}{{Y}_{{({\text{вода}})}}},$(3)
${{\Delta }_{{{\text{tr}}}}}Y(Z) = Y{{(Z)}_{{({\text{растворитель}})}}} - Y{{(Z)}_{{({\text{вода)}}}}},$Для реакции образования комплекса БК–βCD термодинамические функции переноса рассчитывались по формуле (2) с использованием термодинамических параметров реакции образования комплекса БК–βCD (ΔrH, ΔrG, TΔrS) [25]. Графические зависимости полученных термодинамических функций переноса от состава растворителя вода–этанол представлены на рис. 5.
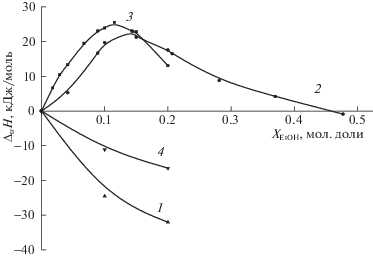
Рис. 5.
Термодинамические параметры переноса для реакции образования комплекса БК-βCD в водно-этанольных растворителях. 1 – –TΔtrSr , 2 – ΔtrGr , 3 – ΔtrHr .

Увеличение концентрации EtOH в смешанном растворителе приводит к снижению устойчивости комплекса БК–βCD и увеличению экзотермичности реакции его образования. Увеличение экзотермичности комплексообразования сопровождается уменьшением энтропийного вклада в изменение энергии Гиббса.
Влияние растворителя на изменение термодинамических параметров реакции (1) можно выразить через сольватационные вклады (ΔtrY) всех участников реакции в соответствии с уравнением:
(4)
${{\Delta }_{{{\text{tr}}}}}{{Y}_{{\text{r}}}}\, = \,{{\Delta }_{{{\text{tr}}}}}Y({\text{БК--}}\beta {\text{CD}})\,--\,{{\Delta }_{{{\text{tr}}}}}Y({\text{БК}})\,--\,{{\Delta }_{{{\text{tr}}}}}Y(\beta {\text{CD}}).$Термодинамические параметры переноса для комплексной частицы ΔtrY(БК–βCD) рассчитаны по формуле (4) с использованием данных литературы для термодинамических параметров сольватации БК и βCD [26–29]. Уравнение (4) применено для анализа вкладов реагентов в изменение термодинамических параметров реакции (рис. 6, 7). Анализ сольватационных вкладов в изменения энергии Гиббса при переходе от воды к водно-этанольным растворителям показывает, что стабилизация БК в основном влияет на снижение устойчивости молекулярного комплекса (рис. 6). Сольватное состояние комплекса включения определяется сольватным состоянием макроцикла. Сходство в сольватном состоянии молекулы-“хозяина” и молекулярного комплекса “гость–хозяин” было отмечено в [28] для комплексов, образованных краун-эфиром 18C6 и аминокислотами в водно-органических растворителях. При анализе энтальпийных характеристик установлено, что оба фактора ΔtrH(БК) и ΔtrH(βCD) способствуют увеличению экзотермичности реакции (1) (рис. 7).
Рис. 6.
Влияние водно-этанольного растворителя на изменение энергии Гиббса реакции комплексообразования [БК βCD] и сольватации реагентов при переходе от H2O к растворителям H2O–EtOH: 1 – ΔtrGr, 2 – ΔtrG(БК), 3 – ΔtrG(βCD), 4 – ΔtrG[БК βCD].

Рис. 7.
Влияние водно-этанольного растворителя на изменения энтальпии реакции комплексообразования [БК βCD] и сольватации реагентов при переходе от H2O к растворителям H2O–EtOH: 1 – ΔtrHr, 2 – ΔtrH(БК), 3 – ΔtrH(βCD), 4 – ΔtrH[БК βCD].
Таким образом, установлено, что растворимость БК и RU значительно улучшается в присутствии βCD и линейно увеличивалась в растворе с ростом концентрации макроцикла. Выходы обоих комплексов были увеличены с использованием смесей воды и этанола. Их максимальные значения наблюдаются при первом добавлении этанола к воде в диапазоне 0.05–0.10 мол. долей этанола.
Влияние водно-этанольного растворителя на термодинамику комплексообразования β-циклодекстрина с бензойной кислотой проанализировано на основе сольватационно-термодинамического подхода в качестве модели реакции образования комплекса включения. Анализ параметров энтальпий сольватации реагентов для образования комплекса БК–βCD выявил наличие эндотермических максимумов для ΔtrH(βCD) и ΔtrH(БК) при 0.10–0.15 мольных долей EtOH. Устойчивость БК–βCD снижается с ростом EtOH. Анализ сольватационных вкладов реагентов показал, что сольватное состояние БК является ключевым фактором в изменении устойчивости комплекса [БК βCD] в растворителе H2O–EtOH.
Термохимические эксперименты на калориметре титрования ТАМ III проводились в Институте термодинамики и кинетики химических процессов Ивановского государственного химико-технологического университета (ISUCT) с использованием оборудования Центра коллективного пользования ISUCT. Pабота поддержана Национальным фондом развития науки и технологий Вьетнама (NAFOSTED) грант № 104.06-2017.329, РФФИ и ВАНТ в соответствии с исследовательским проектом № 19-53-54004 при финансовой поддержке ВАНТ (проект QTRU01.04/19-20). Исследование с использованием ТАМ III проводилось в рамках государственного задания Министерства науки и высшего образования Российской Федерации (проект FZZW-2020-0009).
Список литературы
Guardia T., Rotelli A.E., Juarez A.O., Pelzer L.E. // Farmaco. 2001. V. 56. № 9. P. 683.
Kawabata Y., Wada K., Nakatani M. et al. // Int. J. Pharm. 2011. V. 420. № 1. P. 1.
Mendez S.G., Espinar F.J., Alvarez A.L. et al. // J. Incl. Phenom. Macrocycl. Chem. 2016. V. 85. № 1. P. 33.
Terekhova I., Koz’biał M., Kumeev R., Gierycz P. // Chem. Phys. Lett. 2011. V. 514. P. 341.
Burda S., Oleszek W., Agric J. // Food Chem. 2001. V. 49. № 6. P. 2774.
Brewster M.E., Vandecruys R., Peeters J. et al. // Eur. J. Pharm. Sci. 2008. V. 34. № 2−3. P. 94.
Yan H., Ping L., Samuel H.Y. // International. J. Pharm. 2003. V. 264. P. 25.
Soares-Sobrinho J.L., Santos F.L.A., Lyra M.A.M. et al. // Carbohydr. Polym. 2012. V. 89. № 2. P. 323.
Challa R., Ahuja A., Ali J., Khar R.K. // AAPS Pharm. Sci. Tech. 2005. V. 6. № 2. P. 329.
Li J., Loh X.J. // Adv. Drug Delivery Rev. 2008. V. 60. P. 1000.
Bodor N., Buchwald P. // J. Incl. Phenom. Macrocycl. Chem. 2002. V. 44. № 1−4. P. 9.
Bouchema K. // Drug Discovery Today. 2008. V. 13. № 21−22. P. 960.
Захаров А.Г., Воронова М.И., Батов Д.В., Смирнова К.В. // Вестн. КТУ. 2010. Т. 2. С. 33.
Tachibana M., Furusawa M., Kiba N. // J. Incl. Phenom. Mol. Recogn. in Chem. 1995. V. 22. P. 313.
Fisli H., Bensouilah N., Dhaoui N., Abdaoui M. // J. Incl. Phemom. Macrocycl. Chem. 2012. V. 73. P. 369.
Coleman A.W., Munoz M., Chatjigakis A.K. // J. Phys. Org. Chem. 1993. V. 6. P. 651.
Усачева Т.Р., Фам Тхи Л., Шарнин В.А. // Рос. хим. журн. (Журн. Рос. хим. об-ва им. Д.И. Менделеева). 2015. Т. 59. № 1−2. С. 19.
Usacheva T.R., Sharnin V.A., Chernov I.V., Matteoli E. // J. Therm. Anal. Calorim. 2013. V. 112. P. 983.
Usacheva T.R., Pham Thi L., Kuzmina K.I., Sharnin V.A. // Ibid. 2017. V. 130. P. 471.
Usacheva T.R., Pham Thi L., Terekhova I.V., Kumeev R.S., Sharnin V.A. // J. Therm. Anal. Calorim. 2015. V. 121. P. 975.
Chatjigakis A.K., Donze C., Coleman A.W. // Anal. Chem. 1992. V. 64. P. 1632.
Крестов Г.А., Новоселов Н.П., Перелыгин И.С. и др. Ионная сольватация (Сер. Проблемы химии растворов). М.: Наука, 1987. 320 с.
Al-Nasiri G., Cran M.J., Smallridge A.J., Bigger S.W. // J. Microencapsul. 2018. V. 35. P. 26.
Kim K.H., Frank M., Henderson N.L. // J. Pharm. Sci. 1985. V. 74. P. 283.
Pham T.L., Usacheva T., Nguyen T.D., Kabirov D., Giancola C. // Book of abstracts, CEEC-TAC5 & Medicta. 2019. P. 455.
Chatjigakis A.K., Donze C., Coleman A.W. // Anal. Chem. 1992. V. 64. P. 1632.
Xingen H., Ruisen L., Hanxing Z. // Acta Phys. Chim. Sinica. 1999. V. 15. № 9. P. 838.
Усачева Т.Р., Шарнин В.А. // Изв. АН. Сер. хим. 2015. V. 11. P. 2536.
Belica S., Sadowska M., Stepniak A. et al. // J. Chem. Therm. 2014. V. 69. P. 112.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии






