Журнал физической химии, 2021, T. 95, № 5, стр. 736-742
Твердофазные равновесия и термодинамические свойства фаз в системе Tm–Te
С. З. Имамалиева a, *, И. Ф. Мехдиева a, В. А. Гасымов a, Д. М. Бабанлы a, b, Д. Б. Тагиев a, М. Б. Бабанлы a, c
a Национальная академия наук Азербайджана, Институт катализа и неорганической химии
Баку, Азербайджан
b Азербайджанский государственный университет нефти и промышленности,
Азербайджано-французский университет (UFAZ)
Баку, Азербайджан
c Бакинский государственный университет
Баку, Азербайджан
* E-mail: samira9597a@gmail.com
Поступила в редакцию 18.06.2020
После доработки 20.07.2020
Принята к публикации 03.08.2020
Аннотация
Представлены результаты исследования твердофазных равновесий в системе Tm–Te и термодинамических свойств теллуридов тулия методами электродвижущих сил и рентгенофазового анализа. На основании экспериментальных данных установлено, что в системе образуются соединения TmTe, Tm2Te3 и TmTe3. Из данных измерений ЭДС концентрационных цепей относительно электродов TmTe и Tm в интервале температур 300–450 К впервые определены парциальные термодинамические функции TmTe и Tm в сплавах, на основании которых вычислены стандартные термодинамические функции образования и стандартные энтропии промежуточных соединений.
Соединения редкоземельных элементов (РЗЭ) относятся к числу перспективных функциональных материалов, широко использующихся в аэрокосмических системах и компонентах, мощных радиочастотных источниках, высокопроизводительных твердотельных инфракрасных лазерах, жестких дисках компьютеров, постоянных магнитах для высокоэффективных электродвигателей и т.д. [1–3]. Среди них халькогениды РЗЭ, обладающие высокой термостойкостью, устойчивостью к резким изменениям условий окружающей среды, уникальными магнитными, оптическими и термоэлектрическими свойствами занимают особое положение [4–13].
Разработка и оптимизация методов направленного синтеза новых фаз основывается на данных по фазовым равновесиям в соответствующих системах и термодинамическим свойствам промежуточных фаз [14–18].
Фазовые диаграммы большинства бинарных систем типа Ln–Te изучены подробно и представлены в ряде монографий и справочников [2, 4, 19, 20]. Система Tm–Te изучена в работах [2, 4, 21–23], однако диаграмма состояния до сих пор не построена. Согласно [4], тулий с теллуром образует три соединения: TmTe, Tm2Te3 и TmTe3. По своей кристаллической симметрии эти соединения аналогичны, соответственно, NaCl, Sc2S3 и NdTe3 [4].
В [21] подтверждено существование вышеуказанных теллуридов тулия. Однако состав TmTe3 представлен как Tm2Te5. Кроме того, по данным [21] при температурах выше ∼750 К соединения TmTe и Tm2Te3 образуют непрерывный ряд твердых растворов, которые распадаются с понижением температуры и ниже ∼500 К составы сосуществующих фаз отвечают стехиометрии TmTe и Tm2Te3. В [23] сообщается о соединении TmTe2, которое получено лишь при условии высоких давлений и температур.
Нами не обнаружены какие-либо экспериментальные данные по термодинамическим свойствам теллуридов тулия. В справочнике [24] приведены оценочные данные по стандартной энтальпии образования и энтропии TmTe и Tm2Te3. В недавно опубликованных работах [25, 26] термодинамические функции образования и энтропия соединения Tm2Te3 оценены методом тетрадного эффекта.
В данной работе представлены результаты исследования твердофазных равновесий в системе Tm–Te и термодинамических свойств теллуридов тулия.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для проведения исследований были синтезированы сплавы системы Tm–Te с составами >50 ат. %Те (каждый массой 0.5 г). Синтез проводили прямым взаимодействием элементарных тулия (CAS № 7440-30-4, Alfa Aesar) и теллура (13494-80-9, Alfa Aesar) в эвакуированных (10–2 Па) кварцевых ампулах. С целью предотвращения взаимодействия тулия со стенками кварцевых ампул синтез сплавов проводили в графитизированных ампулах. Графитизирование ампул проводили термическим разложением толуола.
После выдерживания ампул при 1000 К в течение 24 ч сплавы были перетерты в порошок, тщательно перемешены, запрессованы в таблетки и отожжены при 800 К (сплавы составов 50–75 ат. % Те) или 700 К (сплавы составов >75 ат. % Те) в течение 1000 ч. Затем сплавы охлаждали в режиме выключенной печи и образцы исследовали методом РФА (дифрактометр Bruker D8, CuKα1-излучение), результаты которого подтвердили существование соединений TmTe, Tm2Te3 и TmTe3. В качестве примера на рис. 1 приведены порошковые рентгенограммы сплавов с составами 55, 70 и 90 ат. %Те. Как видно, все эти образцы двухфазны и состоят из двухфазных смесей соединений TmTe + Tm2Te3, Tm2Te3 + TmTe3 и TmTe3 + Те соответственно. При этом необходимо отметить, что на дифрактограмме сплава 70 ат. % Те (рис. 1б) отсутствуют линии отражения, которые можно было бы отнести к соединениям Tm2Te5 и TmTe2, указанным в работах [21, 22]. Это подтверждает данные [23] о существовании TmTe2 только при высоких давлениях и указывает на отсутствие в равновесных сплавах соединения состава Tm2Te5, которое, возможно, является метастабильной фазой.
Для изучения термодинамических свойств тройных фаз системы Tm–Te методом ЭДС нами были составлены концентрационные цепи типа:
(1)
$\begin{gathered} ( - )\;{\text{Tm}}({\text{тв}}{\text{.}})\,|\,{\text{глицерин}} + {\text{KCl}} + \\ + \;{\text{TmC}}{{{\text{l}}}_{{\text{3}}}}\,|\,({\text{TmT}}{{{\text{e}}}_{{1 + x}}})({\text{тв}}{\text{.}})\;( + ), \\ \end{gathered} $(2)
$\begin{gathered} ( - )\;{\text{TmТе}}({\text{тв}}{\text{.}})\,|\,{\text{глицерин}} + {\text{KCl}} + \\ + \;{\text{TmC}}{{{\text{l}}}_{{\text{3}}}}\,|\,({\text{TmT}}{{{\text{e}}}_{{1 + x}}})({\text{тв}}{\text{.}})\;( + ) \\ \end{gathered} $В качестве левого электрода в цепях типа (1) использовали тулий, а в цепях типа (2) – монотеллурид тулия с незначительным избытком теллура (состав TmTe1,01). Синтезированные равновесные сплавы с различными составами из двухфазных областей TmTe + Tm2Te3 (50.3 и 55 ат. % Те), Tm2Te3 + TmTe3 (61 и 70 ат. % Те) и TmTe3 + Те (77 и 90 ат. % Те) использовали в качестве правых электродов. Образец состава 50.3 ат. % Те (TmTe1.01) использован в цепях типа (1) как правый электрод и при этом получены воспроизводимые результаты.
Тулиевый электрод готовили путем закрепления металлического тулия на молибденовую проволоку (токоотвод), а все другие – запрессованием соответствующих порошковых сплавов на токоотводы в виде цилиндрических таблеток диаметром ~7 мм и толщиной 3–4 мм.
В обеих электрохимических цепях электролитом служил глицериновый раствор KCl с добавлением небольшого (0.1%) количества TmCl3. Учитывая условие недопустимости присутствия влаги и кислорода в электролите, были использованы безводные, химически чистые соли KCl и TmCl3, а глицерин тщательно обезвоживали и обезгаживали откачкой при температуре ∼450 K.
Ранее метод ЭДС с глицериновым электролитом был успешно использован для термодинамического исследования ряда бинарных и тройных халькогенидных систем [26–35]. Методики приготовления электродов и электролита, а также сборки электрохимической ячейки подробно описаны в [36]. Измерения ЭДС проводили с помощью высокоомного цифрового вольтметра Keihtley Model 193. Температуру в электрохимической цепи измеряли хромель-алюмелевыми термопарами и ртутным термометром с точностью 0.5 К. Хромель-алюмелевую термопару заранее калибровали в интервале температур 300–510 К. В качестве эталонов использовали элементарные галлий (302.9 К), серу (386 К), индий (429.7 К) и олово (505 К).
Первые равновесные значения ЭДС цепей получены после выдерживания ячейки при ∼400 К в течение 40–60 ч, последующие − через каждые 3–4 ч после установления определенной температуры. Равновесными считали те значения ЭДС, которые не отличались друг от друга при неоднократном измерении при данной температуре более, чем на 0.2 мВ, независимо от направления изменения температуры. Для контроля обратимости цепей, в течение эксперимента ЭДС каждого образца измеряли 2–3 раза при двух выборочных постоянных температурах. При расчетах были использованы их среднеарифметические значения (табл. 1).
Таблица 1.
Первичные экспериментальные данные для образов из областей Te + TmTe3, Tm2Te3 + TmTe3 и TmTe + Tm2Te3 системы Tm–Te
| Te + TmTe3 | Tm2Te3 + TmTe3 | TmTe + Tm2Te3 | |||
|---|---|---|---|---|---|
| Цепь типа (1) | Цепь типа (1) | Цепь типа (2) | |||
| Ti, K | Ei, мВ | Ti, K | Ei, мВ | Ti, K | Ei, мВ |
| 301.3 | 441.01 | 301.3 | 337.04 | 301.3 | 902.22 |
| 304.4 | 442.11 | 304.4 | 338.52 | 304.7 | 901.33 |
| 307.7 | 441.12 | 307.7 | 337.24 | 307.2 | 900.45 |
| 312.9 | 442.03 | 312.9 | 338.62 | 311.3 | 900.78 |
| 319.3 | 443.15 | 319.3 | 336.66 | 319.2 | 900.34 |
| 323.4 | 441.45 | 323.4 | 338.51 | 322.4 | 902.23 |
| 329.5 | 442.04 | 329.5 | 337.98 | 328.5 | 901.45 |
| 334.9 | 443.41 | 334.9 | 338.92 | 334.9 | 901.45 |
| 340.6 | 444.52 | 340.6 | 336.76 | 339.6 | 900.23 |
| 348.2 | 443.93 | 348.2 | 337.39 | 345.2 | 900.12 |
| 354.4 | 443.02 | 354.4 | 338.66 | 353.1 | 900.26 |
| 358.4 | 444.83 | 358.4 | 337.02 | 358.2 | 897.89 |
| 364.9 | 443.34 | 364.9 | 338.84 | 365.9 | 896.95 |
| 371.3 | 444.89 | 371.3 | 339.05 | 371.3 | 896.53 |
| 380.2 | 444.52 | 380.2 | 336.62 | 379.2 | 898.26 |
| 385.5 | 446.44 | 385.5 | 338.02 | 385.5 | 897.45 |
| 389.1 | 443.93 | 389.1 | 338.63 | 389.1 | 896.67 |
| 394.9 | 444.78 | 394.9 | 337.24 | 393.9 | 895.45 |
| 403.6 | 446.97 | 403.6 | 338.75 | 403.6 | 893.45 |
| 406.5 | 445.29 | 406.5 | 337.06 | 406.2 | 893.78 |
| 411.2 | 445.67 | 411.2 | 338.02 | 411.2 | 895.67 |
| 415.5 | 447.02 | 415.5 | 338.99 | 413.5 | 894.23 |
| 419.2 | 447.32 | 419.2 | 339.59 | 419.2 | 892.58 |
| 422.9 | 447.89 | 422.9 | 337.09 | 420.8 | 892.78 |
| 423.2 | 446.28 | 423.2 | 337.69 | 422.2 | 894.23 |
| 429.3 | 447.77 | 429.3 | 338.62 | 427.3 | 892.78 |
| 434.4 | 446.59 | 434.4 | 337.09 | 432.4 | 894.01 |
| 438.6 | 447.25 | 438.6 | 338.91 | 437.6 | 891.36 |
| 445.8 | 447.29 | 445.8 | 337.69 | 445.8 | 892.83 |
| 449.7 | 448.8 | 449.7 | 338.6 | 449.7 | 891.23 |
Цепи типа (1) привели к воспроизводимым результатам для обоих электрод-сплавов из гетерогенной области TmTe + Tm2Te3. Для фазовых областей Tm2Te3 + TmTe3 и TmTe3 + Те значения ЭДС (порядка 1200–1350 мВ) имели относительно более высокий численный разброс. Поэтому цепи (1) нами использованы только для изучения сплавов из области TmTe + Tm2Te3. Для двух других фазовых областей были использованы цепи типа (2), которые привели к получению воспроизводимых данных. Из каждой гетерогенной области было исследовано по два сплава. Данные измерений ЭДС для обоих сплавов из одной гетерогенной области совпадали с точностью 0.5 мВ.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Полученные температурные зависимости ЭДС для всех изученных сплавов системы Tm–Te являются линейными (рис. 2), что дает возможность их обработки методом наименьших квадратов. Расчеты проводили с помощью компьютерной программы “Microsoft Office Excel 2003”. Исходные экспериментальные данные (пары температуры и ЭДС) для сплавов из всех трех гетерогенных областей приведены в табл. 1. Полученные линейные уравнения представлены в табл. 2 в виде
(3)
$E = a + bT \pm t{{\left[ {\frac{{S_{E}^{2}}}{n} + \frac{{S_{E}^{2}{{{{\text{(}}T - \bar {T}{\text{)}}}}^{{\text{2}}}}}}{{\sum {{{{{\text{(}}{{T}_{i}} - \bar {T}{\text{)}}}}^{{\text{2}}}}} }}} \right]}^{{{\text{1/2}}}}}{\kern 1pt} ,$Рис. 2.
Температурные зависимости ЭДС цепей типа (1) и (2) для сплавов из областей TmTe3 + Те (1), Tm2Te3 + TmTe3 (2) и TmTe + Tm2Te3 (3) системы Tm–Te.

Таблица 2.
Уравнения температурной зависимости ЭДС цепей типа (1)* и (2) в интервале 300–450 К
| Фазовая область | a | b | $S_{E}^{2}$ | $S_{b}^{2}$ | $\bar {T}$ |
|---|---|---|---|---|---|
| TmTe3 + Te | 428.02 | 0.0446 | 0.65 | 1.02 × 10–5 | 376.7 |
| Tm2Te3 + TmTe3 | 336.78 | 0.0032 | 0.74 | 1.20 × 10–5 | 376.7 |
| *TmTe + Tm2Te3 | 924.56 | –0.0731 | 1.11 | 1.74 × 10–5 | 377.4 |
Из полученных уравнений (табл. 2) по соотношениям [27, 28]:
(6)
$\Delta {{\bar {H}}_{i}} = - zF\left[ {E - T{{{\left( {\frac{{\partial E}}{{\partial T}}} \right)}}_{P}}} \right] = - zFa$Таблица 3.
Парциальные термодинамические функции TmTe в сплавах ${\text{TmT}}{{{\text{e}}}_{{1 + x}}}$ при 298 К
| Фазовая область | $ - \Delta {{\overline G }_{{{\text{TmTe}}}}}$ | $ - \Delta {{\bar {H}}_{{{\text{TmTe}}}}}$ | $\Delta {{\overline S }_{{{\text{TmTe}}}}}$ |
|---|---|---|---|
| кДж/моль | Дж/(моль К) | ||
| TmTe3 + Te | 127.75 ± 0.17 | 123.90 ± 0.70 | 12.91 ± 1.85 |
| Tm2Te3 + TmTe3 | 97.76 ± 0.18 | 97.49 ± 0.75 | 0.93 ± 1.98 |
Таблица 4.
Парциальные термодинамические функции тулия в сплавах Tm–Te при 298 К
| Фазовая область | $ - \Delta {{\bar {G}}_{{{\text{Tm}}}}}$ | $ - \Delta {{\bar {H}}_{{{\text{Tm}}}}}$ | $ - \Delta {{\bar {S}}_{{{\text{Tm}}}}}$ |
|---|---|---|---|
| кДж/моль | Дж/(моль К) | ||
| TmTe3 + Te | 389.06 ± 0.39 | 391.52 ± 1.62 | 8.25 ± 4.27 |
| Tm2Te3 + TmTe3 | 359.07 ± 0.40 | 365.11 ± 1.67 | 20.23 ± 4.40 |
| TmTe + Tm2Te3 | 261.31 ± 0.22 | 267.62 ± 0.92 | 21.16 ± 2.42 |
Нетрудно показать, что величины, приведенные в табл. 3 представляют собой разность соответствующих парциальных молярных функции тулия для правого и левого электродов цепей типа (2). Например,
(7)
$\begin{gathered} \Delta {{{\bar {G}}}_{{{\text{TmTe}}}}}({\text{TmT}}{{{\text{e}}}_{{1 + x}}}) = \\ = \Delta {{{\bar {G}}}_{{{\text{Tm}}}}}({\text{TmT}}{{{\text{e}}}_{{1 + x}}}) - \Delta {{{\bar {G}}}_{{{\text{Tm}}}}}({\text{TmTe}}). \\ \end{gathered} $Тогда
(8)
$\begin{gathered} \Delta {{{\bar {G}}}_{{{\text{Tm}}}}}({\text{TmT}}{{{\text{e}}}_{{1 + x}}}) = \\ = \Delta {{{\bar {G}}}_{{{\text{TmTe}}}}}({\text{TmT}}{{{\text{e}}}_{{1 + x}}}) + \Delta {{{\bar {G}}}_{{{\text{Tm}}}}}({\text{TmTe}}). \\ \end{gathered} $Данные табл. 3 и 4 совместно с результатами РФА позволяют установить характер твердофазных равновесий в системе Tm–Te. Как видно из рис. 3, при постоянной температуре значения парциальной свободной энергии Гиббса тулия (или TmTe) постоянны в пределах каждой из двухфазных областей TmTe3 + Те, Tm2Te3 + TmTe3 и TmTe + Tm2Te3 и скачкообразно меняются на их границах раздела.
Рис. 3.
Зависимости парциальной свободной энергии Tm (линия зеленого цвета, 1) и TmTe (линия красного цвета, 2) от состава в сплавах системы Tm–Te при 298 К по данным табл. 3 и 4.
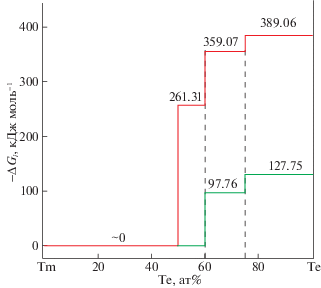
Существование указанных двухфазных областей показывает, что парциальные молярные функции тулия в них являются термодинамическими характеристиками следующих реакций потенциалобразования (состояние веществ – кристаллическое):
Из этих уравнений реакций следует, что стандартные термодинамические функции образования теллуридов тулия могут быть строго вычислены по соотношениям
При расчете стандартных энтропий соединений помимо собственных экспериментальных данных (табл. 4) использованы литературные данные [38] по стандартным энтропиям элементарных тулия (74.01 ± 0.21) и теллура (49.50 ± ± 0.21). Полученные результаты представлены в табл. 5. Погрешности находили методом накопления ошибок.
Таблица 5.
Стандартные интегральные термодинамические функции теллуридов тулия
| Соединение | $ - {{\Delta }_{{\text{f}}}}{{G}^{0}}(298\;{\text{K}})$ | $ - {{\Delta }_{{\text{f}}}}{{H}^{0}}(298\;{\text{K}})$ | ${{S}^{0}}(298\;{\text{K}})$ |
|---|---|---|---|
| кДж/моль | Дж/(моль К) | ||
| TmTe3 | 389.1 ± 0.4 | 391.5 ± 1.6 | 214.3 ± 5.1 |
| Tm2Te3 | 748.1 ± 0.8 | 756.6 ± 3.3 | 268.1 ± 9.7 |
| 816 [24] | 253 [24] | ||
| 774 [26] | 785 [26] | 255.5 [26] | |
| TmTe | 336.5 ± 0.4 | 341.4 ± 1.5 | 107.0 ± 1.4 |
| 313 ± 63 [24] | 97 ± 10 [24] | ||
В табл. 5 представлены также оценочные данные для соединений TmTe Tm2Te3, приведенные в [24, 26].
Таким образом, представлены результаты комплексного исследования твердофазных равновесий в системе Tm–Te и термодинамических свойств теллуридов тулия методами ЭДС и РФА. На основании экспериментальных данных установлено, что в системе образуются соединения TmTe, Tm2Te3 и TmTe3. Существование соединений составов Tm2Te5 и TmTe2, указанных в литературе, не подтверждено. Из данных измерений ЭДС концентрационных цепей типов (1) и (2) в интервале температур 300–450 К впервые определены парциальные термодинамические функции TmTe и Tm в сплавах. С учетом существующих в системе равновесных фазовых областей TmTe3 + + Те, Tm2Te3 + TmTe3 и TmTe + Tm2Te3 составлены уравнения потенциалобразующих реакций для соединений TmTe, Tm2Te3 и TmTe3, на основании которых вычислены стандартные термодинамические функции образования и стандартные энтропии промежуточных соединений.
Работа выполнена в рамках научной программы международной лаборатории “Перспективные материалы для спинтроники и квантовых вычислений”, созданной на базе Института катализа и неорганической химии НАНА (Азербайджан) и Международного физического центра Доностиа (Испания) и частичной финансовой поддержке Фонда развития науки при Президенте Азербайджанской Республики – Грант EİF/ MQM/Elm-Tehsil-1-2016-1(26)-71/01/4-M-33.
Список литературы
Jha A.R. Rare Earth Materials: Properties and Applications, CRC Press, United States, 2014. 365 p.
Кост М.Е., Шилов А.Л., Михеева В.И. Соединения редкоземельных элементов. Гидриды, бориды, карбиды, фосфиды, пниктиды, халькогениды, псевдогалогениды. М.: Наука, 1983. 272 с.
Balaram V. // Geoscience Frontiers. 2019. V. 10. № 4. P. 1285.
Ярембаш Е.И., Елисеев А.А. Халькогениды редкоземельных элементов. М.: Наука, 1975. 260 с.
Елисеев А.А. Хальколантанаты редких элементов. М.: Наука, 1989. 287 с.
Y, Sc, La-Lu, Gmelin Handbock of Inorganic Chemistry, in: Hartmut Bergmann (Ed.), Rare Earth Elements, 8th Edition, Springer-Verlag Heidelberg GmbH, Berlin, 1987. 363 p.
Flahaut J. Sulfides, Selenides and Tellurides, Handbook on the Physics and Chemistry of Rare Earths, Chap.31. V. 4. Gschneidner K.A., Eyring L. Eds. Elsevier 1979. P. 1–88.
Huang H., Zhu J-J. // Analyst. 2019. V. 144. P. 6789. https://doi.org/10.1039/C9AN01562K
Muthuselvam I.P., Nehru R., Babu K.R. et al. // J. Physics: Condensed Matter. 2019. V. 31. № 28. P. 285802. https://doi.org/10.1088/1361-648X/ab1570
Saint-Paul M., Monceau P. // Advances in Condensed Matter Physics. 2019. V. 4. P. 1. https://doi.org/10.1155/2019/2138264
Cheikh D., Hogan B.E., Vo T. et al. // Joule. 2018. V. 2. P. 698. https://doi.org/10.1016/j.joule.2018.01.013
Patil S.J., Lokhande A.C., Lee D.W. et al. // J. Colloid Interface Sci. 2017. V. 490. P. 147. https://doi.org/10.1016/j.jcis.2016.11.020
Zhou X.Z., Zhng K.H.L, Xiog J. et al. // Nanotechnology. 2016. V. 27. № 19. P. 192001. https://doi.org/10.1088/0957-4484/27/19/192001
Tomashyk V. N. Multinary Alloys Based on III-V Semiconductors. 2018. CRC Press. 262 p.
Андреев О.В., Бамбуров В.Г., Монина Л.Н. и др. Фазовые равновесия в системах сульфидов 3d-, 4f-элементов. Екатеринбург: РИО УРО РАН, 2015. 312 с.
Babanly M.B., Mashadiyeva L.F., Babanly D.M. et al. // Russ. J. Inorg.Chem. 2019. № 13. P. 1649. https://doi.org/10.1134/S0036023619130035
Imamaliyeva S.Z., Babanly D.M., Tagiev D.B., and Babanly M.B. // Russ. J. Inorg. Chem. 2018. V. 63. № 13. P. 1703. https://doi.org/10.1134/S0036023618130041
Babanly M.B., Chulkov E.V., Aliev Z.S. et al. // Russ. J. Inorg. Chem. 2017. V. 62. № 13. P. 1703. https://doi.org/10.1134/S0036023617130034
Massalski T.B. Binary alloys phase diagrams, second edition. ASM International, Materials park. Ohio. 1990. V. 2. P. 3589
Диаграммы состояния двойных металлических систем. Справочник / Под ред. Лякишева Р.П., т. 1, 2. М.: Машиностроение, 1996. 992 с.; 1997. 1024 с.
Елисеев А.А., Зинченко К.А., Землянухина В.М., Нгуень Ч.Т. // Журн. неорган. химии. 1976. Т. 21. № 10. С. 2603.
Pardo M.P., Flahaut J. // Bull. Soc. Chim. France. 1968. № 10. P. 3658.
Cannon J.F., Hall H.T. // Inorg. Chem. 1970. V. 9. P. 1639.
Mills K. C. Thermodynamic Data for lnorganic Sulphides, Selenides, and Tellurides, Butterworth, London, 1974. 854 p.
Vassiliev V.P., Lysenko V.A. Gaune-Escard M. // Pure Appl. Chem. 2019. V. 91. № 6. P. 879 https://doi.org/10.1515/pac-2018-0717
Vassiliev V.P., Lysenko V.A. // Electrochimica Acta. 2016. V. 222. P. 1770.https://doi.org/10.1016/j.electacta.2016.11.075
Морачевский А.Г., Воронин Г.Ф., Гейдерих В.А., Куценок И.Б. Электрохимические методы исследования в термодинамике металлических систем ИЦК. “Академкнига”, 2003. 334 с.
Бабанлы М.Б., Юсибов Ю.А. Электрохимические методы в термодинамике неорганических систем. Баку. ЭЛМ. 2011. 306 с.
Имамалиева С.З., Бабанлы Д.М., Гасанлы Т.М. и др. // Журн. физ. химии. 2018. Т. 92. № 11. С. 1684. https://doi.org/10.1134/S0036024418110158
Babanly D.M., Mashadieva L.F., Babanly M.B. // Inorg. Mater. 2017. V. 53. № 5. P. 519. https://doi.org/10.1134/S002016851705003X
Aliev Z.S., Musayeva S.S., Babanlı M.B. // Phase equilibria and diffusion, 2017. V. 38. Issue 6. P. 887.
Бабанлы Д.М., Велиева Г.М., Имамалиева С.З., Бабанлы М.Б. // Журн. физ. химии. 2018. Т. 91. № 7. С. 1098. https://doi.org/10.1134/S0036024417070044
Babanly D.M., Mashadieva L.F., Babanly M.B. // Inorg. Mater. 2017. V. 53. № 5. P. 519. https://doi.org/10.1134/S002016851705003X
Babanly D.M., Huseynov G.M., Aliev Z.S. et al. // Advances in Materials Science and Engineering. 2017. Article ID 5370289, 9 p.
Воронин М.В., Осадчий Е.Г. // Электрохимия. 2011. Т. 47. № 4. С. 446.
Imamaliyeva S.Z., Musayeva S.S., Babanly D.M. et al. // Thermochimica Acta. 2019. V. 679. P. 178319. https://doi.org/10.1016/j.tca.2019.178319
Корнилов А.Н., Степина Л.Б., Соколов В.А. // Журн. физ. химии. 1972. Т. 46. № 11. С. 2974.
База данных термических констант веществ. Электронная версия под ред. В.С. Юнгмана, 2006 г., http://www.chem.msu.su/cgi-bin/tkv.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии



