Журнал физической химии, 2021, T. 95, № 5, стр. 792-799
Синтез, свойства и антимикробная активность наноструктур AlOOH–Zn–ZnO–LDH
С. С. Тимофеев a, А. С. Ложкомоев a, *, С. О. Казанцев a, И. Н. Тихонова a, М. И. Лернер a, b
a Российская академия наук, Сибирское отделение, Институт физики прочности и материаловедения
634055 Томск, Россия
b Национальный исследовательский Томский государственный университет
634050 Томск, Россия
* E-mail: asl@ispms.tsc.ru
Поступила в редакцию 08.06.2020
После доработки 21.10.2020
Принята к публикации 23.10.2020
Аннотация
Исследованы закономерности окисления композитных наночастиц Al/AlN/Zn в воде при различных температурах реакции. Показано, что при температурах реакции от 40 до 80°С процесс характеризуется индукционным периодом, при 90°С процесс окисления происходит без индукционного периода. При этом состав конечных продуктов также различается за счет более полного превращения Zn при повышенных температурах. Были определены оптимальные условия реакции, позволяющие синтезировать нанокомпозит состава AlOOH–Zn–ZnO–LDH. Установлено, что в результате реакции наночастиц Al/AlN/Zn с водой образуется двойной слоистый гидроксид алюминия и цинка (LDH). Полученный нанокомпозит представляет собой агломераты, состоящие из нанолистов псевдобемита, пластин оксида цинка и LDH, а также остаточного цинка в виде наноразмерных включений. На примере грамположительных и грамотрицательных микроорганизмов показана антимикробная активность нанокомпозита AlOOH–Zn–ZnO–LDH в составе полимерной матрицы.
Наночастицы металлов и их оксидов активно применяют для получения новых антибактериальных материалов для борьбы с раневой инфекцией [1, 2]. В настоящее время известны различные полимерные покрытия, мази, гели и перевязочные материалы, содержащие наночастицы металлов и оксидов металлов. С точки зрения антимикробной активности наиболее перспективными являются материалы, содержащие цинк, медь, железо, титан, серебро, их оксиды и композиции [3–5]. Следует отметить, что одним из успешных путей по борьбе с раневой инфекцией и улучшению заживления ран можно считать применение композиционных материалов на основе наночастиц, которые обладают свойствами как сорбентов, так и антисептиков. Такое сочетание позволяет успешно удалять из раны экссудат с патогенной микрофлорой и обезвреживать ее. Так, например, в работе [6] предложены материалы на основе оксигидроксида алюминия, модифицированного коллоидным серебром, а в работе [7] продемонстрировано их применение в хирургической практике.
Еще одним примером являются композиции на основе соединений цинка, которые часто используют в качестве антимикробных компонентов в составе лечебных препаратов для подавления пролиферации микроорганизмов, в том числе резистентных штаммов бактерий [8–13]. Кроме того, интерес представляют системы, в которых отдельные наночастицы Zn могут самостоятельно проявлять антимикробный эффект [14, 15].
На наш взгляд, одним из перспективных способов получения нанокомпозитов с сорбционными и антимикробными свойствами является окисление водой двухкомпонентных наночастиц на основе Al и биоактивного металла: Zn, Cu, Ag и др., полученных совместным электрическим взрывом двух проволочек [9, 16–22]. Продукты окисления таких наночастиц представляют собой сложные системы, объединенные нанолистовыми структурами оксигидроксида алюминия и соединениями второго металла. Однако, в настоящее время, особенности формирования таких нанокомпозитов и их антимикробные свойства изучены слабо.
В настоящей работе исследованы закономерности формирования нанокомпозитов при реакции электровзрывных наночастиц Al/AlN/Zn с водой, проведен анализ структурных характеристик и показана оценка антимикробного действия гибридных материалов, на основе полученных нанокомпозитов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез наноструктур AlOOH–Zn–ZnO–LDH
В качестве прекурсора для создания нанокомпозитов были использованы наночастицы Al/AlN/Zn, полученные совместным электрическим взрывом проволочек Al и Zn в атмосфере N2 по методике, описанной в [9, 10]. Известно, что пара металлов Al–Zn при окислении способна образовывать сорбционные материалы с положительным зарядом поверхности, которые могут проявлять высокую активность к бактериям и обладать антимикробными свойствами. Особенностью таких материалов является наличие складчатых нанолистов псевдобемита с высокой удельной поверхностью и бактерицидного компонента на основе наночастиц цинка или оксида цинка, объединенных в иерархически организованные структуры [8, 9].
Синтез нанокомпозитов осуществляли реакцией окисления наночастиц Al/AlN/Zn в дистиллированной воде. В отличие от наночастиц Al/Zn, полученных электрическим взрывом в атмосфере Ar, наличие фазы AlN способствует более полному протеканию реакции Al и AlN за счет повышенного рН реакционной среды в результате гидролиза AlN с выделением аммиака.
Для проведения синтеза в термостатированный реактор заливали 500 мл дистиллированной воды. При достижении установленной температуры в реактор вносили порошок наночастиц Al/AlN/Zn и проводили реакцию окисления при постоянном перемешивании верхнеприводной механической мешалкой (BioSan MM-1000) с установленной частотой вращения 300 об/мин. Масса образца наночастиц, вносимого в реактор составляла 5.0 ± 0.01 г. Для определения оптимальных параметров синтеза реакцию окисления проводили при разных температурах в ряду: 40, 50, 60, 70, 80, 90°C с точностью поддержания установленной температуры ±0.1°C. Ход реакции окисления водой наночастиц Al/AlN/Zn контролировали по изменению величины рН реакционной смеси. По окончании реакции продукты отфильтровывали на обеззоленном фильтре (синяя лента) и промывали дистиллированной водой до достижения нейтральной реакции промывных вод. Осадок сушили при температуре 105 ± 1°C в сушильном шкафу до постоянной массы.
Определение структурных характеристик
Для исследования размеров и морфологии наночастиц прекурсора и продуктов окисления Al/AlN/Zn использовали просвечивающую электронную микроскопию (ПЭМ) с применением электронного микроскопа JEM-2100 (JEOL).
Средний размер частиц определяли статистической обработкой ПЭМ-изображений наночастиц. Для построения диаграммы распределения по размеру учитывались размеры не менее 1500 наночастиц. Подсчет частиц проводили на серии микрофотографий наночастиц при увеличении ×50 000.
Текстурные характеристики исследовали методом тепловой десорбции азота. В качестве анализатора удельной поверхности использовали прибор “Сорбтометр М” (ЗАО “Катакон”, Россия). Экспериментальные данные обрабатывали с помощью оригинального программного обеспечения, поставляемого совместно с оборудованием.
Определение фазового состава
Фазовый состав прекурсора и продуктов окисления определяли методом качественного рентгенофазового анализа (РФА). В качестве аналитического прибора использовали рентгеновский дифрактометр XRD-6000 (Shimadzu) на CuKα-излучении с использованием баз данных PCPDFWIN, а также программы профильного анализа POWDER CELL 2.4 и программного комплекса Crystallografica.
Определение антимикробной активности
Оценку антимикробной активности синтезированного нанокомпозита AlOOH–Zn–ZnO–LDH (НК) проводили с использованием следующих штаммов бактерий: факультативно-анаэробные грамположительные кокки S. aureus ATCC 6538P и грамотрицательные палочки факультативные анаэробы E. coli АТСС 25922, предоставленные НИИ генетики и селекции промышленных микроорганизмов НИЦ Курчатовский институт (Россия).
Определение минимальной ингибирующей концентрации (МИК) проводили модифицированным методом серийных разведений в бульоне [23, 24]. Для каждого тестируемого штамма бактерий приготовили ряд двойных разведений НК. Рабочую суспензию НК готовили с использованием жидкой питательной среды – бульона Мюллера–Хинтона (MHB). Таким образом, подготовили по 7 пробирок суспензии НК, концентрации которого отличались в 2 раза с каждым разведением. Одновременно для каждого тестируемого вида бактерий подготовили по одной контрольной пробирке с 1 мл бульона (контроль роста) и пробирке с 2 мл бульона для контроля стерильности питательной среды.
Суточные агаровые культуры тестируемых штаммов с помощью стерильной бактериологической петли перенесли в стерильные полимерные пробирки с крышкой, содержащие по 3 мл стерильного 0.9% раствора хлорида натрия и тщательно перемешали на вихревом миксере. Мутность бактериальных суспензий измеряли с помощью оптического прибора Денси-Ла-Метр и корректировали до значения 0.5 единицы стандарта мутности по McFarland (1.5 × 108 КОЕ/мл) стерильным физраствором. Для приготовления рабочего инокулюма бактериальную суспензию каждого штамма с концентрацией 1.5 × 108 КОЕ/мл разбавили в 100 раз, добавив по 300 мкл бактериальной суспензии к 29.7 мл стерильного бульона MHB в два стерильных флакона объемом 50 мл и тщательно смешали.
Далее в каждую пробирку, содержащую по 1 мл двойных разведений суспензии НК и одну контрольную пробирку (контроль роста), внесли по 1 мл бактериальной суспензии концентрацией 106 КОЕ/мл. Конечная концентрация бактериальной суспензии в каждой пробирке составила примерно 5 × 105 КОЕ/мл. После инокуляции пробирки с образцами инкубировали в термостате при 37 ± 1°С в течение суток. На следующий день оценивали мутность суспензий в экспериментальных и контрольных пробирках. Минимальная концентрация НК, при которой подавлялся видимый рост бактерий в пробирке, принимался за МИК.
Для оценки состояния тестируемых бактерий без воздействия наночастиц, из пробирок с МИК и соседней с ней более высокой концентрацией нанокомпозита отобрали пробы по 1 мл и приготовили десятикратные разведения бактерий 10–1, 10–2, 10–3 с помощью MHB. Далее произвели посев 200 мкл каждого разведения в чашки Петри на плотную питательную среду агар Мюллера–Хинтона (MHA). Посевы инкубировали при 37 ± 1°С в течение суток, после чего осуществляли визуальный осмотр, и подсчет выросших колоний с учетом разведения. Наличие роста бактерий в посевах указывает на бактериостатическое действие данной концентрации нанокомпозита, отсутствие – бактерицидное.
Поскольку принято считать, что практически МИК не является “рабочей концентрацией” [25], поэтому дополнительно провели тест по оценке влияния на бактерии следующих концентраций нанокомпозита – 1 МИК, 2 МИК, 3 МИК. В пробирки с бульоном MHB, содержащие бактериальные суспензии E. coli ATCC 25922, S. aureus ATCC 6538 P с концентрацией 5 × 105 КОЕ/мл внесли навески НК в вышеуказанных концентрациях. Пробирки с контролем роста содержали только бактериальные суспензии соответствующих штаммов в концентрации 5 × 105 КОЕ/мл. После инкубирования образцов в термостате при 37 ± 1°С в течение суток, проводили визуальный осмотр и посев десятикратных разведений (10–1–10–3) проб из каждой пробирки на плотную питательную среду MHA. Результаты посевов оценивали через сутки инкубирования в термостате.
Получение гибридных материалов
Для приготовления гибридных материалов (ГМ), содержащих НК, в качестве основы использовали смесь полиэтиленгликолей ПЭГ 400 и ПЭГ 20 000 в соотношении 1 : 9. Выбор основы обусловлен тем, что смесь ПЭГ 400 и ПЭГ 20 000 хорошо наносится на кожу, равномерно распределяется на ней, не препятствует газообмену кожи, не нарушает деятельность желез и нетоксична. В качестве вспомогательного вещества для более однородного распределения компонентов в объеме и улучшения антибактериального действия использовали диметилсульфоксид (ДМСО). Содержание ДМСО варьировали от 5.0 до 25.0 мас. %. Процентное содержание НК в ГМ принимали равным ранее установленной минимальной бактерицидной концентрации (МБК). Основу предварительно нагревали на водяной бане до расплавления твердой фракции, а затем охлаждали до 25 ± ± 2°С. Для получения гомогенной массы, навеску НК смешивали с равной по объему частью основы и тщательно перемешивали. Затем добавляли оставшуюся часть основы, ДМСО и еще раз тщательно перемешивали.
Антимикробное действие экспериментальных составов ГМ исследовали методом лунок и методом дорожки по Флемингу [2, 17, 26]. Степень чувствительности тестируемых микроорганизмов к экспериментальным образцам определяли по ширине зон задержки роста вокруг лунки и канавки, выраженные в миллиметрах. В качестве тест-культур использовали S. aureus ATCC 6538, E. coli АТСС 25922 и P. aeruginosa ATCC 9027, предоставленные НИИ генетики и селекции промышленных микроорганизмов НИЦ Курчатовский институт (Россия).
Для одновременной оценки антимикробного спектра действия ГМ по методу Флеминга в стерильные чашки Петри наливали по 20 мл MHA и охлаждали до полного застывания среды. В застывшей питательной среде MHA стерильным скальпелем по центру чашки диаметрально вырезали и удаляли дорожку шириной 10 мм. В образовавшуюся канавку закладывали тестируемый образец ГМ. Для осуществления отрицательного контроля в другие чашки в канавку закладывали основу, не содержащую наночастицы. Затем во всех чашках по поверхности агара перпендикулярно к канавке с помощью бактериальной петли засевали культуры трех исследуемых штаммов микроорганизмов. Посевы помещали на сутки в термостат при температуре 37 ± 1°C. После этого проводили оценку результатов по образованию зон задержки роста у каждого штамма бактерий возле канавки.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
На рис. 1 представлено ПЭМ-изображение наночастиц Al/AlN/Zn, полученных электрическим взрывом Al и Zn проволочек в атмосфере азота, на котором видно, что они имеют сферическую форму (частицы алюминия и цинка) и форму ограненных пластин (частицы нитрида алюминия). Одной из особенностей данных наночастиц является наличие частиц-янусов с разделенными компонентами в виде зон, обогащенных алюминием и цинком.
На рис. 2 показана дифрактограмма наночастиц Al/AlN/Zn, на которой присутствуют пики, соответствующие фазам Al, Zn и AlN. Наночастицы Al/AlN/Zn имеют удельную поверхность 15 м2/г и средний размер 61 нм.
Для изучения закономерностей окисления водой наночастиц Al/AlN/Zn, а также для определения оптимальных параметров проведения реакции, были получены интегральные кривые изменения величины рН реакции окисления наночастиц Al/AlN/Zn при температуре от 40° до 90° в воде. Они имели характерную S-образную форму с выраженным индукционным периодом. Установлено, что с увеличением температуры реакции индукционный период сокращался с 30 до 1 мин, а при температуре более 80°C индукционный период отсутствовал. Время реакции при температуре более 80°C уменьшалось со 180 до 30 мин (рис. 3).
При взаимодействии нитрида алюминия с водой выделялся аммиак, который хорошо растворялся в воде и увеличивал рН среды, повышая тем самым скорость окисления металлического алюминия:
(1)
${\text{N}}{{{\text{H}}}_{3}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}} \leftrightarrow {\text{N}}{{{\text{H}}}_{3}} \cdot {{{\text{H}}}_{{\text{2}}}}{\text{O}} \leftrightarrow {\text{NH}}_{4}^{ + } + {\text{O}}{{{\text{H}}}^{ - }}.$Стоит отметить, что часть цинка в реакционной смеси реагировала с раствором аммиака с образованием аммиачного комплекса гидроксида тетраамминцинка(II):
(2)
$\begin{gathered} {\text{Zn}} + 4{\text{N}}{{{\text{H}}}_{3}} \cdot {{{\text{H}}}_{{\text{2}}}}{\text{O}} \to [{\text{Zn}}{{({\text{N}}{{{\text{H}}}_{{\text{3}}}})}_{4}}]{{({\text{OH}})}_{2}} + \\ + \;2{{{\text{H}}}_{{\text{2}}}}{\text{O}} + {{{\text{H}}}_{2}}{\kern 1pt} \uparrow {\kern 1pt} . \\ \end{gathered} $Поскольку гидроксид тетраамминцинка(II) не устойчив в условиях эксперимента, то происходила реакция разложения с образованием гидроксида цинка и аммиака:
(3)
$[{\text{Zn(N}}{{{\text{H}}}_{{\text{3}}}}{{{\text{)}}}_{{\text{4}}}}]{{({\text{OH}})}_{2}} \to {\text{Zn}}{{({\text{OH}})}_{2}} + 4{\text{N}}{{{\text{H}}}_{3}}.$Кроме того, протекала реакция взаимодействия гидроксида цинка и гидрата аммиака с повторным образованием гидроксида тетраамминцинка(II) и воды:
(4)
$\begin{gathered} {\text{Zn}}{{({\text{OH}})}_{2}} + 4({\text{N}}{{{\text{H}}}_{3}} \cdot {{{\text{H}}}_{{\text{2}}}}{\text{O}}) \to \\ \to [{\text{Zn}}{{({\text{N}}{{{\text{H}}}_{{\text{3}}}})}_{4}}]{{({\text{OH}})}_{2}} + 4{{{\text{H}}}_{{\text{2}}}}{\text{O}}. \\ \end{gathered} $Одновременно протекал процесс образования слоистого двойного гидроксида (LDH) цинка и алюминия в условиях эксперимента по механизму водного осаждения в щелочной среде, описанному в работе [27]. Образование LDH может протекать циклически до полного превращения гидроксида цинка при температуре от 60° до 90°C в условиях эксперимента, что подтвердилось при РФА продуктов реакции и (рис. 4).
При температуре 90°C реакция протекала в одну стадию. Вероятно, при температуре 90°C происходил гидролиз AlN и в то же время окисление наночастиц Al и Zn. При снижении температуры реакционной среды ниже 80°C можно было наблюдать разделение стадий превращения по времени.
При анализе дифрактограмм продуктов окисления было установлено, что при температуре 40°C в продуктах присутствуют частицы непрореагировавшего алюминия. С ростом температуры наблюдалось увеличение интенсивности пиков оксида цинка и уширение пиков аморфной фазы псевдобемита, в то же время, уменьшалось содержание цинка и алюминия.
С увеличением температуры реакционной среды увеличивалась скорость реакции наночастиц Al/AlN/Zn в воде, и, как следствие, образовывалось большее количество оксида цинка и гидроксида алюминия, что подтверждалось данными РФА на рис. 4.
Установлено, что в образцах, полученных при температуре 40 и 60°C присутствовали частицы непрореагировавшего цинка. На основании интенсивности пиков дифрактограмм анализируемых образцов можно сделать вывод, что количество непрореагировавшего цинка уменьшалось с ростом температуры реакции. При температуре 90°C в продуктах реакции не наблюдалось наличия не связанного цинка.
При температуре реакции выше 60°С наблюдалось образование кристаллической фазы гидроксида алюминия, что в дальнейшем отрицательно могло повлиять на снижение активности синтезируемого компонента по отношению к микроорганизмам. При температуре реакции ниже 60°С процесс окисления наночастиц Al/AlN/Zn протекал значительно медленнее, в результате чего по окончании реакции остались непрореагировавшие частицы прекурсора Al и Zn. Было установлено, что увеличение времени реакции более 60 минут при температуре 40°C привело к образованию кристаллического тригидроксида алюминия с низкой величиной удельной площади поверхности, что так же могло повлиять на снижение активности НК по отношению к микроорганизмам.
Учитывая вышеизложенное, оптимальными параметрами для синтеза НК были выбраны: температура реакции 60°С и время реакции 60 мин. НК, полученный в таких условиях, содержит сорбент, представленный фазой AlOOH и антибактериальные компоненты ZnO и Zn, а также двойной гидроксид LDH.
Для исследования закономерностей формирования нанокомпозитов при окислении водой электровзрывных наночастиц Al/AlN/Zn, были получены и охарактеризованы промежуточные продукты реакции. Реакцию проводили в водно-спиртовом растворе с содержанием воды 10 мас. % при температуре 60°С. На рис. 5 представлены ПЭМ-изображения, демонстрирующие процесс окисления наночастиц Al/AlN/Zn в водно-спиртовом растворе. Для того, чтобы получить более детальную картину процесса окисления прекращали реакцию с помощью холодного этанола. Проанализировав ПЭМ-изображения продуктов, полученных в разные временные отрезки реакции, весь процесс превращения условно разделили на пять стадий. На рис. 5а показано самое начало процесса превращения, сопровождающееся гидратацией оксидной пленки металлических наночастиц. Одновременно происходило окисление алюминия и гидролиз нитрида алюминия. На рис. 5б можно увидеть образовавшиеся нанолепестки псевдобемита. Затем, по мере разрушения целостности частицы, открывался доступ воды вглубь частицы и происходил рост продуктов окисления (рис. 5в), а также образование пластин ZnO и LDH, которые трудно различить на ПЭМ (рис. 5г). Образование оксида цинка происходило одновременно с окислением алюминия, в результате чего происходила агломерация продуктов. Реакция протекала до полного превращения алюминия (рис. 5д).
Рис. 5.
ПЭМ-изображения продуктов окисления наночастиц Al/AlN/Zn в водно-спиртовом растворе. Обозначения см. текст.

В результате окисления частиц Al/AlN/Zn в водно-спиртовом растворе было показано, что ограниченное содержание воды в смеси с этанолом существенно изменяет скорость окисления металлов, что в конечном счете влияет на глубину превращения металлических наночастиц. Определение элементного состава продуктов превращения Al/AlN/Zn в воде в режиме картирования позволило установить, что состав агломератов нанолистов преимущественно представлен композитом из нанолистов и нанопластин, состоящих из AlOOH, ZnO, Zn и LDH (рис. 6).
Рис. 6.
ПЭМ-изображение продуктов превращения в воде наночастиц Al/AlN/Zn и энергодисперсионный элементный анализ в режиме картирования.

Полученный нанокомпозит имеет мезопористую структуру, обусловленную наличием щелевидных пор, образованных нанолистами бемита. Величина удельной площади поверхности полученных нанокомпозитов составила 200 ± 20 м2/г.
Таким образом, анализируя физико-химические и текстурные свойства можно охарактеризовать продукты окисления наночастиц Al/AlN/Zn как систему пористых нанокомпозитов AlOOH–Zn–ZnO–LDH (рис. 7).
Методом серийных разведений были определены МИК и МБК нанокомпозитов для двух штаммов бактерий E.coli ATCC 25922, St.aureus ATCC 6538 P, которые составили 17 мг/мл и 51 мг/мл, соответственно.
Образцы ГМ, содержащие 5.1 мас. %. НК обладают умеренным антимикробным действием к тестируемым культурам микроорганизмов: зона лизиса составляет в среднем от 11 до 14 мм. При этом чувствительность бактерий возрастает в следующем порядке: P.aeruginosa АТСС 9027 < S.aureus АТСС 6538Р < E. coli АТСС 25922 (рис. 8).
Рис. 8.
Оценка антимикробного спектра действия ГМ по методу Флеминга: а – ГМ с нанокомпозитом, 5.1 мас. %, б – аптечная мазь с оксидом цинка 10 мас. %.
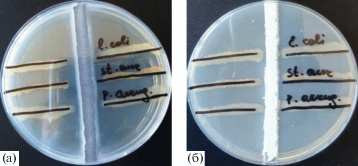
При оценке чувствительности микроорганизмов к основам было установлено, что сама основа ГМ, представленная смесью ПЭГ и ДМСО, обладает слабым антимикробным действием по отношению ко всем тестируемым штаммам микроорганизмов. Это связано с индивидуальной восприимчивостью тест-культур к ДМСО [28].
Таким образом, исследован процесс окисления композитных наночастиц Al/AlN/Zn в воде при различных температурах реакции. Показано, что при взаимодействии наночастиц Al/AlN/Zn с водой при температуре 60°C в течение 60 мин образуются пористые нанокомпозиты AlOOH–Zn–ZnO–LDH, представляющие агломераты, состоящие из нанолистов псевдобемита, слоистого двойного гидроксида алюминия и цинка, оксид цинка и наноразмерных включений цинка. Установлено, что повышение температуры реакции до 90°C приводит к ускорению реакции и полному превращению цинка. Снижение температуры реакции до 40°C не позволяет получить продукты реакции, которые будут содержать оксид цинка и LDH, заявленные для получения эффективного антибактериального композита. На основе полученных нанокомпозитов разработан экспериментальный состав антимикробного гибридного материала: наноструктуры AlOOH–ZnO–Zn–LDH – 5.1% (масс.), ДМСО – 15–24.9 мас. %, смесь ПЭГ 400 и ПЭГ 20 000 – 70–79.9 мас. %.
Стоит отметить, что наноструктуры AlOOH–ZnO–Zn–LDH в составе гибридных материалов проявляют все же умеренную антимикробную активность. Ограничение антимикробной активности может быть обусловлено не высоким уровнем диффузии компонентов и экранирующим действием полимерной основы. Для получения наиболее эффективных составов гибридных материалов с наноструктурами AlOOH–ZnO–Zn–LDH необходим подбор основы с низким экранирующим действием.
Антимикробный гибридный материал разработан в рамках государственного задания ИФПМ СО РАН, тема номер FWRW-2021-0007 и Плана НИР Российско-Вьетнамского Тропического научно-исследовательского и технологического центра на 2020 г., тема Эколан М-1.9.
Список литературы
Пaтeнт WO 2011/033040 A3, Aleksandrovic V. [RS/DE]; Ruthsweg 10, 22307 Hamburg (DE). Schlundt C.R. [DE/DE]; WeiBenburger Str. 14, 22049 Hamburg (DE). Werner K. [DE/DE]; Hasenwiete 5, 25336 Klein Nor-dende (DE). Woost M. [FR/DE]; Struckholt 28, 22337 Hamburg (DE), 16.09.2009.
Бабушкина И.В. // Саратовский научно-медицинский журн. 2011. Т. 7. № 2. С. 530.
Бабушкина И.В., Мамонова И.А., Гладкова Е.В. и др. // Междунар. журн. прикл. и фундаментальных исследований. 2017. № 4–3. С. 501.
Фролова А.В., Генералов И.И. // Вестн. ВГМУ. Т. 11. № 4. 2012.
Добрейкин Е.А. Экспериментальное обоснование сочетанного применения наночастиц меди и низкоинтенсивного лазерного излучения при хирургическом лечении инфицированных ожоговых ран кожи: дис. …канд. мед. наук. Саратов, 2014.
WO 2011/071417 А 1, Lerner M. I. [RU/RU]; Glazkova E.A. [RU/RU]; Psakhie S.G. [RU/RU]; Kirilova N.V. [RU/RU]; Svarovskaya N.V. [RU/RU] Bakina O.V. [RU/RU]; ISPMS SB RAS; пр. Академический, 2/4, Томск, 63402 1, Tomsk (RU), 16.06.2011
Тазин Д.И., Шакиров М.Н., Тазин И.Д., Плешко Р.И. // Вестн. Авиценны. 2018. 20 (1):77.
Lozhkomoev A.S., Glazkova E.A., Svarovskaya N.V. et al. // AIP Conference Proceedings. 2014. V. 367. P. 1623.
Лернер М.И., Давыдович В.И., Сваровская Н.В., Домашенко В.В. // Нанотехника. 2009. Т. 17. № 1.
Домашенко В.В., Первиков А.В. // Материалы I Международной Российско-Казахстанской конференции. Химия и химическая технология. 2011.
Varun Saxena, Lalit M. Pandey // Materials Today: Proceedings. V. 18. Part 3. 2019. P. 1388.
Ananda Miftahul Husna, Fransiska Sri Herwahyu Krismastuti // AIP Conference Proceedings 2019. V. 2175. P. 020026.
Tiwari Vishvanath, Mishra Neha, Gadani Keval et al. // Frontiers in Microbiology. 2018. V. 9. P. 1218.
Chiriac V., Stratulat D., Calin G. et al. // IOP Conference Series: Materials Science and Engineering. 2016. V. 133. P. 12.
Salem W., Leitner D.R., Zingl F.G. et al. //Intern. J. of medical microbiology: IJMM. 2015. V. 305(1). P. 85.
Затолокин В.Д., Мошкин А.С. // Вестн. клинической и экспериментальной хирургии. 2010. Т. 3. № 1. С. 44.
Бабушкина И.В. // Там же. 2013. Т. 6. № 2. С. 217.
Bakina O.V., Glazkova E.A., Lozhkomoev A.S. et al. // Cellulose 2018. V. 25. P. 4487.
Bakina O.V., Glazkova E.A., Pervikov A.V., Svarovskaya N.V. // Current Nanoscience. 2019. V. 5–15. P. 525.
Bakina O.V., Glazkova E.A., Lozhkomoev A.S. et al. // Cellulose. 2020. V. 27. P. 6663.
Бакина О.В., Казанцев С.О., Первиков А.В. и др.// Физика и химия обработки материалов. 2020. № 4. С. 31.
Lozhkomoev A.S., Pervikov A.V., Bakina O.V. et al. // RSC Advances. 2018. V. 8. № 63. P. 36239.
Wiegand Irith, Hilpert Kai, Robert E.W. Hancock Agar and broth dilution methods to determine the minimal inhibitory concentration (MIC) of antimicrobial substances Centre for Microbial Diseases and Immunity Research, University of British Columbia, 2259 Lower Mall Research Station, Vancouver, British Columbia, V6T 1Z4, Canada. Published online 17 January 2008. https://doi.org/10.1038/nprot.2007.521
Дзержинская И.С. Методы выделения, исследования и определения антибиотической активности микроорганизмов, обладающих антагонистическими свойствами: методические указания к практическим работам по дисциплине “Антибиотики” для студентов специальности 012400 “Микробиология”. Астрахань: АГТУ, 2005. 76 с.
Ржеусский С.Э., Довнар А.Г., Кугач В.В. // Вестн. ВГМУ. 2015. Т. 14. № 6. С. 120.
МУК 4.2 1890-04 “Определение чувствительности микроорганизмов к антибактериальным препаратам”.
Субчева Е.Н., Серцова А.А., Юртов Е.В. // Успехи в химии и химической технологии. 2013. Т. XXVII. № 6. С. 116.
Бойко Н.Н. // Хирургия. 1979. № 1. С. 64.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии







