Журнал физической химии, 2021, T. 95, № 5, стр. 800-809
Метод расчета ректификационной колонны для разделения смеси легкой и тяжелой воды
Т. Г. Короткова a, *, Г. И. Касьянов a, **
a Кубанский государственный технологический университет
350072 Краснодар, Россия
* E-mail: korotkova1964@mail.ru
** E-mail: g_kasjanov@mail.ru
Поступила в редакцию 22.05.2020
После доработки 30.07.2020
Принята к публикации 03.08.2020
Аннотация
Предложен метод расчета ректификационной колонны для разделения смеси легкой и тяжелой воды, основанный на теоретических ступенях разделения (ТСР). Расчет колонны проведен от нижней ТСР к верхней; исходные данные: число ТСР, расходы питания и дистиллята, флегмовое число, давление внизу и вверху колонны, состав кубового остатка. На каждой ТСР по известному составу жидкой фазы при заданном давлении определены температура кипения, упругости паров чистых H2O и D2O, коэффициент разделения, коэффициенты активности H2O и D2O и состав равновесной паровой фазы; изменение давления по высоте колонны принято линейным. Приведены блок-схемы расчетов: колонны, фазового равновесия на ТСР и температуры кипения на ТСР. Метод апробирован на насадочной колонне, установленной на Производственном объединении “Маяк” (Россия) последней в каскаде из пяти ректификационных колонн, предназначенных для депротизации тяжеловодного замедлителя. Сравнением экспериментальных и расчетных данных показана применимость данного метода для разделения смеси легкой и тяжелой воды. На основании полученных расчетных значений коэффициентов активности легкой и тяжелой воды сделан вывод, что смесь H2O–D2O неидеальна. Метод рекомендован к применению для уточнения числа ТСР, полученного при моделировании колонных ректификационных аппаратов в интегрированных средах моделирования.
Одна из сложных задач ректификации – разделение смесей изотопных соединений, что связано с небольшим различием их температур кипения. Для разделения требуется большое число теоретических ступеней разделения (ТСР). Разработано много методов расчета ректификационных колонн и фазового равновесия на ТСР, основанных на эмпирических зависимостях или строгих термодинамических моделях, учитывающих неидеальность паровой фазы. Все методы итерационны, содержат прямые и рецикловые потоки, что приводит к значительному повышению затрат машинного времени. В основе расчетов процесса ректификации лежит вычисление парожидкостного равновесия на ТСР, которое представляет основную сложность. Парожидкостное равновесие зависит от концентраций компонентов смеси в жидкой или паровой фазах, температуры и давления. В данной работе предложен метод расчета ректификационной колонны по ТСР для разделения смеси H2O–D2O, позволяющий рассчитывать фазовое равновесие на ТСР. Метод апробирован на насадочной колонне, входящей в каскад из пяти колонн, предназначенных для депротизации тяжелой воды, экспериментальное исследование которых проведено в [1].
Разделение смеси H2O–D2O на легкую и тяжелую воду имеет большое значение для изучения ее уникальных свойств с точки зрения воздействия на живые организмы, растения, вирусы и т.д. Выявлено, что на клеточном уровне D2O влияет на митоз и функцию мембран. Простейшие способны выдерживать до 70% D2O, а водоросли и бактерии способны адаптироваться к росту в 100% D2O. Высокие концентрации тяжелой воды защищают мышей от гамма-излучения [2]. В обзоре [3] представлены сведения о применении D2O в медицинских исследованиях при лечении таких болезней как гипертония, заболевание дыхательных путей, заболевания, вызванные вирусами герпеса и др. D2O применяется в качестве терапевтического средства против рака поджелудочной железы. Обнаружена важная роль оксида дейтерия во внутриклеточных процессах, которые ответственны за метаболизм и жизнеспособность культур ADSC (культивируемые жировые стволовые клетки cultured adipose-derived stem cells) in vitro [4]. С другой стороны, применение тяжелой воды в качестве питьевой приводит к заболеваниям, гибели растений и животных. Белых крыс поили водой с содержанием D2O на уровне 10, 145, 1000 ppm [5]. В качестве контроля использовали воду, содержащую 145 ppm D2O, которая соответствует московской водопроводной воде. Выявлено негативное воздействие при длительном потреблении воды с повышенным содержанием D2O (1000 ppm). Достоверно увеличен процент оксифильных нормоцитов и достоверно снижено число базофильных нормоцитов в костном мозге.
Для повышения жизненных сил организма в условиях неблагоприятных внешних воздействий рекомендовано употреблять легкую воду с пониженным содержанием D2O [6]. Геропротекторные свойства легкой протиевой воды способствуют омоложению и замедлению процесса старения организма. Проведены исследования влияния воды с пониженным содержанием тяжелых стабильных изотопов кислорода и водорода (дейтерия) на цитогенетический статус облученных животных [7]. В результате 24-часового радиационного воздействия обнаружено, что число лейкоцитов в группе мышей, употреблявших легкоизотопную воду, ниже, чем у животных, которые употребляли дистиллированную воду. Авторами [8] установлен градиент 2H/1H в жидкостях человека (δ2H (слюна) ≫δ2H (плазма крови) >δ2H (грудное молоко)). Поднят вопрос о влиянии радиоактивного изотопа трития, содержащегося в питьевой воде, на здоровье человека [9].
Для разделения смеси H2O–D2O применяют следующие промышленные способы: электролиз воды, химический изотопный обмен и ректификация воды под вакуумом. Все способы имеют свои преимущества и недостатки, рассмотренные в [10]. Ректификация воды под вакуумом относится к одному из перспективных способов разделения смеси H2O–D2O.
В [1] рассмотрено разделение легкой и тяжелой воды ректификацией под вакуумом. Моделирование трехступенчатого каскада с сокращением потоков сведено к моделированию одной ректификационной колонны с промежуточными дефлегматорами и испарителями. В основу метода расчета колонны положена математическая модель контактного устройства. Число ТСР принято сверху вниз. В представленной модели не учитываются коэффициенты активностей компонентов H2O и D2O. Авторами [11] предложена математическая модель насадочной колонны по удалению D2O из трехкомпонентной смеси H2O, D2O и DHO. Модель включает уравнения материального баланса куба, ТСР, дефлегматора, эмпирические уравнения для расчета давлений насыщения компонентов, корреляцию для определения задержки жидкости в колонне, перепад давлений на единицу длины сухой насадки и падение давления в орошаемой колонне, выражения для расчета скорости жидкости и пара внутри колонны и др. В данной модели принято, что трехкомпонентная смесь H2O, D2O и DHO является идеальной. Коэффициенты относительной летучести компонентов тождественны коэффициентам разделения и определены как отношение давлений насыщения компонентов к давлению насыщения D2O. Ниже будет показано, что смесь H2O–D2O является неидеальной, и понятия коэффициент относительной летучести и коэффициент разделения для смеси H2O–D2O не тождественны.
Нами разработан метод расчета ректификационной колонны по ТСР для разделения смеси легкой и тяжелой воды.
МЕТОД РАСЧЕТА РЕКТИФИКАЦИОННОЙ КОЛОННЫ ПО ТСР ДЛЯ РАЗДЕЛЕНИЯ СМЕСИ H2O–D2O
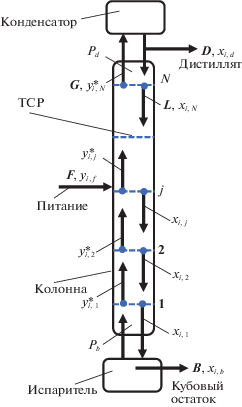
Рассмотрим ректификационную колонну с подачей питания F, кмоль/ч, состава ${{x}_{{i,f}}}$, мол. доли, в среднюю часть (рис. 1). Представим смесь легкой и тяжелой воды, состоящей из двух компонентов D2O и H2О, каждый из которых имеет свой коэффициент активности, не равный 1.
Тарелка питания j делит колонну на две части: верхнюю и нижнюю. В зависимости от поставленной задачи расчет проводят по легкой или тяжелой воде. Если задачей разделения является концентрирование легкой воды, то расчет проводят по H2O, и верхнюю часть колонны называют укрепляющей, а нижнюю – исчерпывающей, и представляют фазовое равновесие в координатах y–x. В случае получения в качестве основного продукта D2O расчет проводят по тяжелой воде и верхнюю часть колонны называют исчерпывающей, а нижнюю – укрепляющей и представляют фазовое равновесие в координатах x–y. Выберем в качестве основного компонента тяжелую воду D2O. Продуктами разделения являются дистиллят D, кмоль/ч, состава ${{x}_{{i,d}}}$, мол. доли, отбираемый сверху колонны из конденсатора, и кубовый остаток B, кмоль/ч, состава состава ${{x}_{{i,b}}}$, мол. доли, отбираемый снизу колонны из испарителя. На тарелках (ТСР) колонны происходит кипение смеси. Пар, покидающий ТСР, находится в равновесии с жидкостью, стекающей с ТСР. Примем счет ТСР снизу вверх. Первую ТСР покидает жидкостной поток состава ${{x}_{{i,1}}}$ и паровой поток состава $y_{{i,1}}^{*}$, равновесный со стекающей жидкостью и связанный со встречным жидкостным потоком со второй ТСР состава ${{x}_{{i,2}}}$ уравнением рабочей линии укрепляющей части колонны. После тарелки питания встречные потоки связаны уравнением рабочей линии исчерпывающей части колонны. Жидкость движется вниз по колонне в количестве L, кмоль/ч, и обогащается труднолетучим компонентом (тяжелой водой D2O). Пары в количестве G, кмоль/ч, поднимаются вверх по колонне, обогащаясь легколетучим компонентом H2O. С верхней N-й тарелки паровой поток состава $y_{{i,N}}^{*}$ поступает в конденсатор, где конденсируется. Часть конденсата отводится в виде верхнего продукта – дистиллята в количестве D, кмоль/ч, состава ${{x}_{{i,d}}}$. Другая часть подается на верхнюю тарелку в виде жидкостного орошения – флегмы. Флегмовое число R = L/D, давление в нижней части колонны составляет ${{P}_{b}}$, кПа, в верхней части – ${{P}_{d}}$, кПа.
Принятые допущения: мольные потоки пара и жидкости по высоте колонны постоянны L = = const, G = const, что допустимо при разделении легкой и тяжелой воды; профиль падения давлений по высоте колонны линейный; тепловой баланс не оказывает влияние на разделение.
При совместном решении уравнений общего и покомпонентного материального балансов известные выражения для рабочих линий колонны имеют вид:
для исчерпывающей части колонны
для укрепляющей части колонны
где ${{x}_{i}}$, ${{y}_{i}}$ – составы встречных потоков в любом сечении соответствующей части колонны, мол. доли; i – номер компонента; f = F/D.Фазовое равновесие при ректификации заключается в определении равновесных составов жидкой ${{x}_{i}}$ и паровой $y_{i}^{*}$ фаз при температуре кипения жидкой фазы t и заданном внешнем давлении P.
Равновесные мольные концентрации i-го компонента в жидкой ${{x}_{i}}$ и паровой ${{y}_{i}}$ фазах, покидающих ТСР, связаны уравнением равновесия:
где ${{K}_{i}}$ – константа фазового равновесия i-го компонента.Для неидеальной смеси ${{K}_{i}}$ вычисляют на основе данных по внешнему давлению P, упругости паров чистого компонента $P_{i}^{^\circ }$ и зависимостей коэффициента активности компонента ${{\gamma }_{{i~}}}$ от температуры t, давления P и концентраций компонентов в жидкой фазе ${{x}_{i}}...{{x}_{n}}$, где n – число компонентов:
При разделении легкой и тяжелой воды используют понятие коэффициента разделения α, под которым понимают отношение относительных концентраций D2O в жидкой и паровой фазах при их равновесии:
(5)
$\alpha = \frac{{\frac{{{{x}_{{{{{\text{D}}}_{2}}{\text{O}}}}}}}{{1 - {{x}_{{{{{\text{D}}}_{2}}{\text{O}}}}}}}}}{{\frac{{{{y}_{{{{{\text{D}}}_{2}}{\text{O}}}}}}}{{1 - {{y}_{{{{{\text{D}}}_{2}}{\text{O}}}}}}}}},$Вычисление коэффициента разделения α проводят по уравнению Г.К. Юри
(6)
$\alpha = \sqrt {\frac{{P_{{{{{\text{H}}}_{2}}{\text{O}}}}^{^\circ }}}{{P_{{{{{\text{D}}}_{2}}{\text{O}}}}^{^\circ }}}~} ,$Путем совместного решения уравнений (3)–(6) находим зависимость между коэффициентами активности компонентов D2O и H2O:
(7)
${{\gamma }_{{{{{\text{D}}}_{2}}{\text{O}}}}} = \alpha {{\gamma }_{{{{{\text{H}}}_{2}}{\text{O}}}}}.{\text{\;}}$Поскольку сумма мольных долей компонентов для каждой фазы равна 1 (стехиометрическое соотношение), то суммируя правые части уравнения (3) для смеси H2O–D2O, получим
(8)
$\frac{{P_{{{{{\text{H}}}_{2}}{\text{O}}}}^{^\circ }}}{P}{{x}_{{{{{\text{H}}}_{2}}{\text{O}}}}}{{\gamma }_{{{{{\text{H}}}_{2}}{\text{O}}}}}{\text{\;}} + {\text{\;}}\frac{{P_{{{{{\text{D}}}_{2}}{\text{O}}}}^{^\circ }}}{P}{{x}_{{{{{\text{D}}}_{2}}{\text{O}}}}}{{\gamma }_{{{{{\text{D}}}_{2}}{\text{O}}}}}{\text{\;}} = {\text{\;}}1.$(9)
${{\gamma }_{{{{{\text{H}}}_{2}}{\text{O}}}}} = \frac{1}{{\frac{{P_{{{{{\text{H}}}_{2}}{\text{O}}}}^{^\circ }}}{P}{{x}_{{{{{\text{H}}}_{2}}{\text{O}}}}} + \alpha \frac{{P_{{{{{\text{D}}}_{2}}{\text{O}}}}^{^\circ }}}{P}{{x}_{{{{{\text{D}}}_{2}}{\text{O}}}}}}},$(10)
${{\gamma }_{{{{{\text{D}}}_{2}}{\text{O}}}}} = \frac{1}{{\frac{1}{\alpha }\frac{{P_{{{{{\text{H}}}_{2}}{\text{O}}}}^{^\circ }}}{P}{{x}_{{{{{\text{H}}}_{2}}{\text{O}}}}} + \frac{{P_{{{{{\text{D}}}_{2}}{\text{O}}}}^{^\circ }}}{P}{{x}_{{{{{\text{D}}}_{2}}{\text{O}}}}}}}.$Для расчета упругости паров $P_{i}^{^\circ }$, кПа, чистых компонентов воспользуемся уравнением Антуана
(11)
$P_{i}^{^\circ } = \exp \left( {{{a}_{i}} + \frac{{{{b}_{i}}}}{{T + {{c}_{i}}}} + {{d}_{i}}\ln T + {{e}_{i}}{{T}^{{{{f}_{i}}}}}} \right),$Значения констант уравнения Антуана для смеси H2O–D2O приведены в табл. 1, которые внесены в библиотеку данных среды программирования сложных химико-технологических систем Hysys, разработанной фирмами США и Канады.
Таблица 1.
Константы уравнения Антуана для смеси H2O–D2O
| Компо-нент | a | –b | c | –d | e × 106 | f |
|---|---|---|---|---|---|---|
| H2O | 65.9278 | 7227.53 | 0 | 7.17695 | 4.03130 | 2 |
| D2O | 73.0861 | 7667.97 | 0 | 8.20681 | 4.52488 | 2 |
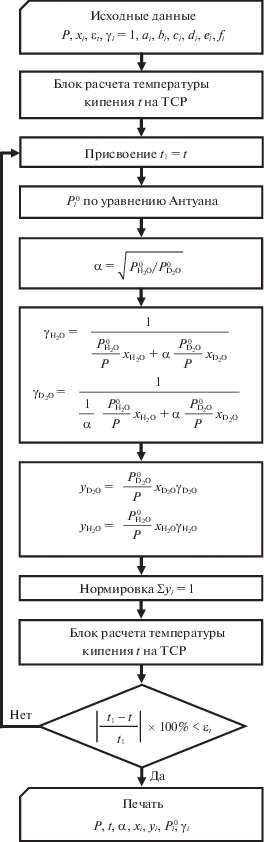
Блок-схема алгоритма расчета колонны приведена на рис. 2. При расчете колонны реализован аналитический метод “от ступени к ступени”, который графически изображается на диаграмме x–y при P = const путем построения вертикальных и горизонтальных отрезков между линией равновесия и рабочими линиями11. Данный метод применяется для расчета как тарельчатых, так и насадочных колонн. При этом в насадочных колоннах под теоретической ступенью разделения понимают высоту насадки, эквивалентной по разделяющему действию одной теоретической ступени (ВЭТС).
На каждой ТСР при движении снизу вверх по колонне проводится расчет фазового равновесия (рис. 3), в основе которого лежит расчет температуры кипения на ТСР (рис. 4). Суть расчета заключается в задании начального приближения по температуре и уточнении состава пара при заданной температуре итерационным методом [12]. Итерации обозначены параметром z (рис. 2). Итерации продолжаются до тех пор, пока не будет выполняться с заданной точностью соотношение
Состав пара ${{y}_{i}}$ вычисляют по уравнению (3), а коэффициенты активности ${{\gamma }_{i}}$ – по известному выражению в виде зависимости от температуры, давления и состава смеси, либо по эмпирическому уравнению. Отклонение суммы мольного состава пара от температуры используется в качестве фактора для корректировки температуры.В предложенном методе расчета (рис. 2–4) коэффициенты активности компонентов H2O и D2O вычисляются по уравнениям (9) и (10). Расчет температуры кипения t смеси H2O–D2O проводится для заданного внешнего давления P = = const и постоянных коэффициентов активностей ${{\gamma }_{i}} = {\text{const}}$, которые итерационно определяются в блоке расчета равновесия (рис. 3). Отличительной особенностью блока расчета равновесия является вычисление на первой итерации температуры кипения смеси при коэффициентах активности компонентов H2O и D2O, равных 1, т.е. ${{\gamma }_{i}} = 1$.
Исходные данные при расчете колонны (рис. 2): расходы питания F и дистиллята D, кмоль/ч; флегмовое число R, составы питания ${{x}_{{i,f}}}$ и кубового остатка ${{x}_{{i,b}}}$, мол. доли; давление внизу ${{P}_{b}}$ и вверху ${{P}_{d}}$ колонны, кПа, и число ТСР. В результате расчета определяется состав дистиллята ${{x}_{{i,d}}}$, мол. доли.
Исходные данные при расчете фазового равновесия на ТСР: состав жидкости ${{x}_{i}}$, мол. доли; давление P, кПа; точность расчета температуры кипения ${{\varepsilon }_{t}}$, °С, и константы Антуана ${{a}_{i}}$, $~{{b}_{i}}$, $~{{c}_{i}}$, $~{{d}_{i}}$, $~{{e}_{i}}$, ${{f}_{i}}$. В результате расчета определяются температура кипения t, °С; состав равновесной паровой фазы $y_{i}^{*}$, мол. доли; коэффициенты активности компонентов ${{\gamma }_{i}}$, упругость паров чистых компонентов $P_{i}^{^\circ }$, кПа, и коэффициент разделения α.
Исходные данные при расчете температуры кипения: давление P, кПа; состав жидкости ${{x}_{i}}$, мол. доли; коэффициенты активности компонентов ${{\gamma }_{i}}$; константы Антуана ${{a}_{i}}$, $~{{b}_{i}}$, $~{{c}_{i}}$, $~{{d}_{i}}$, $~{{e}_{i}}$, ${{f}_{i}}$; начальное приближение по температуре ${{t}_{0}}$, °С; шаг по температуре ${{h}_{{t~}}}$, °С; точность расчета при уменьшении шага ${{\varepsilon }_{h}}$, °С. Использован метод деления отрезка пополам. В результате расчета определяются температура кипения t, °С, и состав паровой фазы ${{y}_{i}}$, мол. доли.
Разработанный метод расчета разделения легкой и тяжелой воды позволяет рассчитать по ТСР по высоте колонны профиль изменения состава паровой ${{y}_{{i,j}}}$ и жидкой фаз ${{x}_{{i,j}}}$ (i – номер компонента, j – номер ТСР), давлений ${{P}_{j}}$, температур ${{t}_{j}}$, коэффициентов разделения ${{\alpha }_{j}}$, упругостей паров чистых компонентов $P_{{i,j}}^{^\circ }$, коэффициентов активности компонентов ${{\gamma }_{{i,j}}}$.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Рассмотрим применение разработанного метода для определения числа ТСР насадочной колонны, установленной на Производственном объединении “Маяк” (Россия) последней в каскаде из пяти ректификационных колонн, предназначенных для депротизации тяжеловодного замедлителя. Режим работы насадочной колонны экспериментально исследован авторами [1] (табл. 2).
Таблица 2.
Режим работы насадочной колонны [1]
| Флегмовое число R | 112.5 |
| Поток жидкости по колонне L, кмоль/ч | 0.75 |
| Концентрация D2O в жидкости, стекающей с нижней тарелки ${{x}_{{b({{{\text{D}}}_{2}}{\text{O}})}}}$, ат. % | 8.89 |
| Концентрация D2O в жидкости, стекающей с верхней тарелки ${{x}_{{N({{{\text{D}}}_{2}}{\text{O}})}}}$, ат. % | <0.1 |
| Давление в нижней части колонны ${{P}_{b}}$, кПа | 55 |
| Давление в верхней части колонны ${{P}_{d}}$, кПа | 30 |
| Число теоретических ступеней разделения | 170 |
Паровое питание состава ${{y}_{{i,f}}}$, ат. %, подается в нижнюю часть колонны, содержащей N = 170 теоретических ступеней разделения (ТСР) (рис. 5). С первой ТСР стекает жидкостной поток состава ${{x}_{{i,b}}}$, ат. %. Счет ТСР принят снизу вверх. Первую ТСР покидает паровой поток состава $y_{{i,1}}^{*}$, равновесный со стекающей жидкостью и связанный со встречным жидкостным потоком со второй ТСР состава ${{x}_{{i,2}}}$ уравнением рабочей линии. Первый нижний индекс (i) обозначает номер компонента, второй нижний индекс – номер ТСР. Основным компонентом принят D2O, по отношению к нему колонна работает в режиме исперпывания и называется исчерпывающей. С верхней N-й ТСР паровой поток состава $y_{{i,N}}^{*}$, ат. %, поступает в конденсатор, где конденсируется. Часть конденсата отводится в виде верхнего продукта – дистиллята ${{x}_{{i,d}}}$, ат. %. Другая часть подается на верхнюю тарелку в виде жидкостного орошения – флегмы. Флегмовое число равно R = 112.5. Давление в нижней части колонны составляет ${{P}_{b}} = 55$ кПа, в врехней части – ${{P}_{d}} = 30$ кПа.
Требуется определить при заданном числе теоретических ступеней разлеления N концентрацию тяжелой воды D2O в жидкостном потоке, стекающем с N-й ТСР.
При расчете ректификационной колонны приняты следующие допущения: мольные потоки пара и жидкости по высоте колонны постоянны L = const, G = const; состав кубового остатка равен составу жидкостного потока ${{x}_{{i,b}}}$, стекающего с первой ТСР; профиль падения давлений по высоте колонны линейный; тепловой баланс не оказывает влияния на разделение смеси легкой и тяжелой воды; укрепляющая часть колонны, расположенная ниже тарелки питания, настолько мала, что ею можно пренебречь; расчет методом “от ступени к ступени” проведен по уравнению рабочей линии исчерпывающей части.
Графическое представление метода “от ступени к ступени” согласно схеме материальных потоков рис. 5 приведено на диаграмме x–y (рис. 6). Отметим, что построение числа ТСР является всего лишь образом, показывающим определение равновесных и рабочих концентраций паровой и жидкостной фаз при движении снизу вверх по колонне при постоянном внешнем давлении P = = const. В поставленной задаче давление изменяется по колонне от ${{P}_{b}}$ до ${{P}_{d}}$. Паровой и жидкостной потоки, покидающие ТСР, связаны уравнением равновесия, встречные потоки – уравнением рабочей линии исчерпывающей части колонны (покомпонентный материальный баланс). Точка “a” лежит на диагонали диаграммы x–y и является точкой, из которой выходит рабочая линия исчерпывающей части колонны. Состав дистиллята ${{x}_{{i,d}}}$ равен составу паровой фазы $y_{{i,N}}^{*}$, выходящей с N-й ТСР. В конденсаторе протекает процесс полной конденсации.
На рис. 6 приведен графический процесс построения ТСР по тяжелой воде D2O. Нижним индексом j обозначен номер ТСР. По известному составу жидкой фазы ${{x}_{j}}$ при заданном давлении ${{P}_{j}}$ определяется состав равновесной паровой фазы $y_{j}^{*}$. По составу паровой фазы $y_{j}^{*}$ по уравнению рабочей линии исчерпывающей части колонны определяется состав жидкой фазы ${{x}_{{j + 1}}}$, стекающей с вышележащей тарелки j + 1. Итерации “от ступени к ступени” при линейно изменяющемся давлении ${{P}_{j}}$ продолжаются до тех пор, пока концентрация тяжелой воды не станет меньше ${{x}_{d}}$.
Разработанный метод расчета реализован на языке программирования Pascal. Расчетным путем по известному составу жидкой фазы ${{x}_{{i,j}}}$ при заданном давлении ${{P}_{j}}$ определены: температура кипения ${{t}_{j}}$, упругости паров чистых компонентов $P_{{{{{\text{H}}}_{2}}{\text{O,}}\,j}}^{^\circ }$, $P_{{{{{\text{D}}}_{2}}{\text{O,}}\,j}}^{^\circ }$, коэффициент разделения ${{\alpha }_{j}}$ и состав равновесной паровой фазы $y_{{i,j}}^{*}$ на каждой ТСР. Результаты расчетов приведены на рис. 7–10. На рис. 7 показано, что в нижней части колонны с первой по 85-ю ТСР происходит значительное падение концентрации D2O от 8.89 до 1.14 мол. % Концентрация дистиллята по D2O составила 0.076 мол. %, т.е. меньше 0.1 мол. %. Полученное значение соответствует экспериментально измеренному, приведенному в табл. 2.
Рис. 9.
Зависимости коэффициентов активности легкой (1) и тяжелой (2) воды от концентрации D2O в жидкой фазе (С).

На рис. 8 показан рост коэффициента разделения α по высоте колонны с 1.0334 в нижней части до 1.0411 в верхней части. Это соответствует общим представлениям, согласно которым, чем меньше температура кипения смеси, тем больше коэффициент разделения. В свою очередь температура кипения смеси зависит от внешнего давления. Приведенная расчетная зависимость α от ТСР (высоты колонны) нелинейна.
Зависимость коэффициента активности ${{\gamma }_{{{{{\text{D}}}_{2}}{\text{O}}}}}$ от концентрации D2O на теоретических ступенях колонны – практически прямая линия, значения ${{\gamma }_{{{{{\text{D}}}_{2}}{\text{O}}}}}$ незначительно отклоняются от единицы (рис. 9). При малых концентрациях D2O в жидкой фазе коэффициент активности ${{\gamma }_{{{{{\text{D}}}_{2}}{\text{O}}}}}$ изменяется по логарифмической зависимости. Полученные расчетные значения коэффициентов активности компонентов не равны 1 и характеризуют смесь H2O–D2O как неидеальную.
Изменение давления на ступенях колонны при моделировании принято линейным в предположении, что на каждой теоретической ступени перепад давлений одинаков. С учетом принятого допущения полученная расчетная зависимость изменения давления по высоте колонны линейна, а зависимость изменения температуры кипения по высоте колонны – нелинейна (рис. 10). Это объясняет нелинейность α, изображенную на рис. 8.
По разработанному методу был выполнен расчет колонны при допущении равенства единице коэффициентов активности компонентов Н2О и D2O, т.е. ${{\gamma }_{i}} = 1$. Для получения состава дистиллята, приведенного на рис. 7, потребовалось ∼75 ТСР, что более, чем в 2 раза меньше 170 ТСР, соответствующих режиму работы колонны (табл. 2) [1]. Несмотря на то, что коэффициенты активности компонентов Н2О и D2O близки к 1, принимать их равными 1 не рекомендуется. Это приводит к существенно заниженному значению числа ТСР, от которого зависит высота колонны и эффективность разделения.
ЗАКЛЮЧЕНИЕ
Разработанный метод расчета адекватно описывает литературные экспериментальные данные по депротизации тяжеловодного замедлителя. Метод позволяет рассчитать фазовое равновесие на ТСР в зависимости от давления и состава жидкой фазы смеси, а также учитывает изменение давления по высоте колонны. В результате расчетов определяются на ТСР температура кипения ${{t}_{j}}$, упругости паров чистых компонентов $P_{{{{{\text{H}}}_{2}}{\text{O,}}\,j}}^{^\circ }$, $P_{{{{{\text{D}}}_{2}}{\text{O,}}\,j}}^{^\circ }$, коэффициент разделения ${{\alpha }_{j}}$ и состав равновесной паровой фазы $y_{{i,j}}^{*}$. Метод применен для расчета насадочной колонны, установленной последней в каскаде из пяти ректификационных колонн, предназначенных для депротизации тяжеловодного замедлителя. Расчетная концентрация D2O в дистилляте соответствует экспериментально измеренной при заданном числе ТСР. Полученные расчетные значения коэффициентов активности компонентов характеризуют смесь Н2O–D2O как неидеальную. Метод рекомендуется применять для уточнения числа ТСР, полученного при моделировании колонных ректификационных аппаратов в интегрированных средах моделирования сложных химико-технологических систем, содержащих прямые и рецикловые материальные потоки.
Список литературы
Магометбеков Э.П., Белкин Д.Ю., Растунова И.Л. и др. // Теор. основы хим. технологии, 2017. Т. 51. № 2. С. 131.
Kushner D.J., Baker A. and Dunstall T.G. // Can. J. Physiol. Pharmacol. 1999. V. 77. P. 79.
Wendell Costa Bila, Reysla Maria da Silveira Marian et al. // Isotopes in Environmental and Health Studies, 2017. P. 1–17. https://doi.org/10.1080/10256016.2017.1281806
Zlatska A., Gordiienko I., Vasyliev R. et al. // The Scientific World Journal. V. 2018, Article ID 5454367, 10 pages https://doi.org/10.1155/2018/5454367
Михайлова Р.И., Беляева Н.Н., Алексеева А.В. и др. // Международный журнал прикладных и фундаментальных исследований, 2018. № 11. С. 75.
Ворожцова С.В., Абросимова А.Н., Куликова Е.И. и др. // Радиационная биология. Радиоэкология. 2014. Т. 54. № 1. С. 21.
Гладкова М.Г., Касьянов Г.И., Шипулин В.И., Христюк А.В. // Вестн. Северо-Кавказского федерального ун-та, 2017. № 4 (61). С. 12.
Basov A., Fedulova L., Baryshev M., Dzhimak S. // Nutrients. 2019. V. 11 (8). P. 1903; https://doi.org/10.3390/nu11081903
Dingwall S., Mills C.E., Phan N. et al. // Dose Response. 2011. (Feb 22) V. 9 (1). P. 6. https://doi.org/10.2203/dose-response.10-048.Boreham
Малков П.М. // Атомная энергия. 1959. Т. 7. Вып. 2. С. 101.
Bhattacharyya R., Bhanja K. // Chem. Technol. Ind. J. 2018. V. 13 (2). P. 125.
Праусниц Дж. Машинный расчет парожидкостного равновесия многокомпонентных смесей. М.: Химия, 1971. 215 с.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии