Журнал физической химии, 2021, T. 95, № 6, стр. 867-874
Фазовая диаграмма системы этиленкарбонат–сульфолан
О. Г. Резницких a, *, А. С. Истомина a, С. С. Борисевич b, c, Е. Ю. Евщик a, b, Е. А. Сангинов a, b, О. В. Бушкова a, b, Ю. А. Добровольский b, d
a Российская академия наук, Уральское отделение, Институт химии твердого тела
Екатеринбург, Россия
b Российская академия наук, Институт проблем химической физики
Черноголовка, Россия
c Российская академия наук, Уфимский федеральный исследовательский центр,
Уфимский институт химии
Уфа, Россия
d Южно-Российский государственный политехнический университет (НПИ) имени М.И. Платова
Новочеркасск, Россия
* E-mail: olga_rezn@mail.ru
Поступила в редакцию 03.07.2020
После доработки 30.09.2020
Принята к публикации 02.10.2020
Аннотация
Методом дифференциальной сканирующей калориметрии исследованы фазовые равновесия в бинарной системе этиленкарбонат (EC)–сульфолан (SL) в интервале температур от –150 до +50°С и построена ее фазовая диаграмма. Отмечено, что она относится к простому эвтектическому типу с точкой эвтектики 70 мас. % сульфолана, ‒16°С. Отмечена склонность растворов EC–SL в диапазоне составов от 50 до 75 мас. % SL к переохлаждению; метастабильная жидкая фаза характеризуется температурой стеклования Tg = –105°С. Заторможенность достижения равновесного состояния в средней области составов можно объяснить наличием сильных диполь-дипольных взаимодействий между разнородными молекулами EC и SL и увеличением их относительного вклада с понижением температуры. Сделан вывод, что квантово-химические расчеты энергии Гиббса образования изолированных димеров разного сорта, выполненные методом M052X, основанным на теории функционала плотности, подтверждают это предположение.
Диполярные апротонные растворители широко используются как основа для жидких неводных и гелевых электролитов в литиевых химических источниках тока и пост-литиевых электрохимических системах [1–3]. Кроме того, они применяются как пластификаторы для полиэлектролитов – пленочных полимерных материалов с униполярной катионной проводимостью, перспективных для использования в металл-ионных аккумуляторах нового поколения. Как правило, индивидуальные растворители не позволяют получить электролиты с желаемым набором электрохимических и физико-химических характеристик и широким диапазоном рабочих температур, поэтому обычно используют смеси двух и более компонентов [1–3].
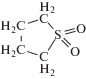
В электролитах для литий-ионных аккумуляторов (ЛИА) массового производства в качестве растворителей преимущественно используется семейство эфиров угольной кислоты (карбонаты). Ключевым компонентом смешанного растворителя является этиленкарбонат (EC) с циклическим строением, обеспечивающий стабильность процессов внедрения-экстракции лития в графитовый электрод за счет эффективной пассивации его поверхности продуктом своего электровосстановления – этилендикарбонатом лития (LEDC) [1]. Помимо EC, в состав смешанного растворителя входит один или несколько диалкилкарбонатов линейного строения – диметилкарбонат (DMC), диэтилкарбонат (DEC) или этилметилкарбонат (EMC); они играют вспомогательную роль, формируя нужные физико-химические характеристики электролитного раствора, так как EC при комнатной температуре находится в кристаллическом состоянии (табл. 1) [1, 2].
Таблица 1.
Физико-химические характеристики компонентов
| Параметр | EC | SL | Литера-тура |
|---|---|---|---|
 |
 |
||
| M | 88.06 | 120.16 | |
| Tпл, °C | 36.4 | 28.5 | [3] |
| Tкип, °C | 238 | 285 | [5] |
| TФП, °C | – | 15.5 | [6] |
| μ, Д | 4.93 | 4.81 | [3] |
| ρ, г/см3 | 1.32 (40°C) | 1.26 (30°C) | [7] |
| η, мПа с | 1.50 (40°C) | 10.07 (30°C) | [10] |
| ε | 90 (40°C) | 60 (20°C); 43.3 (30°C) | [5] |
| DN | 16.4 | 14.8 | [3] |
| AN | ~19.1* | 19.2 | [3, 9] |
* Оценочная величина [9].
Серьезные проблемы с безопасностью, вызванные необходимостью разбавлять этиленкарбонат высоколетучими и горючими линейными карбонатами [4], заставляют обратить внимание на поиск новых вариантов сорастворителей среди малолетучих высококипящих жидкостей. В этой связи, особый интерес представляет сульфолан (SL), отличающийся высокой растворяющей способностью по отношению к солям металлов в сочетании с высокой устойчивостью к окислению на аноде и повышенной огнестойкостью [2, 8]. Однако подобно EC, сульфолан при 25°С является твердым веществом (табл. 1) и нуждается в разбавлении сорастворителем для получения жидкой фазы.
Пределы гомогенно-жидкого состояния, ограничивающие рабочий интервал температур электролита, определяются фазовыми равновесиями в системе. В этой связи, целью настоящей работы было построение фазовой диаграммы бинарной системы сульфолан–этиленкарбонат. (Насколько можно судить, в литературе она отсутствует; удалось обнаружить лишь фрагментарные сведения [10, 11]). Для исследования фазовых равновесий использовали метод дифференциальной сканирующей калориметрии (ДСК). Интерпретацию полученных результатов выполняли с учетом данных квантово-химических расчетов межмолекулярных взаимодействий EC–EC, SL–SL и EC–SL.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Все операции по приготовлению образцов для исследования, а также хранение исходных веществ и готовых смесей проводили в перчаточном боксе “MBraun Unilab Pro” в атмосфере сухого аргона (содержание воды <0.1 ppm). Для получения бинарных смесей использовали безводные этиленкарбонат (99%, “Sigma Aldrich”) и сульфолан (99%, “Sigma Aldrich”). Остаточное содержание воды по данным ИК-спектроскопии не превышало 20 ppm (ИК-спектрометр с фурье-преобразованием Bruker Vertex 70). Приготовление смесей EC–SL проводили весовым методом; масса готовых растворов составляла от 10 до 20 г, точность взвешивания компонентов 0.0001 г. Поскольку температуры плавления этиленкарбоната и сульфолана выше комнатной (табл. 1), растворители предварительно нагревали до их температуры плавления. После 30 мин перемешивания на магнитной мешалке готовые растворы перед исследованиями выдерживали не менее 24 ч при комнатной температуре.
Термическое поведение бинарных смесей этиленкарбонат – сульфолан исследовали методом дифференциальной сканирующей калориметрии с использованием прибора DSC 214 Polyma (NETZSCH, Германия). Перед измерениями прибор калибровали по температуре и чувствительности, используя комплект стандартных образцов (С10H12, In, Sn, Bi, Zn, CsCl, чистота 99.999%) согласно стандарту ASTM E 967. Систематическая погрешность определения температуры составляла <0.8°С, относительная погрешность измерения удельной теплоты <3%. Навеску готовой смеси массой от 16 до 40 мг помещали в одноразовый тигель Concavus, обеспечивающий высокую воспроизводимость измерений, и герметично запечатывали холодной сваркой. Измерительная камера прибора продувалась сухим азотом со скоростью 40 мл/мин. Измерения проводили в интервале температур от –150 до +50°С по следующей температурной программе: нагрев до 50°С и изотермическая выдержка в течение 15 мин для дополнительной гомогенизации образца, охлаждение до –150°С со скоростью 10°С/мин, изотермическая выдержка 3 мин, затем нагрев до +50°С со скоростью 10°С/мин. Для проверки воспроизводимости результатов сегменты охлаждения и нагрева повторяли дважды; кроме того, для отдельных образцов измерения проводили в двух параллелях. Температуры фазовых переходов определяли из кривых нагрева, принимая (в соответствии с общепринятой практикой [12]) за температуру солидуса начало первого эндотермического эффекта, а за температуру ликвидуса – максимум второго эндотермического эффекта. Дополнительную коррекцию значений температуры ликвидуса выполняли с использованием стандартного образца галлия с температурой плавления 29.8°С (ГСО 2312-82) [13, 14]. Температуру перехода сульфолана из кристаллической в мезоморфную фазу, а также температуру плавления мезоморфной фазы SL определяли по началу соответствующих эндотермических эффектов. За температуру стеклования Tg принимали температуру середины эффекта.
МЕТОДИКА РАСЧЕТОВ
Все квантово-химические расчеты проводили с помощью программного продукта GAUSSIAN09-С01 [15]. Стартовую геометрию димерных комплексов EC–EC, SL–SL и EC–SL выбирали из соображений симметрии с учетом полярности атомов. Геометрические параметры предполагаемых структур оптимизировали с последующим решением колебательной задачи. Применяли широко используемый метод расчета M052X [16], основанный на теории функционала плотности, с дисперсионной поправкой [17] и базисным набором TZVP [18]. Отсутствие мнимых частот в матрице вторых производных волновых функций свидетельствует о достижении минимума на потенциальной энергетической поверхности системы. Расчеты проводили в приближении газовой фазы для изолированных димеров при температурах 25 и –70°С и атмосферном давлении. Энергию Гиббса (ΔG) образования димерных комплексов молекул растворителей оценивали как разницу в суммах свободных энергий комплекса и исходных молекул растворителя, исходя из второго следствия закона Гесса.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
На рис. 1 и в табл. 2 приведены результаты измерений сигнала ДСК в режиме нагрева для исследуемых образцов бинарной системы этиленкарбонат–сульфолан в интервале от –150 до +50°С. Фазовая диаграмма системы EC–SL, построенная на основании полученных данных, приведена на рис. 2. Можно видеть, что она имеет простой эвтектический вид, что свидетельствует о неограниченной взаимной растворимости компонентов в жидкой фазе и полном отсутствии взаимной растворимости в твердом состоянии. Эвтектическая температура близка к –16°С, а эвтектический состав соответствует 70 мас. % сульфолана. Положение эвтектики подтверждает приведенный там же треугольник Таммана, построенный с использованием интегральных величин эндотермических эффектов, характеризующих плавление эвтектической смеси [12].
Рис. 1.
ДСК-кривые нагрева бинарных смесей этиленкарбонат–сульфолан (содержание SL в мас. % указано на рисунке). На вставке к рисунку приведен увеличенный фрагмент области стеклования.

Таблица 2.
Значения температуры эвтектики (Tэвт), температуры ликвидуса (Tликв) и энтальпии плавления эвтектики (ΔНэвт) для системы EC–SL
| Содержание SL | Tэвт, °C | Tликв, °C | –ΔНэвт, Дж/г | |
|---|---|---|---|---|
| мас. % | мол. % | |||
| 0 | 0 | 36.4 | 0 | |
| 10 | 7.5 | –16.3 | 33.5 | 11.3 |
| 20 | 15.5 | –14.6 | 27.5 | 24.8 |
| 30 | 23.9 | –15.5 | 22.8 | 34.7 |
| 40 | 32.8 | –15.6 | 15.8 | 44.5 |
| 50 | 42.3 | –15.4 | 5.9 | 66.3 |
| 55 | 47.2 | –15.7 | 0.5 | 67.3 |
| 60 | 52.4 | –15.3 | –2.4 | 80 |
| 65 | 57.6 | –14.9 | –9.5 | 82.2 |
| 70 | 63.1 | –15.7 | –15.7 | 90.4 |
| 75 | 68.7 | –15.8 | –9.5 | 81.7 |
| 80 | 74.6 | –15.2 | –3.1 | 50 |
| 90 | 86.8 | –15.6 | 8.1 | 29.7 |
| 95 | 93.3 | –17.2 | 13.15 | 13.6 |
| 96.7 | 95.6 | –16.9 | 13.8* | 2.1 |
| 18.7 | ||||
| 98.4 | 97.8 | –18.8 | 14.3* | 5.6 |
| 21.3 | ||||
| 100 | 100 | – | 15.1* | 0 |
| 26.4 | ||||
Как видно из рис. 1, на кривой нагрева индивидуального этиленкарбоната присутствует единственный эндотермический эффект при 36.4°С, отвечающий его плавлению. На кривой нагрева индивидуального сульфолана, помимо плавления при 26.4°С, наблюдается значительно более интенсивный эндотермический эффект при 15.1°С, обусловленный фазовым переходом из кристаллической фазы в мезоморфную (пластический кристалл), характеризующуюся свободным вращением молекул SL [6]. Правая ветвь ликвидуса на рис. 2 отражает этот фазовый переход и имеет вид, типичный для бинарных систем сульфолан–диполярный апротонный растворитель (например, [6, 19, 20]).
В интервале составов менее 50 и более 75 мас. % сульфолана на кривых нагрева наблюдается только два эндотермических эффекта, отвечающих плавлению эвтектической смеси и одного из компонентов. Кривые охлаждения этих образцов содержат экзотермические эффекты, отвечающие полной кристаллизации компонентов бинарной смеси (температуры кристаллизации в ходе охлаждения приведены в табл. 3). В этой области составов кривые охлаждения и нагрева хорошо воспроизводятся при повторных измерениях и не изменяются при варьировании условий измерений (охлаждение до –150 и до –90°С). Это свидетельствует о равновесном характере всех фазовых переходов, зафиксированных в областях составов 0–40 и 80–100 мас. % SL.
Таблица 3.
Характеристики тепловых эффектов на кривых охлаждения от +50 до –150°С
| Содержание SL | Tкрист, *°C | Tg, °C | ||
|---|---|---|---|---|
| мас. % | мол. % | |||
| 0 | 0 | 7 | – | |
| 10 | 7.5 | 4 | –34 | – |
| 20 | 15.5 | –17 | –36 | – |
| 30 | 23.9 | –25 | –34 | – |
| 40 | 32.8 | – | –52 | – |
| 50 | 42.3 | – | – | –109.6 |
| 55 | 47.2 | – | – | –110.5 |
| 60 | 52.4 | – | – | –111.8 |
| 65 | 57.6 | – | – | –113.4 |
| 70 | 63.1 | – | –66 | –112.7 |
| 75 | 68.7 | – | –67 | –114.4 |
| 80 | 74.6 | – | –58 | – |
| 90 | 86.8 | –34 | –68 | – |
| 95 | 93.3 | –24 | –65 | – |
| 100 | 100 | 21 | –15** | – |
Совершенно иной тип термического поведения наблюдался в средней области составов от 50 до 75 мас. % SL. На кривых охлаждения этих образцов практически отсутствовали тепловые эффекты кристаллизации (за исключением едва заметных пиков у составов 70 и 75 мас. % SL), зато появились эффекты стеклования (табл. 3), что свидетельствует о переохлаждении жидкой фазы в данном интервале составов. Поэтому кристаллизация компонентов происходит уже в процессе нагрева после расстеклования растворов (Tg ~ ~ ‒105°С), и на кривых ДСК в интервале от ~–80 до ~–45°С появляются соответствующие экзотермические эффекты, предшествующие эндотермическим эффектам плавления (рис. 1). На рис. 3 суммированы тепловые эффекты, относящиеся к фазовым и релаксационным переходам в метастабильной области системы в процессе нагрева. Измерения кривых ДСК в более узком интервале отрицательных температур (от –90 до +50°С), не охватывающем стеклование, не изменили характера кривых охлаждения этих образцов, однако повлияли на форму кривых нагрева ниже температуры солидуса: двойные пики экзотермических эффектов стали неразделяющимися и несколько сдвинулись по шкале температуры (рис. 3). Повторные измерения в тех же режимах тоже оказывали некоторое (хотя и небольшое) влияние на контур и положение экзотермических пиков. Указанные особенности поведения, явно имеющие кинетическое происхождение, наблюдалось только в интервале составов 50–60 мас. % SL (заштрихованная область на рис. 3), тогда как для образцов с 65–75 мас. % SL тепловые эффекты кристаллизации оставались почти неизменными (правая ветвь на рис. 3).
Рис. 3.
Тепловые эффекты на кривых нагрева, характеризующие фазовые и релаксационные переходы в метастабильной области системы EC–SL: 1 – температура стеклования; 2 – температура кристаллизации (измерения от –90°С); 3 – температура кристаллизации (измерения от –150°С).

Особенности термического поведения системы EC–SL в средней области составов однозначно указывают на переход в метастабильное состояние переохлажденного раствора. Причиной этого, по-видимому, является резкое возрастание вязкости с понижением температуры в области концентраций 50–75 мас. % SL, что препятствует достижению состояния истинного равновесия и кристаллизации компонентов. (При температурах вблизи комнатной вязкость в системе EC–SL ведет себя обычным образом – монотонно возрастает с ростом концентрации сульфолана [11]).
Несмотря на метастабильность системы EC–SL в средней области составов при пониженных температурах, тепловые эффекты плавления на кривых нагрева, используемые для определения температур солидуса и ликвидуса, хорошо воспроизводятся как при повторных измерениях в одних и тех же условиях, так и при варьировании нижней границы температурного интервала измерений (–150 и –90°С). Использование другого режима охлаждения, включающего в себя изотермическую выдержку в течение 30 мин в области температуры кристаллизации, индивидуальной для каждого образца (табл. 3), с последующим охлаждением до –90°С со скоростью 5°С/мин позволило избежать переохлаждения таких растворов и полностью завершить кристаллизацию в процессе охлаждения, т.е. предотвратить переход в метастабильное состояние переохлажденного раствора и получить затем кривые нагрева, отвечающие достижению истинного равновесия. В этих условиях кривые нагрева имели типичный вид с двумя эндотермическими эффектами (за исключением эвтектического состава с единственным эндотермическим эффектом). Важно отметить, что температуры солидуса и ликвидуса для всех изученных образцов (включая склонную к переходу в метастабильное состояние среднюю область концентраций) не зависели от нижней температурной границы или режима охлаждения, что подтверждает корректность полученных результатов.
Из рис. 3 видно, что переход в метастабильное состояние, предположительно обусловленный резким ростом вязкости растворов с понижением температуры, характерен для составов с мольным отношением компонентов, близким к 1 : 1. Это позволяет предположить, что причиной наблюдаемых отклонений могут быть особенности диполь-дипольных взаимодействий между разнородными молекулами этиленкарбоната и сульфолана. В этой связи, нами были выполнены квантовохимические расчеты структуры и устойчивости изолированных димерных ассоциатов, образованных одинаковыми (EC–EC и SL–SL) и разными (EC–SL) молекулами компонентов. При проведении расчетов рассматривали две возможных конфигурации димеров – циклическую, или антипараллельную (конфигурация 1) и линейную типа голова–хвост (конфигурация 2). Оптимизированные структуры линейных и циклических димеров приведены на рис. 4, а их энергетические характеристики суммированы в табл. 3. Интересной особенностью линейных димеров, образованных двумя молекулами сульфолана, является их T-образная конфигурация с разворотом плоскости кольца одной из молекул почти перпендикулярно плоскости кольца второй молекулы (рис. 4). Как оказалось, она наиболее энергетически выгодна, тогда как для гетеромолекулярного димерного комплекса EC–SL более вероятна циклическая (антипараллельная) конфигурация (табл. 4). Величины ΔG, рассчитанные для образования димеров при 25 и –70°С, со всей определенностью указывают на повышение вероятности ассоциации молекул растворителей с понижением температуры. Димеризация молекул этиленкарбоната, маловероятная при 25°С и возможная при –70°С, скорее всего, приведет к образованию ассоциатов с циклической структурой (табл. 4). Несмотря на оценочный характер выполненных квантово-химических расчетов, относящихся к взаимодействию двух молекул в газовой фазе, их результаты позволяют судить о высоком взаимном сродстве разнородных молекул этиленкарбоната и сульфолана, обусловленном, по-видимому, близостью химической структуры и физико-химических свойств этих растворителей (табл. 1).
Рис. 4.
Оптимизированные структуры димеров (EC)2 (слева), (SL)2 (в центре) и гетеромолекулярных ассоциатов (EC–SL) (справа). (Конфигурация 1 – циклический (антипараллельный) димер; конфигурация 2 – линейный димер).

Таблица 4.
Энергии Гиббса образования изолированных димерных ассоциатов из молекул растворителей
| № | Координация комплексов | ΔGобр, кДж/моль | |
|---|---|---|---|
| 25°С | –70°С | ||
| 1 | EC + EC ⇆ (EC)2 (конфигурация 1) | 2.5 | –11.2 |
| 2 | EC + EC ⇆ (EC)2 (конфигурация 2) | 4.5 | –4.0 |
| 3 | SL + SL ⇆ (SL)2 (конфигурация 1) | –2.2 | –18.3 |
| 4 | SL + SL ⇆ (SL)2 (конфигурация 2) | –5.7 | –20.9 |
| 5 | EC + SL ⇆ (EC–SL) (конфигурация 1) | –9.2 | –23.6 |
| 6 | EC + SL ⇆ (EC–SL) (конфигурация 2) | –0.2 | –9.3 |
Представляет интерес сравнить исследуемую бинарную систему EC–SL с широко используемыми на практике смешанными растворителями на основе этиленкарбоната, в которых вторым компонентом является диалкилкарбонат линейного строения (DMC, DEC или EMC [21, 22]), а также со смесями EC c циклическими пропиленкарбонатом (PC) [21] и γ-бутиролактоном (GBL) [23]. При использовании в качестве смешанного растворителя для неводных электролитов в первую очередь представляют интерес составы вблизи эвтектических, так как именно они дают возможность наиболее значительно понизить рабочую температуру. При этом для оптимизации физико-химических и транспортных свойств электролита желательно, чтобы содержание этиленкарбоната в смешанном растворителе было достаточно высоким. Однако среди диалкилкарбонатов только DMC определенно дает фазовую диаграмму простого эвтектического типа с температурой эвтектики –8.6°С и эвтектическим составом 29.2 моль % EC [22].
Для двух других систем EC–EMC и EC–DEC экспериментально определяется только одна ветвь ликвидуса, относящаяся к EC, а температура эвтектики близка к Tпл диалкилкарбоната [21, 22]; это говорит о максимальном смещении точки эвтектики от EC к сорастворителю. Как показано в [21, 24], такой характер фазовых диаграмм обусловлен плохой взаимной совместимостью компонентов, значительно различающихся не только по своей структуре, но и по температурам плавления. Очень похожи между собой фазовые диаграммы систем EC–PC [21, 24] и EC–GBL [23], где совместимость компонентов заметно выше, но разница в температурах плавления компонентов остается очень большой (–43°С у GBL и ‒53°С у PC против 36.4 у EC). Обе они относятся к простому эвтектическому типу. В изученной нами системе EC–SL с циклическим строением молекул обоих компонентов и близкими температурами плавления эвтектический состав оказался наиболее близким к эквимолярному (37 мол. % EC), а эвтектическая температура лежит на 52°С ниже, чем температура плавления индивидуального EC и на 44°С ниже, чем Tпл сульфолана. Учитывая, что добавление литиевой соли в оптимальной для электропроводности концентрации ~1 М [1], как правило, не меняет вида фазовой диаграммы бинарной системы, а лишь несколько снижает температуры фазовых переходов [22], можно рекомендовать смесь EC–SL в качестве основы для получения электролитных растворов с нижним пределом рабочих температур ~–20°С.
Таким образом, сульфолан оказался очень эффективным сорастворителем для этиленкарбоната. Добавление SL существенным образом расширяет интервал гомогенно-жидкого состояния этой бинарной системы на основе высококипящих растворителей, делая ее привлекательной для практического использования в жидких и полимерных электролитных системах для металл-ионных аккумуляторов.
Работа выполнена при поддержке Российского научного фонда (проект № 18-19-00014). Квантовохимические расчеты выполнены на кластерном суперкомпьютере УфИЦ УФИХ РАН.
Список литературы
Xu K. // Chem. Rev. 2014. V. 114. P. 11503. https://doi.org/10.1021/cr500003w
Ue M., Sasaki Y., Tanaka Y., Morita M. Nonaqueous Electrolytes with Advances in Solvents // In: T.R. Jow, K. Xu, O. Borodin, M. Ue (Eds). Electrolytes for Lithium and Lithium-Ion Batteries. New York: Springer Science+Business Media, 2014. P. 93. https://doi.org/10.1007/978-1-4939-0302-3_1.
Демахин А.Г., Овсянников В.М., Пономаренко С.М. Электролитные системы литиевых ХИТ. Саратов: Изд-во Сарат. ун-та, 1993. 220 с. Demakhin A.G., Ovsyannikov V.M., Ponomarenko S.M. Elekrolitnye sistemy dlya litievyh HIT. Saratov: Izd-vo Sarat. ун-тa, 1993. 220 p. (in Russian).
Eshetu G.G., Bertrand J.-P., Lecocq A. et al. // J. Power Sources. 2014. V. 269. P. 804. https://doi.org/10.1016/j.jpowsour.2014.07.065
Watanabe Y., Kinoshita S.-I., Wada S. et al. // J. Power Sources. 2008. V. 179. P. 770. https://doi.org/10.1016/j.jpowsour.2008.01.006
Jannelli L., Lopez A., Jalenti R., Silvestri L. // J. Chem. Eng. Data 1982. V. 27. P. 28.
Гордон А., Форд Р. Спутник химика. М.: Мир, 1976. 541 c. Gordon J., Ford R.A. The Chemist’s Companion: A Handbook of Practical Data, Techniques, and References. New York: Wiley, 1972.
Máca J., Vondrák J., Sedlaříková M. // ECS Trans. 2014. V. 48. № 1. P. 135. https://doi.org/10.1149/04801.0135ecst
Johnson P.H. The properties of ethylene carbonate and its use in electrochemical applications: A Literature Review // Lawrence Berkeley Lab., CA (USA), 1985. № LBL-19886. https://escholarship.org/uc/item/8cg2t9r3.
Maca J., Frk M., Sedlarikova M. // RE&PQJ. 2013. V. 1. № 11. P. 218. https://doi.org/10.24084/repqj11.261
Morita M., Goto M., Matsuda Y. // J. Appl. Electrochem. 1992. V. 22. P. 901.
Rycerz L. // J. Therm. Anal. Calorim. 2013. V. 113. P. 231. https://doi.org/10.1007/s10973-013-3097-0
Becket G., Quah S., Hill J. // J. Therm. Anal. Calorim. 1993. V. 40. № 2. P. 537. https://doi.org/10.1007/bf02546623
Hohne G.W.H., Hemminger W.F., Flammersheim H.J. Differential Scanning Calorimetry. Second Edition. Berlin: Springer, 2003. 298 p.
Frisch M.J., Trucks G.W., Schlegel H.B. et al. // Gaussian 09, Revision C.01, Gaussian Inc., Wallingford CT, 2010.
Zhao Y., Schultz N.E., Truhlar D.G. // J. Chem. Theory and Comput. 2006. V. 2. P. 364. https://doi.org/10.1021/ct0502763
Grimme S., Antony J., Ehrlich S., Krieg H. // J. Chem. Phys. 2010. V. 132. P. 154104. https://doi.org/10.1063/1.3382344
Schaefer A., Huber C., Ahlrichs R. // J. Chem. Phys. 1994. V. 100. P. 5829.https://doi.org/10.1063/1.467146
Jannelli L., Pansini M. // J. Chem. Eng. Data. 1985. V. 30. P. 428.
Jannelli L., Inglese A., Sacco A., Ciani P. // Zeitschrift für Naturforschung A. 1975. V. 30. № 1. P. 87.
Ding M.S. // J. Chem. Eng. Data. 2004. V. 49. P. 276. https://doi.org/10.1021/je034134e
Ding M.S., Xu K., Jow T.R. // J. Electrochem. Soc. 2000. V. 147. №. 5. P. 1688.
Chagnes A., Allouchi H., Carre B. et al. // J. Appl. Electrochem. 2003. V. 33. P. 589.
Ding M.S. // J. Solution Chem. 2005. V. 34. № 3. P. 343. https://doi.org/10.1007/s10953-005-3054-z
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии



