Журнал физической химии, 2021, T. 95, № 7, стр. 963-970
Описание смешанных сеток Н-связей в системе вода–этиленгликоль методами теории графов и симплексов делоне
Г. М. Агаян a, Н. К. Балабаев b, М. Н. Родникова c, *
a Московский государственный университет им. М.В. Ломоносова
Москва, Россия
b Российская академия наук, Институт прикладной математики им. М В. Келдыша
Москва, Россия
c Российская академия наук, Институт общей и неорганической химии им. Н.С. Курнакова
Москва, Россия
* E-mail: rodnikova@igic.ras.ru
Поступила в редакцию 12.05.2020
После доработки 12.06.2020
Принята к публикации 15.06.2020
Аннотация
Методом молекулярной динамики (МД) получены координаты атомов в двойной системе вода–этиленгликоль (ЭГ), каждый из компонентов которой склонен к образованию пространственной сетки водородных связей. На основе МД-результатов смешанная сетка Н-связей указанной жидкой системы была описана методами теории графов и симплексов Делоне при 300 К во всем концентрационном интервале этиленгликоля в воде. Для двадцати одной концентрации ЭГ в водном растворе были получены траектории колебательно-усредненных за 0.1 пс V-структур, отстоящих друг от друга на 10 пс. В основу описания сеток был положен критерий Н-связи, полученный методом МД. Результаты описания сеток теорией графов показывают, что при 300 К почти все молекулы исследуемой системы образуют пространственную сетку Н-связей. Определено количество и характеристики водородных связей, составляющих сетку. Полученная картина подтверждена и расширена исследованием симплексов Делоне.
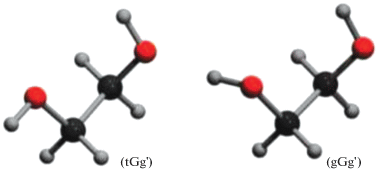
Этиленгликоль (ЭГ) и его водные растворы широко применяются в разных областях технологии, химии и биологии, например, как охлаждающая жидкость, антифриз, противогололедный агент в газопроводах, а также в синтезе полимеров и фармацевтических препаратов [1]. Его молекула, в состав которой входят две гидроксильные группы и две группы –СН2–, обладает достаточной гибкостью для существования в 27-и различных конформациях, из которых 10 достаточно устойчивы [1]. Нас будут интересовать два типа гош-конформеров, характерных для жидкого ЭГ – это tGg' и gGg' представленные на рис. 1 (схема из [1]).
Отметим, что конформер tGg' наиболее распространенный в жидком чистом ЭГ, способен давать слабую водородную связь СН⋅⋅⋅О (гиперконъюгация), что ставит под сомнение образование внутримолекулярной Н-связи в tGg' конформере ЭГ [2]. Межмолекулярные связи в ЭГ, образованные сильными связями ОН⋅⋅⋅О, дают пространственную сетку Н-связей в чистом ЭГ [3]. А конформер gGg', характерный для конформации ЭГ в водных растворах, не образует слабых СН⋅⋅⋅О-связей и способен давать, кроме межмолекулярных, и внутримолекулярные ОН⋅⋅⋅Н-связи, и до определенной концентрации ЭГ вписываться в сетку Н-связей воды [3–5]. Таким образом, обе конформации ЭГ tGg' и gGg' при разных отношениях к внутримолекулярной Н-связи в молекуле ЭГ, дают достаточно сильные межмолекулярные Н-связи ОН⋅⋅⋅Н, образующие пространственную сетку водородных связей в жидком ЭГ [1, 6].
Следует отметить, что Н-сетки и в воде и в ЭГ образованы одинаковыми группами ОН⋅⋅⋅О, поэтому получить смешанные сетки в водных растворах ЭГ казалось бы легко. ЭГ смешивается с водой во всех соотношениях во всем концентрационном интервале жидкой фазы. Энтальпия смешения отрицательна при всех концентрациях ЭГ [7].
Получение же фазовой диаграммы системы Н2О–ЭГ представляло большие трудности. В большинстве случаев получали эвтектическую диаграмму с эвтектикой при соотношении компонентов 1 : 1 [8–10]. Только путем значительных усилий удалось получить фазовую диаграмму системы Н2О–ЭГ с образованием моногидрата ЭГ·Н2О при 230.4 К и две эвтектики при 28 мол. % ЭГ (231.1 К) и 55.5 мол. % (229.7 К) [4] и вырастить и охарактеризовать монокристалл ЭГ·Н2О [11, 1 ].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Тепловые свойства и состояние системы Н2О–ЭГ были исследованы методами ДСК, LAXS-рентгеновским рассеянием и малоугловым рассеянием нейтронов (SANS) в работе [12, 13]. Было показано, что в интервале концентраций 0.3–0.5 мол. доли ЭГ растворы сохраняются в переохлажденном состоянии до ~140 К, в диапазоне 0.6–0.8 мол. доли ЭГ они стеклуются, а от 0 до 0.3 мол. доли ЭГ и от 0.9 до 1 мол. доли ЭГ-растворы кристаллизуются. Зона от 33 до 71 мол. % ЭГ рассматривается как метастабильная фаза. Результаты этих работ согласуются с данными работы [4].
В таблице 1 представлены основные физико-химические свойства компонентов двойной системы Н2О и ЭГ [14, 15].
Таблица 1.
Физико-химические характеристики растворителей
| Характеристики | Н2О | ЭГ |
|---|---|---|
| М | 18 | 62 |
| µ, D | 1.83 | 2.88 |
| DNSbCl5 | 18 | 18.5 |
| Тпл, °С | 0 | –12.9 |
| Ткип, °С | 100 | 197 |
| ∆Тпереох | 40 | 21 |
| ρ(25°С) × 103, кг/м3 | 0.99707 | 1.113 |
| η(25°С) × 10–3, Па с | 0.8903 | 16.16 |
| βT × 10–11, Па–1 | 45.28 | 37.4 |
| ∆Hисп/Ткип, кал/(моль К) | 28.2 | 25.5 |
Обращает на себя внимание разница в плотности и огромная разница в вязкости Н2О и ЭГ, меньшая сжимаемость и большая упругость ЭГ, чем у воды. Характеристики Н-связей в Н2О и в ЭГ близки между собой.
Анализ литературных данных по свойствам системы вода–ЭГ показывает сложный характер этой системы с сильно меняющейся вязкостью и подвижностью частиц, со сложностью описания смешанной сетки Н-связей в зависимости от концентрации ЭГ в системе [16–18]. Поэтому для описания смешанных пространственных сеток мы выбрали топологические методы – теорию графов [19] и построение симплексов Делоне [20].
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Для описания и исследования жидких растворов воды и этиленгликоля использовались рассчитанные методом молекулярной динамики траектории колебательно-усредненных по интервалам 0.1 пс координат атомов (V-структур) при температуре 300 К, записанных через 10 пс. Усреднение координат атомов необходимо, чтобы выделить “собственные” структуры жидкости, убрав из рассмотрения локальные межатомные колебания [21–24].
Время усреднения 10–13 с отвечает временам валентных колебаний и больше времени энергетически невыгодных сближений атомов при тепловых столкновениях.
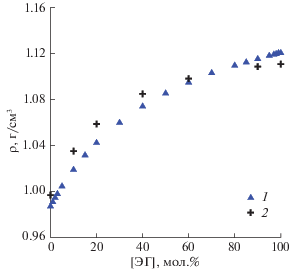
Моделировались смеси этиленгликоля с водой в различной мольной концентрации компонент при температуре 300 К и давлении 1 атм в условиях NPT-ансамбля. В каждой системе в прямоугольной расчетной ячейке с периодическими граничными условиями было ровно 1000 молекул, но в различном соотношении числа молекул ЭГ и молекул H2O. Для каждой мольной концентрации раствора были проведены расчеты для восьми независимых вариантов, различающихся начальными конфигурациями и случайными взаимодействиями с виртуальными частицами столкновительного термостата. Методика расчета описана в [25–28]. Для воды использовалась гибкая модель TIP3P [29]. Использованные параметры взаимодействия хорошо воспроизводят плотности смесей во всем диапазоне концентраций (рис. 2).
Рис. 2.
Плотность смеси ЭГ с водой в зависимости от мольной концентрации ЭГ; 1 – результаты наших расчетов, 2 – экспериментальные данные [30].
Время релаксации систем до выхода на стационарный режим составляло не менее 200 пс. Продуктивные траектории рассчитывались до 3 нс и более с шагом 1 фс.
Анализировались водные растворы, содержащие от 0 до 100 мол. % этиленгликоля. Конкретно: 0, 1, 2, 3, 5, 10, 15, 20, 30, 40, 50, 60, 70, 80, 85, 90, 95, 97, 98, 99, 100 мол. % ЭГ. Все расчеты, приведенные в работе, проводились с V-структурами отстоящими друг от друга вдоль траектории на 60 пс. Всего для каждой концентрации рассматривалось 50 структур.
В основе исследования сеток водородных связей в растворах лежит критерий водородной связи (как межмолекулярной, так и внутримолекулярной). Он был определен из полученных методом молекулярной динамики функций радиального распределения. Наличие водородной связи регистрировалось, если расстояние между кислородами двух гидроксильных групп не превышало 3.5 Å, а расстояние между кислородом одной из гидроксильных групп и протоном другой гидроксильной группы не превышало 2.5 Å.
Свойства сеток, полученных на основе критерия водородной связи, в работе исследовались методами теории графов. Напомним некоторые понятия теории графов, необходимые в дальнейшем [19]. Будем считать молекулы веществ вершинами графов, а водородные связи между молекулами – неориентированными ребрами графа. Последовательность ребер, при которой конец одного ребра является началом другого, называется цепью. Граф называется связным, если для каждой пары вершин существует цепь, которая их соединяет. Компонент связности графа – подграф, в котором для любой пары вершин, существует связывающая их цепь. Основным параметром, оценивающим сетку водородных связей внутри структуры, является размер максимального компонента связности графа, содержащий наибольшее число его вершин. Он описывается матрицей смежности. Наиболее полную информацию о сетке водородных связей содержит матрица смежности для V-cтруктур, построенная с использованием критерия водородной связи. Это квадратная матрица, у которой число строк и столбцов равно числу вершин графа (числу молекул в системе). Элемент матрицы смежности с индексом (i, j) cодержит 1, если i молекула связана с j молекулой водородной связью, и 0, если молекулы не связаны. Единицы в матрице могут быть заменены на некоторый положительный коэффициент, который выражает то или иное свойство этого ребра в графе.
Первой задачей, которая стояла перед нами в этом исследовании, являлась проверка гипотезы о том, что все молекулы веществ для всех концентраций образуют единую сетку водородных связей. Эта гипотеза подтвердилась. Были получены средние значения числа связных компонентов и размеры максимального связного компонента в 1 структуре для каждой концентрации, а также их минимальное и максимальное значение. Число связных компонентов в одной структуре колебалось между 1 и 2, а размер максимального связного компонента в 1 структуре – между 1000 и 999.
Полученные данные позволяют утверждать, что при рассматриваемой температуре 300 К, практически все молекулы в растворах для всех концентраций образуют трехмерную сетку водородных связей. Максимум одна молекула в растворе может не входить в эту сетку. Единственное исключение из этого правила – это 50 мол. %-ная концентрация этиленгликоля (размер максимального связного компонента 998), в которой две молекулы в одной из структур образовали отдельный связный компонент. Для нахождения компонентов связности графа рассматриваемых систем был использован алгоритм Тарьяна [25]. Результатом его работы является количество компонентов связности в графе, их размер, а также список вершин с указанием их принадлежности к тому или другому компоненту связности.
Приведем некоторые полученные результаты. Среднее количество пар молекул в 1 структуре, связанных хотя бы одной водородной связью, увеличивается практически линейно с увеличением воды в смеси. В чистом этиленгликоле эта величина составляет 1811 пар, а в чистой воде – 1939 пар. Суммарное увеличение составляет примерно 7%. На рис. 3 представлено среднее количество водородных связей в структуре, связывающих различные пары молекул: количество пар молекул этиленгликоля изображено пунктирной линией, количество пар молекул воды – линией, состоящей из точек, сплошная линия – это количество водородных связей между молекулами воды и этиленгликоля.
Рис. 3.
Среднее количество водородных связей в структуре (NH), связывающих различные пары молекул в зависимости от числа молекул воды в модели (N): количество пар молекул этиленгликоля –1, количество пар молекул воды – 2, количество водородных связей между молекулами воды и этиленгликоля – 3.
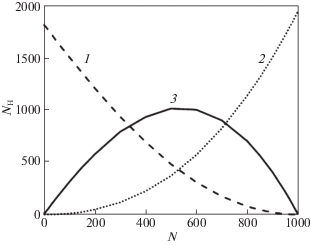
Из рис. 3 видно, что максимум водородных связей между разными молекулами несколько смещен в сторону большей, чем 50% концентрации воды. Также этот рисунок дает возможность утверждать, что примерно в диапазоне 30–70% концентрации воды превалируют смешанные водородные связи между молекулами этиленгликоля и воды.
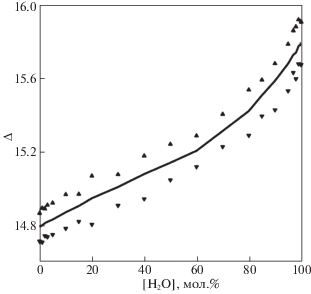
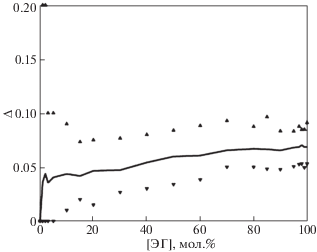
Критерий водородной связи позволяет подсчитать количество молекул этиленгликоля, имеющих внутримолекулярную водородную связь. Количество таких молекул возрастает с ростом концентрации этиленгликоля. На рис. 4 приведен график среднего значения относительной частоты появления молекул с внутримолекулярной водородной связью. Черными треугольниками сверху и снизу графика отмечены минимальное и максимальное значение этого параметра, что позволяет оценить диапазон его изменения относительно среднего значения. Эта величина также с ростом количества молекул этиленгликоля растет со значения примерно в 4% до 7%. Это означает, что число гош-конформеров торсионного угла О–С–С–О возрастает с ростом мольной концентрации этиленгликоля.
Рис. 4.
Среднее значение и диапазон изменения относительной частоты появления молекул этиленгликоля с внутримолекулярной водородной связью (Δ); точки – минимальное и максимальное значение Δ.
Перейдем к рассмотрению ближайшего окружения каждой молекулы в растворе. Наиболее точным методом, позволяющим определить какие молекулы в данный момент времени находятся в непосредственной близости с выбранной молекулой, является построение сетки Делоне, в узлах которой находятся молекулы рассматриваемых жидкостей.
В настоящей работе рассматриваются точки в пространстве, соответствующие координатам центра масс молекул. Для этой трехмерной системы точек строится триангуляция Делоне и соответствующее ей разбиение пространства на многогранники Вороного (с учетом периодических граничных условий!).
Многогранники Вороного разбивают все пространство на области, в каждой из которых расстояние от любой ее точки до расположенной в ее центре молекулы меньше, чем до любой другой. Это позволяет разбить весь объем рассматриваемой жидкости на локальные объемы, относящиеся к каждой молекуле. Симплексы Делоне (в трехмерном пространстве тетраэдры), напротив, характеризуют межмолекулярное пространство, поскольку сферы, проведенные через вершины этих тетраэдров, не содержат никаких молекул [20].
Рассмотрим произвольную молекулу в структуре. Построение триангуляции Делоне в конкретный момент времени позволяет выделить все молекулы в ее ближайшем окружении и дает возможность построить матрицу смежности для такой сетки. Сравнение свойств сетки, построенной на основе критерия водородной связи, и сетки, построенной на основе триангуляции Делоне, является предметом исследования.
На рис. 5 представлено среднее значение (сплошная линия) и диапазон изменения количества соседей у произвольной молекулы на сетке Делоне. При этом практически всегда две молекулы, связанные водородной связью, являлись соседями на сетке Делоне. В каждой структуре максимум один раз это свойство оказывалось не выполненным. Это соответствует очень редко встречающемуся расположению молекул, когда их центры оказывались достаточно далеко друг от друга, в то время как атом водорода одной из них и атом кислорода другой располагались так, что критерий водородной связи был выполнен.
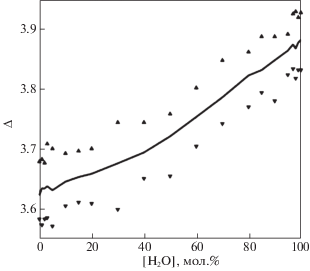
Из рисунка видно, что количество соседей в чистом этиленгликоле равно примерно 14.8, при увеличении количества добавленной воды этот показатель растет и становится равным примерно 15.8. Таким образом, в окружении одной молекулы в среднем добавляется лишь один сосед. Что удивительно, поскольку молекула воды практически в три раза меньше молекулы этиленгликоля.
Если посмотреть на среднее значение количества водородных связей у одной молекулы (рис. 6), то рост составляет 0.25, с 3.63 в чистом этиленгликоле до 3.88 в чистой воде.
После рассмотрения соседей у одной молекулы в структуре без уточнения, какая это молекула: воды или этиленгликоля, интересно посмотреть эти характеристики отдельно для каждого вида молекул. На рис. 7 приведены графики среднего количества соседей у молекулы этиленгликоля на сетке Делоне (сплошная линия), имеющих с ней водородную связь – (линия из точек), пунктирная линия – это соседи на сетке Делоне, не имеющие с выделенной молекулой этиленгликоля водородной связи.
Рис. 7.
Среднее количество соседей у молекулы этиленгликоля на сетке Делоне – 1; соседи, имеющие с ней водородную связь – 2; соседи, не имеющие с выделенной молекулой водородной связи –3.
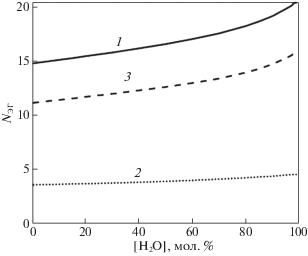
Обращает на себя внимание среднее количество соседей у молекулы ЭГ на сетке Делоне, которое возрастает на 5.6 единицы при увеличении количества молекул воды в растворе. Похожие зависимости имеют место и для среднего количества соседей у молекулы воды, которое возрастает с величины в 12.2 при концентрации воды в 1%, до 15.8 в чистой воде, что почти в 2 раза меньше, чем для молекулы этиленгликоля. Среднее количество водородных связей у молекулы этиленгликоля увеличивается примерно в полтора раза больше, чем для молекулы воды.
50 структур, по которым мы вычисляли все характеристики окружения молекул, выбирались из траектории с интервалом в 60 пс. Таким образом, общее время, которое рассматривалось, составляло 3 нс. Общее количество различных молекул, которые являлись соседями данной молекулы, говорит о подвижности молекул в растворе. На рис. 8 приведены графики среднего количества различных молекул, которые являлись соседями данной молекулы на сетке Делоне (сплошная линия), имели с ней водородную связь (линия из точек), являлись ее соседями на сетке Делоне, но не имели с ней водородных связей (пунктирная линия).
Рис. 8.
Среднее количество различных молекул в течение 3 нс моделирования, которые являлись соседями данной молекулы на сетке Делоне (1); имели с ней водородную связь – (2); являлись ее соседями на сетке Делоне, но не имели с ней водородных связей (3).
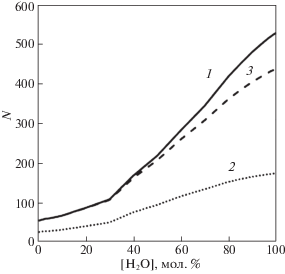
Общее увеличение количества различных молекул, имевших водородную связь с данной молекулой при изменении мольной концентрации воды, увеличилось примерно в 6 раз. При этом общее число молекул, которые на сетке Делоне были в числе соседей данной молекулы, в течение 3 нс увеличилось в 10 раз. Отметим также, что все три графика имеют излом в точке, где мольная концентрация воды в растворе составляет ~ 30%.
Рассмотрим аналогичные показатели для молекулы этиленгликоля: рис. 9.
Рис. 9.
Среднее количество различных молекул, которые являлись соседями данной молекулы этиленгликоля на сетке Делоне (1); имели с ней водородную связь – (2); соседи на сетке Делоне, не имевшие с выделенной молекулой этиленгликоля водородной связи – 3.
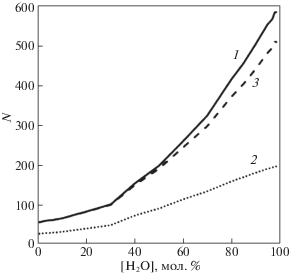
Такой же излом, как на предыдущем рисунке, также наблюдается и на этом рисунке. Общее количество различных молекул, которые были соседями молекулы этиленгликоля, увеличилось более, чем в 10 раз.
Аналогичные графики для молекулы воды очень похожи на приведенные на рис. 8 зависимости, с той лишь разницей, что при минимальной концентрации в 1% воды количество соседей у молекулы воды на сетке Делоне равно 73.8, а количество молекул, образовывавших с ней водородную связь равно 34.2. Для молекул этиленгликоля соответствующие значения равны 55.8 и 26.2.
Изломы на концентрационных зависимостях, представленные на рис. 8 и 9, а также, аналогичный и для молекулы воды, происходит при одной и той же концентрации, отвечающей соотношению компонентов 2ЭГ : Н2О. Это подтверждается и рис. 3. Вероятно, это точка перехода от сетки ЭГ с вкрапленными в нее молекулами воды к смешанной сетке Н-связей, определившей, так называемую “метастабильную” область [4, 12].
Для каждой водородной связи, которую удалось определить с помощью критерия водородной связи, интересным является такой показатель, как частота появления этой связи среди рассмотренных нами 50 структур вдоль траектории. На рис. 10 изображено среднее значение этого показателя в виде сплошной линии. Маленькие треугольники, как и прежде, отображают максимальное значение частоты появления водородной связи.
Рис. 10.
Среднее значение частоты появления водородной связи среди рассмотренных 50 структур – 1, максимальное значение показателя –2.
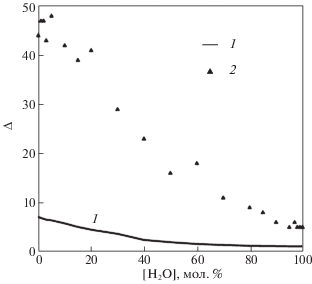
Видно, что в чистом этиленгликоле и в растворе, содержащем меньше 30% воды, имеются водородные связи, которые встречаются практически во всех структурах. При этом, рассмотренные структуры охватывают временной диапазон в 3 нс. Такие долгоживущие водородные связи если и разрываются, то не более, чем на 60 пс, а затем восстанавливаются снова. Однако, таких водородных связей немного, поскольку среднее значение частоты не превосходит 8. Аналогичный показатель рассмотрен и для соседних на сетке Делоне молекул (рис. 11).
Рис. 11.
Среднее значение частоты соседства двух молекул на сетке Делоне среди рассмотренных 50 структур – 1, максимальное значение показателя –2.
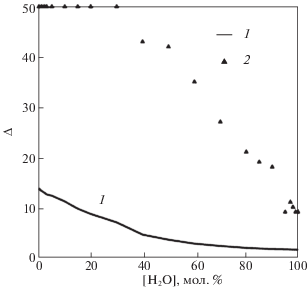
Если рассмотреть на этом рисунке максимальное значение частоты соседства, то видно, что вплоть до 40% содержания воды в растворе есть пары молекул, которые оказывались соседними во всех рассмотренных структурах.
В работе [28] мы оценивали времена жизни водородной связи чистых веществ воды и этиленгликоля на примере V-структур, рассчитанных методом молекулярной динамики при близкой температуре в 293 К. Однако, эти траектории были гораздо менее продолжительными во времени, чем те, которые мы рассматриваем в настоящей статье. А именно, траектории для воды были длительностью менее 500 пс, а для этиленгликоля – менее 1.2 нс. Соответствующие максимальные времена жизни составляли для воды 75 пс, а для этиленгликоля – 1168 пс. Анализ траекторий, полученный в настоящей статье с помощью триангуляции Делоне, позволяет утверждать, что молекулы, которые оказались связанными водородной связью, после того как эта связь нарушается, еще очень долгое время находятся рядом, по соседству и могут вновь и не один раз образовать водородную связь.
ВЫВОДЫ
1. Методами молекулярной динамики, теории графов и симплексов Делоне исследована система Н2О–ЭГ при 300 К.
2. Методами теории графов показано, что во всем концентрационном интервале этой системы все молекулы связаны в смешанную пространственную сетку водородных связей.
3. Получены следующие характеристики сеток: а) среднее значение количества пар молекул в одной структуре, имеющих хотя бы одну водородную связь, б) среднее количество Н-связей в структуре, связывающих различные пары молекул, в) среднее значение количества молекул ЭГ, имеющих внутримолекулярную водородную связь, г) среднее значение относительной частоты появления молекул ЭГ с внутримолекулярной Н-связью. Максимальные и минимальные значения указанных величин.
4. На концентрационных зависимостях описанных свойств выделяется область 30–70 мол. % ЭГ, связанная с максимальным количеством смешанных Н-связей ЭГ–Н2О и ограниченная концентрационными зависимостями Н-связей Н2О–Н2О и ЭГ–ЭГ (см. рис. 3). В литературе [12] эта область называется метастабильной и дает сильное переохлаждение жидкой фазы, объясняемое устойчивостью смешанной сетки, образованной водородными связями ЭГ–Н2О.
5. Симплексы Делоне характеризуют межмолекулярное пространство в системе Н2О–ЭГ и позволяют выделить ближайшее окружение молекулы. Получены следующие характеристики: а) среднее значение количества соседей у одной молекулы на сетке Делоне, б) среднее значение водородных связей у одной молекулы, в) среднее значение количества соседей у одной молекулы, не связанных с нею Н-связью и отдельно эти характеристики для молекулы ЭГ и молекулы Н2О. Максимальные и минимальные значения этих величин.
6. Интересно, что концентрационные зависимости этих величин на сетке Делоне повторяют особенности, полученные теорией графов. Выделяется та же концентрационная область – область, где превалирует Н-связь ЭГ–Н2О (рис. 3).
Основные расчеты были проведены на суперкомпьютерах в МСЦ РАН и ИПМ имени М.В. Келдыша РАН.
Исследование выполнено в рамках государственного задания ИОНХ РАН в области фундаментальных научных исследований при финансовой поддержке Российского фонда фундаментальных исследований в рамках научного проекта № 19-03-00215.
Список литературы
Fortes A.D., Suard E. // J. Chem. Phys. 2011. V. 135. P. 234501.
Klein R.A. // J. Am. Chem. Soc. 2002. V. 124. P. 13931.
Родникова М.Н. // Журн. физ. химии. 1993. Т. 67. № 2. С. 275.
Cordray D.R., Kaplan L., Woyciesjes P.M., Kozak T. // Fluid Phase Equilibria 1996. V. 117. P. 146.
Kaiser A., Ritter M., Nazmutdinov R., Probst M. // J. Phys. Chem. B. 2016. V. 120. P. 10515.
Родникова М.Н., Соловей А.Б., Солонина И.А. // Журн. неорган. химии. 2012. Т. 57. № 2. С. 297.
Белоусов В.П., Морачевский А.Г. Теплоты смешения жидкостей Л.: Химия, 1970.
Ross H.K. // Ind. Eng. Chem. 1954. V. 46. P. 601.
Spangler J.A., Davies E.C.H. // Ind. Eng. Chem. Anal. Ed. 1943. V. 15. P. 96.
Conrad F.H., Hiil E.F., Ballman E.A. // Ind. Eng. Chem. 1930. V. 32. P. 542.
Boese R., Weiss H. // Acta Crystallogr. 1998. V. 54. № 6. P. 24.
Matsugami M., Takamuku T., Otomo T., Yamaguchi T. // J. Phys. Chem. B. 2006. V. 110. P. 12372.
Takamuku T., Tsutsumi Y., Matsugami M., Yamaguchi T. // J. Phys. Chem. B. V. 112. P. 13300.
Родникова М.Н., Самигуллин Ф.М., Солонина И.А., Сироткин Д.А. // Журн. структур. химии 2014. Т. 55. № 2. С. 276.
Лобышев В.И., Калиниченко Л.П. Изотопные эффекты D2О в биологических системах. М.: Наука, 1978.
Egorov G.I., Makarov D.M., Kolker A.M. // Fluid Phase Equilibria 2013. V. 344. P. 125.
Egorov G.I., Makarov D.M., Kolker A.M. // Fluid Phase Equilibria 2013. V. 354. P. 133.
Kaiser A., Ritter M., Nazmutdinov R., Probst M. // J. Phys. Chem. B. 2016. V. 120. P. 19515.
Оре О. Теория графов. М.: Наука, 1968.
Медведев Н.Н. Метод Вороного–Делоне в исследовании структуры некристаллических систем. Новосибирск: СО РАН, 2000.
Фишер И.З. Статистическая теория жидкости. М.: Физ. мат. лит., 1961.
Hirata F., Rosski P. // J. Chem. Phys. 1981. V. 74. P. 6867.
Наберухин Ю.И., Волошин В.П., Медведев Н.Н. // Расплавы. 1987. Т. 1. С. 71.
Маленков Г.Г., Франк-Каменецкий М.М., Гривцов А.Г. // Журн. структур. химии. 1997. Т. 28. С. 81.
Tarjan R.E. // SIAM J. Comput. 1972. V. 1. № 2. P. 146.
Белащенко Д.К., Родникова М.Н., Балабаев Н.К., Солонина И.А. // Журн. физ. химии. 2013. Т. 87. № 7. С. 1171.
Белащенко Д.К., Родникова М.Н., Балабаев Н.К., Солонина И.А. // Журн. физ. химии. 2014. Т. 88. № 1. С. 72.
Rodnikova M.N., Agayan G.M., Balabaev N.K. // J. Mol. Liquids. 2019. V. 283. P. 374.
Jorgensen W.L. et al. // J. Chem. Phys. 1983. V. 79. P. 926.
Sun T., Teja A.S. // J. Chem. Eng. Data. 2003. V. 48. P. 198.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии