Журнал физической химии, 2021, T. 95, № 7, стр. 1002-1005
Предотвращение перехода горения метана во взрыв малыми примесями инертных газов
В. В. Азатян a, *, В. М. Прокопенко b, С. К. Абрамов b
a Российская академия наук, ФИЦ “Институт химической физики им. Н.Н. Семенова”
Москва, Россия
b Российская академия наук, Институт структурной макрокинетики
и проблем материаловедения им. А.Г. Мержанова
Московская область, Черноголовка, Россия
* E-mail: vylenazatyan@yandex.ru
Поступила в редакцию 15.08.2020
После доработки 15.08.2020
Принята к публикации 28.08.2020
Аннотация
На примере горения смесей метана с воздухом показано, что с помощью малых присадок инертных газов можно управлять критическими условиями перехода горения в режим взрыва. Установлено, что резонансная передача энергии в реакции тримолекулярного обрыва реакционных цепей способствует предотвращению перехода горения во взрыв.
Благодаря выявлению определяющей роли цепной природы реакций горения газов при атмосферном и повышенных давлениях, стало возможным управление всеми режимами горения химическими методами [1–3]. В настоящей работе приводятся результаты предотвращения перехода горения метана во взрыв присадками инертных газов.
Известно, что при одновременном выполнении условий превышения скорости тепловыделения реакции (q+) над скоростью теплоотвода (q–) и более сильного ускорения тепловыделения от повышения температуры по сравнению с ускорением теплоотвода процесс переходит в режим воспламенения [4, 5]. Этим условиям соответствуют соотношения:
Величина q+ равна произведению скорости реакции W и теплового эффекта реакции $\bar {Q}$: Воспламенением называется режим прогрессивного ускорения реакции с выделением тепла и света [4–6]. Условие (2) выполняется при температурах выше критического значения, достигаемого благодаря более сильной температурной зависимости q+ по сравнению с q–. С учетом соотношений (1) и (2) была создана теория теплового воспламенения [4], учитывающая реакции только валентно-насыщенных соединений. Позже [2, 3, 7], однако, было показано, что эта теория к горению газов не относится, поскольку скорости газофазных реакций валентно-насыщенных соединений вследствие больших энергий активации чрезвычайно медленные и даже не сопровождаются значительным саморазогревом.Нередко воспламенение называют взрывом. Между тем, взрывной режим горения реализуется лишь в том случае, если горение протекает настолько быстро, что нагретый газ не успевает расширяться до размеров, заметно превышающих размеры зоны горения, и тепло практически не успевает передаваться в газ вне очага горения. В результате этого процесс протекает адиабатически, давление и температура скачкообразно возрастают. Реализуется фактически ударная адиабата. Граница скачка давления и температуры продвигается в реакционной среде со скоростью, соответствующей скорости звука в нагретом участке среды и, значит, со сверхзвуковой скоростью по отношению к не нагретой среде. Такое протекание процесса соответствует определению взрыва при горении, согласно которому, произведение характеристического времени тепловыделения (tp) на скорость звука ($v$) в реакторе значительно меньше, чем линейный размер (l) очага горения [8]:
Если начальные давления не очень низкие, то образуется ударная волна, сопровождающаяся звуковым эффектом. Таким образом, взрыв от воспламенения отличается намного большей интенсивностью, скачкообразным ростом градиентов плотности и температуры горючей смеси, возникновением движения границ нагретого газа со сверхзвуковой скоростью. Пример такого режима горения – взрыв метана, цепной характер горения которого следует из невозможности молекулярного пути в силу большой энергии активации элементарной реакции СН4 с О2 (225 кДж/моль [9]). Проявления цепной природы горения метана: влияние ингибиторов на условия воспламенения и на кинетику [9], а также наличие атомов Н и радикалов ОН в пламени в сверхравновесных концентрациях [10].Ниже приводятся результаты исследования влияния инертных газов на переход горения метана во взрыв. Разветвленно-цепному процессу соответствует следующая обобщенная схема:
где x и y – свободные атомы и радикалы, носители цепей (НЦ), A и B – исходные молекулы, Р – конечный продукт.Скорость расходования исходного реагента, т.е. скорость цепной реакции, равна:
где ω0 – скорость реакции (0), n – концентрации атомов и радикалов – носителей цепей (НЦ), k1 – эффективная константа скорости лимитирующей стадии процесса, обычно стадии разветвления, [В]– концентрация реагента В, участвовавшего в лимитирующей стадии.НЦ вступают также в реакции образования малоактивных продуктов, не участвующих в цепном горении. В их реакциях свободные валентности уничтожаются, цепь обрывается:
Подобно горению водорода, реакциями обрыва цепей являются адсорбция НЦ и реакция если радикал HO2 затем адсорбируется или вступает, например, в реакцию Один из режимов цепного горения – цепно-тепловой взрыв, протекающий при одновременной реализации цепной лавины и прогрессирующего саморазогрева [9, 11]. В этом режиме одновременно реализуются условия (1) и (2), а также условие лавинного размножения активных частиц – свободных атомов и радикалов: В условиях, при которых систему кинетических уравнений НЦ можно методом частичных квазистационарных концентраций привести к уравнению, относящемуся к одной активной частице, скорости реакции горения соответствует следующее уравнение [9]:(7)
$\frac{W}{{[{\text{B}}]}} = {{k}_{1}}{{n}_{0}}\exp \mathop \smallint \limits_{{{t}_{0}}}^t \,[{{f}_{0}}\exp (--{{E}_{1}}{\text{/}}RT)--g]{\kern 1pt} dt.$(VI)
${\text{Н}} + {\text{С}}{{{\text{Н}}}_{4}} = {{{\text{Н}}}_{2}} + {\text{С}}{{{\text{Н}}}_{3}}.$(8)
$2k_{1}^{0}[{{{\text{O}}}_{2}}]\exp (--{{E}_{1}}{\text{/}}RT)--{{k}_{4}}[{\text{M}}][{{{\text{O}}}_{2}}] - {{k}_{6}}[{{C}_{{{\text{C}}{{{\text{H}}}_{4}}}}}] = \varphi .$Из выражения (7) видно, что скоростям реакций цепного горения присуща температурная зависимость, намного более сильная, чем экспоненциальная функция в формуле Аррениуса. Такая зависимость благоприятствует переходу горения во взрыв, в котором вместе с прогрессирующим накоплением тепла и лавинообразным размножением НЦ, в соответствии с неравенствами (1), (2), (6), реализуется также условие (4). Если же величина $\varphi $ больше нуля, но лишь ненамного, то зависимость скорости от температуры весьма слабая, условие (4) не выполняется, и горение протекает без взрыва.
Эффективная константа скорости разветвления цепей в горении метана значительно меньше, чем соответствующая величина в горении водорода. Это проявляется в более высокой температуре самовоспламенения метано-воздушных смесей и в более узких концентрационных пределах распространения пламени [12]. Поэтому следовало ожидать, что переход горения метана во взрыв также имеет очень узкий интервал пределов. Этот вывод подтверждают наши измерения, показывающие, что переход во взрыв осуществляется лишь в смесях, содержащих метан в интервале 8–10%. Между тем, переход горения водородовоздушных смесей во взрыв осуществляется в интервале концентраций водорода 15–59% [9]. Измерения показали также, что взрыв метано-воздушной смеси менее интенсивный.
Введение в горючую смесь примеси инертного газа снижает мольные доли реагентов и, значит, их концентрации. Вследствие этого при положительных значениях $\varphi $ ее величина и, значит, показатель степени в выражении скорости (7) уменьшаются. Из уравнения (7) видно также, что соответственно экспоненциально уменьшается скорость процесса. Если в результате этого нарушаются неравенства (2) и (4), то переход во взрыв становится невозможным. Еще сильнее влияет то, что в молекулах СО2 и НО2 имеются связи с близкими частотами колебаний. Это облегчает резонансную передачу энергии от НО2 на СО2 при столкновении и увеличивает константу скорости k4 реакции обрыва цепей (IV), уменьшает φ. На близости частот колебаний в НО2 и СО2 основано использование СО2-лазера при идентификации радикалов НО2 в пламени и при исследовании реакций этих радикалов методом лазерного магнитного резонанса [13].
Реакции проводили в стальных реакторах объемами 3 и 4000 л, описанных ранее [9]. Смеси составляли предварительно по парциальным давлениям компонентов. Горение инициировали искрой с энергией 3.2 Дж. Проводили синхронную скоростную регистрацию хемилюминесценции и давления. После каждого опыта реакторы тщательно откачивали.
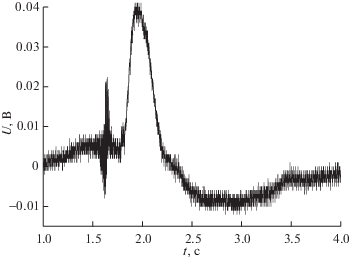
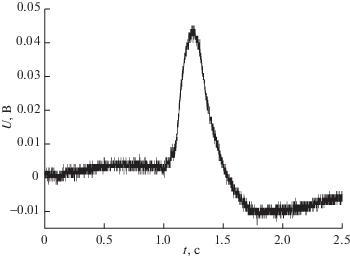
На осциллограммах давления взрыв регистрировался в виде скачков и “шума”, не наблюдаемых при горении без взрыва. Из рис. 1 и 2 видно, что присадки СО2 предотвращают переход горения во взрыв. При взрыве в реакторе объемом 4000 л звук, сопровождающий горение, значительно резче, чем при горении без взрыва. Аналогичные результаты получены в реакторе объемом 3л. Воздействие присадок СО2 значительно сильнее влияния N2.
Список литературы
Азатян В.В., Бакулев В.И., Калканов В.А. и др. // Патент № 1835139, 1992.
Азатян В.В. // Успехи химии. 1999. Т. 62. № 12. С. 1122.
Азатян В.В. // Журн. физ. химии. 2011. Т. 85. № 8. С. 1405.
Семенов Н.Н. Избранные труды. М.: Наука, 2005. Т. 1. Книга 2. 603 с.
Семенов Н.Н. О некоторых проблемах химической кинетики и реакционной способности. М.: Изд-во АН СССР, 1958. 686 с.
Франк-Каменецкий Д.А. Основы макрокинетики, диффузия, теплопередача в химической кинетике. Долгопрудный: Интеллект, 2008. 407 с.
Азатян В.В. Кинетика и катализ. 2015. Т. 56. № 1. С. 3.
Большая Российская Энциклопедия. 2006. Т. 5. Статья Взрыв. С. 242.
Азатян В.В. Цепные реакции в процессах горения, взрыва и детонации газов. Черноголовка: Изд-во ИПХФ РАН, 2017. 448 с.
Korobeinichev O.P., Shmakov A.G., Rybitskaya I.V. et al. Flame at Atmospheric Pressure, Kinetics and Catalysis, 2009. V. 50. № 2. P. 156.
Азатян В.В., Калканов В.А., Мержанов А.Г., Шавард А.А. // Хим. физика. 1987. Т. 6. № 12. С. 1696.
Lewis B., von Elbe G. Combustion, Explosions and Flame in Gases. N.Y.–L.: Acad. Press, 1987.
Азатян В.В., Гаганидзе К.Н., Колесников С.А., Трубников Г.Р. // Кинетика и катализ. 1982. Т. 23. № 1. С. 244.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии