Журнал физической химии, 2021, T. 95, № 7, стр. 994-1001
Исследование жидкой системы этиленгликоль–диметилсульфоксид методом динамического рассеяния света
И. А. Солонина a, Т. В. Лаптинская b, М. Н. Родникова a, *, Е. В. Широкова a
a Российская академия наук, Институт общей и неорганической химии им. Н.С. Курнакова
Москва, Россия
b Московский государственный университет им. М.В. Ломоносова
Москва, Россия
* E-mail: rodnikova@igic.ras.ru
Поступила в редакцию 07.08.2020
После доработки 14.09.2020
Принята к публикации 16.09.2020
Аннотация
Жидкая система этиленгликоль–диметилсульфоксид исследована различными физико-химическими методами. Не все полученные результаты получили объяснение, в частности, вопрос о микрорасслаивании в определенном концентрационном и температурном интервале. Поэтому, в настоящей работе эта система исследована методом динамического рассеяния света. Получены спектры рассеянного света, автокорреляционные функции интенсивности, рассчитаны времена релаксации, коэффициенты самодиффузии и гидродинамические радиусы образующихся ассоциатов. Полученные результаты объяснены сольвофобными эффектами и микрорасслаиванием, подтверждающимся обнаруженным нами ранее жидкофазным расслаиванием в определенном температурном и концентрационном интервале.
Водные растворы этиленгликоля (ЭГ) и диметилсульфоксида (ДМСО) широко применяются как криоагенты, в частности, в криобиологии для длительной консервации органов и клеток [1]. Показано, что в системе Н2О–ЭГ основную роль в переохлаждении жидкой фазы и длительного существования в переохлажденном состоянии играет устойчивость смешанной сетки водородных связей в этой системе [2]. В системе Н2О–ДМСО состав и строение молекулы ДМСО позволяют предположить наличие гидрофобных эффектов в этой системе, что было доказано изучением объемных свойств [3] и методом статического рассеяния света [4].
Представляло интерес исследовать систему ЭГ–ДМСО с целью выявить влияние молекул ДМСО на пространственную сетку Н-связей ЭГ, отчасти похожую на пространственную сетку воды [5].
В табл. 1 приводим физико-химические свойства компонентов системы ЭГ-ДМСО.
Таблица 1.
Физико-химические характеристики исследуемых веществ [6]
| Характеристикa | ЭГ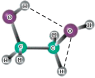 |
ДМСО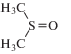 |
|---|---|---|
| М | 62 | 78 |
| μ, D | 2.88 | 3.96 |
| DNSbCl5 | 18.5 | 29.8 |
| Тпл, К | 260 | 297 |
| Ткип, К | 470 | 462 |
| ρ(25°C) × 103, кг/м3 | 1.113 | 1.0955 |
| η(25°C) × 10–3, Па с | 16.16 | 2 |
| D × 105, см2/c | 0.083 | 0.72 |
| $n_{{\text{D}}}^{{20}}$ | 1.4310 | 1.4787 |
| βТ × 10–11, Па–1 | 37.4 | – |
Отметим малый коэффициент самодиффузии молекул ЭГ, большую вязкость и малую изотермическую сжимаемость жидкого ЭГ. Молекулу ДМСО отличает значительная электронодонорная способность.
Фрагмент фазовой диаграммы системы ЭГ–ДМСО, полученной нами методом дифференциальной сканирующей калориметрии [7], приводим на рис. 1.
Рис. 1.
Фрагмент фазовой диаграммы ЭГ–ДМСО [7]; * – температура кристаллизации при охлаждении образцов (кривая охлаждения); ° – температура плавления образцов (линия ликвидуса); Δ – температура расслаивания при медленном нагревании образцов после быстрого охлаждения до температуры стеклования (148К).
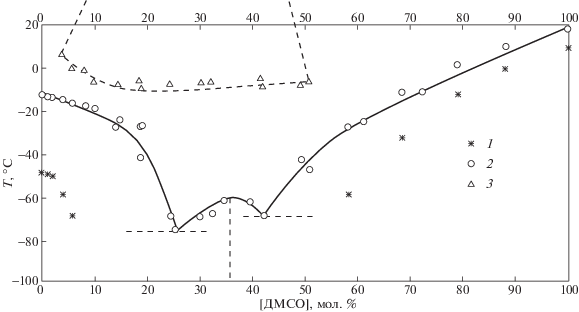
На фазовой диаграмме показано сильное переохлаждение жидкой фазы, стеклование при ~148 К и образование соединения ДМСО·2ЭГ при ~213 К. При медленном нагревании после быстрого охлаждения жидкой фазы до температуры стеклования зарегистрировано жидкофазное расслаивание в интервале температур от 281 до 268 К и концентраций 5 мол. % ДМСО – 50 мол. % ДМСО (рис. 1). Похожее жидкофазное расслаивание (нагревание после сильного охлаждения) было найдено и в ряде других этиленгликолевых неэлектролитных системах [8].
Энтальпии смешения ЭГ и ДМСО, измеренные при 308 К, отрицательны во всей области концентраций [9].
Концентрационные зависимости плотности этиленгликолевых растворов ДМСО показывают слабый максимум при 2 мол. % ДМСО, исчезающий при повышении температуры [10, 11]. Кажущийся объем ДМСО, рассчитанный нами по данным работы [10], имеет очень слабый минимум при той же концентрации ДМСО.
Область малых концентраций ДМСО в этиленгликолевых растворах была исследована нами методом спин-эхо на протонах в интервале температур 303–343 К. Концентрационная зависимость коэффициентов самодиффузии и молекул ЭГ и ДМСО имеет плавный ход на повышение и не обнаруживает сольвофобных эффектов [12].
Измерения статического рассеяния света в интервале концентраций 0–17 мол. % ДМСО при двух температурах 293 и 323 К также ясно не показали наличия сольвофобных эффектов в системе ЭГ–ДМСО [13].
Мы связываем сольвофобные эффекты (сольвофобную сольватацию и сольвофобное взаимодействие) с лабильностью и упругостью пространственной сетки водородных связей в жидких системах [14]. Температурную зависимость объемных свойств и теплоемкости [10, 11, 15] и слабое выражение сольвофобных эффектов в этиленгликолевых растворах ДМСО мы объясняем малой лабильностью пространственной сетки Н-связей в ЭГ, большой вязкостью ЭГ, сильно зависящей от температуры, и малым коэффициентом самодиффузии, т.е. малой подвижностью молекул ЭГ, малой способностью образовать полость для сольвофобной сольватации ДМСО в ЭГ.
Для исследования распределения частиц ДМСО в растворе ЭГ на больших масштабах длины, для изучения ассоциаций в жидкой фазе системы ЭГ-ДМСО, их регистрации и рассмотрении на молекулярном и наноуровне, для определения размеров образующихся частиц, их подвижности и кинетики их образования был выбран метод рассеяния света, две его модификации – статическое или упругое, и, в основном, динамическое или квазиупругое, рассеяние света. В основе этих методов лежит анализ интенсивности флуктуаций концентраций рассеянного света.
В методе статического светорассеяния измеряется средняя интенсивность рассеянного света, которая определяется средней величиной флуктуаций концентраций. Этим методом мы определили концентрации, которым соответствуют наибольшие интенсивности рассеянного света, т.е. концентрации при которых образуются ассоциаты.
Динамическое светорассеяние позволяет определить время жизни флуктуаций [16]. В основе этого метода лежит анализ флуктуаций интенсивности света, рассеянного частицами, находящимися в состоянии Броуновского движения. Возникающие при этом временные флуктуации интенсивности рассеянного света анализируются автокоррелятором, который строит корреляционную функцию сигнала. В эксперименте измеряют корреляционную функцию интенсивности рассеянного света, из которой вычисляют времена релаксации движений и коэффициент диффузии образующихся частиц. Метод применим для частиц размером от 0.6 нм, т.е. от 6 Å [16]. Заметим, что диаметр молекулы ДМСО составляет 5.7 Å [17].
Возможности применения метода динамического рассеяния света к смесям жидкостей, растворам электролитов и неэлектролитов, в частности, к водным растворам ДМСО, подробно описаны в работах M. Sedlak [18–20].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Эксперименты по светорассеянию проведены на гониометре-корреляторе AVL-CGS-6010, Ланген, Германия. Прибор оснащен Не–Nе-лазером с длиной волны 632.8 нм. Мощностью 23 мВт. Коррелятор имеет 250 каналов. Минимальное время задержки 250 нс, максимальное – 4 с. Интенсивность сигнала рассеивания измеряется счетчиком фотонов как среднее число фотоимпульсов за 1 с. В данной работе мы полагаем 1 фотон в секунду =1 Гц. Время накопления корреляционной функции в первый день наблюдения 5–10 мин, в дальнейшие дни 30–40 мин. Угол рассеяния был выбран 30 или 40° (меньше обычного 90°). Рассеивающий объем, образованный пересечением трека лазерного пучка и линиями апертуры приемника, равен 150 мкм и находится в центре цилиндрической кюветы диаметром 10 мм с исследованным раствором. Термостатирование образца осуществлялось с помощью термостата Lauda. Температура выдерживалась с точностью ±0.1 К.
В экспериментах измеряется автокорреляционная функция интенсивности рассеянного света (КФ)
(1)
${{g}_{2}}(t) = \frac{{\left\langle {I({{t}_{n}})\left. {I({{t}_{n}} + \tau )} \right\rangle } \right.}}{{\left\langle {I(t{}_{n})} \right\rangle \left\langle {I({{t}_{n}} + \tau )} \right\rangle }},$Подробное описание эксперимента и расчетов времен релаксации (tоi) и коэффициента трансляционной диффузии (D) описано в работах [21, 22]. Укажем только, что для определения времен релаксации из автокорреляционной функции интенсивности использовался алгоритм CONTIN [23], а коэффициент диффузии связан с временем релаксации D = (1/toi)q–2, где q = (4πn/λ0)sin(θ/2) – волновой вектор рассеяния для данного угла θ, n – коэффициент преломления раствора, λ0 – длина волны облучающего света лазера.
Из коэффициентов трансляционной диффузии по формуле Стокса–Эйнштейна рассчитывался гидродинамический радиус (Rh) твердой частицы, диффундирующей с той же скоростью, что и рассматриваемый рассеивающий объект.
Когда в растворе присутствуют частицы разных размеров, то автокорреляционная функция представляет собой сумму экспоненциальных спадов, соответствующих каждому из видов ассоциатов, с соответствующими временами релаксации.
Мы исследовали систему ЭГ–ДМСО в интервале концентраций 0–50 мол. % при двух температурах 302 и 322 К. Из-за большой вязкости растворов съемки проводили через разные времена после приготовления образцов, учитывая их гигроскопичность.
Прежде всего, статическим методом рассеяния света мы рассмотрели концентрационную зависимость средних значений интенсивности рассеянного света при угле рассеяния 40°. Полученные результаты приведены в табл. 2.
Таблица 2.
Интенсивности рассеянного света (I, кГц (40°)) в системе ЭГ–ДМСО при температуре 302 и 322 К
| ДМСО мол. % | 302 К (1 день) | 302 К (10 день) | 322 К (1 день) | 322 К (10 день) |
|---|---|---|---|---|
| 0.39 | 1.63 | 2.09 | 1.93 | 2.10 |
| 0.79 | 1.73 | 2.92 | 1.88 | 2.52 |
| 0.83 | 1.59 | 2.47 | 2.00 | 2.18 |
| 1.11 | 1.66 | 2.04 | 2.56 | 2.37 |
| 1.61 | 1.62 | 2.57 | 2.41 | 2.51 |
| 2.17 | 2.16 | 2.42 | 1.88 | 2.38 |
| 2.20 | 1.64 | 1.81 | 2.67 | 1.98 |
| 2.44 | 1.62 | 56.26 | 2.98 | 3.75 |
| 2.45 | 1.97 | 5.83 | 2.24 | 3.06 |
| 2.56 | 1.60 | 1.72 | 1.85 | 1.89 |
| 2.72 | 1.59 | 2.20 | 1.81 | 2.49 |
| 3.01 | 1.62 | 2.47 | 2.33 | 2.62 |
| 3.07 | 1.64 | 2.41 | 2.15 | 2.21 |
| 3.61 | 1.61 | 2.77 | 2.62 | 3.15 |
| 4.79 | 1.60 | 2.08 | 1.80 | 2.40 |
| 5.63 | 1.68 | 7.35 | 11.11 | 9.82 |
| 6.87 | 1.53 | 10.73 | 6.12 | 8.36 |
| 7.18 | 1.58 | 1.72 | 1.77 | 1.89 |
| 7.93 | 1.68 | 2.27 | 1.86 | 2.39 |
| 8.11 | 1.59 | 2.15 | 1.81 | 2.32 |
| 12.75 | 1.71 | 3.54 | 1.88 | 2.42 |
| 14.93 | 1.64 | 2.83 | 1.87 | 2.45 |
| 18.49 | 1.59 | 5.28 | 1.83 | 2.50 |
| 25.45 | 1.61 | 2.82 | 1.85 | 2.57 |
| 32.25 | 1.58 | 2.74 | 1.88 | 2.46 |
| 43.34 | 1.57 | – | 1.84 | – |
Из таблицы видны максимумы интенсивностей, увеличивающиеся на десятый день съемок и с повышением температуры.
Область 2–3 мол. % ДМСО коррелирует с минимумом молярного парциального объема ДМСО [10] и максимумом теплоемкости [15] в исследованной системе. Мы склонны объяснить максимум рассеяния света в этой области концентраций сольвофобным эффектом ДМСО в этиленгликолевом растворе. Температурные зависимости эффектов в этой области концентраций, вероятно, связаны с достаточно высокой вязкостью раствора и ее сильной зависимостью от температуры.
Объяснить изменения интенсивностей в районах 5–6 мол. % ДМСО и 18 мол. % ДМСО довольно сложно. Напомним только, что при температурах 281 К–268 К и концентрациях ~5–50 мол. % ДМСО на фазовой диаграмме системы ЭГ–ДМСО зафиксировано жидкофазное расслаивание рис. 1 [7], а раствор чувствует фазовый переход задолго до перехода и по температуре и по концентрации [24, 25].
В динамическом рассеянии света временные флуктуации интенсивности рассеянного света автоматически анализируются автокоррелятором, строящим корреляционную функцию сигнала. На рис. 2 мы приводим временное затухание автокорреляционных функций для растворов ряда концентраций в системе ЭГ–ДМСО (выборка из 35-и исследованных концентраций, сводка полученных результатов во всем концентрационном интервале дана в Приложении 1).
Рис. 2.
Корреляционные функции флуктуаций интенсивности рассеянного света (затухание во времени) для некоторых концентраций системы ЭГ–ДМСО, G2 – нормированная КФ; τ – время задержки между перемножаемыми сигналами.
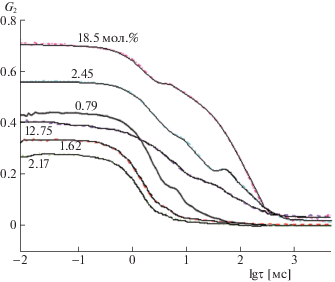
Из рис. 2 видно, что затухание автокорреляционных функций описывается, в основном, двумя экспонентами. Поэтому, рассчитанное из них распределение гидродинамических радиусов, приведенное на рис. 3, в основном бимодально.
Рис. 3.
Распределение радиусов частиц для концентраций 2.45 мол. % и 18.49 мол. % ДМСО, рассчитанных из корреляционных функций, которые наблюдались через 72 и 144 ч; R – радиус в нм, I – интенсивность, нормированная на максимум.
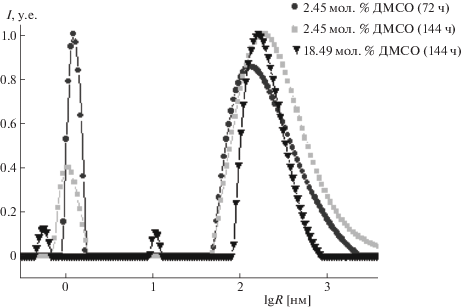
Заметим, что алгоритм CONTIN дает возможность рассчитать вклады в интенсивность рассеяния от частиц каждого наблюдаемого размера (так называемое “распределение взвешенного по интенсивности размера”). Гидродинамические радиусы рассеивающих свет частиц рассчитываются в максимумах распределений взвешенных по интенсивности размеров.
Основные результаты работы приведены в табл. 3.
Таблица 3.
Основные результаты работы при 302 К (пять выделенных концентраций)
| τ1, ч | [ДМСО], мол. % | γ, град | R, нм | τ ,мс | k × 1012 [м2/с] |
|---|---|---|---|---|---|
| 144 | 0.79 | 30 | 4.0 | 4.53 | 3.80574 |
| 49 (24%) | 54.7 | 0.31517 | |||
| 72 | 2.45 | 30 | 1.0 (40%) | 1.23 | 14.01626 |
| 185 | 213 | 0.08094 | |||
| 72 | 5.63 | 40 | 294 (широкая л.) | 294 | 0.0333 |
| 144 | 12.75 | 40 | 1.9 (85%) | 1.23 | 7.96 |
| 100 | 65 | 0.151 | |||
| 72 | 18.49 | 40 | 0.57 (10%) | 0.36 | 27.19444 |
| 10.6 (10%) | 7.13 | 1.37307 | |||
| 162 | 102 | 0.09598 |
Программа позволяет разложить измеренную функцию не только по экспонентам. Динамическое светорассеяние отражает не только диффузионные, но и другие движения в жидкости. В наших экспериментах мы наблюдали функции, характерные для микрорасслаивания с вязкоупругими взаимодействиями, при концентрациях 5.63 и 6.87. Для остальных образцов с наблюдаемыми корреляционными функциями последние достаточно точно раскладывались по экспонентам, что свидетельствует о наличии частиц, движущихся диффузионно.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Рассмотрение интенсивностей рассеянного света, полученных при температурах 302 и 322 К, показывает увеличение интенсивности на 10-й день и с увеличением температуры для трех концентраций: ~2.5, 5.5–6.6, 18.49 мол. % ДМСО. Эти концентрации выпадают из общей картины зависимостей (табл. 2). Мы объясняем это сольвофобным эффектом ДМСО в растворе ЭГ [14]. Упрочнение сетки водородных связей ЭГ вследствие сольвофобной сольватации ДМСО, проявляющейся при ~ 2.5 мол. % ДМСО, и как следствие этого сольвофобное взаимодействие на сетке ЭГ молекул ДМСО, ведущее к образованию ассоциатов ДМСО, т.е. к микрорасслаиванию в системе, проявляющееся наиболее резко при ~6 мол. % ДМСО и идущее к настоящему расслаиванию в жидкой фазе при медленном нагревании образца после быстрого охлаждения до температуры стеклования, что показано на фазовой диаграмме системы ЭГ–ДМСО (рис. 1). Система с пространственной сеткой водородных связей чувствует жидкофазное расслаивание и по концентрации и по температуре задолго до критических условий жидкофазного расслаивания [24–26]. Наличие сетки определяет и размеры области расслаивания. Оно происходит благодаря большой упругости пространственной сетки Н-связей [14, 25, 26] и заканчивается с разрушением сетки молекулами ДМСО. Именно поэтому мы не получаем ассоциаты ДМСО при концентрациях выше 18.49 мол. % ДМСО (Приложение 1). Наибольшие радиусы ассоциатов и наименьшие коэффициенты их диффузии при концентрации 5.63 мол. % ДМСО через 72 ч после приготовления растворов (табл. 3). При концентрации 6.87 мол. % даже через 76 дней было замечено расслаивание. Большой разброс точек, показанный в приложении, обусловлен предкритическим состоянием системы, особенно в области концентраций 5–20 мол. % ДМСО.
Полученные в работе результаты очень важны как с научной, так и с прикладной точки зрения. Исследование этой системы следует продолжить и подтвердить полученные результаты другими методами.
Авторы благодарят д.х.н. Л.О. Кононова за полезные советы и обсуждение данной работы.
Исследование выполнено в рамках государственного задания ИОНХ РАН в области фундаментальных научных исследований при финансовой поддержке Российского фонда фундаментальных исследований в рамках научного проекта № 19-03-00215.
Список литературы
Cordeiro R.M., Stirling S., Fahy G.M., Magalhaes J.P. // Cryobiology. 2015. V. 71. P. 405.
Агаян Г.М., Балабаев Н.К., Родникова М.Н. // Журн. физ. химии. 2021. том 95. № 7. https://doi.org/10.31857/S0044453721070025.
Егоров Г.И., Макаров Д.М. // Там же. 2009. Т. 83. № 5. С. 805.
Родникова М.Н., Захарова Ю.А., Солонина И.А., Сироткин Д.А. // Там же. 2012. Т. 86. № 5. С. 993.
Родникова М.Н. // Там же. 1993. Т. 62. № 2. С. 275.
Кононова Е.Г., Родникова М.Н., Солонина И.А., Сироткин Д.А. // Там же. 2018. Т. 92. № 7. С. 1071.
Солонина И.А., Родникова М.Н., Киселев М.Р. и др. // Там же. 2018. Т. 92. № 5. С. 751.
Родникова М.Н., Каюмова Д.Б., Доброхотова Ж.В., и др. // Там же. 2007. Т. 81. № 11. С. 2107.
Comelli F., Ottani S., Francesconi R., Castellari C. // J. Chem. Eng. Data 2003. V. 48. P. 995.
Егоров Г.И., Макаров Д.М. // Журн. физ. химии. 2008. Т. 82. № 10. Р. 1982.
Westht P. // J. Phys. Chem. 1994. V. 98. P. 3222.
Rodnikova M.N., Idiyatullin Z.Sh., Barthel J. et al. // J. Mol. Liquids 2017. V. 248. P. 898.
Солонина И.А., Родникова М.Н., Захарова Ю.А. и др. // X Международное Курнаковское совещание по физико-химическому анализу. г. Самара. 2013. Т. 2. С. 289. ISSN: 978-5-7964-1644-0.
Rodnikova M.N. // J. Mol. Liquids. 2007. V. 136. P. 211.
Тюрин А.В., Солонина И.А., Родникова М.Н., Сироткин Д.А. // Журн. физ. химии. 2021. В печати.
Dynamic Light Scattering. The Method and Some Applications / Ed.by W. Brown. Clarendon Press. Oxford (England). New York.: Oxford University Press., 1993. P. 752.
Carl L. Yaws “Thermophysical Properties of Chemicals and Hydrocarbons” 2nd Edition // Gulf Professional Publishing 2014. P. 694.
Sedlak M. // J. Phys. Chem. B. 2006. V. 110. P. 4329.
Sedlak M. // Ibid. 2006. V. 110. P. 4339.
Sedlak M. // Ibid. 2006. V. 110. P. 13976.
Orlova A.V., Laptinskaya T.V., Malysheva N.N, Kononov L.O. // J. Solution Chem. 2020. V. 49. № 5. P. 629.
Лагодзинская Г.В., Лаптинская Т.В., Казаков А.И. // Изв. АН. Серия химическая 2018. № 12. С. 2212.
Provencher S.W. // Comput. Phys. Commun. 1982. V. 27. P. 213
Родникова М.Н., Ланшина Л.В., Чабан И.А. // Докл. АН СССР 1990. Т. 315. С. 148
Чабан И.А., Родникова М.Н., Чайков Л.Л. и др. // Журн. физ. химии. 1997. Т. 71. № 12. С. 2183.
Rodnikova M.N. // Acta Chim. Slov. 2009. V. 56. P. 215.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии


