Журнал физической химии, 2021, T. 95, № 7, стр. 1012-1017
Кинетика и механизм взаимодействия и трансальдимирования продуктов конденсации пиридоксаль гидрохлорида с L-α-, D- и β-аланинами
Ф. В. Пищугин a, *, И. Т. Тулебердиев a
a Институт химии и фитотехнологии Национальной Академии наук Киргизии
720071 Бишкек, Киргизия
* E-mail: pishugin@rambler.ru
Поступила в редакцию 28.09.2020
После доработки 28.09.2020
Принята к публикации 30.10.2020
Аннотация
Методами УФ-спектроскопии и поляриметрии изучены кинетика и механизм конденсации и трансальдимирования продуктов конденсации пиридоксаля с L-α-, D-α- и β-аланинами. Установлено, что пиридоксаль гидрохлорид взаимодействует с L-α-, D-α-аланинами стереоспецифично с образованием промежуточных продуктов строго определенной структуры, способствующих отщеплению атома водорода (с L-α-аланином) или СО2 (с D-α-аланином) с последующим образованием хиноидной структуры, гидролиз которой приводит к получению конечных продуктов. Изучены реакции трансальдимирования пиридоксалиден-β-аланина, пиридоксалиден-L-α- и пиридоксалиден-D-α-аланинами с L-α- и D-α-аланинами. Показано, что процесс трансальдимирования протекает через две стадии: первая стадия присоединения L-α- и D-α-аминокислот к основаниям Шиффа с образованием N-ацеталей строго определенной структуры: вторая стадия – отщепления одной из аминокислот с образованием новых оснований Шиффа. Предложены схемы механизмов изученных реакций
Пиридоксаль (PL) и пиридоксаль -5'-фосфат (PLP) являются коферментами огромного количества ферментативных процессов с их участием [1, 2]. Под действием этих коферментов происходит огромное количество химических превращений аминокислот (элиминирование, рацемизация, переаминирование, декарбоксилирование, расщепление боковых цепей аминокислот, трансальдимирование и т.д.).
Известно большое количество работ по изучению этих биохимических процессов под действием PLP-зависимых ферментов. Однако, из-за сложности ферментативных систем, быстрого и порой неоднозначного процесса их протекания возникают огромные трудности в изучении этих реакций. Поэтому в настоящее время для подтверждения предполагаемых схем биохимических превращений аминов и аминокислот используют модельные соединения, содержащие коферменты или их структурные аналоги.
Аминокислоты за исключением глицина оптически активные соединения, т.е. соединения, имеющие хиральные центры. Подавляющее количество аминокислот имеют один хиральный центр, за исключением изолейцина, треонина и 4-гидроксипролина имеющих два хиральных центра. Количество стереоизомеров определяется по формуле 2n, где n – количество хиральных центров. Для построения пространственной структуры белков α-аминокислоты человека и животных используются исключительно L-стереоизомерной формы. С этим связана стереоспецифичность действия ферментов с теми субстратами, которые имеют определенную конфигурацию.
α-аминокислоты D-ряда не используются для построения белков человеческого организма. D-α-аминокислоты встречаются во многих пептидах продуцируемых микроорганизмами, входят в состав биополимеров их клеточной ткани.
Введение в структуру белков и ферментов D-α-аминокислот вызывает негативные биохимические процессы, которые в конечном счете могут привести к фатальному исходу.
Одним из возможных путей включения D-α-аминокислот в структуру белков человеческого организма является процесс трансальдимирования белков, содержащих лизин, под действием кофермента-пиридоксаля или пиридоксаль-5'-фосфата.
Изучение процесса конденсации и трансальдимирования аминокислот в ферментативных системах представляют огромные трудности из-за очень быстрого и часто неоднозначного биохимического процесса. Поэтому в настоящее время для решения этой важной проблемы используют модельные соединения – продукты конденсации коферментов с L-α-аминокислотами и D-α-аминокислотами.
Работа посвящена изучению кинетики и механизма взаимодействия пиридоксаль гидрохлорида с L-α-, D-α- и β-аланинами, а также изучение реакции транальдимирования продуктов конденсации пиридоксаля с этими аминокислотами.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве объектов исследования использовались L-α- и D-α-аланины производства фирмы Reanal, Венгрия, пиридаксаль гидрохлорид марки “х.ч.” фирмы Ferak, Berlin. Основания Шиффа синтезировались и идентифицировались по методикам, приведенным в работе [3].
Кинетику трансальдимирования измеряли в термостатированных кюветах и поляриметрических трубках. Термостатирование проводилось при помощи термостата U-4 с точностью до ±0.1°С. За начало реакции принимался момент сливания растворов. Идентификацию продуктов реакции проводили методами элементного анализа, УФ-, ИК-спектроскопии, поляриметрии [3]. Константы скорости конденсации и трансальдимирования рассчитывались по уравнениям второго порядка для обратимых и необратимых реакций [4].
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Проведенные ранее нами исследования показали, что при взаимодействии пиридоксаля с L- и D-α-аланинами возникает новый хиральный центр в аминоспирте со знаками (+) при взаимодействии пиридоксаля с L-α-аланином и знаком (–) при взаимодействии пиридоксаля с D-α-аланином, абсолютные величины которых со временем увеличиваются [5]. Эти результаты можно объяснить тем, что присоединение NH2-группы аминокислот происходит не перпендикулярно плоскости карбонильной группы пиридоксаля, а вдоль ее плоскости с образованием аминоспирта и появлением хиральных центров. Далее, по-видимому, происходит поворотная изомерия с образованием промежуточных и конечных продуктов путем оптимизации их энергетических и геометрических параметров (увеличение абсолютного значения удельного угла вращения во времени). Возникает вопрос почему L- и D-α-аланины при взаимодействии с пиридоксалем образуют аминоспирты с различными знаками удельного угла вращения, а также почему абсолютные величины их со временем увеличиваются?
Для выяснения этого вопроса были рассмотрены структуры продуктов взаимодействия пиридоксаля с L-α- и D-α-аланинами с учетом оптимизации их геометрических и энергетических параметов в программе Hyper Chem. Структура этих продуктов рассматривалась путем расположения фрагмента пиридинового кольца ~90° от глаза наблюдателя (совмещение его атомов углерода в орто- и мета-положениях) . Анализ рассматриваемых структур, показал, что ОН-группа располагается приблизительно в одной плоскости пиридинового кольца (условно “левая часть”), СН2ОН-группа, ввиду нелинейности ее структуры, выступает за плоскость пиридинового кольца (условно “правая часть”). СН2ОН-группа в аминоспиртах находится слева, а аминокислотный фрагмент – справа от плоскости пиридинового кольца в случае конденсации D-α-аланина с пиридоксалем. Обратная картина наблюдается для аминоспиртов в случае конденсации L-α-аланина с пиридоксалем – (СН2ОН-группа – справа, аминокислотный фрагмент слева). Такое же расположение наблюдается и у оснований Шиффа – >С=N–R-группа – слева для D-α-аланинового фрагмента и справа для L-α-аланинового фрагмента.
На основании рассмотрения структур промежуточных продуктов конденсации пиридоксаля с L-α- и D-α-аланинами и их конечных продуктов – оснований Шиффа, можно сделать ряд предположений:
1. Карбонильная группа в пиридоксале расположена под углом 90° относительно плоскости пиридинового кольца.
2. Присоединение аминокислот к пиридоксалю происходит стереоспецифично вдоль плоскости карбонильной группы с образованием аминоспиртов и возникновением хиральных центров в них (появлением оптической активности).
3. Далее стереоспецифично происходит поворотная изомерия путем оптимизации геометрических и энергетических параметров аминоспиртов и оснований Шиффа, приводящих к изменению угла вращения за счет вращения аминоспиртовых фрагментов при хиральном центре относительно плоскости пиридинового кольца с образованием R (D)- или S (L)-изомеров.
Результаты проведенных исследований [6–12] взаимодействия пиридоксаля с различными по структуре аминокислотами и аминами показали:
1. β- и ε-аминокислоты (β-аланин и лизин) взаимодействуют с пиридоксалем с образованием оснований Шиффа, устойчивых к дальнейшим химическим превращения.
2. L-$\alpha ~$-аминокислоты, взаимодействуя с пиридоксалем образуют основания Шиффа, которые после отщепления α-водорода перестраиваются в хиноидную структуру с последующим гидролизом и образованием в качестве конечных продуктов – кетокислот и пиридоксамина.
3. Основания Шиффа с D-α-аминокислотами декарбосилируются с последующей перестройкой в хиноидную структуру с образованием после гидролиза пиридоксаля и этиламина.
Из литературных данных [13] известно, что образование новых оснований Шиффа, по-видимому, происходит путем присоединения аминогруппы не к $ > {\kern 1pt} {\text{C}}{\kern 1pt} = {\kern 1pt} {\text{C}}$-группы PLP-зависимых ферментов, а к С=NH+-группе, путем трансальдимирования. За стадией присоединения к продукту конденсации пиридоксаля с L-лизином следует стадия элиминирования ε-аминогруппы молекулы лизина. Косвенным доказательством этого предположения механизма служит предложенная авторами работы [13] гипотеза, что присоединение к НС=NH+-группе происходит гораздо быстрее, чем присоединение к HC=O-группе. Это подтверждается, по мнению авторов, исчезновением положительного кругового дихроизма при добавлении субстрата к коферменту, которое после превращения субстрата круговой дихроизм появляются вновь.
При взаимодействии пиридоксалиден-β-аланина с L-α-аланином при λ 430 нм оптическая плотность растворов смеси на стадии присоединения резко уменьшается, а затем со временем на стадии отщепления β-аланина– возрастает. При взаимодействии пиридоксалиден-β-аланина с D-α-аланином при той же длине волны оптическая плотность смеси растворов на первой стадии со временем резко возрастает, а затем на второй стадии медленно увеличивается до некоторого постоянного значения (рис. 1).
Рис. 1.
Изменение оптической плотности смеси 0.01 М растворов пиридоскалиден-β-аланина (1) с L-α- (2) и D-α-аланинами (3) по времени (90%-ный спиртово-водный буферный раствор, рН 6.7; Т = 20°С).
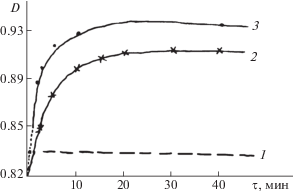
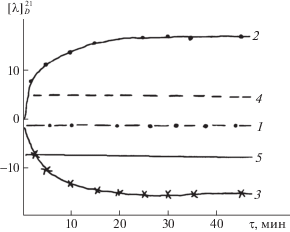
Анализ кинетических кривых позволил сделать предположение, что на первой стадии (быстрое увеличение или быстрое уменьшение оптической плотности смесей растворов) происходит присоединение NH2-групп аминокислот к основанию Шиффа с образованием промежуточного продукта аминаля. На второй стадии происходит отщепление β-аминокислоты с образованием конечного продукта –пиридоксалиден – L-α-аланина или пиридоксалиден-D-α-аланина. Возникает вопрос почему в результате взаимодействия пиридоксалиден- β-аланина с L-α-аланином на первой стадии происходит уменьшение оптической плотности смеси растворов, а при взаимодействии пиридоксалиден – β-аланина с D-α-аланином, наоборот – резкое увеличение оптической плотности смеси растворов, хотя согласно литературным данным и нашим экспериментальным данным на первой стадии образуется один и тот же промежуточный продукт – аминаль? Для выяснения этого вопроса была изучена кинетика и механизм трансальдимирования методом поляриметрии. На стадии присоединения к основанию Шиффа L-α-аланина или D-α-аланина должен возникнуть хиральный центр. Данные, приведенные на рис. 2, показывают, что при взаимодействии пиридаксалиден-β-аланина с L-α-аланином на первой стадии очень быстро образуется продукт, у которого удельный угол вращения – положительный. Обратная картина наблюдается при взаимодействии пиридоксалиден-β-аланина с D-α-аланином. Очень быстро образуются промежуточный продукт – аминаль с отрицательным удельным углом вращения.
Рис. 2.
Изменение удельных углов вращения во времени при взаимодействии 0.01 М смеси раствора пиридаликсен-β-аланина (1) с L-α-аланином (2) и D-α-аланином (3) на стадии образования N-ацеталей (90°-ный спиртово-водный буферный раствор, рН 6.7; Т = = 20°С. DigiPol DS Automatic Sacsharimeter, USA; удельные углы вращения L-α-аланина (4) и D‑α-аланина (5).
Критический анализ кинетических кривых методами УФ-спектроскопии, поляриметрии, а также рассмотрение структуры промежуточных (аминалей) и конечных продуктов по программе Hyper Chem показал:
1. В основаниях Шиффа и (пиридоксалиден-β-аланина) и в конечных продуктах аминная группа развернута на 90° относительно плоскости пиридинового кольца.
2. Присоединение аминокислоты к основанию Шиффа происходит стереоспецифично – вдоль плоскости $ > {\kern 1pt} {\text{C}}{\kern 1pt} = {\kern 1pt} {\text{NH}}{\kern 1pt} - $ группы из-за пространственных затруднений (наличие ОН- и СН2ОН-групп в орто-положении ) с образованием аминаля ($ - {\kern 1pt} {\text{CH}}{\kern 1pt} < {\kern 1pt} \begin{array}{*{20}{c}} {{\text{NHR}}} \\ {{\text{NHR}}{\kern 1pt} '} \end{array}$) в строго определенных положениях аминокислотных фрагментов в пространстве. При этом происходит очень быстрое изменение оптической плотности смеси растворов (резкое увеличение или резкое уменьшение) с возникновением хиральных центров.
3. Затем, по-видимому, происходит поворотная изомерия за счет оптимизации геометрических и энергетических параметров с отщеплением одного из компонентов в N-аминалях (программа Hyper Chem).
Попытки выделить аминали не увенчались успехом даже при проведении реакций при низких температурах из-за большой нестабильности промежуточных продуктов. Возникает вопрос почему при взаимодействии пиридаксалиден-β-аланин с L-α- и D-α- аланинами образуются аминали с различными знаками удельных углов вращения с изменениями их абсолютных величин во времени? Для объяснения этого сложного вопроса были рассмотрены структуры аминалей и оснований Шиффа в программе Hyper Chem с учетом оптимизации их геометрических и энергетических параметров. Поскольку, как отмечалось ранее, $ > {\kern 1pt} {\text{C}}{\kern 1pt} = {\kern 1pt} \mathop {{\text{NHR}}}\limits^ + $- и $ > {\kern 1pt} {\text{C}}{\kern 1pt} < {\kern 1pt} \begin{array}{*{20}{c}} {\mathop {{\text{N}}{{{\text{H}}}_{{\text{2}}}}{\text{R}}}\limits^ + } \\ {{\text{NHR'}}} \end{array}$-группы развернуты относительно плоскости пиридинового кольца ~90° от глаза наблюдателя структура промежуточных и конечных продуктов рассматривалась путем совмещения атомов углерода пиридинового кольца в орто- и мета-положениях. Анализ рассматриваемых структур показал, что орто-ОН-группа расположена приблизительно в одной плоскости пиридинового кольца (условно “левая часть”), а CH2OH-группа ввиду ее нелинейности выступает за плоскость пиридинового кольца (условно “правая часть”).
D-α-аминокислотный фрагмент в N-аминалях и основаниях Шиффа располагается “слева”, а β-аминокислотный фрагмент в этих структурах располагается “справа”. Поэтому при взаимодействии пиридоксалиден-β-аланина с L-α- и D-α-аланинами в качестве промежуточных продуктов образуются N-аминали с различным расположением аминокислотных фрагментов в пространстве относительно плоскости пиридинового фрагмента с образованием двух конфигураций R (D+) и S (L–).
Далее происходит отщепление одного из фрагментов в N-аминалях с одновременной поворотной изомерией с образованием конечного продукта с оптимальными энергетическими и геометрическими параметрами. Эти экспериментальные данные, по-видимому, объясняют взаимосвязь величин удельного угла вращения и его знак со структурой промежуточных и конечных продуктов, обнаруженных методами УФ-спектроскопии.
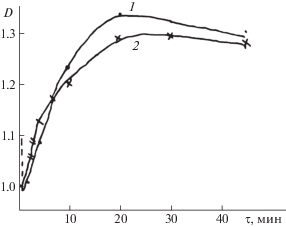
Изучение кинетики и механизма трансальдемирования продуктов конденсации L-α-аланина и D-α-аланина с пиридоксалем УФ-спетрофотометрическим методом показало, что реакция протекает через две кинетически различимые стадии: 1 – стадия присоединения аминокислот к основанию Шиффа с образованием промежуточного продукта – N-аминаля, 2 – стадия отщепления одного из энантиомеров аминокислот с образованием нового основания Шиффа. Это доказывается кинетическими кривыми зависимости изменения оптической плотности смеси реагирующих растворов во времени. Согласно данным рис. 3 на первой стадии – стадии присоединения происходит в обеих случаях резкое уменьшение оптической плотности смеси растворов, а затем на второй стадии увеличение оптической плотности за счет образования нового основания Шиффа.
Рис. 3.
Изменение оптической плотности смеси 0.01 М растворов пиридоксалиден-L-α-аланина с D‑α-аланином (1) и пиридоксалиден-D-α-аланина с L-α-аланином (2) на стадии дезаминирования N‑аминалей во времени (90%-ный спиртово-водный буферный раствор, рН 6.65, Т = 20°С).
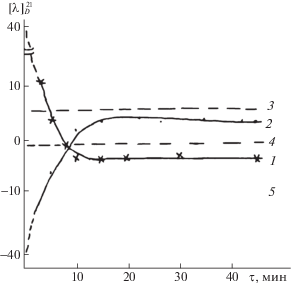
При таком предполагаемом механизме трансальдимирования на стадии присоединения аминокислоты к основанию Шиффа должен возникнуть хиральный центр. Изучение кинетики и механизма трансальдимирования энантиомеров аланина поляриметрическим методом показало, что при сливании растворов в начальный момент времени наблюдается резкое понижение положительного удельного угла вращения при взаимодействии пиридоксалиден-L-α-аланина с D-α-аланином (стадия присоединения), а затем медленно положительный удельный угол вращения уменьшается, переходя в отрицательный, на стадии отщепления L-α-аланина и образования пиридоксалиден-D-α-аланина. Обратная картина наблюдается при взаимодействии пиридоксалиден-D-α-аланина с L-α-аланином (рис. 4). На первой стадии наблюдается вначале времени резкое уменьшение отрицательного удельного угла вращения, а затем медленно удельный угол вращения переходит от отрицательного значения в положительное на стадии дезаминирования и образования нового основания Шиффа.
Рис. 4.
Изменение удельных углов вращения при взаимодействии пиридоксалиден-L-α-аланина с D-α-аланином (1) и пиридоксалиден-D-α-аланина с L-α-аланином (2), 3 – [α] – L-α-аланин, 4 – [α] – D-α-аланин (90%-ный буферный раствор, рН 6.65, Т = 20°С).
Изучение кинетики и механизма взаимодействия пиридаксалиден- L-α- и пиридаксалиден- D-α-аланинами с D-α- и L-α-аланинами соответственно использованием программы Hyper Chem показало, что в результате присоединения этих аминокислот к основаниям Шиффа образуются в качестве промежуточных продуктов – N‑аминали с различным расположением аминных фрагментов в них относительно плоскости пиридинового цикла. Эти соединения, по всей вероятности, имеют различные знаки и величины удельных углов вращения. Аналогичные зависимости структур промежуточных продуктов – аминалей и новых оснований Шиффа наблюдается в реакциях трансальдимирования с L-α-аланина и D-α-аланина под действием пиридоксаля. В целом механизм трансальдимирования можно представить:
Таким образом, результаты кинетических и структурных исследований позволили сделать ряд важных выводов для биохимии и решения ферментативных проблем.
1. В пиридоксале карбонильная группа развернута на 90° относительно плоскости пиридинового фрагмента.
2. В продуктах взаимодействия пиридоаксаля с L-α- и D-α-аминокислотами аминные фрагменты в основаниях Шиффа развернуты относительно плоскости пиридинового фрагмента на ~90°.
3. При конденсации пиридоксаля с аминокислотами и трансальдимировании оснований Шиффа с аминокислотами реагент атакует –HC=NR-связи вдоль их плоскостей расположения в пространстве.
4. Структура образующихся промежуточных продуктов (аминоспиртов и N-аминалей), их оптические свойства (величины и знак удельных углов вращения), определяются различным расположением ОН-групп и аминных фрагментов относительно плоскости пиридинового кольца.
Список литературы
Мецлер Д. Биохимия. М.: Мир, 1980. Т. 2. С. 5–27.
Ivanov V.I., Karpeisky M.Ya. // Adv. Enzymol. 1969. T. 32. C. 21.
Пищугин Ф.В., Тулебердиев И.Т. // Известия НАН КР, 2012. № 2. С. 96.
Лейдлер К. Кинетика органических реакций. М: Мир, 1966. С. 31.
Пищугин Ф.В., Тулебердиев И.Т. // ЖОХ. 2009. Т. 79. Вып. 1. С. 120. https://doi.org/10.1134/S1070363209010174
Баделин В.Г., Венедиктов Е.А., Баранников В.П. // Химия и хим. технология, 2007. Т. 50. Вып. 12. С. 34.
Венедиктов Е.А., Баранников В.П., Баделин В.Г. // Там же. 2009. Т. 52. Вып. 1. С. 36.
Баранников В.П., Баделин В.Г., Венедиктов Е.А., и др. // Журн. физ. химии. 2011. Т. 85. № 1. С. 20. DOI.org/10.1134/S003602441101002X
Пищугин Ф.В., Тулебердиев И.Т. // ЖОХ. 2010. Т. 80. Вып. 9. С. 1518. https://doi.org/10.1134/S1070363210090203
Пищугин Ф.В., Тулебердиев И.Т. // Там же. 2012. Т. 82. Вып. 7. С. 1168. https://doi.org/10.1134/S1070363212070146
Пищугин Ф.В., Тулебердиев И.Т. // Там же. 2014. Т. 84. Вып. 7. С. 1167. https://doi.org/10.1134/S1070363214070196
Пищугин Ф.В., Тулебердиев И.Т. // Журн. физ. химии. 2017. Т. 91 № 10. С. 1648. https://doi.org/10.7868/S0044453717100326
Gordes E.H., Jencks W.P. // Biochemistry. 1972. V. 1. P. 773.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии