Журнал физической химии, 2021, T. 95, № 8, стр. 1156-1164
Политермическое исследование двух- и трехжидкофазных состояний и эффектов всаливания–высаливания в тройной системе иодид калия–вода–триэтиламин
Д. Г. Черкасов a, *, А. И. Калмыкова a, В. В. Данилина a
a Институт химии, Саратовский национальный исследовательский государственный университет
имени Н.Г. Чернышевского
Саратов, Россия
* E-mail: dgcherkasov@mail.ru
Поступила в редакцию 20.06.2020
После доработки 15.12.2020
Принята к публикации 16.12.2020
Аннотация
Визуально-политермическим методом в интервале 0.0–60.0°C изучены фазовые равновесия и критические явления в смесях компонентов тройной системы иодид калия – вода–триэтиламин, в которой жидкостная подсистема расслаивается с нижней критической температурой растворения 18.3°C. В смесях компонентов осуществляются двух- и трехжидкофазные состояния, монотектика, насыщенные растворы. Определена температура образования критической ноды монотектического состояния (1.9°C). Построенные при пятнадцати температурах изотермы фазовых состояний выявили топологическую трансформацию фазовой диаграммы изученной системы. Небольшие концентрации иодида калия оказывают всаливающее действие на гетерогенные смеси воды и триэтиламина, вызывая их гомогенизацию. Дальнейшее введение иодида калия в гомогенные трехкомпонентные смеси и повышение температуры приводят к их расслаиванию. На фазовой диаграмме существует поле трех жидких фаз внутри поля двухжидкофазного состояния в интервале 10.1–18.4°С. Возможно, что возникновение и исчезновение третьей жидкой фазы вызвано всаливающим–высаливающим действием иодида калия на гидраты триэтиламина. Установлено, что иодид калия эффективно высаливает триэтиламин из его водных растворов выше 20.0°C и исследованную систему можно использовать в качестве экстракционной.
Настоящее исследование является продолжением цикла работ [1–4], посвященных выявлению природы соли и температуры на фазовое поведение двойной жидкостной системы вода–триэтиламин. Эта двойная система характеризуется расслаиванием с нижней критической температурой растворения (НКТР), определенные значения которой многочисленны и различаются в пределах от 17.55°С [5] до 18.7°C [6]. Смеси компонентов двойной системы вода–триэтиламин подробно изучены по ряду физико-химических свойств [7–23]. Авторы работ делают выводы о существовании прочных межмолекулярных взаимодействий между компонентами, образовании гидратов за счет водородных связей и ассоциатов клатратного типа, содержащих на молекулу амина от одной до девяти молекул воды. В работе [24] приведена фазовая диаграмма двойной системы триэтиламин–вода, на которой отмечен плавящийся конгруэнтно при –22°С дигидрат триэтиламина.
Актуальность исследования влияния солей на систему вода–триэтиламин обусловлена возможностью изменения температурно-концентрационного интервала существования области расслоения, что открывает возможности к оптимизации технологических процессов, таких как жидкостная экстракция органических веществ и экстрактивная кристаллизация солей. Нитраты натрия (калия, цезия) [1–4] и хлориды натрия (калия) [25] увеличивают область расслаивания и понижают НКТР системы вода–триэтиламин, т.е. оказывают высаливающее действие. Роданиды натрия (калия) [26, 27] при небольших концентрациях в водно-триэтиламиновых растворах увеличивают взаимную растворимость жидких компонентов вплоть до гомогенизации растворов, т.е. наблюдается всаливание. Дальнейшее добавление этих солей и повышение температуры ведет к появлению второй области расслоения вследствие высаливающего действия солей. В работе [28] отмечено аналогичное влияние иодида калия на равновесие жидкость–жидкость в некоторых смесях воды и триэтиламина, однако авторы подробно не исследовали наблюдаемый эффект, не построили фазовые диаграммы при различных температурах, не дали рекомендаций для его практического использования.
Цель данной работы – выявление закономерностей топологической трансформации фазовой диаграммы тройной системы иодид калия–вода–триэтиламин при изучении фазовых равновесий, критических явлений, эффектов всаливания–высаливания и установление зависимости эффекта высаливания триэтиламина из водных растворов от температуры.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Вещества, использованные для исследования, тщательно очищали. Воду и триэтиламин квалификации “ч.” подготовили как описано в работе [1], препарат иодид калия квалификации “х.ч.” – как изложено в работе [29].
Фазовые равновесия и критические явления в смесях компонентов тройной системы KI–H2O–(C2H5)3N изучали визуально-политермическим методом [30] в стеклянных ампулах при давлении паров в интервале температур 0–60°С по методике, изложенной в [29]. Ампулы со смесями запаивали и поочередно помещали в ультатермостат Lauda A-100 с прозрачными стенками, в котором поддерживали температуру с точностью 0.05°С. В качестве рабочей жидкости использовали дистиллированную воду. Температуру измеряли с помощью электронного лабораторного термометра ЛТ-300-Н с точностью 0.05°С. Вблизи температуры фазового перехода нагревание и охлаждение рабочей жидкости проводили с малой скоростью (около 0.5 град/мин). Температуру фазового перехода в случае жидкофазных равновесий определяли путем последовательного нагревания и охлаждения каждой смеси при периодическом перемешивании содержимого ампулы, отмечая визуально исчезновение или образование второй или третьей жидкой фазы. Температуру фазового перехода с образованием/растворением твердой фазы определяли путем медленного нагревания при постоянном перемешивании содержимого ампулы, отмечая визуально исчезновение последнего кристалла (в изучаемой системе твердая фаза характеризовалась положительным температурным коэффициентом растворимости). Каждое значение температуры фазового перехода являлось средним результатом нескольких повторных измерений и характеризовалось погрешностью ±0.1°С [29].
Составы растворов, отвечающие критическим точкам растворимости, определяли методом отношения объемов жидких фаз [31]. Равновесие двух и трех жидких фаз в смесях компонентов устанавливалось в течение 1 ч, равновесия с участием жидких и твердой фаз достигалось через 3 ч при непрерывном перемешивании смеси. Признаком установления равновесия являлась воспроизводимость результатов измерений температуры фазового перехода при подходе к ней со стороны как более низких, так и более высоких температур.
Равновесную твердую фазу в смесях компонентов тройной системы идентифицировали методами термического (дериватограф OD-102 фирмы МОМ, Венгрия) и рентгенофазового (дифрактометр ДРОН-3) анализа.
По результатам исследования для каждого сечения строили графические зависимости температур фазовых переходов от содержания одного из компонентов в смесях всех компонентов системы (политермы фазовых состояний). Используя политермы фазовых состояний системы по всем сечениям и полученные зависимости состава критического раствора от температуры (критические кривые), методом графической интерполяции определяли составы смесей, отвечающие точкам фазовых переходов при выбранных температурах [29]. Относительная погрешность определения составов смесей, отвечающих точкам фазовых переходов при выбранных температурах, была ±0.5–1.0%.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Охарактеризуем растворимость и фазовые равновесия в двойных системах, составляющих изучаемую тройную систему KI–H2O–(C2H5)3N. Система H2O–(C2H5)3N расслаивается с НКТР, значения которой, найденные разными авторами, значительно отличаются [5, 6]. Определенная нами НКТР равна 18.3°С, содержание триэтиламина в критическом растворе составляет 32.10 мас. % [1]. Диаграмма растворимости двойной системы иодид калия–вода характеризуется эвтектическим равновесием при –23.2°С (51.9 мас. % соли), твердыми фазами которого является лед и индивидуальный иодид калия [32]. Иодид калия хорошо растворим в воде и имеет положительный температурный коэффициент растворимости [32]. Растворимость KI в триэтиламине ранее не изучалась; проведенное исследование показало, что эта соль в нем практически не растворима.
Фазовые равновесия были изучены в смесях компонентов тройной системы тройной системе KI–H2O–(C2H5)3N, составы которых изменялись по четырнадцати сечениям концентрационного треугольника. Смеси компонентов сечений I–XI характеризовались переменным содержанием иодида калия и постоянным соотношением масс триэтиламина и воды: 10 : 90 (I), 20 : 80 (II), 25 : 75 (III), 27 : 73 (IV), 33 : 67 (V), 35 : 65 (VI), 48 : 52 (VII), 61 : 39 (VII), 73 : 27 (IX), 84 : 16 (X), 89 : 11 (XI).
Политерма фазовых состояний по сечению I (рис. 1) состоит из четырех кривых, сходящихся в одной точке и отделяющих друг от друга четыре поля фазовых состояний: ненасыщенные растворы ℓ, насыщенные растворы ℓ + S (S – иодид калия), расслоение ℓ1 + ℓ2 (ℓ1 – органическая фаза, ℓ2 – водная фаза) и монотектика ℓ1 + ℓ2 + S (рис. 1). Политермы сечений II-XI аналогичны. В качестве примера на рис. 1 представлена политерма сечения VII. Как и на политерме сечения I, четыре кривые сходятся в точке и отделяют друг от друга те же самые поля фазовых состояний. Отличие состоит в резком изломе линии растворимости соли при переходе из монотектического состояния в расслоение в интервале 10.0-20.0°С. Подобное поведение можно объяснить наличием на поле двух жидких фаз замкнутого поля трех жидких фаз ℓ1 + ℓ2 + ℓ3 в интервале от 13.9–18.3°С. Можно предположить, что возникновение и исчезновение третьей фазы обусловлено всаливающим–высаливающим действием иодида калия на гидраты амина, существующие в водно-триэтиламиновых растворах [7–24]. Возможно, гидраты амина оказываются настолько прочными в определенном температурно-концентрационном интервале, что способны образовывать отдельную среднюю фазу при введении соли в водно-триэтиламиновые растворы.
Рис. 1.
Политермы фазовых состояний тройной системы иодид калия–вода–триэтиламин по сечениям I, VII и XIV треугольника состава.

Смеси компонентов по сечениям XII–XIV характеризовались переменным содержанием триэтиламина и постоянным соотношением масс иодида калия и воды: 21:79 (XII), 49:51 (XIII). 67:33 (XIV). Политерма сечения XIV (рис. 1) состоит из двух кривых, разделяющих поля ℓ1 + S, ℓ2 + S и ℓ1 + ℓ2 + S. Эти кривые соединяются в критической точке KS, которой соответствует смесь с равными объемами двух жидких фаз в равновесии с кристаллами иодида калия (S) при 1.9°С. Очевидно, точка KS принадлежит критической ноде монотектики и эта температура является минимальной, при которой существует расслаивание в системе.
Для определения зависимости состава критического раствора от температуры были изучены смеси компонентов по ряду дополнительных сечений треугольника состава (рисунок не приводится). Установлено, что введение иодида калия в смесь критического состава двойной системы вода–триэтиламин приводит вначале к повышению критической температуры от 18.3 (НКТР) до 21.6°С, а при концентрации более 6 мас. % соли к ее резкому снижению. Это указывает на переход от всаливающего действие иодида калия к высаливающему при повышении его концентрации.
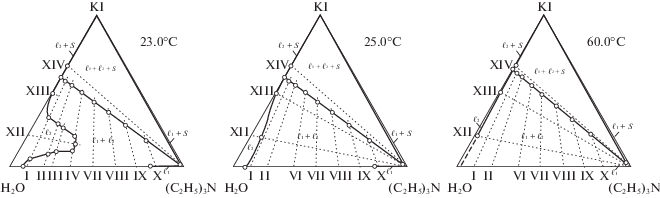
Политермические данные использовали для графического определения составов смесей, соответствующих точкам фазовых переходов при выбранной температуре. Результаты определения растворимости компонентов приведены в табл. 1 (данные о растворимости иодида калия в воде взяты из справочника [33]). На рис. 2–4 изображены изотермы фазовых состояний системы при 0.0, 1.9, 5.0, 10.0, 12.0, 13.0, 14.0, 15.0, 17.0, 18.0, 18.3, 21.0, 23.0, 25.0 и 60.0°С, которые позволили выяснить топологическую трансформацию фазовой диаграммы тройной системы.
Таблица 1.
Растворимость компонентов (мас. %) тройной системы иодид калия (I)–вода (II)–триэтиламин (III) (состав насыщенного раствора)
| I | II | III | I | II | III | I | II | III | I | II | III |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 0.0°C | 15.0°C | ||||||||||
| 56.5 | 43.5 | 0.0 | 25.0 | 29.3 | 45.8 | 36.8 | 42.6 | 20.9 | 5.6 | 10.4 | 84.0 |
| 51.8 | 43.4 | 4.82 | 17.6 | 22.2 | 60.2 | 36.4 | 41.3 | 22.3 | 1.4 | 5.1 | 93.5 |
| 47.0 | 42.4 | 10.6 | 10.0 | 14.4 | 75.6 | 17.0°C | |||||
| 38.6 | 39.9 | 21.5 | 1.0 | 3.6 | 95.4 | 58.8 | 41.2 | 0.0 | 28.4 | 37.2 | 34.4 |
| 31.6 | 35.6 | 32.8 | 48.2 | 50.2 | 1.6 | 21.8 | 30.5 | 47.7 | |||
| 1.9°C | 44.6 | 49.9 | 5.5 | 15.0 | 22.9 | 62.1 | |||||
| 56.8 | 43.2 | 0.0 | 32.2 | 35.3 | 32.5 | 40.6 | 47.5 | 11.9 | 9.7** | 14.9** | 75.4** |
| 52.0 | 43.2 | 4.8 | 25.4 | 29.1 | 45.5 | 38.2 | 46.3 | 15.5 | 8.4 | 12.8 | 78.8 |
| 49.5* | 42.3* | 8.2* | 17.9 | 22.2 | 59.9 | 37.8 | 45.4 | 16.8 | |||
| 47.8 | 41.8 | 10.4 | 9.5 | 14.5 | 76.0 | 18.0°C | |||||
| 39.6 | 39.3 | 21.1 | 1.0 | 3.7 | 95.3 | 58.8 | 41.2 | 0.0 | 33.6 | 43.2 | 23.2 |
| 5.0°C | 48.2 | 50.2 | 1.6 | 27.6 | 37.6 | 34.8 | |||||
| 57.0 | 43.0 | 0.0 | 33.6 | 34.5 | 31.9 | 43.2 | 51.1 | 5.7 | 20.8 | 30.9 | 48.3 |
| 51.4 | 43.7 | 4.9 | 26.2 | 28.8 | 45.0 | 39.2 | 48.6 | 12.2 | 13.6 | 33.8 | 52.6 |
| 48.4** | 42.9** | 8.7** | 14.6 | 23.1 | 62.3 | 37.5 | 46.9 | 15.6 | 9.1** | 16.5** | 74.4** |
| 47.0 | 42.4 | 10.6 | 10.0 | 14.4 | 75.6 | 36.8 | 46.1 | 17.1 | 6.8 | 14.9 | 78.3 |
| 40.2 | 38.9 | 20.9 | 34.2 | 44.1 | 21.7 | 1.7 | 6.3 | 92.0 | |||
| 10.0°C | 18.3°C | ||||||||||
| 57.4 | 42.6 | 0.0 | 38.7 | 46.0 | 15.3 | 58.8 | 42.2 | 0.0 | 33.8 | 43.0 | 23.2 |
| 48.6 | 46.3 | 5.1 | 32.8 | 43.7 | 23.5 | 48.2 | 50.1 | 1.7 | 26.4 | 38.3 | 35.3 |
| 45.9** | 44.6** | 9.5** | 26.6 | 38.2 | 35.2 | 41.4 | 52.8 | 5.9 | 20.2 | 31.1 | 48.7 |
| 45.8 | 43.4 | 10.8 | 17.9 | 32.0 | 50.1 | 40.0 | 48.0 | 12.0 | 13.6 | 23.3 | 63.1 |
| 41.8 | 43.3 | 14.7 | 11.2 | 14.2 | 74.6 | 37.2 | 47.1 | 15.7 | 8.2** | 17.4** | 74.4** |
| 12.0°C | 36.5 | 46.4 | 17.1 | 6.5 | 15.0 | 78.5 | |||||
| 58.0 | 42.0 | 0.0 | 32.2 | 35.3 | 32.5 | 33.9 | 44.3 | 21.8 | 1.7 | 6.5 | 91.8 |
| 48.4 | 46.4 | 5.2 | 25.6 | 29.0 | 45.4 | 20.0°C | |||||
| 44.8** | 45.0** | 10.2** | 18.6 | 22.0 | 59.4 | 59.0 | 41.0 | 0.0 | 0.8 | 2.8 | 96.4 |
| 44.6 | 44.3 | 11.1 | 10.8 | 14.3 | 74.9 | 48.4 | 50.3 | 1.3 | 0.0 | 88.0 | 12.0 |
| 42.1 | 43.9 | 14.0 | 7.0 | 10.2 | 82.8 | 39.0 | 54.9 | 6.1 | 1.7 | 78.6 | 19.7 |
| 37.6 | 40.6 | 21.8 | 1.2 | 4.4 | 94.4 | 37.5 | 50.0 | 12.5 | 1.6 | 64.0 | 34.4 |
| 13.0°C | 31.2 | 44.7 | 24.1 | 1.6** | 61.4** | 37.0** | |||||
| 58.4 | 41.6 | 0.0 | 37.6 | 40.6 | 21.8 | 23.4 | 39.8 | 36.8 | 1.2 | 51.4 | 47.4 |
| 47.6 | 47.2 | 5.2 | 31.6 | 35.6 | 32.8 | 17.0 | 32.4 | 50.6 | 1.0 | 38.6 | 60.4 |
| 43.0** | 46.2** | 10.8** | 25.2 | 29.2 | 45.6 | 10.4 | 24.2 | 65.4 | 0.7 | 26.8 | 72.5 |
| 44.2 | 44.6 | 11.2 | 17.9 | 22.2 | 59.9 | 6.8** | 21.4** | 71.8** | 0.0 | 21.7 | 78.3 |
| 41.6 | 43.8 | 14.6 | 10.7** | 14.7** | 74.8** | 4.6 | 15.3 | 80.1 | |||
| 40.4 | 43.5 | 16.1 | 10.4 | 14.3 | 75.3 | 23.0°C | |||||
| 37.8 | 41.7 | 20.5 | 6.5 | 10.3 | 83.2 | 59.6 | 40.4 | 0.0 | 19.3 | 79.8 | 1.1 |
| 14.0°C | 43.6 | 55.3 | 1.1 | 10.0 | 67.5 | 22.5 | |||||
| 58.4 | 41.6 | 0.0 | 36.8 | 41.1 | 22.12 | 32.4 | 60.9 | 6.7 | 9.8 | 58.6 | 31.6 |
| 47.0 | 47.7 | 5.3 | 30.8 | 36.0 | 33.2 | 28.0 | 57.6 | 14.4 | 7.8 | 73.8 | 18.4 |
| 46.1 | 47.9 | 6.0 | 24.6 | 29.4 | 46.0 | 25.0 | 56.25 | 18.75 | 5.0 | 85.5 | 9.5 |
| 42.8 | 45.8 | 11.4 | 17.4 | 22.3 | 60.3 | 20.8 | 78.1 | 1.1 | 0.0 | 89.0 | 11.0 |
| 41.0 | 44.2 | 14.8 | 10.5** | 21.2** | 68.3** | 19.6 | 52.26 | 28.14 | 0.0 | 20.0 | 80.0 |
| 39.8 | 43.9 | 16.3 | 10.4 | 14.3 | 75.3 | 25.0°C | |||||
| 37.4 | 41.9 | 20.7 | 6.2 | 10.3 | 83.5 | 59.8 | 40.2 | 0.0 | 0.0 | 90.0 | 10.0 |
| 15.0°C | 48.6 | 50.5 | 0.9 | 0.0 | 18.0 | 82.0 | |||||
| 58.5 | 41.5 | 0.0 | 30.2 | 36.3 | 33.5 | 19.5 | 73.5 | 7.0 | |||
| 47.1 | 49.1 | 3.8 | 23.8 | 29.7 | 46.5 | 60.0°C | |||||
| 42.0 | 46.4 | 11.6 | 17.4 | 22.3 | 60.3 | 63.8 | 36.3 | 0.0 | 20.7 | 77.9 | 1.4 |
| 40.4 | 44.7 | 14.9 | 9.7 | 14.4 | 75.9 | 48.8 | 50.8 | 0.4 | |||
| 39.2 | 44.4 | 16.4 | 7.2** | 13.0** | 79.8** | ||||||
Рис. 2.
Изотермы фазовых состояний (мас. %) тройной системы иодид калия–вода–триэтиламин при 0.0, 1.9, 5.0, 10.0, 12.0 и 13.0°С.

Рис. 3.
Изотермы фазовых состояний (мас. %) тройной системы иодид калия–вода–триэтиламин при 14.0, 15.0, 17.0, 18.0, 18.3 и 21.0°С.
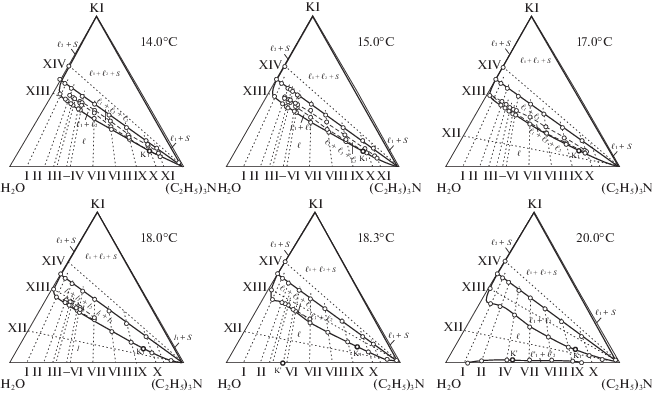
Рис. 4.
Изотермы фазовых состояний (мас. %) тройной системы иодид калия–вода–триэтиламин при 23.0, 25.0 и 60.0°С.
В интервале 0.0–1.9°С фазовые диаграммы системы характеризуются наличием плавной линии растворимости, разделяющей поля гомогенного жидкого состояния ℓ и насыщенных растворов ℓ + S (изотерма при 0.0°С, рис. 2). При 1.9°С на поле насыщенных растворов возникает критическая нода KS монотектического состояния. В критической конечной точке K две жидкие фазы ℓ1 (органическая) и ℓ2 (водная) идентичны по составу и свойствам.
С повышением температуры критическая нода KS, как и в ранее изученных системах с нитратами натрия (калия, цезия) [1–3], трансформируется в монотектический треугольник. На изотерме при 5.0°С (рис. 2) располагается небольшой треугольник монотектического состояния ℓ1 + ℓ2 + S с примыкающими к нему полями насыщенных растворов ℓ1 + S и ℓ2 + S и узким полем расслоения ℓ1 + ℓ2 с критической точкой K растворимости. С дальнейшим повышением температуры (изотерма при 10.0°С, рис. 2) треугольник монотектического состояния и поле расслоения увеличиваются.
В двойной системе вода–триэтиламин образуются гидраты различного состава [7–24], в том числе и моногидрат (С2Н5)3N · H2O, содержащий 84.8 мас. % амина. На изотерме при 12.0°С в указанной области концентраций амина на поле двух жидких фаз ℓ1 + ℓ2 появляется небольшое поле трех жидких фаз ℓ1 + ℓ2 + ℓ3, граница которого обозначена пунктирной линией на изотермах (рис. 2, табл. 2). В тройных жидкостных системах равновесие трех жидких фаз изображается треугольником [33]. Однако на изотермах исследованной системы поле трехжидкофазного состояния (рис. 2, 3) не имеет такой формы. Возможно это косвенно указывает, что данная система формально в определенном температурном интервале относится к трехкомпонентным, по сути являясь четырехкомпонентной. Можно предположить, что четвертым компонентом выступают жидкие гидраты триэтиламина или же их смесь переменного состава [7–24]. Их правильно называть составной частью системы, поскольку они образуются в результате химических реакций компонентов системы – воды и триэтиламина. Как известно, если в системе протекают химические реакции, то число компонентов равно числу составных частей, уменьшенному на число независимых химических реакций, которые идут в ней [30]. Поэтому изученная система все равно остается трехкомпонентной. Наличие в смесях компонентов гидратов триэтиламина позволяет отнести изученную систему к типу соль–три растворителя. Графическим подтверждением этой гипотезы является овальная форма поля трех жидких фаз, характерная для разрезов четырехкомпонентных систем соль–три растворителя с наличием трехжидкофазного и четырехфазного (три жидкие и одна твердая фазы) состояний [34]. Изучение причин появления области трех жидких фаз на фазовых диаграммах будет предметом отдельного исследования.
Таблица 2.
Составы смесей, соответствующие точкам на кривой, разделяющей поля двух и трех жидких фаз тройной системы иодид калия (I)–вода (II)–триэтиламин (III)
| I | II | III | I | II | III | I | II | III | I | II | III |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 12.0°C | 15.0°C | ||||||||||
| 11.8 | 14.1 | 74.1 | 10.0 | 9.9 | 80.1 | 17.6 | 22.3 | 60.1 | 43.0 | 41.6 | 15.4 |
| 7.4 | 10.2 | 82.4 | 13.8 | 13.8 | 72.4 | 10.2 | 14.4 | 75.4 | 44.1 | 41.9 | 14.0 |
| 13.0°C | 7.8 | 10.1 | 82.1 | 45.7 | 43.4 | 10.9 | |||||
| 37.2 | 32.7 | 30.1 | 9.2 | 10.0 | 80.8 | 17.0°C | |||||
| 29.0 | 27.7 | 43.3 | 14.0 | 13.8 | 72.2 | 42.4 | 46.1 | 11.5 | 10.4 | 14.3 | 75.3 |
| 21.2 | 21.3 | 57.5 | 23.0 | 20.8 | 56.2 | 40.2 | 44.8 | 15.0 | 18.3 | 22.1 | 59.6 |
| 10.8 | 14.3 | 74.9 | 30.6 | 27.1 | 42.3 | 39.0 | 44.5 | 16.5 | 25.6 | 29.0 | 45.4 |
| 7.4 | 10.2 | 82.4 | 37.4 | 32.6 | 30.0 | 36.4 | 42.6 | 21.0 | 32.7 | 35.0 | 32.3 |
| 14.0°C | 36.4 | 41.3 | 22.3 | 37.8 | 40.4 | 21.8 | |||||
| 47.1 | 41.2 | 11.7 | 8.8 | 10.0 | 81.2 | 29.5 | 36.7 | 33.8 | 37.8 | 41.7 | 20.5 |
| 45.3 | 41.0 | 13.7 | 13.4 | 14.2 | 72.4 | 22.8 | 30.1 | 47.1 | 40.8 | 43.2 | 16.0 |
| 44.7 | 40.4 | 14.9 | 20.8 | 21.4 | 57.8 | 16.3 | 22.6 | 61.1 | 41.4 | 43.9 | 14.7 |
| 42.1 | 38.8 | 19.1 | 29.6 | 27.5 | 42.9 | 10.0 | 23.4 | 66.6 | 43.2 | 45.4 | 11.4 |
| 41.8 | 37.8 | 20.4 | 36.8 | 32.9 | 30.3 | 18.0°C | |||||
| 34.8 | 33.9 | 31.3 | 42.2 | 37.6 | 20.2 | 39.2 | 48.6 | 12.2 | 29.0 | 36.9 | 34.1 |
| 26.4 | 28.6 | 45.0 | 42.7 | 38.4 | 18.9 | 38.0 | 46.5 | 15.5 | 36.0 | 41.6 | 22.4 |
| 18.0 | 22.1 | 59.9 | 44.8 | 40.3 | 14.9 | 37.0 | 45.4 | 17.6 | 36.0 | 42.9 | 21.1 |
| 10.8 | 14.3 | 74.9 | 45.4 | 40.9 | 13.7 | 34.8 | 44.4 | 20.8 | 39.0 | 44.5 | 16.5 |
| 7.0 | 10.2 | 82.8 | 47.2 | 46.7 | 10.6 | 33.8 | 43.4 | 22.8 | 39.8 | 45.1 | 15.1 |
| 15.0°C | 28.0 | 37.4 | 34.6 | 40.6 | 47.5 | 11.9 | |||||
| 45.6 | 43.5 | 10.9 | 9.6 | 9.9 | 80.5 | 18.3°C | |||||
| 44.0 | 42.0 | 14.0 | 12.6 | 14.0 | 73.4 | 39.0 | 48.8 | 12.2 | 28.0 | 37.4 | 34.6 |
| 42.8 | 41.8 | 15.4 | 20.8 | 21.2 | 58.0 | 37.5 | 46.9 | 15.6 | 33.5 | 43.2 | 23.3 |
| 40.6 | 39.8 | 19.6 | 28.6 | 27.8 | 43.6 | 36.5 | 46.4 | 17.1 | 34.0 | 44.5 | 21.8 |
| 39.4 | 25.5 | 35.1 | 35.8 | 33.4 | 30.8 | 34.0 | 44.2 | 21.8 | 36.5 | 46.4 | 17.1 |
| 33.4 | 34.6 | 32.0 | 39.9 | 39.1 | 21.0 | 33.5 | 43.2 | 23.3 | 37.5 | 46.9 | 15.6 |
| 25.4 | 29.1 | 45.5 | 41.2 | 39.4 | 19.4 | 28.0 | 37.4 | 34.6 | 39.0 | 48.8 | 12.2 |
С повышением температуры размеры поля трех жидких фаз увеличиваются, оно принимает еще более продолговатую форму, возможно, вследствие изменения взаимодействий в двойной системе вода–триэтиламин с повышением температуры. На поле двух жидких (изотерма при 13.0°С, рис. 2, табл. 1) фаз появляется вторая критическая точка растворимости К1.
С дальнейшим повышением температуры поле трех жидких фаз увеличивается и на изотермах при 14.0, 15.0 и 17.0 (изотермы аналогичны) имеет наибольшие размеры как по концентрации амина, так и по концентрации соли (рис. 3, табл. 2). На поле расслоения остается одна критическая точка растворимости K1. При более высоких температурах происходит уменьшение размера трехжидкофазной области и смещение ее положения на поле двух жидких фаз в области концентраций богатых водой и солью (изотерма при 18.0°С, рис. 3, табл. 2). На изотерме при 18.3°С (рис. 3), отвечающей НКТР двойной жидкостной системы, на стороне треугольника состава вода–триэтиламин появляется еще одна критическая точка К′ и поле трех жидких фаз становится очень узким. Введение достаточного количества иодида калия в смесь критического состава жидкостной системы вода–триэтиламин приводит к образованию трех жидких фаз в изучаемой системе. Отметим, что линия, отделяющая поля ℓ1 + ℓ2 от ℓ имеет S-образную форму в области существования трех жидких фаз.
При дальнейшем повышении температуры из нижней критической точки двойной системы вода–триэтиламин на треугольнике состава развивается второе поле расслоения $\ell _{1}^{'}$ + $\ell _{2}^{'}$ с критической точкой K', примыкающее к стороне треугольника состава вода–триэтиламин (изотерма при 20.0°С, рис. 3). Таким образом, в некотором интервале температур на изотермической диаграмме тройной системы существуют два изолированных поля расслоения. Введение иодида калия в гетерогенные смеси двойной системы вода–триэтиламин (например, по сечениям II, VI–IX) приводит к их гомогенизации при введении иодида калия до 1.6 мас. %, т.е. при небольших концентрациях соль оказывает сильное всаливающее действие. Дальнейшее введение иодида калия в трехкомпонентные смеси снова приводит к их расслаиванию, т.е. значительные концентрации соли оказывают высаливающее действие на водно-триэтиламиновые растворы. Известно, что большие по размерам ионы K+ и I– при относительно небольших их концентрациях разрыхляют структуру воды [35, 36], способствуя гомогенизации водно-органического раствора. Повышение температуры и возрастание концентрации соли оказывают разрушающее действие на структуру гомогенных трехкомпонентных растворов, вызывая снова их расслаивание [37].
В интервале температур между 20.0 и 23.0°С происходит слияние двух полей двухжидкофазных состояний ℓ1 + ℓ2 и $\ell _{1}^{'}$ + $\ell _{2}^{'}$. На изотерме при 23.0°С (рис. 4) существует единое поле двух жидких фаз сложной формы с наличием экстремума на линии, разделяющей поля ℓ1 + ℓ2 от ℓ и простирающееся от стороны монотектического треугольника до стороны треугольника вода–триэтиламин. Наличие экстремума на линии растворимости двух жидких фаз и негладкую форму бинодальной кривой можно объяснить слияние двух полей двухжидкофазных состояний ℓ1 + ℓ2 и $\ell _{1}^{'}$ + $\ell _{2}^{'}$ при некоторой температуре, более низкой чем 23°С, и упомянутым выше всаливающим–высаливающим действием соли на смеси компонентов по сечениям I–IV.
При более высоких температурах качественных изменений на изотермических диаграммах не наблюдается. Растворимость соли возрастает, что приводит к уменьшению монотектического треугольника, увеличению поля двух жидких фаз и сглаживанию экстремума на линии растворимости (изотермы при 25.0 и 60.0°С, рис. 4).
Для количественной оценки эффекта высаливания триэтиламина из его водных растворов иодидом калия на основе политермических данных графически определены составы равновесных жидких фаз монотектического состояния (табл. 3). Количественной характеристикой высаливающего действия соли на водно-органические смеси является коэффициент распределения Kр, характеризующий распределение органического растворителя между жидкими фазами монотектического равновесия при различных температурах. При каждой температуре коэффициент распределения рассчитывали как отношение концентраций триэтиламина в органической и водной фазах монотектики:
Таблица 3.
Составы жидких фаз монотектического состояния, находящихся в равновесии с твердым KI (мас. %), и коэффициенты распределения Kр триэтиламина в тройной системе иодид калия (I)–вода (II)–триэтиламин (III)
| t, °C | I | II | III | I | II | III | Kр |
|---|---|---|---|---|---|---|---|
| водная фаза | органическая фаза | ||||||
| 1.9 | 49.5 | 34.2 | 16.3 | 49.5 | 34.2 | 16.3 | 1.0 |
| 5.0 | 55.8 | 42.3 | 1.9 | 38.1 | 24.8 | 37.1 | 19.5 |
| 10.0 | 56.4 | 42.7 | 0.9 | 22.8 | 27.2 | 49.8 | 55.3 |
| 18.3 | 58.5 | 40.9 | 0.6 | 1.0 | 1.5 | 97.5 | 162.5 |
| 20.0 | 58.8 | 40.6 | 0.5 | 0.8 | 1.2 | 98.0 | 196.0 |
| 25.0 | 59.3 | 40.3 | 0.4 | 0.5 | 1.0 | 98.5 | 246.3 |
| 40.0 | 61.3 | 38.5 | 0.2 | 0.4 | 0.9 | 98.7 | 493.5 |
| 60.0 | 63.5 | 36.4 | 0.1 | 0.3 | 0.7 | 99.0 | 990.0 |
Анализ полученных данных (табл. 3) показывает, что с повышением температуры органическая фаза значительно обогащается амином, в то время как в водной фазе его содержание становится незначительным. Возрастание коэффициента распределения с повышением температуры связано с разрушением гидратов амина и увеличением концентрации соли в водной фазе монотектического равновесия. Высокие значения Kр в интервале 20–60°С свидетельствуют о том, что иодид калия является эффективным высаливателем данного растворителя.
Таким образом, построенные изотермы фазовых состояний изученной тройной системы иодид калия–вода–триэтиламин позволили выявить топологическую трансформацию фазовой диаграммы в интервале 0.0–60.0°С. Установлено, что в смесях компонентов возникает нонвариантное состояние – критическая нода монотектического состояния при 1.9°C, являющаяся минимальной температурой существования двух жидких фаз в изученной системе. Впервые для тройных систем соль–два растворителя обнаружено существование поля трех жидких фаз внутри поля двухжидкофазного состояния в интервале 10.1–18.4°С. Сделано предположение, что образование третьей жидкой фазы связано с высаливанием образующихся в смесях компонентов прочных гидратов триэтиламина. Установлено, что иодид калия при небольших концентрациях (до 6 мас. %) в жидких смесях ведет себя как хороший всаливатель и гомогенизирует смеси воды и триэтиламина. При температурах выше 20°С и высоких концентрациях иодид калия проявляет сильный высаливающий эффект за счет хорошей растворимости. Найдены большие значения коэффициентов распределения триэтиламина (от 196 до 990) между жидкими фазами монотектического состояния, а также высокие концентрации триэтиламина (98–99 мас. %) в органической фазе монотектики в интервале 20–60°С. Исследованную систему рекомендуется использовать в качестве экстракционной для концентрирования веществ различной полярности из водных растворов, а также выделения триэтиламина при его высаливании.
Список литературы
Черкасов Д.Г., Ильин К.К. // Журн. прикл. химии. 2011. Т. 84. № 3. С. 396.
Черкасов Д.Г., Ильин К.К. // Там же. 2011. Т. 84. № 5. С. 768.
Ильин К.К., Черкасов Д.Г., Смотров М.П. // Матер. V Всерос. конф. “Физико-химические процессы в конденсированных средах и на межфазных границах (ФАГРАН–2010)”. Воронеж: Изд-во “Научная книга”. 2010. Т. II. С. 543.
Ильин К.К., Черкасов Д.Г. // Изв. Сарат. ун-та. Нов. сер. Сер. Химия. Биология. Экология. 2011. Т. 11. Вып. 2. С. 15.
Рогачева Л.В., Остапенко Г.М., Никурашина Н.И. // Журн. прикл. химии. 1979. Т. 52. № 3. С. 697.
Meerburg P.A. // Z. Phys. Chem. 1902. B. 40. P. 641.
Kartzmark E.M. // Can. J. Chem. 1967. V. 45. P. 1089.
Behrends R., Telgmann T., Kaatze U. // J. Chem. Phys. 2002. V. 117. № 21. P. 9828.
Brundage R.S., Kustin K. // J. Phys. Chem. 1970. V. 74. № 3. P. 672.
Counsell J.F., Everett D.H., Munn R.J. // J. Pure Appl. Chem. 1961. V. 2. P. 335.
Hafaiedh N., Toumia A., Bouanzab M. // J. Chem. Eng. Data. 2009. V. 54. P. 2195.
Hafaiedh N., Toumia A., Bouanzab M. // J. Phys. Chem. Liq. 2009. V. 47. № 4. P. 399.
Letcher T.M., Spiteri W. // J. Chem. Thermodynamics. 1983. V. 15. P. 965.
Pepin C., Bose T.K., Thoen J. // Phys. Soc. 1988. V. 60. № 60. P. 2507.
Furrow G.P., Greer S.C. // J. Chem. Phys. 1983. V. 79. № 7. P. 3474.
Gastaud R., Beysens D., Zalczer G. // J. Chem. Phys. 1990. V. 93. № 5. P. 3432.
Bertrand G.L., Larson J.W., Hepler L.G. // J. Phys. Chem. 1968. V. 78. № 12. P. 4194.
Thoen J., Bloemen E., Dael W. V. // Ibid. 1978. V. 68. № 2. P. 735.
Flewelling A.C., DeFonseka R.J., Khaleeli N. // J. Chem. Phys. 1996. V. 104. № 20. P. 8048.
Garland C.W., Lai C. // Ibid.. 1978. V. 69/ № 4. P. 1342.
Kartzmark E.M. // Can. J. Chem. 1967. V. 45. P. 1089.
Counsell J.F., Everett D.H., Munn R.J. // J. Pure Appl. Chem. 1961. V. 2. P. 335.
Iwanowski I., Kaatze U. // J. Am. Chem. Soc. 2007. V. 111. P. 1438.
Kartzmark E.M. // Can. J. Chem. 1967. V. 45. P. 1089.
Остапенко Г.М., Шелудько Л.И., Никурашина Н.И. // Журн. прикл. химии. 1977. Т. 50. № 6. С. 1398.
Воробьева Л.Д., Крупаткин И.Л. // Сб. статей: Фазовые равновесия. Калинин: Изд-во Калининского ун-та, 1974. С. 18.
Воробьева Л.Д., Крупаткин И.Л. // Сб. статей: Фазовые равновесия. Калинин: Изд-во Калининского ун-та, 1974. С. 26.
Thangavel S., Moolel M.J. // Z. Phys. Chem. (BRD). 1984. B. 139. P. 217.
Il’In K.K., Cherkasov D.G. // Chem. Eng. Commun. 2016. V. 203. Issue 5. P. 642. https://doi.org/10.1080/00986445.2015.1076802
Аносов В.Я., Озерова М.И., Фиалков Ю.Я. Основы физико-химического анализа. М.: Наука, 1976. 504 с.
Трейбал Р. Жидкостная экстракция: Пер. с англ. под ред. С.З. Кагана. М.: Химия, 1966. 724 с.
Справочник по растворимости: Бинарные системы / Под ред. В.В. Кафарова. Т. 1. Кн. 1. М.; Л.: Изд-во АН СССР, 1961. 960 с.
Roozeboom H.W.B., Schreinemakers F.A.H. Die heterogenen gleichgewichte vom standpunkte der phasenlehre. Braunschweig: Druck und Verlag von Friedr. Vieweg und Sohn, 1913. Teil 2. Heft 3: Die Ternären Gleichgewichte. 348 s.
Ильин К.К. Топология фазовых диаграмм трех- и четырехкомпонентных систем с равновесиями конденсированных фаз: Дис. … д-ра хим. наук. Саратов: Сарат. ун-т, 2000. 383 с.
Самойлов О.Я. Структура водных растворов электролитов и гидратация ионов. М.: АН СССР, 1957. 182 с.
Крестов Г.А. Термодинамика ионных процессов в растворах. Л.: Химия, 1984. 272 с.
Черкасов Д.Г. Топология фазовых диаграмм трех- и четырехкомпонентных конденсированных систем с всаливанием–высаливанием: Дис. … д-ра хим. наук. Саратов: Сарат. ун-т, 2013. 413 с.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии


